Dr. Julio César Potenziani Bigelli
TEMAS ACTUALES
EN UROLOGÍA
Reproduced here by permission of the editor.
"En virtud de lo dispuesto en el artículo 23 de la Resolución Mediante la cual se dictan las Normas para la Promoción y Publicidad de Medicamentos dictadas por el Ministerio de Salud y Desarrollo Social, AstraZeneca informa que solamente ha aportado su patrocinio económico para la publicación final de la presente obra. Todos los aspectos relativos a la compilación y análisis de información, redacción de la obra y afines han sido realizados exclusivamente por el autor de la obra de manera independiente y sin ningún tipo de participación por parte de AstraZeneca en la misma. AstraZeneca no se hace responsable de la veracidad o exactitud de la información contenida en la obra así como de las opiniones contenidas en la misma."
No está permitida la reproducción total o parcial de este libro, ni su tratamiento o procesamiento informático, ni la transmisión de ninguna forma o por cualquier medio, ya sea electrónico, mecánico, por fotocopia, por registro u otros métodos, así como la distribución de ejemplares mediante alquiler o préstamos públicos, sin el permiso previo y por escrito de los titulares del Copyright.
Derechos Reservados. Copyright © 2006 Julio Potenziani
ISBN: 980-12-1777-4
Diseño y Diagramadón: Janet Salgado M.
Diseño de Portada: Janet Salgado
Impresión:
Moore de Venezuela, S.A.
Impreso en Venezuela - Printed in Venezuela
Dr. Julio César Potenziani Bigelli
Estudios de Primaria y Secundaria Colegio América San Bernardino-Caracas y la Salle La Colina hasta 1972.
Estudios de Medicina en la Universidad de Carabobo (U.C.) graduándose, el año de 1977.
Estudios de Postgrado de Urología en el Hospital Universitario de Caracas (UCV) el año de 1982.
Experiencia docente en cursos de postgrado de urología, en el hospital militar de caracas "Dr. Carlos Arvelo", desde 1983 hasta 1990, donde ejerció como monitor y coordinador del curso de Postgrado de Urología.
Miembro activo de la Sociedad Venezolana de Urología.
Miembro activo (Member) de la American Urological Assodation (AUA)
Miembro activo de la Confederación Americana de Urología (CAU)
Miembro de la Sociedad Médica Del Hospital Privado Centro Médico De Caracas.
Miembro de la Sociedad Venezolana De Historia De La Medicina.
Médico, escritor de 6 libros de medicina (Vejiga Hiperactiva, Enfermedades de la Próstata, Tópicos en Urología, Historia de la Urología (Cronología Histórica de la Urología Mundial y Venezolana), Temas Actuales en Urología, Historia de la Urología (2da. edición ampliada y corregida) de enorme aceptación entre todo el gremio médico, urólogos y estudiantes de medicina y estudiantes de los Postgrados de Urología de todas las universidades nacionales.
En preparación libro de "Psicopatología del Arte de la Pintura Italiana de los Siglos XIV, XV y XVI (para el año 2006) y el libro "Las Enfermedades en la Historia de la Humanidad" (para el año 2007).
Creador-editor de la página Web venezolana urologiaaldia.com desde 1999, considerada como página Web de orientación pedagógica en Venezuela e Hispanoamérica.
Conferencista urológico a través de todo el territorio nacional.
Director de la revista de la Sociedad Venezolana de Historia de la Medicina (2002).
Director-Coordinador de la página Web de la Sociedad Venezolana de Historia de la Medicina (2005).
En sus años de especialista, ha investigado y desarrollado una vasta experiencia en los campos de oncología urológica, en uroneurología, en el campo de la urología femenina, en especial en lo concerniente a la incontinencia urinaria en la mujer (IOE), la hiperactividad vesical y en las enfermedades prostáticas en general y en deficiencia androgénica del hombre maduro.
Designación como individuo de numero con el sillón #XXIV en la Sociedad Venezolana de Historia de la Medicina en la reunión ordinaria del 1 de octubre 2003 acta # 684 Caracas Palacio de las Academias.
Investigador y escritor de programas de educación médica continua en el campo urológico (con más de
12 CD-ROM de tópicos variados en el campo urológico) de gran valía para nuestras universidades y nuestra población médica urológica.
Autor de 78 trabajos de investigación en medicina y urología.
Conferencista a nivel nacional.
Designación como representante del consejo científico de uro-ginecología de la Sociedad Venezolana De Urología en el periodo comprendido entre 2002-2006.
Designación como representante de la comisión de Historia de la Urología de la Sociedad Venezolana de Urología en el período comprendido entre el período 2002-2006.
Designación como parte del Comité Editorial de la Revista Informe Médico desde el año 2002.
Designación como coordinador de la comisión de la Historia de la Urología designado por la Junta Directiva de la Sociedad Venezolana de Urología en su reunión ordinaria efectuada el día 17 de mayo del año 2003 en la ciudad de Maracaibo, estado Zulia.
Designación como integrante del comité de árbitros de la revista de la Sociedad Venezolana de Historia de la Medicina a partir del mes de junio del año 2003.
Ejerce profesionalmente en el Hospital Privado Centro Médico de Caracas desde el año 1988.
e-mail: julcpotb206@cantv.net sitio WEB: www.urologiaaldia.com
e-mail: jpotenziani@cantv.net
CARMEN MARTÍNEZ NATERA * ARIEL KAUFMAN * LUIS CARICOTE M. * LETICIA O'NEIL * LUISA AYALA * JOSEFA VIVAS DE VEGAS * HUGO DÁVILA B. * ROBERTO BENATUIL S * EMILIA MORA * JOSÉ BRICEÑO * LUIS BENAVIDES * JOSÉ GONZÁLEZ BENAVIDES * DAVID ARANA CASTRO * DAVID ARANA GARCÍA * IVO RODRÍGUEZ * JULIO C. POTENZIANI BIGELLI * SILVIA D. POTENZIANI PRADELLA * LUIS GONZALO GÓMEZ * RENE SOTELO * SALVADOR J. ROCAFULL G. * ANDRÉS HANSSEN * OSWALDO KARAM * BERNARDO VAINRUB * DAVID PARADA * EMILIO ÁLVAREZ * RODOLFO MATHEUS * RONALD GUÍA * WILLIAM UZCÁTEGUI S. * RICARDO SZEMAT DAHER * IRWIN GOLDSTEIN * RICARDO MUNARRIZ * RICARDO SZEMAT NIKOLAJENKO * VICENTE DIEGUEZ * JUAN CARLOS JAIME * OSCAR MARTÍNEZ * ALEJANDRO EGEA * FERNANDO BIANCO TROCONIS * NELSON MEDERO
Presentamos el libro "Temas Actuales en Urología", donde reunimos más de 30 colaboradores (médicos urólogos, nutricionistas, oncólogos, radioterapeutas, patólogos, pediatras-oncólogos, infectólogos, médicos en gerencia de salud, cirujanos oncólogos de transplante), dentro de nuestras fronteras y fuera de ella, como es el caso de médicos que ejercen en los Estados Unidos de Norteamérica, que desarrollan 30 temas de interés para estudiantes de pregrado, postgrado, urólogos y médicos afines en general.
Esperando que la obra sea del agrado de todos.
Atentamente,
Dr. JULIO C. POTENZIANI BIGELLI
Cuando el Dr. Julio César Potenziani, me pidió que escribiera la introducción de esta su nueva publicación literaria titulada "TEMAS ACTUALES EN UROLOGÍA", solo me quedó recordar que conozco a este eminente urólogo venezolano desde mis primeros contactos con la urología académica de mi formación hace ya bastantes años, por lo que quiero expresar, se trata de un excelente profesional que tiene como virtudes su pasión y la excelencia con que realiza todas las tareas que se traza.
Ha escrito diversas publicaciones que van desde la historia de la urología en Venezuela, pasando por temas como enfermedades prostéticas, enfermedades del piso pélvico y hoy me sorprende de nuevo presentando esta publicación con altísimo nivel académico, tanto de sus colaboradores como el suyo propio.
Este libro, nos pasea por los temas más importantes en el mundo urológico actual, tales como, disfunción vesical en niños y adultos, disfunción eréctil, andropausia y osteoporosis masculina, infertilidad, infecciones urinarias, laparoscopia urológica, tratamiento adyuvante de neoplasias en urología, anatomía patológica de los tumores del tracto urinario y tratamiento quirúrgico de diversas patologías de grandísima importancia en el devenir de nuestro quehacer urológico, tratando las últimas tendencias en dichos temas.
Logró rodearse en todos los temas de este libro, de un grupo, todos insignes urólogos, que ejercen en diferentes latitudes y sub-espedalidades, uniéndonos como una gran familia urológica sin mezquindades y con una gran necesidad de compartir sus propias experiencias con el resto de los urólogos y otros especialistas de este país.
Adicionalmente, integró a famosos médicos extranjeros reconocidos mundialmente, tales como, el Dr. I. Goldstein, el Dr. Munárriz, el Dr. Parada y el Dr. Fernando Bianco Troconis, todos integrantes de servicios muy importantes en Universidades en los Estados Unidos.
Debo expresar que además contó con los mejores especialistas en patología, nutrición, oncología, radioterapia, escribiendo temas importantes de mucha ayuda al urólogo en ejercicio.
En representación de la Sociedad Venezolana de Urología, quiero felicitar al Dr. Julio Cesar Potenziani y a invitar al resto de los urólogos de Venezuela a emular el encomiable trabajo que el realiza.
Como amigo, lo felicito por la fuerza y el tesón que ha demostrado a lo largo de los años, a pesar de los obstáculos que ha tenido que enfrentar y que ha superado con éxito.
Dr. Alessandro J. Colantuono M.
Presidente Sociedad Venezolana de Urología
Agradecemos a Laboratorios AstraZeneca de Venezuela, en las personas de Gabriela Linares y Adela Bider, que hicieron posible la publicación del libro "Temas Actuales en Urología", que reúne 33 especialistas y 30 temas de actualidad urológica que esperamos sea del agrado y utilidad de todo el conglomerado de urólogos y especialistas afines de nuestra querida Venezuela.
Atentamente,
Dr. Julio César Potenziani Bigelli
TEMA 1: "Disfunción vesical. El recien nacido y los estudio urodinámicos"
CARMEN MARTÍNEZ NATERA (Urólogo)
TEMA 2: "Manejo Urológico del niño con Mielodisplasia"
ARIEL KAUFMAN (Urólogo) * LUIS CARICOTE M (Urólogo)
TEMA 3: "Aspectos nutricionales en el paciente con trastornos litiasicos"
LETICIA O'NEIL (Nutricionista Centro Médico de Caracas) * LUISA AYALA (Nutricionista Centro Médico de Caracas) JOSEFA VIVAS DE VEGAS (Nutricionista Centro Médico de Caracas)
HUGO DÁVILA B. (Urólogo) * ROBERTO BENATUIL S. (Urólogo)
EMILIA MORA (Oncóloga-Pediatra) * JOSE BRICEÑO (Urólogo pediátrico)
TEMA 6: "Reflujo Neonatal. Actualización"
LUIS BENAVIDES (Urólogo) * JOSÉ GONZÁLEZ BENAVIDES (Res. Cirugía)
TEMA 7: "Status del transplante renal"
DAVID ARANA CASTRO (Urólogo) * DAVID ARANA GARCÍA (Médico General)
TEMA 8: "Braquiterapia en urología"
IVO RODRÍGUEZ (Oncólogo-Radioterapeuta)
TEMA 9: "Síndrome de hiperpresión en uretra prostética"
JULIO C. POTENZIANI BIGELLI (Urólogo) * SILVIA D. POTENZIANI PRADELLA (Estudiante Medicina)
TEMA 10: "Varicocele en población juvenil. Revisión de un tema controversial"
JULIO C. POTENZIANI BIGELLI (Urólogo) * SILVIA D. POTENZIANI PRADELLA (Estudiante Medicina)
JULIO C. POTENZIANI BIGELLI (Urólogo) * SILVIA D. POTENZIANI PRADELLA (Estudiante Medicina)
TEMA 12: "Disfunción eréctil posterior a cirugía radical. Modelo de decisión"
JULIO C. POTENZIANI BIGELLI (Urólogo) * SILVIA D. POTENZIANI PRADELLA (Estudiante Medicina)
TEMA 13: "Historia de la circuncisión y su trascendencia en las diferentes culturas de la humanidad"
JULIO C. POTENZIANI BIGELLI (Urólogo) * SILVIA D. POTENZIANI PRADELLA (Estudiante Medicina)
JULIO C. POTENZIANI BIGELLI (Urólogo) * SILVIA D. POTENZIANI PRADELLA (Estudiante Medicina)
LUIS GONZALO GÓMEZ (Patólogo) (Fallecido)
TEMA 16: "Prostatectomía radical Laparoscópica"
RENÉ SOTELO (Urólogo) * SALVADOR J. ROCAFULL G. (Urólogo)
TEMA 17: "Nefrectomía Radical Laparoscópica"
RENÉ SOTELO (Urólogo) * SALVADOR J. ROCAFULL G. (Urólogo) * ANDRÉS HANSSEN (Urólogo) * OSWALDO KARAM (Urólogo)
TEMA 18: "Infecciones urinarias"
BERNARDO \AINRUB (Infectólogo)
TEMA 19: "Células basales prostáticas. Condiciones benignas y malignas"
DAVID PARADA (Patólogo)
TEMA 20: "Carcinoma urotelial y sus diagnósticos diferenciales"
DAVID PARADA (Patólogo)
TEMA 21: "Cáncer de Vejiga Urinaria. Enfoque multidisciplinario"
EMILIO ÁLVAREZ (Oncólogo-Radioterapeuta)
TEMA 22: "Evaluación del hombre Infértil"
RODOLFO MATHEUS (Urólogo)
TEMA 23: "Fistula vesicovaginal. Nueva técnica para su cura"
RONALD GUÍA (Urólogo) * WILLIAM UZCÁTEGUI (Urólogo)
TEMA 24: "Reconstrucción arterial peneana" (Revascularización peneana)
RICARDO SZEMATDAHER (Médico interno) * IRWIN GOLDSTEIN (Urólogo)
RICARDO MUNARRIZ (Urólogo)
RICARDO SZEMATDAHER (Médico interno) * IRWIN GOLDSTEIN (Urólogo)
RICARDO MUNARRIZ (Urólogo)
TEMA 26: "Manejo de la disfunción sexual femenina"
RICARDO SZEMATDAHER (Médico interno)- IRWIN GOLDSTEIN (Urólogo)
RICARDO MUNARRIZ (Urólogo)
TEMA 27: "Osteoporosis en el hombre venezolano"
RICARDO SZEMAT NIKOLAJENKO (Urólogo) * VICENTE DIEGUEZ (Urólogo)
JUAN CARLOS JAIME (Urólogo) * OSCAR MARTÍNEZ (Urólogo)
RICARDO SZEMAT DAHER (Médico interno)
TEMA 28: "Medicina sexual en Venezuela"
RICARDO SZEMAT NIKOLAJENKO (Urólogo) * ALEJANDRO EGEA (Urólogo)
RICARDO SZEMAT DAHER (Médico interno)
FERNANDO BIANCO TROCONIS (Urólogo)
TEMA 30: "Avances en el tratamiento farmacológico oral de la disfunción eréctil"
NELSON MEDERO (Urólogo)
Dra. Carmen Martínez Natera * Urólogo
Hospital Militar de Caracas "Dr. Carlos Arvelo"
DISFUNCIÓN VESICAL EL RECIÉN NACIDO Y LOS ESTUDIOS URODINÁMICOS
Los Estudios Urodinamicos en los recién nacidos son indicados cuando hay riesgos de deterioro del tracto urinario, Bauer, Mcguire y Van God, entre otros han evaluado urodinamicamente niños recién nacidos hasta los quince años; la conclusión de estos niños con anormalidades urodinamicas de hiper-reflexia del detrusor o di sinergia efinteriana, fue que estadísticamente tenían riesgos de hidronefrosis o reflujo vesico ureteral o ambos.
Mcguire y colaboradores en el seguimiento de veinte y dos pacientes, con presión intravesical mayor de cuarenta (40) C.m.h2o, de estos 61% tenían reflujo vesico ureteral, Bauer, encontró que en la evaluación de 36 niños, 18 tenían di sinergia esfinteriana, en estos niños se recomendó urografía de eliminación o ecosonograma cada 6 meses hasta los dos años y luego cada año hasta los cinco año de edad; los niños con estudios urodinamicos normarles debían ser seguidos con urografía de eliminación o ecosonograma cada año en los primeros dos año, el protocolo de estos autores esta dado por exámenes de orina cultivos, urografía de eliminación y uretro-cistografia misional en todos los recién nacidos, si estos estudios son normales y el niño no esta infectado debe ser seguido con ecosonografía cada seis mes o a un año, cada año durante la pubertad y posteriormente cada año.
En niños con hidonefrosis y reflujo, el cateterismo vesical intermitente (C.V.I.), esta indicado con estudios de ecosonografía para evaluar el progreso del daño renal, en niños con reflujo vesico ureteral el
C.V.I., puede necesitar terapias anti-colinergica; Koff ha notado el reflujo vesico ureteral ha mejorado y se ha resuelto con esta terapia, los reflujos severos deben ser manejados con derivaciones urinarias, y los niños que tienen evidencia de contracciones no inhibidas necesitan meditación anticolinergicas.
El Programa de Cateterismo Intermitente ha sido Instituido en niños con recurrentes infecciones urinarias, hidronefrosis y reflujo, una alternativa en niños pequeños deberá ser la vesicostomía; en los niños con tracto urinario indemne, no se realizaron evaluaciones urodinamicas, estos estudios han sido reservados cuando falla la terapia inicial; el tratamiento farmacoterapico se inicia con PRO-BAN-THINE (de 7.5 a 15 miligramos tres (3) veces al día). DITROPAN (2.5 a 5 MILIGRAMOS TRES (3) VECES AL DÍA), TOFRANIL (10 a 25 miligramos tres (3) veces al día).
En intratables Incontinencias Urinarias, el ideal manejo es el uso de esfínteres artificiales, con apoyo farmacológicos en los casos que presentes elevación de las presiones intra vesicales (Fenoxibenzamina o esfínter otomía), uso de anti colenergícos o procedimientos quirúrgicos para disminuir la presión intravesical.
El Tracto Urinario bajo (Vejiga, Uretra), y el sistema nervioso son estructuras complejas con alternativas funciones en el llenamiento y vaciamiento vesical, estas funciones dependen de la integridad de cada uno de los niveles del sistema nervioso central, la gran variedad de desordenes en estos niveles hacen que ellos sean disfuncionales, la transición del control de la vejiga en el niño a la adultez, es posible por el orden de las estructuras neurológicas y cuando se altera este proceso es cuando ocurren las disfunciones vesicales.
La enuresis, la cistitis recurrente, el reflujo vesico uretral, la constipación son significativamente los problemas urológicos mas importante en las disfunciones vesicales de vejiga.
El primer circuito de integración neuronal va desde el lóbulo frontal al núcleo pontino, el condicionamiento y aprendizaje en el vaciamiento vesical, son asociados con la integridad de estas áreas; el desarrollo de este circuito en niños favorece la continencia y el retardo en la maduración acarrea a su vez un retardo en la capacidad de inhibir el reflejo del detrusor.
El segundo circuito desde la formación reticular del núcleo pontino al nervio motor en la medula espinal; la contracción del detrusor durante la fase de llenamiento se refleja en el estudio dstometrico, para demostrar integridad del circuito.
El Tercer circuito es el responsable de la coordinación del detrusor al esfínter, estas entidades trabajan sincrónicamente para producir una completa y baja presión de evacuación vesical. El último circuito realiza la integridad del lovulo central al esfínter.
En los primeros meses de edad la evacuación vesical es un mecanismo reflejo, el niño aprende los niveles de sensación de llenamiento, contracción vesical y puede retardar la micción, la edad para el control de vaciamiento, coincide con un importante periodo emocional del desarrollo del niño, llamado "Fase Anal", entre los 10 y 36 meses es cuando el niño sicologicamense separa e identifica a la madre, coincidiendo con el desarrollo loco motor y el vocabulario, la capacidad de controlar el vaseamiento vesical también es reconocida en esta edad; de manera que el reforzamiento social es motivación para permanecer seco, en la etapa de maduración la incontinencia urinaria puede ser precipitada por cualquier condición que incremente la sensibilidad de la vejiga (sueño, stress, juegos etc.)
Una de las formas mas comunes y benignas de dis-fundón vesical es la enuresis nocturna; el aprendizaje, la influenda del credmiento, maduradón, stress, fadures genéticos, experiendas y motivadón se combinan como elementos condidonantes en la aparidón de la enuresis.
El 15% de los niños mayores de 15 años que permanecen húmedos en la noche, tienen posibilidad de cura espontánea y la mayoría de los niños en uréticos no tienen riesgos de problemas urológicos futuros; la evaluadón de estos niños debe induir completa historia dínica examen físico, química orinaría y los estudios radiológicos, endoscopios y urodinamicos raramente son necesarios, cuando consideramos modalidades terapéuticas, la enuresis primaria, condición benigna, con el mejoramiento de la calidad de vida es suficiente y la enuresis secundaria que es una forma de disfundón vesical, a merita de medidas de reforzamiento, disminudón de la ingesta de líquidos, programa de vaciamiento vesical, condicionamiento con alarmas, medicación con anticoli-nérgicos y antidepresivos tridclicos.
Entre los 3 y los 8 años de edad los niños, normalmente los niños tienen hábitos de vaciamiento. Estos niños pueden desarrollar episodios febriles de infección orinaría, marcados por disuria, frecuenda orinaría, urgencia e incontinencia. Se estima que el 15% de los niños mayores de los 6 años sufren de disfunción vesical, la humedad durante la noche sin problemas diurnos son los síntomas más importantes y ocasionalmente incontinenda fecal durante el día. El riesgos de desarrollar infecdones orinario con disfunción vesical es mas alto en niñas que en niños. La corta uretra femenina acarrea una pequeña distancia en el perine y la vejiga. La inestabilidad del detrusor es muy común en las disfundones vesicales pedriáti-cas en el síndrome puro de urgenda la fase de llenamiento está distorsionada, el vaceamiento es completamente normal, se considera que la inmadurez para inhibir el centro sacral de la micción es el responsable de esta inestabilidad; se considera que la apertura del cuello de la vejiga durante la fase de contracciones inestables es la causa de las infecciones urinarias, especialmente en niñas donde la uretra es colonizada con baderias que son arrastradas hasta la vejiga y sí hay el fenómeno de la constipadón la colonizadón baderiana es más uropatogena. El tratamiento de la inestabilidad del detrusor es lo importante en la prevendón de la infecdón urinaria, anti colinergicos y/o anti pasmodicos y el tratamiento de la constipación son mandatarios.
Un completo vaciamiento es parte de la protección contra la infección urinaria, el residuo urinario contribuye a mantener en estos niños las infecdones.
En el tratamiento de la disfunción vesical, la correcdón de la fase de vaciamiento es crítica.
Constipadón; en muchos niños que sufren de disfunción vesical la constipación esta presente y se ha demostrado que la virulenda de la flora bacteriana fetal se incrementa con la constipación, la impacción fecal comprime el redo desplazando el trígono vesical lo cual irrita la vejiga y ocasiona hiperactividad del detrusor los problemas de constipadón, ocurren mas frecuente durante la fase de entrenamiento vesical, con alteradón de la fase voluntaria de rejalacion esfinteriana eltratamiento debe evitar el uso de enemas y supositorios en forma crónica y evitar conductas de reforzamiento negativas.
Los estudios radiológicos frecuentemente son normales, al igual que los estudios endoscopios, la disfundón vesical como causante de recurrente dstitis ha sido identificada usando estudios urodinamicos.
Los estudios urodinamicos han demostrados diferentes patrones vejiga de pequeña capacidad hipertónica, vejigas con contracdones no inhibidas, vejigas hiperrefléxicas. El incremento de la predsión intravesical puede disminuir la defensa vesical contra las infecdones, la elevada presión disminuye el flujo capilar sanguíneo vesical (ANDRIOLE Y COLABORADORES). El resultado de la infección incrementa la hiperreflexia del detrusor, los antibióticos deben ser usados para eliminar las infecdones activas conjuntamente con la terapia anticolinergica.
REFLUJO VESICO URETERAL Y DISFUNCIÓN VESICAL
Con el reconodmiento de la disfunción vesical en niños el concepto de reflujo secundario ha apareado. Las altas presiones debido a contracdones inestables y los cambios anatómicos secundarios a hiperactivi-dad del detrusor contribuyen a la aparición del reflujo, el reflujo secundario es frecuentemente de bajo grado y por si mismo no es responsable de la alta inddencia de infecdones urinarias en niños con disfundón vesical. Se describe la correcdón del reflujo con el tratamiento de la infecdón urinaria, la correcdón endoscopia del reflujo ofrece una excelente alternativa.
MIELODISPLASIA: Es una causa común de incontinencia o disfundón vesical en niños; el derre del tubo neural, comienza en región cervical y se extiende caudalmente entre los 20 días de gestadón y se completa a los 26; la perdida de la completa tubu-larizadón del tubo neural, con inadecuado derre mesodérmico y arresto de la formadón del arco vertebral, esta anormalidad embriológica conlleva al mielomeningocele, el défidt neurológico esta relacionado con la injuria del nervio. El nivel del mielomeningocele no siempre corresponde a la distribution de la injuria de la raíz nerviosa, la extensión de la falla vesical y de las extremidades se correlaciona con la severidad del compromiso neurológico.
La evaluadón y el contratamiento son inidados después del nadmiento, esto permite que el niño sea estabilizado y evaluado para descartar anormalidades asociadas. Se necesita una evaluadón urológica completa para predsar y determinar la severidad del compromiso del trado urinario. La mayoría de los niños con mielo displasia tienen problema de incontinencia, deterioro del tracto urinario superior, algún grado de retensión urinarias infecciones. El problema urológico es determinar cual de estos niños experimentará disfunción del tractor urinario superior y planificar tratamiento efedivo de la inconti-nenda y/o disfunción vesico uretral, se describe la di sinergia vesico efinteriana como el tipo mas común del trado urinario bajo en mielo displasias.
La introducdón del cateterismo vesical intermitente por LAPIDES, condujo a una mejoría en el resultado a largo plazo de los pacientes con mielo displasia, disminuyendo marcadamente la inddencia de las complicadones urológicas, pero con poca mejoría de la incontinencia. MCGUIRE y COL., notaron que 42 de los pacientes
estudiados urodinamicamente el 83% tenía arreflexia del detrusor y un 86% con cuello desical abierto. Es muy importante individualizar cada caso de forma de poder relacionar presiones abdominales, adividad física y estado neurológico; el tratamiento farmacológica con anticolinergicos puede tener efecto sobre la continenda, aunque no ejerza efedo sobre la función uretral, buenos resultados han sido obtenido a corto plazo con el uso del efinte artifidal, las anchas han sido usadas en parientes masculinos y femeninos, con éxito razonables igualmente el uso de materiales inyedables.
Saber oriental, diagnosticar y manejar los problemas clínicos que fundamentalmente forma la mielo displasia es esencial para lograr buenos resultados en el tratamiento, debemos tener conocimientos básicos a cerca de la dinámica y patogénesis de la enfermedad, en consecuencia la evaluación urodinamica integral representa la piedra angular para el diagnósticos y diseño de las estrategias terapéuticas que permitan prevenir el deterioro del tractor urinario superior, mantener la complacencia vesical, mejorar la continencia y el vaciamiento vesical. El cateterismo vesical intermitente representa una herramienta de gran vigencia y utilidad en el tratamiento de los problemas que ocasiona esta entidad clínica.
Las enfermedades asociadas con incontinencia urinaria o disfunción de vaciamiento en niños incluye congénitas y adquiridas, enfermedades con causas neurologías, anatómicas y funcionales.
CONGÉNITAS: Mielodisplasia, agenesia sacral, disrafismo.
ADQUIRIDAS: Mielitis, meriguitis, cirugía de la columna vertebral, tumores primar dios o MT.
Enuresis, vejigas neurogenicas no neurogenicas, infecciones urinarias recurrentes.
Complejo extrofia -epispadia, valvas de uretra-posterior.
Historia Clínica. La historia clínica y el examen clínico, en todo niño con antecedentes de, anoxia neonatal, síndrome convulsivo, traumatismo de cabeza y cuello, son indispensables, para explicar trastornos de vaciamiento en ausencia de enfermedad neurológica.
Los estudios básicos urodinamicos, dstrometria, uroflujometria, perfil de presión uretral, electro miografía y estudios combinados con video.
Cístometría. Es el método por el cual los cambios de presión vesical, son medidos con progresivo aumento del volumen vesical. El test es básicamente para evaluar el llenamiento vesical y el vadamiento, la presencia o ausenda de contracciones del detrusor .La capaddad de vesical varia con la edad, en recién nacidos la capacidad es de 50 a lOOcc, en adolescentes es de 300cc. Anormalidades en el patrón cistométrico se pueden ver, disminución del compílanse del detrusor, contracción involuntaria del detrusor, hiperreflexia del detrusor, involuntarias contracciones, areflexia del detrusor etc.
Uroflujometria. Es definido como el volumen de fluido expelido desde la uretra por unidad de tiempo y expresado enml por segdo.rios
Existen variables de flujimetria de acuerdo a la edad y al sexo.
Electro miografía. Es el estudio de los potendales bioeléctricos generados por la despolarización de el músculo esquelético .La descarga eled rica produce una contracción de las fibras musculares de la unidad motora y el potendal de acdón es detectado por electrodos, a un osciloscopio, para convertirse en una señal audible.
Videourodinamia. Se utilizan técnicas de urodi-namica y de cistouretrografia en forma sincrónica para la evaluación de problemas complejos del trado urinario bajo especialmente de tipo obstructivo.
1. Barret DM, Wein. A.J. Flow evaluación and simultáneos external sphinc t ert electromyhraphy in clical urodynamic J. Urology. 125. 538, 1981.
2. Blaivas J.C. Electromyography and sacral evoked responses in Urodynamic Principles. Edinburgh Livingstone. 1984 bp 139.
3. Blaivas J.G. Bhimani G. Labib KB. Vesicouretethral disfunción in multiple esclerosis. J. Urology 122. 342, 1979.
4. Blaivas J.G. Manegement of bladder disfunción in multiples esclerosis. Neurology 30 part 2.12, 1980.
5. Blaivas J.G. L. abib KL. Bauer SB. ,et al. A new approach to electromyography of the external urethral sphin cter. J.,Urology 177.773, 1977.
6. Abrams P. The practice of urodynamic. In Urodynamics principles. Practice and Aplication. Edingurgh. Churchill Levingstone. 1984, pp 76-92.
7. Lapides, J. Mechanismos of urinary tract infections, Urology. 14. 217. 225,1979.
8. McGuire E.J.,Woodside J.R. Diagnostic advantages of fluoroscopic monitoring during urodinamic evaluación J., Urolo. 125. 830,1981.
9. McGuire E.J., Woodside J.R. Borden. TA, et al, Prognostic value of urodynamic testing in mielo dis-plasia patients. J. Urolo. 126.205, 1986.
10. Piet Hoebeke. Voiding disfunción, recurrent urinary tract infections. Constipación and vesicoureteric reflux a common disease complex. Dialogues Pediatric urology. 25. 8, 2002.
Dr. Ariel M. Kaufman K.
Unidad de Vídeo-Urodinámica, Neurourología e Incontinencia Urinaria del Hospital de Clínicas Caracas-Venezuela
Dr. Luis F. Carleóte M.
Fellow de la Unidad de Vídeo-Urodinámica, Neurourología e Incontinencia Urinaria del Hospital de Clínicas
Caracas-Venezuela
MANEJO UROLÓGICO DEL NIÑO CON MIELODISPLASIA
RESUMEN
Este artículo presenta una revisión práctica y detallada de la conducta urológica en los pacientes con disrafismo espinal. Dicha patología constituye la principal causa de los problemas de vejiga neu-rogénica en niños. En pacientes con mielodisplasia, los problemas urológicos representan una causa importante de morbimortalidad en los primeros dos años de vida. Por tanto, el buen enfoque diagnóstico y terapéutico del paciente con mielodisplasia permite prevenir e identificar, en forma temprana, trastornos anatómicos y/o funcionales del tracto urinario que puedan poner en riesgo la vida del paciente. Gran parte de la información y experiencia aquí presentada fue recaudada durante el trabajo realizado en la División de Urología del Centro de Ciencias de la Salud de la Universidad de Texas, Houston-USA y en la Unidad de Video-Urodinamica, Neurourología e Incontinencia Urinaria del Hospital de Clínicas Caracas-Venezuela.
Palabras claves: mielodisplasia; disrafismo espinal; urodinamica; vejiga neurogénica.
DEFINICIÓN
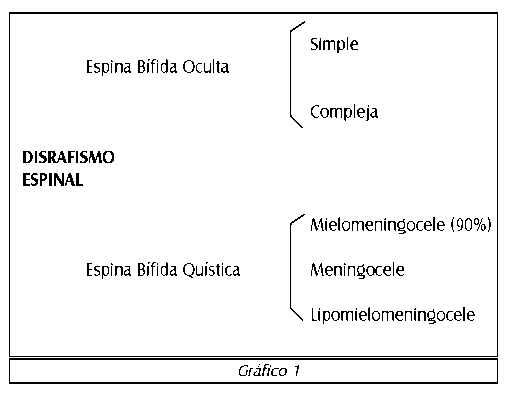
Mielodisplasia (espina bífida) se refiere a una malformación que afecta a la porción caudal del tubo neural y los arcos vertebrales y representa la causa más común de vejiga neurogénica en niños.1 Espina bífida oculta (disrafismo espinal oculto) resulta de la falla de la fusión del arco vertebral, usualmente en la columna sacra, lumbar o cervical, y es generalmente un hallazgo incidental en el cual solo un defecto óseo está presente aunque puede existir una variedad bifi-da oculta compleja con una prevalencia de 1% que ocasiona problemas urológicos.2 Espina bífida quísti-ca se caracteriza por presentar una protrusión de un saco o quiste a través de un defecto de un arco vertebral y éste puede incluir partes de tejido nervioso, meninges, líquido espinal y/o grasa. En un Meningocele el saco contiene únicamente las meninges; mientras que un Mielomeningocele, el cual es visto en un 90% de pacientes con espina bífida quística, contiene las meninges y cierta parte de los elementos de la medula espinal. Un Lipomielomeningocele comprende crecimiento de tejido graso y médula espinal, ambos protruyendo en el saco. Mielosquisis, ocurre cuando la médula espinal está completamente abierta sin cubiertas de meninges y es la forma más severa de espina bífida quística.1 (Ver gráfico 1).
PATOGÉNESIS, INCIDENCIA, ETIOLOGÍA Y PRESENTACIÓN CLÍNICA
La incidencia de disrafismo espinal en el mundo es de aproximadamente 2/1000 nacimientos y en USA aproximadamente 1/1800, pero varía geográficamente, siendo más común hada el este del país. En los últimos 50 años, ha existido una disminución sostenida en el número de defedos del tubo neural incluyendo mielodisplasia, lo cual se relaciona probablemente con las mejoras introducidas en el diagnóstico prenatal de la condición, consulta genética, suplementación de áddo fólico y a la culminación del embarazo. La región lumbar es la más frecuentemente comprometida (lumbar 26%, lumbosacra 47%) siendo seguida por la región sacra (20%) y la torádea (5%) y la menos frecuentemente afectada es la región
cervical (2%). Sin embargo los pacientes con mielomeningocele cervical y toráxico alto, tienen un riesgo bajo de presentar desordenes de la micción y deterioro del tracto urinario superior, a menos que otras condiciones, tales como anclaje congénito de la medula, este presente.3
Entre 80 y 90% de los neonatos con mielodisplasia también tienen hidrocefalia. La lesión neurológica creada por el mielomeningocele produce disfunciones variadas: motora, sensorial y autonómica. Y dependiendo de la extensión de la lesión, anomalías asociadas y si la reconstitución de nervios ocurre debajo de la lesión: lesiones torácicas y cervicales altas. La extensión de la falla vesical, intestinal y de extremidades inferiores se correlaciona con el nivel y la severidad del compromiso neurológico, aunque aproximadamente 5% de los pacientes tienen función normal del tracto urinario inferior. Entre 5% y 10% de pacientes con espina bífida quística tienen un meningocele, con fallas neurológicas y urológicas menos severas.1 Malformaciones del tracto urinario ocurren en 3% de pacientes con mielodisplasia (riñón en herradura, ectopia cruzada, agenesia renal, etc.) y 5% tienen criptorquidia.4
La causa de la mielodisplasia es incierta. El tubo neural normalmente se fusiona y se cierra completamente. El proceso ocurre de la región cervical a la caudal y se inicia cerca del día 20 de gestación finalizando el día 26 del desarrollo. En el 5-10% de los niños se piensa que los defectos embrionarios básicos son: 1. la pérdida de tubularización completa del tubo neural, 2. la inadecuada invaginación del meso-dermo y 3. el subsecuente arresto de la formación de los arcos vertebrales. La ausencia de los arcos óseos vertebrales posteriores y las capas integumentarias permiten a las meninges protruir hada las estruduras ectodérmicas laterales con o sin elementos neurales.5
Numerosos estudios han sugerido una variedad de fadores de riesgo tales como localizadón geográfica, status económico y defidencias dietéticas y de ácido fólico. También han sido implicados múltiples teratógenos, tales como alimentos ahumados, medicamentos, alcohol e infección. Alteraciones genéticas han sido involucradas en parientes con mielodisplasia. Por ejemplo, cuando hay un niño con espina bífida en la familia, existe un 5% de riesgo de afectación en futuros embarazos, y cuando hay dos niños afectados la incidencia es de 10-12%. Sin embargo, en más del 90% de todos los nacimientos con espina bífida no hay historia familiar. Existe una ligera predominancia del sexo femenino así como también variabilidad étnica, tanto negros como asiáticos tienen más baja incidencia que los blancos.3
La evaluación y el tratamiento neuroquirúrgico son iniciados inmediatamente después del nacimiento de un niño con mielomeningocele. El defedo espinal usualmente es cerrado dentro de las primeras 24-48 horas. Esto permite que el niño sea estabilizado y evaluado para descartar anormalidades asodadas, tales como malformaciones cardíacas y gastrointestinales las cuales podrían diferir la intervención quirúrgica precoz.
Aproximadamente 85 a 100% de los neonatos con mielodisplasia tienen el síndrome de Arnold-Chiari, en el cual las amígdalas cerebelosas se han herniado hacia el foramen magno, obstruyendo el cuarto ventrículo e impidiendo que el líquido cerebro-espinal entre al espacio subaracnoideo circundante al cerebro y la médula espinal. La hidrocefalia es corregida mediante la realización de una derivación ventrículo-peritoneal en el momento del cierre del defedo o en una fecha más tardía cuando el infante se encuentre más estable.1
El déficit neurológico no siempre se correlaciona con el nivel del defecto de mielodisplasia. Por esta razón, la extensión del compromiso del trado urinario no puede ser juzgada apropiadamente por un examen físico únicamente. Se necesita realizar una evaluación urológica completa para precisar y determinar la severidad del compromiso del trado urinario. Inidalmente se realiza un examen físico cuidadoso. La evaluación neurológica de miembros inferiores que incluye sensación, tono muscular, movimientos y reflejos, debería ser hecha antes del cierre del defedo. Los primeros estudios paradínicos incluyen nitrógeno ureico sanguíneo, creatinina y uroanálisis.5
Luego de que el redén nacido se encuentra estable posterior al cierre del defedo, debe ser evaluado nuevamente con otro examen físico, así como también con estudios de imágenes tales como urografía de eliminadón o ultrasonido renovesical, uretrodstografia u otros tales cómo la tomografía computarizada helicoidal urografica y resonancia magnética nuclear, y por supuesto, estudios urodinámicos. Los componentes del tracto urinario inferior que deben ser evaluados incluyen las uniones ureterovesicales, detrusor, mecanismos de control uretral y el conducto uretral. La evaluación funcional del tracto urinario inferior debe incluir el estudio de las fases de almacenamiento, vaciamiento y continencia. Sin embargo debe tenerse presente que el nivel de la lesión se correlaciona pobremente con los hallazgos urodinamicos y uroradiologicos. De hecho, las lesiones cervicales, torácicas y óseas lumbares altas tienden a conservar con mayor probabilidad la medula sacra y preservar las contracciones del detrusor que en las lesiones mas bajas.6
LA NATURALEZA DEL PROBLEMA UROLÓGICO
La mayoría de los niños con mielodisplasia tienen:
- Problemas de continencia,
- Deterioro del tracto urinario superior,
- Algún grado de retención urinaria e
- Infecciones urinarias.
El problema urológico es determinar cuál paciente es proclive a experimentar disfunción del tracto urinario superior así como también planear el tratamiento efectivo de la incontinencia y/o disfunción vesicouretral.
En la década de los 60's, Smart y Cooper describieron la disinergia detruso-esfinteriana como el tipo más común de disfunción del tracto urinario bajo en mielodisplasia.7'8 Aproximadamente en el mismo momento, Durham-Smith sugirió que la vejiga arrefléxica y el esfínter interno no funcional eran las formas de disfunción dominante de la vejiga y la uretra en este grupo de pacientes.9 Los principales puntos de vista expuestos a favor de la primera alteración funcional se basan en que: -La evolución de los pacientes con mielodisplasia fue similar a la de aquellos pacientes con daño de médula espinal que tenían disinergia detruso-esfinteriana en comparación a aquellos con arreflexia del detrusor, y en segundo lugar que los estudios radiológicos de la vejiga y uretra en niños con mielodisplasia son parecidos a los de los pacientes con daño medular y disinergia detruso-esfinteriana. Reportes de investigaciones individuales mostraron mejoría del vaciamiento, disminución de la orina residual y mejoría de la función del tracto urinario superior después de sobredila-tadón del esfínter o esfinterotomía en parientes mielodisplásicos, los cuales fueron similares a los resultados obtenidos usando estos métodos en pacientes con lesión medular y disinergia detruso-esfinteriana.10 Sin embargo, a pesar de estas observaciones, la aceptación del uso de los procedimientos ablativos del esfínter no ha ocurrido debido a que muchos niños con mielodisplasia presentaban una incontinencia seria. No hay categoría de pacientes con disfunción vesical neurogénica que estén tan incontinentes como aquellos con mielodisplasia.
La introducción de la cateterización intermitente por Lapides, condujo a una mejoría revolucionaria en el resultado a largo plazo de los pacientes con mielodisplasia, disminuyendo marcadamente la incidencia de las complicaciones urológicas, pero con pocas mejorías de la incontinencia en estos niños.11 De hecho, la experiencia acumulada con el cateterización intermitente ha reflejado que solo el 30-60% de los niños lograron continencia, y este es el grupo de 10-15% pacientes con espina bífida que muestran un cierre normal del cuello vesical, y por tanto alcanzarían la continencia. En 1981 McGuire y colaboradores notaron que de 42 pacientes con mielodisplasia estudiados urodinámicamente, 83% tenían arreflexia del detrusor y 86% un cuello vesical abierto.12 Así pues, que de este grupo estudiado, es probable que solo una minoría de niños con vejiga arreflexica y esfínter interno no funcional alcance continencia por cateterización intermitente.
En resumen hay dos principales problemas urológicos en pacientes con mielodisplasia:
- Incontinencia y el tracto urinario bajo neurogénico, y;
- Complacencia vesical y función del tracto urinario superior.
Cada punto será considerado separadamente.
INCONTINENCIA Y TRACTO URINARIO BAJO NEUROGÉNICO EN MIELODISPLASIA
Hay dos fuerzas que afectan la uretra para determinar la continencia: presión vesical y presión abdominal. Dado que ambas fuerzas son medidas dentro de la vejiga, son difíciles de conceptuar como fuerzas diferentes; para la uretra sin embargo, estas no son equivalentes. Si la función del esfínter interno es normal, la uretra es capaz de resistir excursiones fisiológicas de la presión abdominal y mantendrá la continencia del cuello vesical (esfínter interno). Por otra parte, la presión intrínseca generada por la vejiga como resultado del llenado o de una contracción, refleja o autónoma, causaría fuga tan pronto cuando la presión de la uretra (esfínter externo) y la vejiga sean iguales. La presión máxima de cierre uretral será determinante en el momento de la fuga, solamente si la vejiga es arrefléxica y el esfínter externo de la uretra no está afectado por el grado de llenado o actividad vesical.
La presión de punto de fuga abdominal es definida como la presión abdominal requerida para vencer la resistencia uretral, y por tanto, producir fuga. Un mecanismo de cierre normal del esfínter interno, resiste las excursiones fisiológicas de la presión abdominal; un esfínter interno débil permite fugas a presiones abdominales menores de 80 cms de H20 y un esfínter interno no funcional fuga a presiones menores de 60 cms de H20. Es importante puntualizar que esta presión abdominal es independiente y no relacionada a la función del esfínter externo o a presiones registradas en esta área, por ejemplo el área de presión de cierre uretral máxima.
La presión de punto de fuga vesical es definida como la presión intrínseca de la vejiga requerida para vencer la resistencia uretral (esfínter externo) durante la fuga o la micción, y esta presión es derivada únicamente de la misma vejiga. La presión de punto de fuga vesical es proporcional, y usualmente igual a la presión ejercida en el área del esfínter externo.
Estas dos fuerzas de expulsión o de salida son diferentes. La presión abdominal no tiene efecto sobre la función ureteral, en contraste con la presión vesical la cual afecta directamente la capacidad de los uréteres para eliminar orina hacia la vejiga en forma continua. La resistencia a la presión intraabdominal puede ser incrementada sin riesgos, pero la resistencia uretral a la presión vesical no.
Si la presión vesical es la fuerza responsable de producir la incontinencia urinaria en el paciente con mielodisplasia, el tratamiento debe ser dirigido a la vejiga y no al esfínter uretral. Ahora bien, es importante recalcar que un niño con mielodisplasia típicamente está incontinente como resultado de una ausencia de función del esfínter interno. La incontinencia urinaria de esfuerzo severa se relaciona a la incapacidad de la uretra proximal de resistir cambios de la presión abdominal, y puede ocurrir a pesar de la presencia de una adecuada presión del esfínter externo capaz de producir los efectos deletéreos de presión vesical elevada sobre la función ureteral.
La complacencia vesical es anormal en todos los pacientes con mielodisplasia, pero en la mayoría de los casos la presión vesical sola es un factor contribuyente y no causante de la incontinencia, explicando por qué muchos niños persisten incontinentes a pesar del uso de agentes anticolinérgicos o cateterización intermitente.13 La complacencia vesical anormal en este grupo de pacientes perjudica el beneficio de la frágil presión del esfínter externo sobre la vejiga y esta presión (esfínter externo) no es muy efectiva para contrarrestar la presión abdominal. A medida que la ventaja de la frágil presión del esfínter externo se torna progresivamente menor que la presión vesical, la fuga de orina se producirá a presiones abdominales y vesicales cada vez menores.
COMPLACENCIA VESICAL Y FUNCIÓN DEL TRACTO URINARIO SUPERIOR
Han existido reportes de factores de riesgo para el tracto urinario superior. Tanaka y cois, demostraron que una presión máxima de cierre uretral mayor de
50 cms de H20 constituya un factor de mal pronóstico para reflujo en pacientes con mielodiplasia. Ellos propusieron que la resistencia uretral es importante para el deterioro del tracto urinario superior en niños no tratados con mielodisplasia asimismo otros describen que la incidencia de deterioro del tracto urinario superior en este grupo de pacientes se ha correlacionado con la edad (alrededor de los tres anos).14 Sin embargo no hay duda que la contribución mas importante en este sentido fue la de McGuire, Woodside y colaboradores quienes demostraron en 1981 que la presión de punto de fuga vesical que excedía 40 cms. de H20 estaba asociada con una alta tasa de deterioro del tracto urinario superior, el cual con el tiempo se acercaba a un 100%. Como antes se mencionó, 83% de un grupo de 42 pacientes mielodisplásicos manifestaron arreflexia del detrusor y 86% un mecanismo no funcional del esfínter interno. Bajo estas circunstancias, la presión de punto de fuga vesical fue idéntica a la presión máxima del derre uretral. Por otro lado, en el grupo reduddo de parientes con disinergia detruso-esfinte-riana (7%) la presión de punto de fuga vesical fue más alta que la presión máxima del cierre uretral restante, estos hallazgos reflejan un incremento en la actividad del esfínter externo al momento de la contracción vesical refleja.12
McGuire y colaboradores han demostrado en un grupo de pacientes con mielodisplasia, seguidos en la Universidad de Michigan con cistometrogramas repetidos, que si los dejaba de tratar 40% de los niños desarrollaban valores altos de presión de punto de fuga vesical y deterioro del tracto urinario superior a los cinco años. La cateterización intermitente y la medicación anticolinérgica resultaban en mejoras definitivas en acerca del 85% de los niños que requirieron este tratamiento, fallando en 15% de los pacientes quienes continuaron mostrando deterioro progresivo del tracto urinario superior.15 Analizando estos mismos datos, Ghoniem y colaboradores encontraron que los niños con deterioro del tracto urinario superior invariablemente mostraban pobre complacencia vesical.13'16
MANEJO DE LOS PACIENTES CON MIELODISPLASIA
Los objetivos que se pretenden lograr durante el tratamiento de estos pacientes están dirigidos a:
- Mejorar y/o alcanzar un estado optimo de continencia y de almacenamiento, y;
- Prevenir y/o disminuir el riesgo del daño al tracto urinario superior. Existen dos tendencias que han creado controversias, en cuanto al manejo del problema: una propone una conducta expectante con evaluaciones radiológicas periódicas, hasta identificar signos precoces de deterioro del tracto urinario superior. Teichman, Klose y cois., favorecen esta tendencia ya que ellos consideran que estos cambios en el tracto superior pueden ser reversibles.17 Y la otra conducta avoca una conducta proactiva, la cual consiste en identificar, desde el punto de vista urodi-namico, aquellos pacientes con riesgo de daño al tracto urinario superior y comenzar en ellos, medidas tipo cateterización intermitente y/o uso de medicamentos anticolinergicos.18 Existen varias razones en pro de esto últimas. Nosotros hemos demostrado que: 1. Aunque la mayoría de los cambios del tracto urinario superior parecen ser reversibles, la complacencia vesical no siempre mejora luego de la instauración de la cateterización intermitente y/o terapia farmacológica; 2. Mas del 90% de los pacientes tienen o desarrollaran, en alguna etapa de sus vidas, signos clínicos, urodinamicos y/o uroradiologicos que indicaran la necesidad de comenzar con cateterización intermitente; 3. La urodinamia no es 100% precisa ni sensible ni especifica en predecir cuales de estos pacientes recién nacidos tendrán cambios deletéreos en el tracto urinario superior; 4. Las lesiones neurológicas pueden cambiar durante los primeros tres anos de vida, especialmente durante el primer ano y estos cambios silentes podrían no ser detectados (disinergia); 5. Los padres y los pacientes tienden a aceptar mejor la implementadón temprana de la cateterización intermitente. En vista de todo lo expuesto y de acuerdo a los resultados de diferentes estudios, se justifica manejar proactivamente a este grupo de pacientes.6'18
Los recién nacidos con mielodisplasia a menudo demuestran altos valores de presiones de puntos de fuga, pero estos usualmente caen a niveles muy bajos luego del cierre neuroquirúrgico del defecto. Basado en esta información, es mandatario evaluar en estos niños la presión de punto de fuga vesical después el cierre del defecto y antes del alta. McGuire y colaboradores han demostrado que controlando la presión vesical ellos fueron capaces de prevenir el deterioro del tracto urinario superior a los tres años, pero no siempre alcanzaban la continencia.15
La complacencia vesical y la determinación de la presión de punto de fuga vesical puede ser hecha en niños jóvenes usando un catéter uretral de 5 o 7 Fr. y un sistema de monitoreo de presión. El manejo está basado en la magnitud de la presión de punto de fuga vesical (Ver Gráfico 2). Si esta es de 30 cms de H20 o mayor, entonces la cateterización intermitente es iniciada y se repite la medición de la presión de punto de fuga vesical en 4 a 6 semanas. En este momento la complacencia vesical debería mejorar en promedio para un volumen dado y las presiones vesicales deberían ser más bajas que las registradas en la visita anterior. También es importante el volumen máximo obtenido durante la cateterización intermitente, debido a que la presión a este volumen debería ser menor de 30 cm de H20. Si esto no es alcanzado, se debería comenzar a utilizar agentes anticolinérgicos en dosis ajustadas para la edad. La
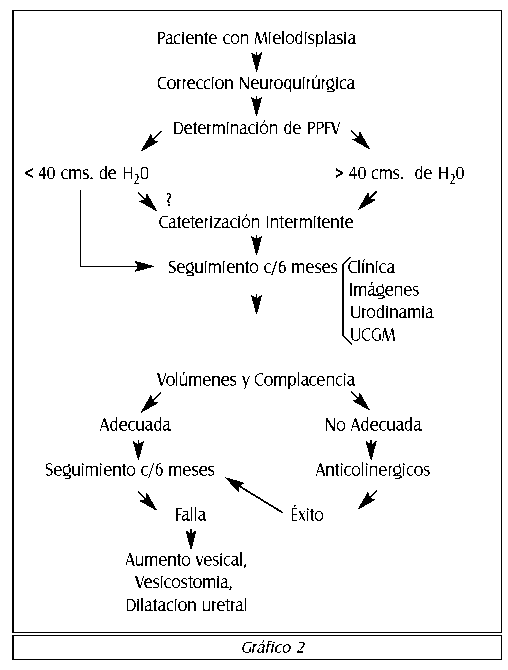
medidón de la presión del punto de fuga debería ser repetida en intervalos regulares. Si éste tratamiento se inicia precozmente, la oportunidad de alcanzar el éxito se acerca al objetivo deseado de obtener una vejiga complaciente que mantenga una presión segura a los volúmenes que usualmente almacena. Por ejemplo, un niño cuyo pañal esta usualmente húmedo, al cateterizar podría tener una presión vesical de 16 cms de H20 para un volumen de 180 cc, volumen que es mayor que el que se obtiene al cateterizar. Con el niño en supino, la pérdida uretral es observada a un volumen vesical de 290cc y una presión de 48 cms de H20. Este niño no tiene riesgo de daño del tracto urinario superior a pesar del alto valor de presión de punto de fuga, debido a que los volúmenes obtenidos en la cateterización intermitente, son mucho menores que aquellos requeridos para causar elevación de la presión vesical que conduzca a pérdida. La causa de la incontinencia en este caso es la interacción de la presión abdominal y un esfínter interno no funcional. Permítanme considerar otro ejemplo: una niña de tres años tiene volumen reducido al cateterizar intermitentemente y se encuentra húmeda la mayoría de las veces. Al máximo volumen obtenido por cateterización intermitente, la presión vesical es de 44 cms de H20 y la presión de punto de fuga vesical con el niño en supino es de 49 cms de H20. Esta es una situación peligrosa ya que se registran altas presiones vesicales a volúmenes usuales obtenidos con cateterización intermitente. Cuando el tratamiento con cateterización intermitente y con medicación anticolinérgica falla, esto usualmente es debido a que el niño se pierde de seguimiento por un tiempo. Por tanto especialmente durante los primeros cinco años, los estudios urodinamicos de presión vesical deberían ser repetidos cada seis meses. El ultrasonido renal es útil ya que permite detectar cambios precoces en el tracto urinario superior que podrían significar un problema relacionado al incremento de la presión vesical. La oxibutinina (Ditropan®) es administrada en una dosis de 1,0 mg por año de edad, cada 12 horas. En neonatos o niños menores de un año, la dosis disminuye por debajo de 1,0 mg en relación a la edad del niño para el momento y es incrementada proporcionalmente a medida que el niño o la niña se acerquen al año. No ha existido ninguna manifestación de efectos secundarios cuando la oxibutinina ha sido administrada de acuerdo a este esquema. (Ver cuadro 1).

Cuando una vejiga no responde a terapia conservadora, entonces la resistencia de salida debe ser disminuida por una vesicostomía o dilatación uretral o aumento del reservorio vesical.19'20 La vesicostomía reduce la resistencia de salida al sobrepasar una uretra funcionalmente deficiente (en relación a contrarrestar tanto la presión abdominal como la presión vesical). Este efecto de la reducción de la resistencia de salida también puede ser logrado mediante la dilatación del esfínter uretral. Con estos dos métodos, podemos esperar: 1. Mejoría de la función del tracto urinario superior; 2. Mejoría en el grado de reflujo vesicoureteral y la incidencia de infecciones sintomáticas;
y 3. Sorprendentemente, una mejoría en la complacencia vesical con la dilatación del esfínter uretral.19 La dilatación uretral se intenta primero bajo anestesia general, el esfínter uretral de las niñas es dilatado hasta un punto en el cual la presión de punto de fuga vesical cae a 20 cms de H20 o menos. En niños, un balón tipo Grundzing es usado para dilatar el esfínter hasta aproximadamente 30 Fr, luego de lo cual la presión de punto de fuga vesical es nuevamente medida para asegurarse que cae a un valor aceptable. Si esto no ocurre, la dilatación se repite a un mayor diámetro. Estos niños son seguidos con determinaciones regulares de presión de punto de fuga vesical y ultrasonogramas.20
Si las medidas mencionadas anteriormente no son prácticas, o la situación es tan mala que amerite que se tomen medidas definitivas, entonces la miomec-tomía del detrusor o la dstoplastia de aumento podrían ser usadas como último recurso. El tratamiento de la vejiga mielodisplásica persigue obtener una fase de almacenamiento a bajas presiones, lo cual es requerido para el vadamiento vesical. Si se elige tratar la disfunción de almacenamiento eliminando la resistencia de salida, la continenda es el predo que se debe pagar, pero la función del tracto urinario superior podrá ser preservada. Por otro lado, si uno elige preservar la continencia, mejorar la fundón del esfínter interno y obtener una fase de almacenamiento a bajas presiones, el predo es usualmente cateterizadon intermitente.
McGuire y colaboradores han demostrado que realizar evaluadones urodinámicas regulares (presión de punto de fuga vesical y curvas de volumen-presión) con implementadón inmediata de cateterización intermitente, tan pronto cuando la presión comience a aumentar, elimina la necesidad de imple-mentar terapias más agresivas requeridas cuando se produce una pobre complacencia vesical.21 Cuando los parientes son tratados en los primeros 4 ó 5 años de vida, nosotros estamos de acuerdo con el objetivo de preservar bajas presiones en la fase de almacenamiento, aún si esto significa usar cateterización intermitente, drogas, reducción quirúrgica de la resistencia de salida o cistoplastia de aumento. Precisamente para tratar de facilitar las evaluaciones urodinamicas regulares, recientemente se han diseñado equipos de medición ambulatoria de la presión del detrusor, que tienen como finalidad detedar cambios precoces de significancia clínica de la condición urológica de base, sin embargo aun faltan precisiones técnicas y confirmar con estudios relevantes si estos dispositivos tienen validez para la toma de decisiones clínicas.22
Adualmente está bien documentado que la lesión neurológica de la mielodisplasia es un proceso patológico dinámico con cambios que toman lugar a través de la infancia, especialmente en infantes pequeños, y en la pubertad, cuando nuevamente la tasa de crecimiento lineal se acelera. Cuando se evidencia un cambio en las evaluaciones neurológicas, ortopédicas y/o urodinámicas, la investigación ima-geneologica del sistema nervioso central pudiera revelar anclaje de la médula espinal, hidromielia de la médula espinal, incremento de la presión intracraneal secundaria a un mal funcionamiento de la derivación ventrículo peritoneal, o a una her-niación parcial del tallo encefálico y el cerebelo. Los niños con función de la médula sacra completamente intada o solo enervación parcial están particularmente expuestos a cambios progresivos. La resonancia magnética es el estudio de elección debido a que revela con detalle la anatomía de la columna vertebral y del sistema nervioso central.23
La dstouretrografía miccional es de utilidad para determinar si el trado urinario de salida está cerrado o abierto en reposo, y si existe reflujo vesicoureteral. Si el tracto urinario de salida (uretra proximal) se encuentra cerrado en reposo, puede que el reflejo vesical fundonal sea el problema. Si éste el caso necesitamos determinar si la vejiga trabaja coordinada o en forma dissinérgica con el esfínter externo. Si existe dissinergia detrusoesfinteriana, las presiones miccionales serán superiores a los 30 cms de H20. Esta condición debe ser tratada implantando a la brevedad cateterismo vesical intermitente y agentes anticolinérgicos. En estos niños se puede tener la expedativa de alcanzar la continencia si el tratamiento es iniciado en estadios precoces antes de que la interacdón detrusor-esfínter dañe la complacencia vesical irreversiblemente. Cuando esto ocurre, la cistoplastia de aumento es el mejor método para restaurar el comportamiento normal de almacenamiento vesical. Igualmente la miomedomia del detrusor ha sido popularizada por Cartwright como una alternativa terapéutica para incrementar la capacidad vesical y disminuir las presiones de llenado.24'25 Sin embargo nosotros hemos demostrado que la miomectomia del detrusor (autoaumento
vesical) no ofrece resultados clínicos o urodinamicos satisfactorios en pacientes mielodisplasicos.26 Si el tracto urinario de salida (uretra proximal) se encuentra abierto en reposo, existe arreflexia del detrusor y la micción en la manera usual no es posible. Igualmente, si existe reflujo vesicoureteral, la presión vesical que lo causa es una variable crítica. Una vejiga arrefléxica eleva su presión a medida que aumenta el volumen. El verdadero reflujo vesicoureteral primario de baja presión que requiere ureteroneods-tostomía es infrecuente en parientes mielodisplási-cos. Cuando el reflujo está presente, usualmente es secundario a complacencia vesical anormal y presiones elevadas (Ver Gráfico 3). Por esta razón es ideal que la imagen radiológica del llenado vesical y la fuga urinaria sean combinadas con medidas uro-dinámicas de presiones debido a que esto proporciona la información necesaria para planificar, ejecutar y monitorear el tratamiento de esta población de pacientes en relación a dos problemas independientes: 1. Presiones vesicales elevadas, y 2. Incontinencia. De manera que la información obtenida de una evaluación videourodinamica integral debería incluir: 1. Determinación imageneologica y urodinamica del status del esfínter interno, 2. Curvas de medidas de volumen-presión vesical y 3. Medidas de presiones de puntos de fuga urinaria del detrusor y de valsalva. Cuando existe un reflujo vesicoureteral de alto grado, el diagrama de la curva volumen-presión podría resultar artificialmente normal debido a que parte del reservorio funcional vesical está comprendido por los uréteres. En este caso, el reflujo puede hacer que una curva inadecuada presión-volumen sea observada como normal. Más aún, esta curva artificialmente normal de presión-volumen oculta la pobre complacencia vesical la cual, de hecho, es responsable del reflujo. En este punto, si la presión de punto de fuga vesical es mayor de 35 cms de H20, o la presión máxima de cierre uretral es 35 cms de H20, nosotros podemos asumir que la presión vesical causó el reflujo. Reparar el reflujo al momento de la cistoplastia de aumento todavía es controversial, debido a que después de la enterodstoplastia, el reflujo vesicoureteral masivo a menudo se resuelve espontáneamente. Por lo tanto, la decisión de proceder con el réimplanté ureteral debe ser individualizada en cada paciente. Sin embargo, esta claro que realizar el réimplanté ureterovesical en forma aislada (sin cistoplastia de aumento) no es el tratamiento correcto para esta condición. Finalmente, la ausencia de reflujo veicoureteral masivo no protege al tracto uri-

nario superior de los efectos de las presiones vesicales elevadas.27
MÉTODOS PARA ALCANZAR LA CONTINENCIA
EN PACIENTES CON MIELODISPLASIA
Brevemente consideraremos las diferentes opciones de tratamiento para la incontinencia en pacientes mielodisplásicos, no sin antes precisar cuándo se debe tratar a un niño mielodisplásico con incontinencia. Es muy importante individualizar cada caso de forma de poder relacionar presión abdominal, actividad física y estado neurológico. El esfínter uretral de un paciente confinado a una silla de ruedas, incapaz de valerse por sí mismo, no se enfrenta a la misma fuerza de expulsión que el de un niño que camina en muletas.
Tratamiento farmacológico. Los medicamentos anticolinérgicos pueden, al influenciar la presión vesical tener un efecto sobre la continencia, aunque no ejercen efecto alguno sobre la función uretral y su interacción con la presión abdominal. El uso de agentes alfa-estimulantes no ha sido exitoso en mejorar el cierre uretral.
Esfínter urinario artificial. Buenos resultados han sido obtenidos a corto plazo con el uso del esfínter urinario artificial. Existen, sin embargo dos problemas fundamentales: 1. Complicaciones inherentes al procedimiento: infección, erosión, falla de los componentes y el mecanismo hidráulico; 2. Complicaciones tardías del efecto obtenido con el procedimiento: desarrollo silente de enfermedad en el tracto urinario superior, posiblemente relacionado al hecho de que el esfínter artificial resulta en una significante mejoría del mecanismo esfinteriano uretral lo cual se opondría a ambas presiones, abdominal y vesical en forma efectiva, y al no vaciar frecuente y completamente la vejiga, se crea una situación que puede conllevar al deterioro de la complacencia vesical y derivado de esto, deterioro del tracto urinario superior. De cualquier manera, resultados a largo plazo serán capaces de evaluar el uso de los esfínteres artificiales en este grupo de pacientes.
Cinchas fascíales. Estas han sido usadas en pacientes masculinos y femeninos con éxito razonable. Las cinchas mejoran la eficiencia del esfínter uretral contra la presión abdominal, sin influenciar la presión de punto de fuga vesical.28 No ha habido reportes definitivos del deterioro del tracto urinario superior relacionados al uso de las cinchas en la población mielodisplásica. La principal desventaja de las cinchas es la necesidad de cateterización intermitente. Además se ha propuesto la realización de una técnica de tipo envolvente mediante la utilización de aponeurosis del músculo recto anterior del abdomen para resolver los casos en los cuales a pesar de una enterocistoplastia de aumento, el paciente persiste con incontinencia debido a la existencia de un cuello vesical marcadamente abierto. En este paciente la cincha de aponeurosis del recto rodea circunferencialmente englobando el cuello vesical. Este grupo de pacientes puede seleccionarse en base a si presentan: presión de punto de fuga de Valsalva de menos de 40 cms de H20 o un cuello vesical abierto en la ds-tografia o en la endoscopia.29
Materiales inyectables para la continencia. El tratamiento ideal para la continenda debida a un esfínter interno no funcional, sería un método que simplemente coaptara el esfínter interno sin indudr un cambio significativo en la presión del detrusor. Esto puede ser logrado con la inyección submucosa de sustancias implantables como el colágeno. Es posible alcanzar un incremento dramático en el punto de presión de escape urinario de valsalva a trabes de una inyecdón de colágeno sin modificar el punto de presión de escape urinario del detrusor. Por tanto, este es un método seguro, debido al hecho de que la baja presión de cierre del esfínter interno produce un mecanismo competente contra la presión abdominal sin modificar la reladón esfínter externo-vejiga y de allí, determinar la integridad del trado urinario superior. McGuire y colaboradores usaron inyecciones de colágeno en un grupo de niños mielodisplásicos con incontinencia, con una tasa de cura o mejoría promedio de 88% luego de 1 a 6 inyecciones (promedio 2.1).30 Ningún tratamiento para la incontinencia fundonará si la complacencia vesical se encuentra alterada, y debemos claramente separar los tratamientos dirigidos a mejorar la presión vesical de aquellos dirigida a contener la perdida urinaria causada por la presión abdominal. Los métodos para mejorar o aumentar la función uretral y por tanto alcanzar la continenda requieren un reservorio vesical con presiones normales. Si la incontinenda urinaria ocurre a pesar de existir un adecuado reservorio funcional a los volúmenes usuales de cateteri-zadón, la causa más probable de la incontinencia es secundaria a un esfínter interno no funcional. Este diagnóstico puede ser hecho basado en una adecuada dstografía que demuestre un esfínter interno no funcional, abierto de la salida vesical al esfínter externo. Para medir la efidenda del esfínter interno contra la presión abdominal se debe determinar el punto de presión de escape urinario de valsalva. Una vez que esto se ha hecho y se evalúa la fundón adecuada del reservorio vesical, las opdones de tratamiento son inyección de colágeno, una ancha o un esfínter artificial. Idealmente el colágeno u otros materiales inyectables reemplazarían los otros dos métodos debido a que ofrecen seguridad para el trado urinario superior y evitan una cirugía abierta.
Alergia al látex. Recientemente ha habido numerosos reportes de niños con sensibilidad al látex, y aparentemente los niños con mielodisplasia son de particular riesgo. La reacción puede ser menor, variando desde urticaria de contado, rinitis y conjuntivitis a severa anafilaxia incluyendo bron-coespasmo y colapso cardiovascular. Esta respuesta alérgica parece ser mediada por IgE. Se piensa que los niños con mielodisplasia son de mayor riesgo para hipersensibilidad para el látex debido a la frecuente exposición a este tipo de material durante los procedimientos quirúrgicos y el cateterismo vesical intermitente. Los procedimientos abdominales en pacientes susceptibles pueden estar asociados con anafilaxia. Es importante identificar aquellos niños que tienen riesgo antes de hacer una cirugía principal abdominal o reconstructiva. Una historia puede identificar reacciones en el pasado, y un test cutáneo al látex puede identificar los pacientes de riesgo.
MÉTODOS PARA ALCANZAR UN ESTADO ÓPTIMO DE ALMACENAMIENTO EN PACIENTES CON MIELODISPLASIA
Como se expuso anteriormente, tanto el cateterismo vesical intermitente como las medicaciones anti-colinérgicas, al modificar las presiones vesicales, pueden mantener y/o mejorar la complacencia vesical. Sin embargo cuando estas medidas fallan se recomienda las correcciones quirúrgicas. Como hemos mencionado existen dos tipos de cistoplastia de aumento, aquellas que requieren manejo postoperatorio del moco (usando intestino delgado o grueso) y aquellas que no precisan de lo anterior (cistoplastia de aumento ureteral, detrusotomía, aumento con estómago y aumento compuesto, ej: procedimiento de Gonzáles) las cuales no parecen ser tan buenas para mejorar la complacencia vesical a largo plazo como anteriormente se pensaba. El manejo del moco es fundamental para evitar: infecciones, formación de cálculos vesicales, problemas de vaciamiento a través del catéter. La producción de moco disminuye con el tiempo (alrededor de los dos años) y es fácilmente manejable por la mayoría de los pacientes. Cuando se encuentra disponible, el uréter dilatado parece ser el mejor material para cistoplastia de aumento.2 Otra forma que se ha estudiado para lograr o mantener, un almacenamiento vesical a bajas presiones, es la estimulación intravesical, introducida por Katona y cois, en 1959 y mejorada por Katona y Berenyi en 1975. A pesar de los reportes, según estos autores, de logro de continencia diurna de hasta un 71%, así como vaciamiento espontáneo luego de ser capaces de sentir la vejiga llena, en estos pacientes. En USA, dicha técnica no se ha popularizado y los reportes de éxito varían entre un 16% a 53%. Los cuales generalmente no se mantienen en el tiempo y no son iguales a los descritos por Katona.31'32
En conclusión es importante reconocer a la mielodisplasia o disrafismo espinal como la principal causa de vejiga neurogénica en niños y a la vez no olvidar que es causa de problemas significativos de morbimortalidad en esta población de pacientes. Por tanto saber orientar, diagnosticar y manejar los problemas clínicos que fundamentalmente ocasiona dicha enfermedad es esencial para lograr buenos resultados en el tratamiento planeado por el especialista, y para lograr lo anterior debemos tener conocimientos básicos acerca de la dinámica y patogénesis de la enfermedad.
En consecuencia necesitamos tener claro que:
a) La evaluación urodinámica integral, representa la piedra angular para el diagnóstico y diseño de las estrategias terapéuticas que nos permitan prevenir el deterioro del tracto urinario superior, mantener la complacencia vesical, mejorar la continencia y el vaciamiento vesical;
b) El manejo proactivo ofrece a nuestro paciente las mejores probabilidades de control de su condición clínica, y
c) El cateterismo vesical intermitente representa una herramienta de gran utilidad y vigencia en el tratamiento de los problemas que ocasiona dicha entidad clínica.
Y para finalizar creemos que a pesar que actualmente hay conceptos más claros con respecto al manejo de la enfermedad, sin embargo, nunca se insistirá lo suficiente para entender y recalcar la complejidad de los problemas urológicos que ocasiona la mielodisplasia.
1. McGuire, EJ; Bloom, DA; Ritchey, ML: Myelodysplasia, in Problems in Urology. 7:1:1, 1993.
2. Feng, W; Churchill, B: Dysfunctional elimination syndrome in children without obvius spinal cord diseases. Ped. Clin. N.A. 48:6, 2001.
3. Perez, L; Wilbanks, J; Joseph, D; Oakes, J: Urological outcome of patients with cervical and upper thoracic myelomeningocele. J. Urol. 164: 962, 2000.
4. Kaufman,AM; Norbeck, J; Roberts, A, et al:
Congenital renal anomalies associated with spinal
dysraphism. Meeting AUA, 1997.
5. Selzman, A; Elder, J; Mapstone, T: Urologie consequences of myelodysplasia and other congenital abnormalities of the spinal cord. Urol. Clin. N.A. 20:3:485, 1993.
6. Churchill, B; Abramson, R; Wahl, E: Dysfunction of the lower urinary and distal gastrointestinal tracts in pediatrics patients with known spinal cord problems. Ped. Clin. N.A. 48: 6, 2001.
7. Smart, PJG: Spasm of the external sphincter in spina bifida. Br. J. Urol 37:574, 1965.
8. Cooper, DGW; Bladder studies in children with neurogenic incontinence, with comments on the place of pelvic floor stimulation. Br J Urol 40:157, 1968.
9. Smith ED: Spina bifida and the total care of spinal myelomeningocele. Springfield, IL: Chas C. Thomas, 1965.
10. Shochat SJ, Perlmuter AD: Myelodisplasia with severe hydronephrosis :the value of urethral dilatations. J Urol 157:146, 1972.
11. Lapides J, Diokno AC, Lowe BS, et al: Follow-up on unsterile, intermitent self catheterization. J Urol 111:184, 1974.
12. McGuire, EJ; Woodside, J; Borden, T, et al: Prognostic value of urodynamics testing in myelodysplastic patients.J. Urol. 126:205, 1981.
13. Ghoniem, GM; Roach MD; Lewis, VH, et al: The value of leak pressure and bladder compliance in the urodynamic evaluation of meningomyelocele patients. J. Urol. 144: 1440,1990.
14. Tanaka, H; Kakizaki, H; Kobayashi, S, et al: The relevance of urethral resistance in children with myelodysplasia: its impact on upper urinary tract deterioration and the outcome of conservative management. J Urol 161: 929, 1999.
15. McGuire, EJ; Woodside, JR; Borden, TA: Upper tract deterioration in patients with Myelodysplasia and detrusor hypertonia: A follow up study. J. Urol. 129: 823, 1983.
16. Ghoneim, G; Bloom, D; McGuire, E; Stewart, K: Bladder compliance in meningomyelocele children. J. Urol. 141: 1404, 1989.
17. Teichman, JM; Scherz, HC; Kim, KD; Cho, DH; Packer, MG and Kaplan, GW: An alternative approach to myelodysplasia management: aggresive observation and prompt intervention. J.Urol., part 2, 152:807, 1994.
18. Kaufman,AM; Ritchey,M; Roberts,A; Rudy,D; McGuire,E: Decreased Bladder Compliance in Patients with Myelomeningocele Treated with Radiological Observation. J. Urol. 156: 2031, 1996.
19. Wan, SC; McGuire, EJ; Bloom, DA: Urethral dilation in the management of urological complications of myelodysplasia. J. Urol. 142: 1054, 1989.
20. Bloom, D; Knechtei, J; McGuire, E: Urethral dilation improves bladder compliance in children with meningomyelocele and high leak point pressures. J. Urol. 144: 430, 1990.
21. Wang, SC; McGuire, EJ; Bloom, DA: A bladder pressure management system for myelodysplasia-clini-cal outcome.J. Urol. 140: 1499, 1988.
22. Damaser, M; Brzezinski, J; Walter, J, et al: Estimating detrusor pressure at home in pediatric patients with myelomeningocele. J. Urol. 162: 1410, 1999.
23. Bauer, S: Neurogenic vesical dysfunction in children in Campbell's Urology. 7th Edition, 1996.
24. Cartwrigth, P; Snow, B: Bladder autoaugmentation: Early clinical experience. J. Urol. 142: 505, 1989.
25. Cartwrigth, P; Snow, B: Bladder autoaugmentation: Partial detrusor excision to augment the bladder without use of bowel. J. Urol. 142: 1050, 1989.
26. Kaufman, AM; Kenelly, M; Rudy, D; Ritchey, M: Long Term Outcome in Myelodysplastic Patients Undergoing Detrusor Myectomy. Meeting AUA,
1996.
27. Bauer, S: Early evaluation and management of children with spina bifida in Clinical Neurourology and Urodynamics. Second Edition, 1991.
28. Walker, D; Erhard, M; Starling, J: Long term evaluation of rectus fascial wrap in patients with spina bifida. J. Urol. 164: 485. 2000.
29. Wan, J; McGuire, E; Bloom, D; Ritchey, M: Stress leak point pressure: A diagnostic tool for incontinent children. J. Urol. 150: 700, 1993.
30. Wan, J; McGuire, E; Bloom, D; Ritchey, M: The treatment of urinary incontinence in children using glu-taraldehyde cross-linked collagen. J. Urol. 148: 127, 1992.
31. Pugach, J; Salvin, L; Steinhardt, G: Intravesical electrostimulation in pediatric patients with spinal cord defects. J. Urol. 164: 965, 2000.
32. Van Savage, J; Perez, A; Palanca, L, et al: Electrically stimulated detrusor myoplasty. J. Urol. 164: 969, 2000.
Lic. Leticia G. O'Neill * Lic. Luisa Ay ala Dra. Josefa Vivas de Vegas
Servicio de Nutrición Diétetica Hospital Privado Centro Médico de Caracas
ASPECTOS NUTRICIONALES EN EL PACIENTE CON TRASTORNOS LITIÁSICOS
La litiasis renal es un trastorno relativamente frecuente, que constituye un problema de salud en el ámbito de la atención primaria, por ser una causa importante de morbilidad que origina un elevado costo socioeconómico.1
La litiasis renal, también denominada en la literatura científica como urolitiasis, nefrolitiasis o litiasis renoureteral, es la entidad que se caracteriza por la aparición de cálculos en el aparato urinario superior (parénquima renal, cálices, pelvis y uréter) -figura
1, que pueden producir dolor y obstrucción, facilitando la infección secundaria de las vías urinarias. De igual manera, dependiendo de la magnitud de los cálculos, y de la rapidez con que se tomen las medidas terapéuticas pertinentes para eliminar sus complicaciones, el paciente podría evolucionar hacia la insuficiencia renal por destrucción del parénquima.1'2
Los cálculos renales son conjuntos de cristales mezclados con una matriz de proteínas, que causan la obstrucción del flujo de orina en el sistema colector del riñón, de los uréteres o de la uretra, ocasionando dolor severo, sangramiento, o erosión local del tejido renal.4
Se han descrito dos tipos de calcificaciones asociadas con el tracto urinario: la urolitiasis, que se refiere a la calcificación macroscópica en el sistema colector renal, y la nefrocalcinosis, calcificación microscópica que se observa a nivel de los túbulos, del epitelio tubular o del intersticio renal.5
2. CONSIDERACIONES EPIDEMIOLÓGICAS
De acuerdo con los datos proporcionados por la Encuesta Nacional de Salud de los Estados Unidos (U.S. National Health Interview Survey: 1990 -1992), aproximadamente 1 millón de personas presentan cálculos renales anualmente.6 Esta condición afecta entre el 1% y el 20% de la población general, con una incidencia anual de 0.1 - 0.3%.4-7 En España, la urolitiasis tiene una prevalencia de 4.16%, y una incidencia de ü.27%.1 Sin embargo, la incidencia parece ser más alta en ciertas áreas, especialmente en Latinoamérica. El incremento de la frecuencia en esta zona geográfica, puede deberse a factores hereditarios, nutricionales y del medio ambiente.7
La práctica establece que la incidencia y la prevalencia de la enfermedad también varían según la edad, raza, género, y situación geográfica. La mayor tasa de incidencia se da entre la tercera y quinta décadas de la vida, con un claro predominio en varones (4:1), excepto en el caso de litiasis corali-formes, secundarias a infecciones por organismos urealíticos, más prevalentes en el sexo femenino.1 Por su parte, la prevalencia de los cálculos renales aumenta con la edad hasta los 70 años, momento en que declina; otro punto importante a considerar son los antecedentes familiares de nefrolitiasis, por cuanto incrementan el riesgo.4
La fisiopatología de la nefrolitiasis es compleja, y abarca la interacción entre diversos factores fisico-químicos, genéticos, climáticos, dietéticos, anatómicos, metabólicos e infecciosos. No obstante, se ha descrito que las anomalías urológicas subyacentes y los procesos infecciosos, son las causas más comunes que predisponen la presentación de esta patología.5'8
Para ser más precisos, a continuación se destacan los factores que influyen en la formación de urolitiasis:1'5'8'9'10
1. Edad - más común en personas de mediana edad.
2. Sexo - 3 veces más común en varones que en mujeres.
3. Actividad - inmovilización o excesivas pérdidas de líquido por el sudor.
4. Clima - En relación a los factores climáticos, se establece que cuanto más cálido y seco es el clima, mayor será la probabilidad de tener una orina concentrada en forma permanente, así como el riesgo de formación de cálculos. De igual forma, en regiones donde la exposición a los rayos solares es prolongada e intensa, la mayor producción de vitamina D podría ocasionar un aumento de la absorción y excreción de calcio.
5. Disminución de la ingesta de agua / Deshidratadón.
6. Volumen urinario bajo.
7. Sobresaturación: Grado de saturación urinaria con solutos de calcio, oxalato, cistina, urato o combinación de ellos, y presencia o ausencia de inhibidores biológicos.
Orina acida: aumenta la incidencia de cálculos de ácido úrico.
Orina alcalina: aumenta la incidencia de litiasis por fosfato cálcico y estruvita.
9. Alteraciones genéticas - gota, hiperoxaluria primaria.
10. Alteraciones metabólicas - problemas intestinales, endocrinos y renales que incrementan los niveles plasmáticos y urinarios de calcio y oxalato.
11. Factores Dietéticos - consumo elevado de proteínas, purinas, sodio, y oxalatos; baja ingesta de calcio y líquidos.
12. Uso indiscriminado de medicamentos y otros compuestos que promueven la formación de nuevos cálculos, o el crecimiento de los ya existentes (antiácidos con calcio, vitaminas A, C y D, sulfamidas, acetazolamida, etc).
4. MECANISMOS FISIOPATOLÓGICOS
Se puede inferir que aún existen una serie de interrogantes y controversias acerca de los procesos fisiopatológicos responsables de la formación de cálculos.7 No obstante, en la actualidad es posible diagnosticar la causa potencial de la enfermedad, en más de un 95% de los casos.4
La literatura científica establece que en la formación de los cálculos renales, intervienen principalmente dos mecanismos:2
1. Aumento relativo de la concentración de solutos en la orina, secundario a:
- reducción de la diuresis (orinas concentradas).
- aumento de la excreción de solutos (calcio, oxalato, áddo úrico, cistina, o una mezda de ellos).
2. Alteradones fisicoquímicas capaces de indudr la formación de cálculos, en orinas con concentration normal de solutos:
- modificaciones del pH urinario.
- matriz del cálculo.
- éstasis urinaria.
- presencia de cuerpos extraños.
- modificaciones de las sustancias protectoras: citrato, magnesio, pirofosfatos y péptidos renales.
De acuerdo con la información previa, los cálculos renales se forman cuando la concentración de los componentes de la orina alcanzan un nivel en el cual es posible la cristalización.11 En general, la precipitación de las sales que forman los cálculos, es consecuencia de una composición urinaria anormal, que incluye elevados niveles de los promotores de la litogé-nesis (calcio, oxalato, áddo úrico); bajas concentra-dones de los inhibidores de ésta (dtrato, magnesio, pirofosfatos, glicoaminoglicanos, y proteínas renales como nefrocaldnas, mucoproteínas Tamm-Hoesfall, uropontinas), o cuando ambas condidones coexisten.4
Usualmente, los cálculos renales constan de sales de caldo, áddo úrico, cistina o estruvita (sal triple de
amonio, magnesio y fosfato), y aunque las manifestaciones clínicas de estos cálculos son similares, evidentemente difieren en su patogénesis y tratamiento.11
El citrato, considerado componente clave en el ciclo del áddo cítrico, ha adquirido una creciente importancia como inhibidor de la formación de cálculos, por cuanto retarda el proceso de cristalización a través de dos maneras: formando un complejo con el calcio, lo cual reduce la concentración iónica de éste en la orina, e inhibiendo directamente la precipitación del oxalato y fosfato de calcio. Paralelamente, la nefrocaldna (glicoproteína ácida), inhibe la nucleación, crecimiento y aglomeración del oxalato de calcio, mientras que la uropontina impide el crecimiento de los cristales de oxalato de calcio.4
5. CAUSAS METABOLICAS DE LA NEFROLITIASIS
Las causas metabólicas de la nefrolitiasis, así como su frecuencia, se enumeran en el siguiente cuadro (Cuadro 1). En algunos casos, dichas alteraciones son susceptibles de tratamiento nutri-cional, punto que se desarrollará posteriormente.8

5.1. HIPERCALCIURIA
La excreción excesiva de calcio en la orina, representa un factor fisiopatológico importante para la formación de cálculos renales, puesto que promueve la precipitación de las sales de calcio, y el crecimiento de los cristales.4
La hipercalduria ha sido definida, como la excreción urinaria de caldo mayor de 300 mg/24 horas en varones, y 250 mg/24 horas en mujeres, o como la excreción de calcio en dos muestras distintas de orina de 24 horas, superior a 4 mg/kg/día en ambos sexos.7'8'12
Para ser más precisos, la práctica establece que hay al menos tres tipos de hipercalciuria: absortiva, renal y resortiva. En la hipercalciuria absortiva, el defecto primario es el aumento de la absordón intestinal de calcio; en la renal, se produce la "fuga" primaria de caldo en los túbulos renales, y en la resortiva, la resorción ósea dependiente de la hormona paratiroidea, aumenta la carga filtrada de caldo, y la excreción renal de este mineral.8'13
En teoría, el riesgo a desarrollar cálculos renales de caldo aumenta, en la medida que la excredón de caldo en la orina es mayor; el mecanismo involucrado incluye una elevadón de la carga filtrada de calcio y/o un descenso en la eficada de la reabsordón tubular de éste.4
En los parientes con hipercalciuria y nefrolitiasis, la densidad mineral ósea se encuentra disminuida en relación directa con el grado de hipercalciuria; por tal motivo, existe mayor susceptibilidad de desarrollar osteopenia y un potencial riesgo de osteoporosis, demostrado en estudios donde se compara a estos pacientes con sujetos controles normales.14
5.2. HIPEROXALURIA
Se define como la excreción urinaria de oxalato mayor de 40 mg en 24 horas.
El oxalato es un producto de desecho normal del metabolismo: 90% proviene de los procesos metabólicos endógenos, y el 10% de los alimentos ingeridos.8'15 La producción de oxalato endógeno deriva del metabolismo final de la glicina y del ácido ascórbico, mientras que el oxalato urinario se origina a partir del glioxilato endógeno y de las fuentes alimentarias, que son responsables sólo de una pequeña fracción (= 20%) del oxalato urinario.4
La ingesta promedio de oxalato a través de los alimentos, es de aproximadamente 150 mg/día; sin embargo, la hiperoxaluria secundaria al consumo excesivo de alimentos ricos en oxalato no es frecuente, por cuanto una gran proporción del oxalato exógeno es degradado por las bacterias intestinales (oxalobac-ter formígenes, microflora anaeróbica del intestino humano), o excretado sin cambios en las heces. En consecuencia, sólo alrededor del 2-5% del oxalato dietético se encontrará disponible para su absorción y excreción en la orina.4
Por tanto, la presencia de estos microorganismos, así como la magnitud de la degradación intestinal del oxalato alimentario, podría influir en la cantidad absorbida de este compuesto, y por tanto, en su nivel urinario.11
Un punto relacionado a lo anterior considera que, si bien la ingesta de alimentos con alto contenido de oxalato (> 600 mg de oxalato/100 g de alimento) podría favorecer la hiperoxaluria, los alimentos que se consumen con mayor frecuencia contienen por lo general bajos niveles de oxalato (Cuadro 2).4
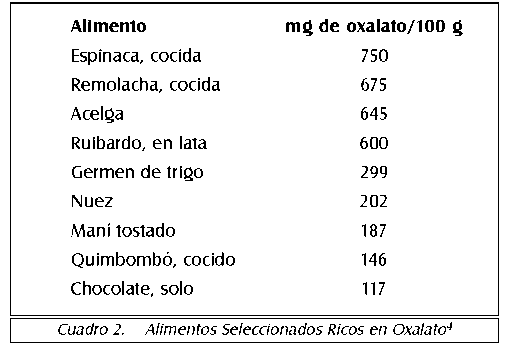
Es importante destacar, que los cambios en la excreción de oxalato urinario, ejercen más influencia en la formación de cristales de oxalato de calcio, que los cambios en la concentración urinaria de este mineral.4'8'11'15'16
La hiperoxaluria puede ser genética o adquirida. La forma genética, hiperoxaluria primaria, es un trastorno metabólico hereditario poco frecuente, que provoca recurrencia de cálculos de oxalato de calcio y depósito final de este compuesto en el parénquima renal, derivando en insuficiencia renal progresiva y muerte, antes del tercer decenio de vida. Por su parte, la hiperoxaluria adquirida o entérica, es consecuencia de una absorción intestinal excesiva de oxalato, observada comúnmente en patologías del intestino delgado, como enfermedad de Crohn, Esprue Celíaco, cirugía de derivación intestinal, o en la insuficiencia pancreática.4'11
Es preciso destacar que en condiciones normales, el oxalato intestinal se une al calcio intraluminal, interfiriendo con la absorción del primero. Numerosos estudios realizados en animales y humanos, enfatizan que el colon es el principal sitio de absorción de oxalato, que en su mayoría es captado por difusión pasiva. Por el contrario, en las patologías intestinales que cursan con malabsordón, el caldo intraluminal se une a los ácidos grasos no digeridos, disminuyendo su disponibilidad para ligar al oxalato; a su vez, el proceso de malabsorción permite que las sales biliares lleguen al colon, alteren la permeabilidad colónica, y propicien la absorción excesiva de oxalato. Seguidamente, es filtrado por los glomérulos y excretado en la orina; por consiguiente, los niveles de oxalato urinario se elevan, mientras que los de citrato urinario descienden, como consecuencia de la pérdida de álcali del intestino delgado.8'16'17
Esta hiperabsorción puede agravarse con la defi-cienda de piridoxina (vitamina B6), por ser cofactor del metabolismo del oxalato, y la ingesta excesiva de vitamina C (precursora del oxalato). Es posible que el consumo excesivo de esta vitamina (más de 1000 mg por día) aumente el oxalato urinario. No está daro si la conversión de vitamina C en oxalato ocurre "in vivo", o después que la orina ha abandonado el organismo.8'11
5.3. HIPERURICOSURIA
Se define como la excredón de áddo úrico mayor de 800 mg/24 horas en varones, ó 750 mg/24 horas en mujeres. Por lo general, es secundaria a la sobreproducción resultante de una anormalidad intrínseca del metabolismo de las purinas (menos frecuente), pre-scripdón de fármacos uricosúricos, o ingestión excesiva de alimentos ricos en purinas (Cuadro 3), siendo esta última la causa más usual.8
La solubilidad del ácido úrico está determinada en gran parte, por el pH urinario. A medida que el pH disminuye por debajo de 5.5 y 6.0, la solubilidad del ácido úrico disminuye, favoreciendo su precipitación, aún si la hiperuricosuria no está presente.10

Adicionalmente, los cristales de ácido úrico actuarían como especie de "nido" o núcleo, para favorecer el crecimiento de cristales de oxalato de calcio, en personas susceptibles a estos cálculos.8
6. COMPOSICION DE LOS CALCULOS RENALES
Existen varios tipos de cálculos renales; estos difieren en cuanto a su composición, patogénesis y frecuencia de presentación (Cuadros 4 y 5)A8

Los cálculos renales usualmente presentan una composición heterogénea, y su formación depende de múltiples factores fisiopatológicos o metabólicos. Sin embargo, la mayoría de los cálculos contienen calcio, por lo general en la forma de cristales de oxalato y/o de fosfato, y con menos frecuencia pueden estar compuestos de áddo úrico, dstina o fosfato de magnesio y amonio (estruvita).7'8
Para ser más precisos, se ha determinado que el 10% de los cálculos renales son orgánicos (compuestos de cistina o ácido úrico), mientras que el 90% son inorgánicos (formados por caldo, magnesio, amonio, oxalato, fosfato o carbonato).9'10
7. FUNCION DE LA NUTRICION EN LA NEFROLITIASIS
Los nutrientes pueden partidpar en la etiología de la nefrolitiasis, así como también, utilizarse en el tratamiento de la misma. El papel de los fadores dietéticos en la determinación del riesgo de formación de cálculos es aún materia de controversia, ya que en el pasado, se consideraba que una ingesta baja en líquidos, junto con una dieta rica en caldo, sodio, oxalato y proteínas animales, constituía un riesgo para la formación de cálculos; sin embargo, los estudios epidemiológicos recientes contradicen algunas de estas arraigadas creencias.4
Las manipulaciones dietéticas son una parte esencial de esta terapia, por lo que a continuación, se hará una revisión de los factores nutricionales desencadenantes de la litogénesis renal:
1. Proteína Dietética:
Numerosos estudios han demostrado, que una dieta rica en proteínas incrementa el calcio urinario, mediante el aumento neto de la excreción ádda disminuyendo el pH de la orina, y en menor extensión, a través del incremento de la velocidad de filtración glomerular (Figura 2).4'18'19'20'21'22
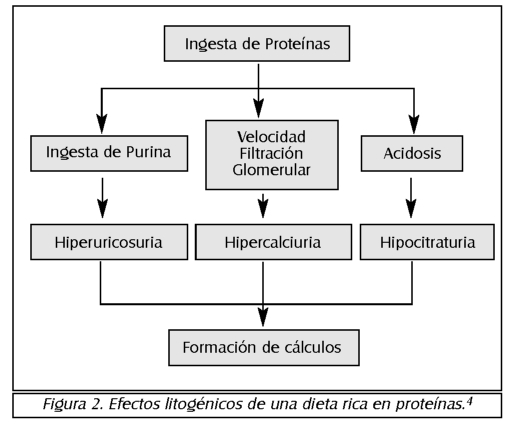
Durante las últimas dos décadas, se ha recopilado considerable evidencia en relación a que la ingesta de una dieta rica en proteína animal (carne, pescado, pollo, huevos y productos lácteos) aumenta el riesgo de nefrolitiasis por calcio, mientras que la enfermedad es menos común en poblaciones que consumen prindpalmente proteínas de origen vegetal. El mecanismo de esta asodación, probablemente se relacione con un incremento del calcio urinario dependiente da la ingesta proteica, causado por la acidosis leve (inducida por el metabolismo de aminoáddos azufrados), que estimula a su vez la reabsordón ósea, y disminuye la reabsorción de calcio a nivel renal.4
De igual manera, el exceso de proteínas se asoda con cambios en la excreción de varios inhibidores y promotores de la formación de cálculos. De hecho, puede ocurrir un aumento del áddo úrico urinario, ya que los productos cárnicos también son ricos en purinas. Así tenemos que el consumo de proteína animal, además de aumentar la excreción de áddo úrico y calcio, también disminuye la excreción de citrato urinario, representando todos ellos, fadores de riesgo para la litogénesis. La excreción de citrato, puede verse afectada durante estados de addosis, inducidos por el metabolismo de aminoácidos azufrados, provenientes de dietas hiperproteicasA11
Se ha descrito que el magnesio y el citrato, producen mayor solubilidad urinaria de las sales de calcio, por consiguiente, la hipomagnesuria e hipocitraturia se relacionan con la nefrolitiasis. Paralelamente, las dietas ricas en proteínas de origen animal, la addosis tubular renal y otras causas de acidosis metabólica, disminuyen la síntesis de citrato y promueven la resorción de éste en los túmulos renales. A la inversa, las dietas con restricción de proteínas, se acompañan de un aumento de la concen-tradón urinaria de citrato, principalmente en personas con hipercalduria.8
Redentemente, se evaluaron los efectos litogéni-cos urinarios inmediatos de la restricdón moderada de proteínas, en un grupo pequeño de parientes con hipercalduria idiopática y nefrolitiasis. Después de una evaluación basal durante 15 días, todos los pacientes recibieron una dieta con un aporte proteico de 0,8 g/kg al día (43% proteína animal y 57% proteína vegetal); contenía 955 mg de calcio y 140 mmol de sodio. Como se esperaba, la úrea y el calcio en la orina descendieron en gran medida después del control de la ingesta proteica, al igual que el ácido úrico, fosfato y oxalato. El citrato en la orina aumentó de manera importante, mientras que el sodio no experimentó cambios. De este modo, se demostró que en el corto plazo, el control de la ingesta de proteínas en pacientes con hipercalduria y nefrolitiasis por caldo, mejora el perfil litogénico urinario y reduce la excreción de caldo.23
2. Sodio:
Las personas formadoras de cálculos tienen mayor sensibilidad al sodio de la dieta, que guarda relación directa con el aumento de la excreción tubular renal de calcio.8
La ingesta elevada de sodio se relaciona positivamente con un incremento en la excreción de calcio, mediante: la expansión del volumen extracelular, aumento de la velocidad de filtración glomerular, y disminución de la reabsorción tubular de calcio.15'24
El papel de la ingesta de sodio en la patogénesis de la hipercalciuria, se basa en la estrecha relación que existe entre el calcio de los túbulos renales y el manejo de sodio, puesto que la reabsorción de calcio es paralela a la reabsorción renal del sodio en el túbu-lo proximal y en el Asa de Henle. En consecuencia, una elevada ingesta de sodio puede influir en la reabsorción renal del calcio a nivel del túbulo distal, ya sea directa o indirectamente, a través de su efecto en los niveles de la hormona paratiroides.4
Por ende, los factores que inhiben la natriuresis, también lo hacen sobre la excreción de calcio, en tanto que los factores estimulantes de la excreción de sodio, aumentan la hipercalciuria.8
8. TRATAMIENTO NUTRICIONAL
RECOMENDACIONES GENERALES
El tratamiento nutritional de la nefrolitiasis es más eficaz, cuando forma parte de una estrategia global ajustada a la situación específica del paciente.
Además del tratamiento de la obstrucción, que puede ser quirúrgico o no, y de la infección urinaria con frecuencia agregada, existen varios principios generales que deben ser tenidos en cuenta (cuadro 6).2'8

El objetivo de la terapia nutricional en los pacientes con nefrolitiasis, consiste fundamentalmente en la eliminación de los factores de riesgo relacionados, para minimizar la formación de nuevos cálculos, y prevenir el crecimiento de los ya existentes.15
De acuerdo con la Fundación National de las Enfermedades Urológicas y del Riñón (Nacional Kidney and Urologic Diseases Foundation), las mejores estrategias generales para prevenir los cálculos renales son las siguientes:25
1. INGESTA DE LIQUIDOS
Una elevada ingesta de líquidos es el componente esencial de la terapia nutricional para los pacientes con nefrolitiasis (Figura 3).15

Se recomienda aumentar el consumo de líquidos, hasta valores que mantengan el gasto urinario en más de 2 ó 3 litros en 24 horas. Esto produce una orina más diluida, y a su vez, un descenso en la concentración de componentes litogénicos, lo que presuntamente descenderá la frecuencia de su formación.2'4'8
Por tal motivo, independientemente del tipo de cálculo o su causa, se recomienda el consumo de grandes volúmenes de líquido (1,5 a 3 L/ día), principalmente agua, con aumento de la ingesta si lo hay de las pérdidas. En un estudio realizado en 199 personas que formaron cálculos, se encontró que quienes aumentaban el consumo de líquidos para mantener un volumen urinario diario de más de 2 L, presentaban una tasa de recurrencia de cálculos significativamente más baja (27%), a diferencia de los que sólo mantenían volúmenes urinarios de 1 L por día.27
Así mismo, se recomienda ingerir de 8 a 12 oz de líquido en horas nocturnas, debido a que la concentración urinaria se produce durante el período de descanso. Los jugos cítricos parecen disminuir el riesgo de formación de cálculos, aunque el beneficio de incrementar la excreción de citrato urinario está acompañado por un incremento concomitante del oxalato urinario, lo cual puede mitigar el efecto neto.10
Se recomienda evitar la ingesta de agua mineral u otras embotelladas (a menos que su contenido de minerales sea inocuo), y no beber del grifo en áreas de aguas "duras", puesto que contienen más calcio; preferir agua destilada.8'9
2. INGESTA DE SODIO
Se sugiere la restricción moderada de sodio a 2,5 g/día (100 meq), dado que las personas con litiasis recurrente son más sensibles a la hipercalciuria que se produce con la natriuresis.8
Con base en algunos estudios sobre la carga de sal en adultos normales, se ha demostrado que la excreción urinaria de calcio asciende alrededor de 1 mmol (40 mg), por cada 100 mmol (2300 mg) de incremento en el sodio alimentario. En consecuencia, se puede inferir que un menor consumo de sodio ayuda a minimizar el riesgo de formación de cálculos de caldo.11
3. INGESTA DE PROTEINAS
Dado el efecto hipercalciúrico de las dietas ricas en proteínas, y los potenciales efectos adversos en la formación de cálculos,28 es razonable asumir que el control moderado de la ingesta proteica, podría reducir la formación de cálculos.
En líneas generales, se recomienda limitar la ingesta de aquellos alimentos ricos en proteína, tales como carnes, aves, pescados y huevos, en pacientes con nefrolitiasis.15
A pesar de los hallazgos epidemiológicos que indican un aumento en el riesgo de litogénesis con regímenes hiperproteicos, es importante considerar los siguientes aspectos:4
• La restricción de proteínas puede elevar la PTH, lo cual podría promover la pérdida de hueso.29
• El efecto negativo de las dietas hiperproteicas sobre el equilibrio del calcio se produce, cuando el nivel de proteínas es mayor de 1,5 g/kg por día. Aún cuando este aporte de proteínas debería evitarse, el restringirlas por debajo de los niveles recomendados (0,8 g/kg por día) no es inocuo, descartándose por tanto, esta última alternativa.4
• Se necesitan estudios de mayor duración, con el objeto de dilucidar mejor los efectos de la restricción de proteínas en el metabolismo y excreción del calcio, en los pacientes con nefrolitiasis.4
4. VITAMINA C
En todas las personas formadoras de cálculos, se debe evitar las dosis excesivas de vitamina C, dada su propensión ampliamente conocida, a estimular la excreción de oxalato en la orina.8
5. CALCIO
La restricción de calcio en la dieta, ha sido una terapia adoptada durante muchos años, en un intento de disminuir la calciuria, y así evitar la nefrolitiasis recurrente.28
Esta medida puede constituir una forma potencialmente peligrosa de terapia nutricional, puesto que una restricción severa del calcio exógeno puede ocasionar un balance marcadamente negativo de este mineral y efectos adversos en la densidad ósea. En segundo término, se ha demostrado que la restricción de la ingesta de calcio, puede favorecer el riesgo de formación de cálculos, principalmente de oxalato.4'7'10'28'30
Una recomendación nutricional segura para los pacientes susceptibles a la formación de cálculos, consistiría en incluir una adecuada cantidad de calcio, que permita cumplir con la ingesta alimentaria de referencia actual (1000-1200 mg/día). Se contraindican las dosis excesivas de calcio (>2500 mg/día), por derivar en consecuencias adversas para la salud, y potenciales efectos litogénicos.4
6. CARBOHIDRATOS
Los carbohidratos simples (dulces concentrados), promueven la excreción de calcio y oxalato, inducen la calciuria, y favorecen la absorción de calcio a nivel intestinal. Existe evidencia de los efectos calduréticos de la insulina, en individuos propensos a formar cálculos de calcio; al ingerir considerables cantidades de carbohidratos refinados, se produce un incremento de la excredón urinaria de caldo.15
9. ESTRATEGIAS NUTRICIONALES ESPECIFICAS DE LOS DIFERENTES TIPOS DE LITIASIS
9.1. LITIASIS POR HIPERCALCIURIA
1. Incrementar la ingesta de líquidos (50% como agua), para lograr una excreción urinaria mínima de 2 litros/día.10'31
2. Restricción dietética de proteínas, oxalato y sodio.7'10
3. Sodio: restricción moderada (90-150 meq/ día).31
4. Ingesta moderada de calcio: evitar la limitación de este mineral.
Hombres: 800 mg/día.
Mujeres: 1000 mg/día (Pre-menopausia).
1200 mg/día (Post-menopausia).10'31
5. Incrementar la fibra dietética.31
6. Los pacientes con hipercalciuria absortiva, pueden beneficiarse con la prescripción de fosfato de sodio y celulosa, resina ligadora de calcio que inhibe la absorción gastrointestinal del mineral.8'16
7. Los casos que presentan hipercalciuria secundaria a addosis tubular renal, pueden ameritar suplementadón dietética que favorezcan la alcalinidad de la orina, lo cual propida la excredón de citrato urinario, y disminuye potendalmente el grado de hipercalciuria.16
8. Los suplementos de potasio, aminoran la excreción de calcio en adultos sanos, y reducen el riesgo de litiasis.11
9. El citrato de calcio es el agente preferido para la suplementación de calcio en pacientes posmenopáusicas con enfermedad litiásica. Aunque la excreción urinaria de calcio se potencia con la administración de esta sal, los niveles de citrato urinario también aumentan.10
9.2. LITIASIS POR HIPEROXALURIA
1. Restricción dietética de oxalato: aun cuando los alimentos puedan tener un alto contenido de esta sustancia, hasta el momento sólo se ha demostrado que ocho alimentos realmente elevan la excreción urinaria de oxalato (Cuadro 7).11'32
2. Garantizar un adecuado aporte de líquidos por VO, incrementar el volumen urinario, y evitar la deshidratadón.
3. El tratamiento de este trastorno requiere de 800 a 1200 mg/día de calcio oral, para fijar el oxalato intestinal y limitar su absorción.11'16'17
4. Acido Ascórbico: dosis máxima (1 g/día).31
5. El citrato y el magnesio inhiben la formadón de nefrolitiasis, por lo que es importante incluir en la terapia nutricional, citrato y piri-doxina, (esta última, es cofador en la vía metabólica defectuosa, que conduce a la sobreproducción de oxalato).8'16'17'33 La vitamina B6 reduce la producción de oxalato en un 50%, logrando reforzar el tratamiento.3
6. Hiperoxaluria Entérica:
a) Incrementar el aporte de caldo (suplemen-tar con 1 g de carbonato de caldo).
b) Limitar el consumo de los lípidos: la restricción de grasa dietética disminuye la esteatorrea, y reduce tanto la absorción como la saturadón urinaria de oxalato.17'31
7. Debido a que los alimentos vegetales son la única fuente de oxalato dietético, los regímenes vegetarianos usualmente contienen más oxalato que las dietas omnívoras con el mismo contenido energético. Marangella y col. compararon los niveles de oxalato urinario de vegetarianos y omnívoros, y reportaron que los vegetarianos presentaban un 50% más de oxalato urinario y 35% menos de calcio urinario que los omnívoros; como resultado, la saturación de oxalato cáldco fue significativamente mayor en la orina de vegetarianos.18
8. Puesto que parte del oxalato endógeno es sintetizado a partir de aminoácidos por vía glio-xilato, se puede inferir que el aumento de la ingesta de proteína dietética, podría incrementar el oxalato urinario. Holmes y col. reportaron que aunque el glioxilato fue mayor en una dieta de 1.8 g de proteína/kg de peso corporal, que en una de 0.6g/kg, el oxalato urinario/creatinina resultó ser el mismo en hombres, pero fue 20% superior en mujeres que consumieron los niveles mayores de proteínas.18
9. La dieta debería ser moderada en sodio, rica en potasio, y baja en proteínas animales.9'28
10. Se recomienda evitar el consumo de té, café, chocolate y bebidas a base de cola, por cuanto pueden intensificar la excreción urinaria de oxalato y favorecer la formación de cálculos.4
11. Ha sido demostrado, que la restricción de oxalato exógeno reduce los niveles de oxalato urinario, pero no previene la formación de cálculos.10

9.3. LITIASIS POR HIPERURICOSURIA
1. El ácido úrico es el producto final del metabolismo de las purinas, por lo que se indica el control dietético de sus precursores.2
2. Entre los alimentos ricos en purinas, se encuentran las carnes, en particular las sardinas y el hígado (ver Cuadro 3).8
3. La ingesta elevada de proteínas se acompaña de mayor excreción urinaria de áddo úrico. Sin embargo, muchos pacientes con cálculos de este áddo no tienen hiperuricosuria, sino que presentan una orina persistentemente ácida, con la disminudón consecuente de la solubilidad del urato.8
4. La hiperuricosuria se trata limitando el consumo de proteínas, al nivel del requerimiento alimentario recomendado (RDA).11
5. Se sugiere alcalinizar la orina con dtrato o bicarbonato.9 El fador más importante que interviene en la formadón de cálculos de áddo úrico, al parecer es la producción de una orina ádda. Por esta razón, la piedra angular del tratamiento de estos cálculos, además de la ingestión de líquidos, es elevar el pH de la orina, que en condidones normales es levemente ácido (6.0 - 6.5). Esto se logra con una dieta rica en residuos alcalinos, complementada con dtrato o bicarbonato (ver cuadros 8, 9 y 10).11
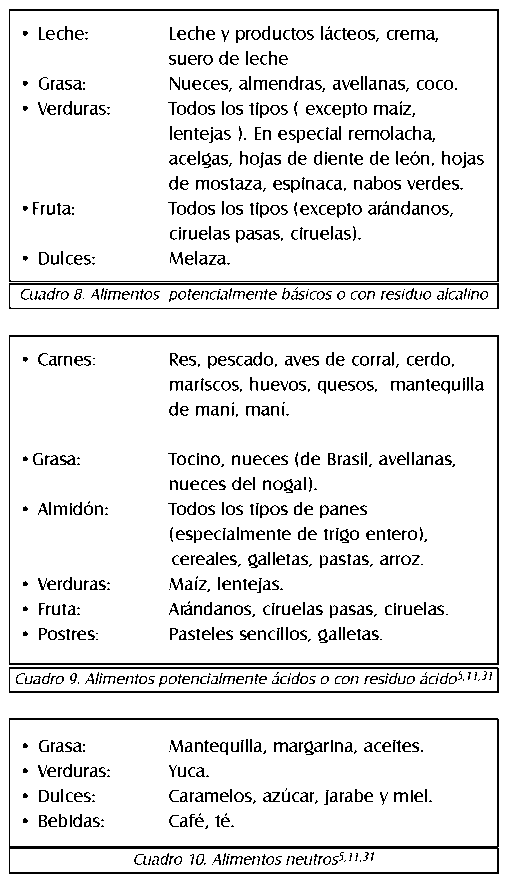
La litiasis renal es una enfermedad de origen mul-tifactorial, en cuya etiopatogenia destacan tanto variables extrínsecas como intrínsecas. La elección del tratamiento adecuado para evitar la recidiva de la nefrolitiasis, es un proceso complejo y requiere la evaluación minuciosa, que incluye el análisis de la composición de los cálculos, y estudios de factores de riesgo metabólicos o de otro tipo. La práctica establece que todo cálculo renal es potendalmente prevenible, con una adecuada evaluación metabólica, y con el tratamiento pertinente de los problemas detectados.
Para prevenir la formadón de cálculos por métodos dietéticos, se sugiere insistir en los benefidos preventivos de un régimen nutridonal equilibrado. En consecuenda, parece prudente sugerir medidas dietéticas generales, consistentes en: mantener los niveles recomendados de caldo y proteínas alimentarias, suficiente ingesta de líquidos, una dieta rica en frutas y vegetales, y moderada en sal.
1. Buitrago Ramírez F., Cobos Sánchez N. "Estudio y seguimiento de los cólicos nefríticos". FMC 2000; 07: 446-455.
2. Longo Elsa N., Navarro Elizabeth T. Técnica Dietoterápica. Edit. El Ateneo, 1ra edición - Buenos Aires; 1994.
3. "About Kidney Stones". 2001 National Kidney Foundation, Inc. http://www.kidney.org
4. Martini Ligia A, Wood Richard J. ¿Se Debería Restringir el Calcio y las Proteínas a los Pacientes que Sufren de Litiasis Renal (Cálculos renales)? Nutrition Reviews en Español, 1ra. Edición 2000: 10-16.
5. Paoli Ingrid. "Urolitiasis". En: Nutrición en Pediatría. Gladis Henríquez Perez, Maritza Landaeta de Jiménez y Elizabeth Dini Golding, Editores. Centro de Atención Nacional Infantil Antímano (CANIA). Caracas, 1999. Capítulo 27, pp. 415 - 430.
6. National Center for Health Statistics (NCHS). Vital and health statistics - prevalence of selected chronicconditions: United States, 1990-92. U.S. Department of Health and Human Services. Centers for Disease Control and Prevention/National Center for Health Statistics 1997; series 10, No 194.
7. Weisinger JR. "Litiasis Renal: Aspectos Fisiopatológicos y afectación del hueso en hipercalciuria idiopática". http//www.paof.org/tol5.pdf
8. Weinstock Brown Wendy, Wolfson Marsha. La dieta como causa o tratamiento: Nefrolitiasis, insuficiencia renal crónica y síndrome nefrótico. En: Clínicas Médicas de Norteamérica-Nutrición Clínica. Inter americana McGraw Hill. México; Vol 4/1993. pp. 817-830.
9. Escott-Stump Sylvia. Urolithiasis/ Nephrolithiasis (Kidney Stones). En: Nutrition and Diagnosis-Related Care. Williams & Wilkins. Fourth Edition, 1998. pp.644-645.
10. Goldfarb DS, Coe FL. Prevention of Recurrent Nephrolithiasis. Am Fam Physician 1999; 60: 2269 - 76.
11. Wilkens Katy G. Nutrioterapia médica en trastornos renales. En: Nutrición y Dietoterapia de Krause. Editado por: L. Kathleen Mahan and Sylvia Escote-Stump. Décima edición. McGraw-Hill Interamericana, México. 2001. pp: 902-936.
12. Levy FL, Adams, Huet B, Pak C. Ambulatory Evaluation of Nephrolithiasis: an Update from 1980. Am J Med 1995; 98:50-59.
13. Coe FL, et al. The pathogenesis and treatment of kidney stones. N Engl J Med. 1992; 327:1141.
14. Ross PD. Osteoporosis. Frequency, Consequences, and Risk Factors. Archives of Internal Medicine. 1996; 156(13): 1399-411.
15. Morrison G, Stover J, Matthews N, Smith E, Diewald LK. Renal Disease. In: Morrison G and Hark L, editors. Medical Nutrition and Disease. Blackwell Science. USA, 1996.
16. Gonzalez Esther, Fitzsimons Muriel and Martin Kevin. "Calcium, Phosphorus, and Vitamin D". In Handbook of Nutrition and the Kidney. Mitch William and Klahr Saulo Editors. Lippincott Williams & Wilkins. Fourth Edition. USA, 2002. pp. 93-117.
17. Khursheed N. Jeejeebhoy. Short Bowel Syndrome-Intestinal Disorders. Modern Nutrition in Health and Disease. Maurice E. Shills, James A. Olson and Moshe Shike Editors. Lea & Febiger, 8th Edition -Vol.2, USA. 1994, 1036-1042.
18. Massey Linda K., Kynast-Gales Susan A. "Diets with either beef or plant proteins reduce risk of calcium oxalate precipitation in patients with a history of calcium kidney stones". J Am Diet Asoc. 2001; 101: 326-331.
19. Remer T, Manz F. Estimation of the renal net acid excretion by adults consuming diets containing variable amounts of protein. Am J Clin Nutr. 1994; 59: 1356-1361.
20. Hu J-F, Zhao X-H, Parpia B, Campbell TC. Dietary intakes and urinary excretion of calcium and acids: a cross-sectional study of women and China. Am J Clin Nutr. 1993; 58: 398-406.
21. Kerstetter JE, Allen LH. Dietary protein increases urinary calcium. J Nutr. 1990; 120: 134-136.
22. Goldfarb S. The role of diet in the pathogenesis and therapy of nephrolithiasis. Endocrinol Metab Clin North Am 1990; 19(4): 805-20.
23. Giannini S, Nobile M, Sartori L, et al. Acute effects of moderate dietary protein restriction in patients with idiopathic hypercalciuria and calcium nephrolithiasis. Am J Clin Nutr 1999; 69: 267-71.
24. Lerolle N, Lantz B, Paillard F, et al. Risk Factors for Nephrolithiasis in Patients with Familial Idiopathic Hypercalciuria. Am J Med. 2002; 113: 99-103.
25. University of UTA Health Sciences Center. La Urología: Los Cálculos del Riñón. Mayo/2001. http://www.med.utah.edu/healthinfo/urology/stone s.htm
26. Lo que necesito saber sobre las piedras en los rinones. National Kidney and Urologic Diseases Information Clearinghouse (NKUDIC). Abril 2002. http://www.niddk.nih.gov
27. Borghi L, et al. Urinary volume, water and recurrence in idiopathic calcium nephrolithiasis: A 5 year randomized prospective study. J. Urol 155: 839, 1996.
28. Curhan GC, Willet WC, Rimm EB, Stampfer MJ. A prospective effect of dietary calcium and other nutrients and the risk of symptomatic kidney stones. N Engl J Med 1993; 328: 833-8.
29. Dawson-Hughes B, Dallal GE, Krai EA, et al. Effect of vitamin D supplementation on wintertime and overall bone loss in healthy postmenopausal women. Ann Intern Med 1991; 115(7):505-12.
30. Coe FL, Favus MJ, Crocket T. Effects of low calcium diet on urine calcium excretion, parathyroid function and serum l,25(OH)2D3 levels in patients with idiopathic hypercalciuria and in normal subjects. Am J Med 1982; 72:25-32.
31. Nelson J, Moxness K, Jensen M, Gastineau C. Mayo Clinic Diet Manual - A Handbook of Nutrition Practices. Mosby, 7th edition; 1994. pp: 315-362.
32. Brinkley LJ, et al. A further study of oxalate bioavailability in foods. J Urol 1990; 144:94.
33. Milliner DS, et al. Results of long term treatment with orthophosphate and pyridoxine in patients with primary hyperoxaluria. N Engl J Med 1994; 331:1553.
Dr. Hugo Dávila B. Dr. Roberto E. Benatuil Stall
Hospital de Clínicas Caracas
USO DE MATERIAL SINTÉTICO EN EL TRATAMIENTO DE LA INCONTENENCIA URINARIA DE ESFUERZO TIPO III EN LA MUJER
La incontinencia urinaria de esfuerzo (IUE) es una de las patologías mas frecuentes en la mujer. Se define como la pérdida de orina en formas involuntaria asociada a los esfuerzos o maniobras de val-salva y en ausencia de contracciones no inhibidas del detrusor.
Ya McGuire había clasificado las IUE en tres tipos dependiendo de la presión de fuga abdominal a la cual se observara el evento: tipo I si el punto de presión de fuga abdominal (PPFA) superaba los 90 cm de H20; Tipo II si el PPFA oscilaba entre 90 y 60 cm de H20 y Tipo III cuando el PPFA se encontraba en menos de 60 CM de H20. Blaivas desarrollo otra clasificación tomando en cuenta el aspecto radiológico de la vejiga y así muchas otras clasificaciones. Sin embargo es importante saber que la IUE no es un concepto estático sino dinámico y el urólogo debe evaluar todos los aspectos que rodean a la paciente desde los síntomas y signos que se encuentran al examen físico como su calidad de vida evaluada a través de cuestionarios especializados.
Existen otras clasificaciones propuestas por Blaivas (radiológica) y por Raz (anatómica) sin embargo no son contrapuestas sino complementarias y lo importante es que las tres clasificaciones coinciden en que en la incontinencia urinaria tipo III existe un daño intrínseco del esfínter sea por la causa que sea. Este tipo de incontinencia es la que trataremos en este capítulo y su forma de tratamiento actual.
Al hablar de incontinencia sabemos que esto es una patología que denota por si misma un síntoma un signo y una condición. Un síntoma porque es lo que el paciente o su cuidador refieren al acudir a la consulta; un signo porque es evidenciable o reproducible este síntoma durante el examen físico en la consulta y una condición ya que existe de hecho una razón que este condicionando esta incontinencia ya sea por problemas en la propia vejiga o anormalidades en el esfínter.
Es por todo esto que al hacer el diagnostico de IUE hay que investigar muy bien la causa para poder-ofrecer a la paciente la mejor alternativa de tratamiento.
En aquellas pacientes en las cuales se ha realizado procedimientos quirúrgicos anteriores para la corrección de IUE y persisten con la sintomatología o esta aparece luego de varios años, es importante descartar que la paciente no tenga condiciones inherentes a la propia vejiga que produzcan incontinencia como pueden ser: hiperactividad del detrusor, detrusor inestable, baja capacidad de la vejiga o fístula urinaria.
Es por todo esto que para tener éxito en el tratamiento de la IUE se debe hacer primero un buen diagnostico, comenzando por hacer una buena historia clínica de la paciente con su examen físico y un diario miccional y luego proceder a realizar exámenes especiales a aquellas pacientes a las que le haga falta como son: uretrocistoscopia y pruebas urodinamicas.
Existen hoy en día muchas técnicas para la corrección de la incontinencia urinaria y algunas con mucho éxito. Existen la corrección suprapúbica tipo burch o marshall-marchetti-krantz, el uso de cinchas biológicas o sintéticas y el uso de sustancias inyectables.
Se usa las sustancias inyectables como una de las formas de tratamiento de la IUE desde hace mucho tiempo. Todavía hoy en día no se ha logrado descubrir la sustancia ideal la cual debe cumplir con ciertos requisitos: no degradable, biológicamente inerte, no migre, no cambie su capacidad de abultamiento, no inmunogenico, hipoalergénico. (Dmochowski y Apell UROLOGY 2000).
La indicación del uso de sustancias inyectables es en aquellas pacientes que tienen una deficiencia intrínseca del esfínter y se conoce hoy en día que la mejor tasa de respuesta esta en aquellas pacientes que tienen uretra fija o con muy poca motilidad y son estas las condiciones que proporcionan una mayor tasa de curación a largo plazo.
La paciente ideal debe además no tener ninguna patología vesical asociada y por supuesto debe tener una uretra sana. (Dmochowski y Apell UROLOGY 2000).
Sin embargo muchos autores han señalado algunas desventajas de su uso debido a que requieren de equipo especial para su colocación y una manipulación especial de la sustancia a inyectar que no es familiar a todo tipo de urólogo todo lo cual pudiera contribuir a una tasa de fracaso elevada de la técnica aplicada.
Haremos una breve descripción de algunas de las sustancias empleadas para este tratamiento.
Politetrafluoroetileno (PTFE): es una sustancia compuesta de partículas de unas 50 a 300 mieras de diámetro, que son hipoalergénicas, pero pueden ser fagocitadas y por lo tanto migrar hacia cerebro, pulmón, baso e hígado.
Los trabajos realizados con esta sustancia han demostrado una tasa de curación al año de entre 20% y 86%, pero esto cae considerablemente con el paso del tiempo a menos de 40%.
Entre las desventajas del PTFE podemos describir que se necesita una alta presión para realizar la inyección de la sustancia, produce reacciones inflamatorias y hasta se ha llegado a describir síndromes febriles sin evidencia de infección. Se ha descrito además fibrosis uretral, granuloma de la pared uretral y absceso periuretral. Por todas estas razones esta sustancia ha caído en desuso.
Colágeno bovino: Se ha utilizado también y se dice que la profundidad óptima para la inyección es la submucosa, sin embargo la localización y el volumen suficiente para la coaptación de la mucosa no ha sido determinado y de alguna manera depende de las características individuales de cada paciente. La tasa de curación oscila entre un 7% y 83% según reportes de diversos trabajos y podemos observar que es un rango muy amplio porque esta ahora no existe uniformidad en el desarrollo de la metodología
de investigación de los trabajos en cuanto al tiempo y forma de seguimiento, elección del tipo de paciente.
Con esta sustancia hemos visto un 4% de reacciones alérgicas y se ha reportado un 13% de pacientes con urgencia de novo. Como podemos apreciar no es la sustancia ideal.
Grasa autóloga: Se uso durante mucho tiempo ya que tenia una característica muy importante y es que al ser autóloga se podían olvidar de reacciones alérgicas y era biológicamente inerte, además de disminuir mucho los costos, pero se observo que la tasa de reabsorción de grasa era tan alta como de un 60% lo cual producía resultados espectaculares en el postoperatorio inmediato pero su éxito disminuía a menos de 30% en menos de seis meses, todo lo cual disminuye el entusiasmo de su uso. El volumen promedio de inyección fue de 12 cc y un promedio de reinyecdon de tres veces para lograr derta mejoría. (Santarosa y Blaivas J Urol, 1994).
Partículas de carbón: Son partículas de carbón cubiertas por zirconio y esta técnica ha sido empleada anteriormente en prótesis cardiacas por su bajo potendal inmunogenico. Esta sustancia no requiere de pruebas cutáneas para su aplicación y no esta asociado a antigenicidad.
Migran por vía linfática lo cual no la hace la sus-tanda ideal. El volumen promedio de inyección es de
6 cc y produce una mejoría de 70% a los 6 meses y de 33% al año. (Líghtner y col J Urol 2000; Apell y col UROLOGY 2000; Pannek y col J Urol 2001)
Microbalon: Es una técnica adualmente en desarrollo y consiste en unas cápsulas de silicona de un volumen de 0,2 a 0,9 cc rellenas de un hidrogel.
Colágeno humano: Por el hecho de ser de origen humano es biocompatible y además es no alergenico. La desventaja que tiene es que la alta concentración de colágeno por cc dificulta la inyección a través de agujas pequeñas, por su viscosidad. La tasa de éxito no varía mucho con respecto a las demás sustancias anteriormente descritas. (Dmochowski y col UROLOGY 2000)
Cartílago autologo: Es una sustanda utilizada antes en el tratamiento del reflujo vesico ureteral y que se esta desarrollando para el tratamiento de la IUE. Sin embargo los resultados no son muy distintos a los ya vistos con las otras sustancias. (Bent y col ] Urol 2000).
Silicon: Es una sustancia con partículas que varían entre 100 y 300 mieras de diámetro. La tasa de curación varía entre un 33 y 67%. La reinyecdon no esta recomendada antes de las 6 semanas siendo un periodo optimo a las 12 semanas.
Así existen gran cantidad de sustandas inyectables desarrolladas y en desarrollo tratando de buscar la sustanda ideal. Existe además el bioglass, hidroxi-lapatita de calcio, ácido hialuronico y copolimero de etileno vinil alcohol, todas estas sustandas inyectables en desarrollo.
En la figura 1 podemos observar en forma esquemática la colocación de uno de los materiales arriba mencionados y en forma similar se realiza con todas las sustancias.
A manera de condusión pedemos afirmar que:
1. Las sustandas inyectables son una alternativa viable para el tratamiento de la IUE.
2. Es necesario una muy cuidadosa selecdón de la padente para tener resultados óptimos.
3. Mientras todos están de acuerdo que las sustandas inyedables son útiles en una variedad de situadones, los pobres resultados y la necesidad de reinyecdon, limita su uso en las incontinencias femeninas típicas.
4. La inyecdón uretral es apropiada en aquellas pacientes con IUE tipo III que desean evitar un acto quirúrgico o tienen un riesgo quirúrgico elevado.
I CIMCI\V_IM IV11 \AAI\ IAA U C COrUCIVZ-W 1 ITU III Cl\ l_/A ÍVILJJCIV
5. No se ha encontrado la sustanda inyedable ideal y es por eso que existen gran cantidad de sustancias en estudio y resultados tan pobres a largo plazo.
Además de las sustancias inyedables para el tratamiento de la IUE tipo III, las cuales no ha superado la prueba del tiempo y los resultados a largo plazo son pobres en comparación con otros métodos, existe la ancha.
Las cinchas son una técnica interesante de reparadón de la IUE de tipo III ya que corrige el defecto principal que es deficiencia intrínseca del esfínter y además da soporte a la uretra corrigiendo el ángulo uretro-vesical y volviéndolo a colocar de la forma más anatómica posible.
Existen en el mercado muchos tipos de ancha y las podríamos clasificar de la siguiente manera:
Cinchas biológicas
• Autólogas
- Fascia lata
- Fascia de redo anterior del abdomen
• Heterologas
- Cadavéricas
Cinchas Sintéticas
• Mallas de polipropileno (SPARC, TVT). (Fig. 2 y 3).

• Cinchas de Silicon (SAFIRE).
• Cinchas combinadas de polipropileno y área central de material absorbible. (T-SLING). (Fig.4)
De las cinchas biológicas, las de fascia cadavérica se usan muy poco debido básicamente al temor de transmisión de enfermedades (a pesar de estar esterilizada) y porque no han superado la prueba del tiempo y los resultados a largo plazo no son satisfactorios incluso hay reportes de fracasos altos a los 3 y 6 meses con una tasa de curación al año entre un 25% y 30%. (Huang YH, Lin AT, UROLOGY 2001).
Los pro y los contra de usar una cincha biológica (autologa) o una cincha sintética son:
Cinchas Antologas
• Mayor dolor postoperatorio.
• Mayor morbilidad.
• Mayor tiempo quirúrgico.
• Menor costo.
Cinchas sintéticas
• Menos dolor postoperatorio.
• Menos morbilidad.
• Menor tiempo quirúrgico.
• Menor tiempo de estadía hospitalaria.
• Mayor costo.
A la luz de estas premisas es decisión del médico en conjunto con su paciente quien decide que tipo de cincha utilizar ya que las 2 tienen la misma tasa de respuesta favorable en los estudios que se han realizado a largo plazo. (Kuo, J Urol, 2001 y UROLOGY 1999).
En estos trabajos se compara las técnicas desde el punto de vista de videourodinamia pre y postoperatoria en 50 pacientes seleccionados al azar y a los que se les colocó fascia de recto (24 pacientes) y malla (26 pacientes), obteniendo una tasa de curación objetiva a los 2 años de 95,8% con fascia de recto y de 100 % con malla y una tasa de curación subjetiva de 91,6% con fascia de recto y de 92,3% con malla.
Por todo lo antes expuesto y a manera de conclusión podemos afirmar que:
1. El tratamiento con cincha es efectivo y durable reportándose hasta 4 años con una continencia de 88%.
2. Mejora la calidad de vida de las pacientes.
3. Resuelve la incontinencia de urgencia en 74% de las pacientes tratadas con cinchas.
4. Existen trabajos que incluso proponen el uso de cinchas para todo tipo de incontinencia. Este punto despierta mucha controversia ya que hay autores que no recomiendan su uso en todo tipo de incontinencia y las razones que dan es que no son recomendables para el tratamiento de la incontinencia urinaria de esfuerzo tipo I, porque significa la colocación de un material sintético en pacientes por lo general jóvenes y que no sabemos que puede pasar en 10 o 15 años y la otra razón es que le dan paso primero a la corrección suprapúbica tipo Burch que a demostrado ser tan efectiva como la cincha en pacientes jóvenes bien seleccionadas y se deja intacta la vía vaginal, dejándose para estos casos el uso de la cincha para el tratamiento de las recurrencias o en pacientes con cirugías pélvicas anteriores.
5. Se puede observar urgencia de novo en un 3% a 7 %.
6. La retención aguda de orina se resuelve espontáneamente en 6 a 8 días de post-
operatorio con ayuda del cateterismo vesical intermitente. (Me Guíre y col. J Urol 2000 - J Urol 1998 - Blaivas y col J Urol 1998 - Zaragoza MR J Urol 1996 - Fulford y col J Urol 1999 -Kreder y col J Urol 1996).
Es de destacar que el uso y la colocación de las cinchas mas actuales se hacen por lo general libres de tensión, para garantizar que no halla obstrucción de la uretra; que se produzca una sobrecorreción del ángulo uretro - vesical que pueda producir dificultad para la micción espontánea en el postoperatorio y un flujo obstructivo patológico con alto volumen residual.
Con el advenimiento de estas nuevas técnicas con el uso de material sintético se puede pensar en que las otras técnicas como la corrección suprapúbica de Burch desaparecerán y no es así. El procedimiento de Burch y el uso de las cinchas tienen efectividad similar como tratamiento quirúrgico de la IUE con una tasa de curación a los 2 años de 94,8% y 95,3% respectivamente (Weber AM, Walters MD Obstet Gynecol 2000). Es por esta razón que el medico en común acuerdo con su paciente y después de una breve explicación debe tomar la decisión de cual será el tratamiento adecuado para la paciente que represente para esa persona el mejor costo-beneficio.
Se han realizado trabajos comparando la tasa de curación de las pacientes después de usar cinchas vs. inyección de colágeno. En un trabajo realizado por Kreder y col, se describe comparativamente 28 pacientes a las que se coloco cinchas pubo-vaginales y 22 a las que se inyecto colágeno y los resultados fueron que 81% de las pacientes con cincha experimentaron curación de sus síntomas y solo el 25% de las pacientes con inyección de colágeno se curaron. (Kreder KJ, Austin ]C J Urol 1996).
Los agentes inyectables han sido usados durante décadas para el tratamiento de la incontinencia urinaria debida a la deficiencia del esfínter y constituye un método sencillo pero que actualmente debe ser utilizada en aquellas pacientes con riesgo cardiovascular elevado y en aquellas pacientes que deseen evitar un acto quirúrgico. (Dmochowski RR y col UROLOGY 2000).
En nuestra unidad de urodinámica del Hospital Universitario de Caracas estamos desarrollando nuestra experiencia en la colocación de cinchas tipo
SPARK en las pacientes con incontinencia urinaria de esfuerzo tipo II y III. Se seleccionan para esta técnica aquellas pacientes entre 30 y 70 años que tengan antecedente quirúrgico previo de cirugía pélvica y específicamente aquellas a las que se les ha realizado algún procedimiento para la corrección y tratamiento de la IUE.
Se les realiza previo al acto quirúrgico su examen físico, su estudio urodinámico con determinación de presión de perdida abdominal, test de calidad de vida.
El seguimiento se realiza a través de 4 visitas postoperatorias al mes, 3 meses, 6 meses y al año, en donde se les realiza examen físico, urocultivo, uroflu-jo con medición de volumen urinario postmiccional y test de calidad de vida.
Con esta técnica hemos logrado buenos resultados en cuanto a continencia se refiere actualmente con casi 10 meses de seguimiento las pacientes permanecen continentes. Sin embargo se ha reportado en algunas pacientes dispareunia y quejas de su pareja de sensación de cuerpo extraño en la vagina (sin evidencia de erosión) y todas las pacientes se han quejado de dolor suprapúbico en el postoperatorio inmediato de casi un mes de duración el cual se alivia con AINES. A pesar de todo esto al realizarles el test de calidad de vida a las pacientes durante su seguimiento estas refieren una mejoría significativa y se sienten muy satisfechas con los resultados obtenidos y recomendarían este tipo de técnica a sus amigas.
Todavía nuestra serie es modesta de unos 25 pacientes y el seguimiento es todavía muy corto pero seguimos trabajando hasta lograr un seguimiento mínimo de 2 años.
A continuación haré una breve descripción sobre como debe colocarse una de las cinchas sintéticas conocida con el nombre de SPARC:
Luego de colocar a la paciente en posición ginecológica y con la técnica anestésica que se elija, se procede a realizar la antisepsia adecuada, para el inicio de la intervención.
Se separan los labios mayores para exponer la vagina bien sea con sutura o con separador automático.
Pasos:
1. Se realiza una incisión transversal de 1,5 a 2 cm. de longitud y a mas o menos 1 cm. del meato uretral sobre la pared vaginal anterior en lo que correspondería a la uretra media. (Fig 5 y 6).
2. Se hace la disección a ambos lados de la uretra hasta permitir el paso del dedo índice para alcanzar la aguja.
3. Realice 2 incisiones abdominales de alrededor de 0,5 cm. a cada lado de la línea media y apenas por encima del pubis, con una separación no mayor de 4 a 5 cm. entre si. Sujete la empuñadura de la aguja para pasarla a través de la incisión anterior y llevarla con el dedo índice a través de la fascia endopelviana, hasta la incisión vaginal. Utilice la parte posterior del pubis siempre como referencia. NOTA IMPORTANTE: ASEGÚRESE QUE LA VEJIGA ESTA VACIA COLOCANDO CON ANTERIORIDAD UNA SONDA DE FOLEY. Cuando la primera aguja este en su lugar pase la segunda aguja de igual modo por el lado contralateral.
4. Se colocan los dilatadores a través de la punta de ambas agujas hasta verlos en la región suprapúbica. Si se observa salida de líquido por cualquiera de las agujas es probable que haya punzado la vejiga. En este caso basta con retirar la aguja y recolocarla. En este momento se realiza la cistoscopia para verificar la integridad de la vejiga. (Fig.7).
5. Retire los dilatadores y acople la malla a las agujas. NOTA: TENGA MUCHO CUIDADO EN ESTE PUNTO. Una vez acoplada la malla esta no se desprende nuevamente, por lo que debe tener cuidado de colocar la malla derecha sin giros o retorcida y con las marcas azules hacia fuera, en dirección opuesta de la uretra. Asegúrese que la malla y sus acopladores estén bien sujetos a fin de que no se desprendan durante su ascenso.
6. Tire de las agujas hacia arriba. Una vez la malla se encuentre suprapúbica sujétela a cada lado con un damp y corte la malla para retirar las agujas. Coloque la malla bajo la uretra media sin tensión. La marca azul esta en el centro del cabestrillo y puede usarse para centrar la malla.
7. Manteniendo una tijera u otro instrumento entre la cinta y la uretra media, se procede a retirar la vaina de plástico tirando de esta con un damp hacia arriba. Primero un lado y luego el otro lado. (Fig. 8).
8. Se puede utilizar la sutura azul de la malla para ajustes adicionales (aflojar o apretar). Después de tensar el cabestrillo adecuadamente corte la sutura de la malla bilateralmente a la uretra y extráigala. NOTA IMPORTANTE: Al retirar la sutura corte solo la sutura, no la malla de cabestrillo. Es necesario retirar solo la sutura en la zona de la uretra. Si el resto de sutura se tranca o no sale no es imprescindible sacarla, se puede dejar en el sitio.
9. Recorte la malla suprapúbica al ras de la piel y proceda a cerrar las incisiones suprapúbicas y vaginal.
10. A criterio del medico se puede o no dejar sonda de foley.
• El cabestrillo debe ser colocado SIN TENSION.
• Las infecciones vaginales o de las vías urinarias deben tratarse antes de la intervención.
• Debe realizar la dstoscopia para verificar la integridad de la vejiga o detedar punción de la misma. En caso de punción acddental debe sacarse la aguja y recolocarse de nuevo y realizar nuevamente la dstoscopia. En este caso debe dejarse a la paciente con sonda de foley por 4 a 5 días.
• Debe comunicarse a la paciente que futuros embarazos pueden anular los efedos del procedimiento quirúrgico, con lo que la padente puede experimentar nuevamente incontinencia.
• Debe indicarse a la padente que se abstenga de levantar peso, realizar ejerdcios y mantener relaciones sexuales durante un mínimo de 4 semanas. Las parientes pueden volver a realizar otras adividades normales diarias a discreción del medico.
Así pues tenemos una noción de cómo se debe colocar una cincha sintética y que cuidados se debe tener para realizar un procedimiento exitoso.
Debemos concluir diciendo que la utilización de cinchas sintéticas para la incontinencia urinaria tipo III es hasta ahora el mejor método de tratamiento, sin embargo y es lo mas importante que debe quedar bien entendido es que no existe ningún tratamiento bueno sin una buena selección de la paciente a tratar.
where are we now?. UROLOGY 56 (suppl6A): 32-40, 2000.
3. Santarosa R.R, Blaivas J.G; Periurethral injection of autologous fat for the treatment of sphincteric incontinence. J Urol 151: 607-608, 1994.
4. Su T.H., Wang K.G., Hsu Y. et al: Periurethral fat injection in the treatment of recurrent genuine stress incontinence. J Urol 159: 411-414, 1998.
5. Bent A.E., Foote J., Faerber G., et al: Collagen implant for treating stress urinary incontinence in women with urethral hypermobility. J Urol 166(4): 1354-7, 2001.
6. Bent A.E., Tutrone R.F., Lloyd K. et al: Treatment of intrinsic sphincter deficiency using autologous ear cartilage as periurethral bulking agent. J Urol 163: 75, 2000. (Abstract 332A).
7. Cross C.A., English S.F., Cespedes R.D., McGuire E.J.: A followup on transurethral collagen injection therapy for urinary incontinence. J Urol 159 (1): 106-
8, 1998.
8. Lightner D., Calvosa C., Andersen R., et al.: A new injectable bulking agent for treatment of stress urinary incontinence: results of a multicenter, randomized, controlled, double-blind study of duras-phere. UROLOGY 58 (1): 12-5, 2001.
9. Pannek J., Brands F.H., Senge T. : Particle migration after transurethral injection of carbon coated beads for stress urinary incontinence. J Urol 166 (4): 1350-3, 2001.
10. McGuire E.J., Bennett C.J., Konnak J.A., et al: Experience with pubovaginal sling for urinary incontinence at the University of Michigan. J Urol 138: 525-526, 1987.
11. Zaragoza M.R.: Expanded indicatons for the pubovaginal sling: treatment of type 2 or 3 stress incontinence. J Urol 156 (5): 1620-2, 1996.
12. Fulford S.C., Flynn R., Barrington J., et al.: An Assessment of the surgical outcome and urodynam-ic effects of the pubovaginal sling for stress incontinence and the associated urge syndrome. J Urol 162(1): 135-7, 1999.
13. Cross C.A., Cespedes R.D., McGuire E.J.: Our experience with pubovaginal sling in patients with stress urinary incontinence. J Urol 159 (4): 1195-8, 1998.
14. Chaikin D.C., Rosenthal J., Blaivas J.G.: Pubovaginal fascial sling for all types of stress urinary incontinence: long term analysis. J Urol 160 (4):1312-6, 1998.
15. Chaikin D.C., Blaivas J.G.: Weakened cadaveric fascial sling: an unexpected cause of failure. J Urol 160: 2151, 1998.
16. Kuo H.C.: Videourodynamic results after pubovagi-nal sling procedure for stress urinary incontinence. UROLOGY 54 (5): 802-6, 1999.
17. Weber A.M., Walters M.D.: Burch procedure compared with sling for stress urinary incontinence: a decision analysis. Obstet Gynecol 96 (6): 867-73, 2000.
18. Morgan T.O. Jr., Westney O.L., McGuire E.J.: Pubovaginal sling: 4-year outcome analysis and quality of life assessment. J Urol 163 (6): 1845-8, 2000.
19. Sousa-Escandon A.: "Sandwich technique" for suburethral placement of mersilene mesh sling during pubovaginal suspension surgery: preliminary results. UROLOGY 57 (1): 49-54, 2001.
20. Groutz A., Blaivas J.G., Hyman M.J., Chaikin D.C.: Pubovaginal sling surgery for simple stress urinary incontinence: analysis by an outcome score. J Urol 165 (5): 1597-600, 2001.
21. Kuo H.C.: Anatomical and functional results of pubovaginal sling procedure using polypropylene mesh for the treatment of stress urinary incontinence. J Urol 166 (1): 152-7, 2001.
22. Huang Y.H., Lin A.T., Chen K.K., Pan C.C., Chang L.S.: High failure rate using allograft fascia lata in pubovaginal sling surgery for female stress urinary incontinence. UROLOGY 58 (6): 943-6, 2001.
23. Kuo H.C.: Comparison of video urodynamic results after the pubovaginal sling procedure using rectus fascia and polypropylene mesh for stress urinary incontinence. J Urol 165 (1): 163-8, 2002.
24. O'Reilly K.J., Govier F.E.: Intermediate term failure of pubovaginal slings using cadaveric fascia lata: a case series. J Urol 167(3): 1356-8, 2002.
25. Walsh I.K., Nambirajan T., Donellan S.M., Mahendra V., Stone A.R.: Cadaveric fascia lata pubovaginal slings: early results on safety, efficacy and patiens satisfaction. BJU Int 90 (4): 415-9, 2002.
26. Flynn B.J., Yap W.T.: Pubovaginal sling using allograft fascia lata versus autograft fascia for all types of stress urinary incontinence: 2-year minimun followup. J Urol 167 (2 ptl): 608-12, 2002.
27. Carbone J.M., Kavaler E., Hu J.C., Raz S.: Pubovaginal sling using cadaveric fascia and bone anchors: disappointing early results. J Urol 165 (5): 1605-11, 2001.
28. Blaivas J.G., Romanzi N.J., Heritz D.M.: Urinary incontinence: Pathophysiology, evaluation, treatment, overview and non surgical management. Campbell's Urology, Seventh edition: 1007-1043, 1998.
29. Kreder K.J., Austin J.C.: Treatment of stress urinary incontinence in women with uretral hypermobility and intrinsic sphincter deficiency. J Urol 156 (6): 1995-8, 1996.
Dra. Emilia ]. Mora G. * Urólogo-Pediatra Dr. José A. Briceño * Urólogo-Pediatra Hospital de Niños "J.M. de los Ríos" Caracas - Venezuela
TUMOR DE WILMS
INTRODUCCIÓN
El nefroblastoma ha sido mejor conocido como tumor de WILMS, después de que Max Wilms publicara su famosa monografía en 1899.1
Es el tumor renal más frecuente en pediatría constituyendo más del 80% de todos los tumores que se presentan en este órgano.2 Otros tumores renales como carcinomas, sarcomas, son muchísimo menos frecuentes y representan solo el 1% de los tumores renales en la infancia.
Los otros tumores renales son: Sarcoma renal de células claras, el tumor rabdoide de riñón, ambos considerados anteriormente variedades del T.W, pero de peor pronóstico; el carcinoma de células renales, el nefroma mesoblástico y el nefroma quístico multi-locular, los cuales representan menos del 10% de las neoplasias primarias del riñón en la población pediátrica.3
HISTORIA
Según Beckwith el primer espécimen Conocido de tumor de Wilms ha estado en despliegue en el Museo de Hunterian de la Universidad real de cirugía en Londres, Inglaterra desde los 1700s.4 Ranees detalló 1814 casos reportados como "fungus haematodes" es unos de los primeros artículos sobre tumor de Wilms en la literatura inglesa.5 De éste y otros artículos publicados se puede concluir que había dudas significantes acerca de la naturaleza maligna de éste tumor en aquél tiempo. Comenzando con la descripción de Elberst de su patología en 1872, una serie de artículos mostrados en la literatura alemana documentaron la naturaleza maligna del tumor de Wilms.6'7'8'9 Al tumor se le dieron muchos nombres pero la confusión nosológica terminó algún tiempo después de que Max Wilms produjo su larga disertación, cuando su nombre fue el epónimo más usado.10 El término tumor de Wilms es la apelación casi universal, aunque muchos prefieren llamarlo nefroblastoma o embrioma renal.
Por razones obvias la terapia fue muy limitada durante el siglo 19, la anestesia y medidas de soportes eran deficientes. Ni la terapia antimicrobiana, ni la quimioterapia existían. La primera nefrectomía realizada fue en 1877.11 Unos pocos años más tarde Walker reportó una horrenda tasa de mortalidad quirúrgica de 35 % en 145 casos.12 No fue sino hasta los 1930 que la cirugía comienza a ser una alternativa terapéutica lo suficientemente efectiva. En 1936 Priestley y Schulte reportaron una sobrevida a los 5 años de 15% seguida de la nefrectomía.13
El desarrollo de la terapia radiante ha proporcionado a los clínicos una terapia menos riesgosa que la cirugía y es así que la radioterapia fue propuesta como la primera alternativa terapéutica para tumores renales en niños.14 Dé hecho, esto fue así a pesar de que no hubo ningún sobreviviente en la revisión de Priestley de 39 casos tratados con radioterapia.15
En 1937 Dean reportó la sobrevida a los 5 años de 5 de los 20 casos de pacientes tratados con radioterapia sola.16 Esto fue uno de los éxitos débiles pero se concluyo que una combinación de la cirugía y la radioterapia podría ser una modalidad terapéutica mejor. En 1941, Ladd y Gross pioneros en la técnica
Transabdominal (ahora estándar) y el soporte de fluidos intravenosos y transfusiones sanguíneas reportaron una sobrevida a largo plazo de 13 de 54 casos (24%). De esta manera el grupo de Boston Propuso a la cirugía como la primera línea de terapia seguida de radioterapia postoperatoria.
Aunque la sensibilidad del T.W a la radioterapia había sido claramente establecida, una sutil controversia persistía acerca del uso de radioterapia antes ó después de la cirugía.17 Gross destacó el hecho de que los niños con tumores abdominales deben ser tratados como una emergencia quirúrgica aguda ya que según su criterio la permanencia de la tumoradón en el abdomen incrementa cada minuto el riesgo de metástasis a distanda.18 Este concepto persistió hasta los finales de los años 60.
En 1956 Farber introdujo la quimioterapia sistémi-ca Actinomidna D, como complemento a la drugía y a la radioterapia.19'20'21 El objetivo fue tratar en el paciente la enfermedad metastásica como un adyuvante a la cirugía y a la terapia radiante del tumor primario.22'23 Los reportes iniciales fueron limitados a experiendas anecdóticas, pero los datos acumulativos soportaron el rol efedivo de la Actinomidna D.
Con la adición de vincristina (1960), la tasa de sobrevida de niños con tumor de Wilms aumentó dramáticamente.24'25'26 La ddofosfamida también mostró ser efediva contra un número de neoplasias malignas de niños, pero su eficada en tumor de Wilms era imprecisa.22'27'28 Al inido de los años 1970, la doxorrubicina mostró ser comparable con la vincristina y la actinomicina para el uso contra tumor de Wilms.29'30'31'32'33
Por lo relativamente raro del T.W., muchos investigadores dínicos tenían dudas sobre la terapia, por
lo que para resolver este problema los representantes de los grandes grupos de estudios para el cáncer unieron sus fuerzas para establecer en el año 1969, el grupo nacional de estudio para el tumor de Wilms "NATIONAL WILMS TUMOR STUDY GROUP (NTWSG)". Una de las claves de éste grupo fue la indusión de un sistema de estadiaje anatómico que hiciera posible hacer comparaciones estadísticamente significativas entre varios regímenes de tratamiento.
En Europa paralelamente al desarrollo del grupo en los estados unidos (NWTS), la Sociedad internacional de oncología pediátrica SIOP comienza su grupo de estudio corporativo en 1971.
Así la tasa de sobrevida para tumor de Wilms fue de 40-60% en 1960 con el uso de cirugía y radioterapia. En los años 60 la quimioterapia basándose en vincristina y dactinomicina se uso de primera línea en el tratamiento de tumor de Wilms y la sobrevida mejoró a 60%. En los años 1970 con la adicción de adriamicina a los regímenes de quimioterapia la tasa de sobrevida mejoró a un 70 %. En los últimos 30 años con el desarrollo de la oncología pediátrica como una espedalidad, y los refinamientos hechos en la terapéutica basados en los estudios del National Wilms Tumor Study Group (NWTS) en los Estados Unidos y de la Sociedad Internacional pediatría Oncológica ( SIOP) en Europa, la tasa de cura para
Tumor de Wilms es ahora de 90%. Estos sucesos se lograron sobre la base de 4 conceptos del tratamiento de cáncer de niño:
Terapia multimodal.
Equipo multidisciplinario.
El Estadiaje.
Estudios multi-institucionales.
La terapia multimodal es el uso de quimioterapia, cirugía y radioterapia.
Un equipo multidisciplinario incluye por lo menos un oncólogo pediatra, enfermera, nutri-cionista, farmaceuta, cirujano, urólogo, radiotera-peuta, radiólogo, patólogo, trabajador sodal, pediatra y familiares. El pediatra y el familiar no solo constituyen parte del equipo multidisciplinario sino También constituyen las figuras claves en evitar él diagnostico tardío y el abandono de la terapia.
El estadiaje es el concepto de agrupar a los parientes cuyas enfermedades se han diseminado de manera similar para definir él pronóstico y el tratamiento.
Los grupos multi institucionales así como el NWTS y la SIOP son importantes en pediatría porque los tumores son raros. Algunas Instituciones se unen para registrar un número adecuado de pacientes en protocolos de tratamientos.
Basado en la estrategia de nefrectomía inmediata el NWTSG recomienda resección quirúrgica temprana del tumor y riñón afedado. Como consecuencia dependiendo de la histología del tumor y del estadiaje clínico patológico los pacientes recibirán quimioterapia. Pacientes con enfermedad avanzada o fadores adversos, recibirán radioterapia adicionalmente. En contraste la SIOP recomienda quimioterapia pre-operatoria para todos los tumores, con tratamiento postoperatorio para los tumores localizados acordando al estadiaje asignado en el momento de la cirugía.
El tumor de Wilms es el tumor renal más común en niños. La incidencia anual total de tumor de
J—'/. JUDC ii, LJI LL.CUU
Wilms en los Estados Unidos es estimada en 450 a 500 casos. Este representa un 5 a 6 %, de todos los cánceres pediátricos. Se presenta casi igual en el sexo masculino que en el femenino. Los tumores son bilaterales en un 5 a 10% de los casos. La edad media de presentación es de 44 meses para tumores unilaterales y 31 meses para tumores bilaterales. La incidencia del tumor de Wilms es aproximadamente 8,1 casos por 1.000.000 niños por año. Hubo una más alta incidencia en niños africanos o afroamericanos cuando se comparo con niños caucásicos o asiáticos. Por lo menos un factor ambiental, exposición del padre a ciertas sustancias químicas parece estar involucrado en el desarrollo del tumor de Wilms en niño.
GENETICA Y BIOLOGÍA MOLECULAR
Al igual que otras neoplasias, el T.W está caracterizado por alteraciones en genes que regulan el crecimiento, la diferenciación y el potencial proliferativo.
Celular.
La mayoría de los T.W. aparecen por mutaciones somáticas que se restringen al tejido del tumor. Algunos, sin embargo, se originan de mutaciones de la línea germinal, lo cual puede heredarse de un padre o puede levantarse de novo.
Por debajo de un 10% de los T.W. ocurren en individuos con anomalías congénitas y síndromes,34 los cuales están sumados en las tablas 1 y 2.
Los fenotipos relacionados con el T.W. pueden clasificarse en:
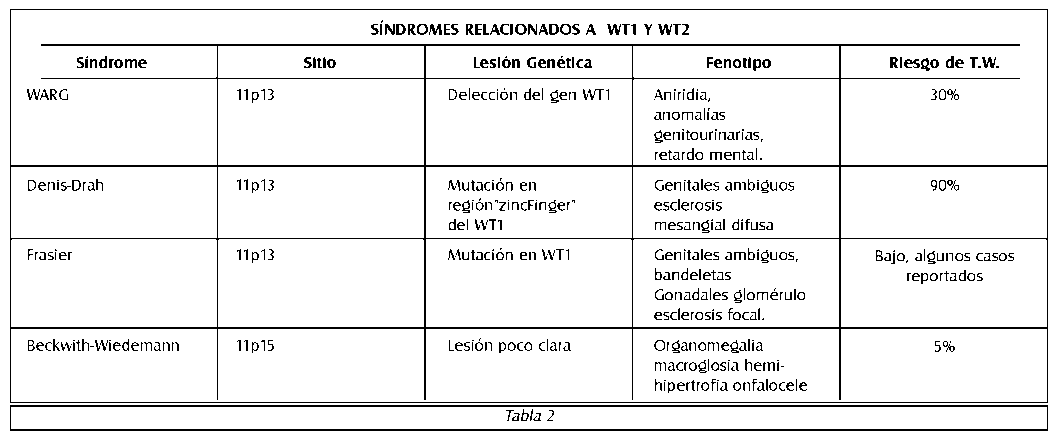
Síndromes macrosómicos y síndromes no macrosómicos
Los síndromes macrosómicos son el resultado de un excesivo crecimiento somático prenatal y postnatal, lo cual puede resultar en macroglosia, nefrome-galia y hemihipertrofia .De estos los más comunes relacionados con T.W. son el Beckwith-Weidemann y la hemihipertrofia aislada.
Otros incluyen el síndrome de Perlman, el de Soto y el de Simpson Golabi-Behemel.
Los Síndromes no macrosómicos relacionados con el T.W. incluyen aniridia aislada, trisomía 18, aniridia combinada con malformaciones genito-uri-narias y retardo mental, Síndrome de Bloom y el síndrome de Denis Drash.
De un 5 a 10% de los tumores son bilaterales o multifocales y de 1 a 2% están asociado con una historia familiar de T.W.35 se presume que estas características de presentación son manifestaciones de mutaciones germinales.

Aunque el tumor de Wilms es uno de los paradigmas originales de Knudson's y su modelo de los dos golpes de formación de cáncer, se ha puesto claro que varios eventos genéticos contribuyen a la tumoroge-nesis de Wilms. Los genes y locus implicados en la patogénesis del tumor de Wilms son:
El gen WT1:
Fue el primero en identificarse y es el más caracterizado en el campo de la genética del T.W. El descubrimiento del WT1 provino de la observación de que los paciente con aniridia, anomalías genitourinarias y retardo mental, están en el riesgo alto (>30%) para la aparición de tumor de Wilms. Esta constelación de rasgos se denominó síndrome de WAGR. Los análisis citogenéticos de individuos con el síndrome de WARG, revelan grandes delecciones en el cromosoma 11 (banda llpl3), el cuál fue encontrado posteriormente acompañando a un juego de los contiguos de genes que incluyen PAX6, el gen responsable para la aniridia (37) y WT1.38'39
El WT1 codifica un factor proteico de trascripción en forma de dedo (zinc finger transcription factor) que se expresa en riñones, gónadas, bazo y mesote-lio. El gen es crítico en el desarrollo de riñón normal y en el de las gónadas, cualquier pérdida en una de sus copias, como se ve en el síndrome de WARG ó en el síndrome de Denys Drash: (T.W., seudoher-mafroditismo masculino, esclerosis mesangial renal),40 es suficiente para causar serios defectos genitourinarios. El WT1 es también un gen supresor tumoral como se demuestra por la presencia de mutaciones inactivantes bialélicas en un subtipo de T.W.
El gen WT 2: localizado también en el cromosoma
11 pero en el brazo corto del 15, la presencia de este segundo gen se dedujo por primera vez de la observación de que la pérdida de la heterogodgosidad (LOH) del cromosoma llp en T.W con la exclusión del WT1 locus llpl3, a menudo involucra al locus llpl5.
El locus llpl5 también está ligado al Síndrome de Beckwith Wiedemann, un desorden macrosómico asodado a un riego de un 5 a 10 % de T.W. y a otras neoplasias.41'42
Aunque se le da el nombre de WT2 al locus llpl5, éste no ha sido bien identificado. La caracterización molecular del WT2 ha revelado por lo menos 10 copias de genes que son genes que están expresados en uno de los pares alelos. Algunos de éstos incluyen fador 2 de credmiento pareado a la insulina (I FG2), H19 y P57. En vista de que el IFG2 induce crecimiento celular el aumento de la expresión de éste gen podría contribuir al desarrollo de ambos T.W y Síndrome de Betckwinth Wiedemann.
Restos nefrogénicos y WT1/ WT2
Los restos nefrogénicos son focos de células renales embrionarias que persisten anormalmente en la vida postnatal. Ellos se encuentran en aproximadamente 1 % de riñones de recién naddos y usualmente regresan ó se diferendan en la infancia.43
En vista de que los restos nefrogénicos se encuentran en los riñones de aproximadamente un 40% de los T.W. unilaterales y en cerca de un 100% de los T.W bilaterales, se presume que los restos nefrogénicos representan precursores de T.W.
Los parientes con mutaciones de la línea germinal WT1 ó WT2 tienen una alta incidencia de restos nefrogénicos sugiriendo que estas mutaciones predisponen a la persistencia anormal de las células embrionales. Esta noción se soporta por un estudio de 34 Wilms con restos nefrogénicos que demostraron alteraciones de WT1 y WT2 en ambos, los restos y en los tumores de Wilms, indicando que lesiones del WT1 y WT2 ocurren tempranamente en el desarrollo del tumor de Wilms. En vista de que la mayoría de los restos nefrogénicos incluyendo algunos con mutaciones bialélicas inactivadas del WT1 nunca se convierten en T.W. se asume que debe haber eventos adicionales para completar el proceso de transformación (Ver figura 1).
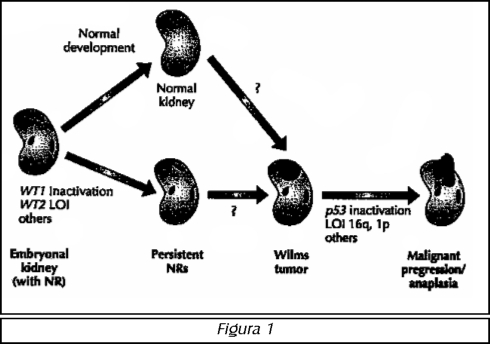
FWTly FWT2
La predisposición familiar es rara, afectando ala 2% de paciente con T.W. Análisis de familias con algunos miembros afectados han indicado que la susceptibilidad es una herencia autosómica dominante con penetranda incompleta.
Aunque las mutadones constitucionales del gen WT1 han sido implicadas en algunos Wilms familiares, el análisis genético exduye al llpl3 como el locus predisponente en muchas otras familias afectadas.
En el análisis de dos familias se reveló unión con cromosoma 17q, y el gen de Wilms putativo a este sitio se denominó FVVT'l .44,45 los análisis de otras 5 familias revelaron un segundo locus predisponente a tumor de Wilms familiar, localizado en el cromosoma 19q, se denomino FWT2.
El gen p53
Es un gen supresor tumoral el cual está localizado en el cromosoma 17p, es la mutadón genética encontrada más frecuentemente en todo los tumores humanos. Este actúa como un regulador negativo de la proliferación celular y un regulador positivo de la apoptosis en respuesta a agentes que dañan al ADN. En algunos tipos de neoplasias la acumuladón de la proteína p53 ha sido reportada por estar correlacionada con un comportamiento clínico más agresivo. El rol de la expresión del p53 en T.W, no está totalmente daro, pero la mayoría de los estudios han confirmado su correlación con anaplasia y con estadios avanzados de enfermedad El p53 se ha encontrado en un 75% de tumores con histología anaplásica.46'47
B-catenina
Es una proteína de adhesión celular que está asociada con miembros fador celular T (TCF), familia de factores de trascripdón que promueven la expresión de genes relacionados al crecimiento celular como "el C myc y cydin DI". Este es efector central en la señal del paso de traducdón del Wnt y su desreguladón es crítica en el desarrollo de un número de malignidades, mutaciones o delecdones de los sitios de fosforiladón de la B catenina resulta en la acumuladón de la proteína, su incremento y su disponibilidad para adivar la transcripción de genes designados. Algunos estudios han sugerido que la desregulación de la señal Wnt juega un rol en la génesis de algunos tumores de Wilms. Maiti y colaboradores reportaron mutación de B catenina en 21/153 (14%), casos de Wilms confirmando observaciones más tempranas que demuestran mutaciones de B catenina en 6 de 40 (15%) tumores de Wilms.48
El estudio de Maiti y colaboradores reveló una mas alta correladón entre mutadones de la B catenina y mutaciones de WT1, todos los tumores menos uno con mutación de B catenina tenían una mutación WT1 y el 50% de los tumores con mutaciones WT1 tenían una mutadón B catenina. Estas caraderísticas de mutadones sugieren que estos dos genes operan en distintos pasos y pueden colaborar en la génesis de la aparidón de los tumores de Wilms.
Cromosoma 16 q, lp y 7p
Estudios preliminares han mostrado que la pérdida de la heterogocigosidad en el cromosoma 16q y en el lp puede tener significancia biológica para T. W., ya que las pérdidas de estos locus estaban asociadas con pronóstico adverso, independientemente del estadio del tumor y de la histología.49'50 El objetivo primario del estudio 5 del NWTS es determinar en forma prospediva la significancia pronostica de la perdida de la heterogocigosidad del locus 16q y lp.
Dada la asodación de anomalías congénitas con predisposición a desarrollar T.W. se ha recomendado que un niño con éste tipo de condición debe ser evaluado clínicamente y con ultrasonido en forma periódica. Si se detecta T.W se debe complementar los estudios con pruebas moleculares tales como presencia del gen WT1, índice de ADN y alteraciones del P53 para determinar si estos parámetros tienen valor pronóstico.
Los niños con predisposidón a desarrollar tumor de Wilms se les deben realizar ecosonograma abdominal cada 3 meses hasta los 8 años de edad.
Apariencia macroscópica
Los tumores de Wilms son masas grandes que miden más de 5 cm, de diámetro y en un terdo ó más son más grandes de 10 cms. Con frecuenda pesan más de 500grs. A la superfide de corte son sólidos,
suave y grisáceo o rosado pareciéndose al tejido cerebral (ver figura 2,3 y 4). Es frecuente encontrar focos de hemorragia y de necrosis, las áreas quísticas también son comunes. Los tumores usualmente están englobados por una pseudo cápsula prominente compuesta de tejido renal y pararrenal comprimido,
Apariencia histológica
El tumor de Wilms está compuesto en forma típica de una mezcla variable de blastema epitelio y estroma aunque en algunos tumores están presente solo uno ó dos de los componentes (Ver Fig. 5 a y b).
Basados en los resultados del NWTS, los tumores de Wilms están divididos dentro de 2 categorías histología favorable y desfavorable; acordando a la ausencia ó presencia de anaplasia. La anaplasia se encuentra en un 5% de pacientes con tumores de Wilms, es rara en pacientes menores de 1 año y más del 80% de los pacientes afectados son mayores de 2 años. En los estudios precoces del NWTS, la presencia de anaplasia se reconoció que conlleva a un riesgo incrementado de fallas de tratamiento y muerte. Pequeños focos de anaplasia pueden estar asociados con una sobrevida adversa.
La anaplasia ha sido definida por el NWTS como la combinación de células con núcleos muy grandes, hipercromáticos y figuras mitóticas multipolares; el reconocimiento de la anaplasia demanda una buena preparación histológica, una fijación apropiada de los cortes y una adecuada tinción de los mismos. esto da una apariencia de circunscripción y una cápsula verdadera, el crecimiento polipoideo en la cavidad de la pelvis renal semeja a sarcoma botriodes, es una característica que está asociada con la diferenciación de músculo esquelético y podría conllevar a un diagnostico erróneo de rabdiomiosarcoma.
Sarcoma renal de células claras del riñón y tumor rabdoide del riñón. Los cuales constituyen tumores renales infantiles no relacionados con tumor de Wilms. Debido a su ubicación renal han sido tratados en ensayos clínicos desarrollados por el grupo nacional para el estudio del tumor de Wilms. El enfoque de tratamiento de estos tumores, es distinto al del tumor de Wilms y requiere de un diagnóstico preciso a tiempo.
El sarcoma renal de células claras originalmente denominado tumor renal metastizante a hueso es una neoplasia altamente maligna resistente a la terapia convencional para tumor de Wilms responde a los regímenes que contienen doxorrubicina, ocurre en el mismo rango de edad que el T.W, compromete aproximadamente el 6 % de los tumores renales de niños; son diagnosticados en su mayor parte en pacientes entre 12 y 36 meses de edad (51, 52), aunque casos raros también ocurren en adultos jóvenes. Aproximadamente el 66% son masculinos. La propensión a metastizar a hueso es marcada, el sarcoma renal de células claras es por lo menos 10 veces más metastizante a hueso que cualquier otro tumor renal pediátrico.
El tumor rabdoide de riñón inicialmente se pensó que era una variante Rabdomiosarcomatosa del tumor de Wilms, es la más maligna de las neoplasias renales en niños, usualmente metastiza profundamente y causa la muerte del paciente entre los 12 meses del diagnostico .Los pacientes son muy jóvenes en el momento del diagnostico (edad media de presentación en el NWTS es de 11 meses y es raro después de los 3 años), hay un predominio masculino 1, 5:1.
Asociado con tumores embrionales del S.N.C y la hipercalcemia paraneoplásica ha sido reportada.
PRESENTACIÓN CLINICA
El conocimiento de la presentación clínica típica de tumor de Wilms es importante para el personal médico y paramédico ya que esto evita él diagnostico tardío.
El tumor de Wilms es un tumor de niños pequeños. La edad promedio en el momento del diagnóstico es de 3 Vi años. La presentación más común (80%), de T.W es una masa abdominal ó un aumento de la circunferencia abdominal generalmente en niños con buen estado general, lo cual hace la diferencia con el neuroblastoma donde el toque al estado general es predominante, es una masa firme, indolora de superficie regular que puede atravesar la línea media pero en la mayoría de los casos permanece en el mismo lado generalmente diagnosticada por la madre ó abuela. Ver figura 6 a y b.
A diferencia del neuroblastoma, solo el 20 -30% de los niños con tumor de Wilms tienen dolor. Usualmente éste es un dolor abdominal probablemente por el sangramiento intermitente dentro del tumor. Muy raramente un niño con T.W. se presentará con un abdomen agudo por ruptura del tumor, 20 a 30 % de los pacientes tienen hematuria. Aproximadamente un 25% de los pacientes tienen hipertensión arterial, lo cual ocurre por compresión del tejido renal normal ó por secreción tumoral de renina, de allí la importancia de la lectura de la misma en éste tipo de paciente. La fiebre está presente en un 20 -30 % de los pacientes. También otras formas de presentación más raras consisten en varicoceles, hernias, testículos aumentados de tamaño e insuficiencia cardiaca congestiva como consecuencia
de la propagación del tumor en el corazón ó debido a fístula arteriovenosa intrarenal. Ocasionalmente se manifiesta clínicamente con síntomas debido a metástasis pulmonares vía principal de diseminación.
Un 2 % de los pacientes muestran estigmas de algunos otros síndromes. Ver figura 7.

DISEMINACIÓN
Esta puede ser de dos maneras;
Local: Penetración de la cápsula renal.
Penetración dentro del tejido peri renal.
A través de los vasos sanguíneos, por la formación de trombos.
A través de los ganglios linfáticos.
Hematógena.
Pulmón e hígado.
Raramente disemina, pero cuando lo hace, su principal diseminación es a pulmón. Aproximadamente un 10 a 15% de los pacientes con tumor de Wilms tienen metástasis pulmonares en el momento de diagnostico.
El tumor de Wilms puede desarrollarse simultáneamente en ambos riñones sugiriendo que ésta es una enfermedad que se origina de células pre-malignas en ambos riñones. Cerca de un 5% de niños con tumor de wilms tienen enfermedad bilateral en el momento de diagnostico.
ESTAD I AJE
El T.W. es generalmente estadificado acordando a el sistema de Estadiaje del NWTS. Ver figura 8, 9, 10,11.
Estadio I: Tumor confinado a riñón, y completamente encapsulado. No hay invasión de los vasos sanguíneos y el tumor puede ser removido intacto.
Estadio II: El tumor se extiende por fuera del riñón pero es completamente removido puede haber extensión regional del tumor (por Ej.: penetración de la cápsula renal ó invasión extensiva del seno renal. Los vasos sanguíneos por fuera del parénquima renal, incluyendo aquellos del seno renal pueden contener tumor. El tumor ha sido biopsiado (excepto por aspiración con aguja fina) o hubo diseminación del tumor antes o durante de la cirugía estando confinada a flanco y no involucra a la superficie peritoneal.
Estadio III: Tumor no hematógeno residual que está presente y confinado al abdomen. Puede ocurrir lo siguiente:
Hallazgo de ganglios linfáticos involucrados por tumor dentro del abdomen o pelvis, (hilio renal, paraórticos o más allá de ellos).
Los ganglios linfáticos ubicados en el tórax en otro sitio extra abdominal deben ser un criterio de estadio IV.
Implantes tumorales en el peritoneo.
Tumor residual macroscópico ó microscópico post-operatorio (por Ej.) hallazgo de células tumorales en el margen de resección quirúrgica o en el examen microscópico.
El tumor no es completamente resecado por infiltración local dentro de estructuras vitales.
Diseminación del tumor no confinada a flanco que ocurre antes o después de la cirugía.
Estadio IV: Metástasis hematógenas (pulmón, hígado, hueso y cerebro) o ganglios metastásicos fuera de la región abdomino pélvica.
Estadio V: Compromiso renal bilateral en el momento del diagnostico.
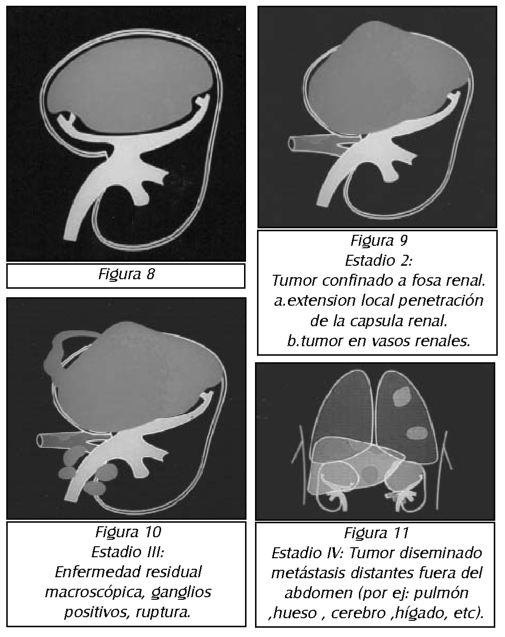
DIAGNOSTICO
La evaluación inicial del niño con una masa abdominal es más adecuada hacerla por ultrasonido. El ultrasonido frecuentemente permite:
• Diferenciar tumor de Wilms de neuroblastoma.
• Evaluar la vena renal y demostrar la presencia de trombos renales
• Examinar el riñón opuesto, lo cual es importante ya que cerca de un 5% de los niños pueden tener enfermedad bilateral. Ver Fig. 12.
La tomografía computarizada es de ayuda en la definición de los contornos del tumor. Es también útil en los casos de enfermedad bilateral y al utilizar contraste con la aparición del TAC helicoidal nos muestra la deformación pielocalicial, lo que ha desplazado a la Urografía de Eliminación Cerca del 10 al 15 % de los pacientes tiene metástasis ó enfermedad estadio IV, en el momento del diagnostico, por lo que es importante hacer una RX simple de tórax, para evidenciar si hay diseminación al pulmón. El rol de la tomografía computarizada de tórax en el diagnostico del tumor de Wilms es controversial. Aunque un 10% de los pacientes tienen lesiones en la tomografía y no en la Rx de tórax Desafortunadamente aunque la tomografía es más sensible ,ésta ,no es específica Estas lesiones pueden ser tumor, atelectasia, artefacto ó granuloma. Tampoco está claro, aún cuando estas lesiones son tumor, si estos pacientes están más en el riesgo de recaída. Ver Fig. 13 y 14.
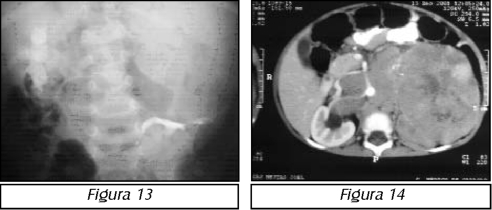
A pesar de algunos estudios que se avocan a éste problema, no está clara la respuesta a ésta pregunta. En los actuales momentos especialmente en países con recursos limitado el curso más razonable es obtener una radiografía del tórax y tratar en esa base.
Los tumores de Wilms raramente metatizan a hueso así un gamma grama óseo no es necesario a menos que exista dolor óseo ó que el paciente tenga un Sarcoma renal de células claras, El sarcoma renal de células clara involucra el riñón y puede ser indistinguible del tumor de Wilms. Si en un paciente que se piensa con tumor de Wilms hay metástasis a hueso, se debe revisar el diagnostico patológico y si éste resulta un sarcoma renal de células claras es pertinente realizar el gamma grama óseo.
Hay unos pocos reportes del tumor de Wilms metastizando a cerebro, pero esto es muy raro y una tomografía de cráneo no está indicada al menos que existan trastornos neurológico ó cefalea.
Puede incluir lo siguiente:
• Nefroma quístico multilocular.
• Nefroma mesoblástico.
• Nefroblastomatosis.
• Carcinoma renal.
• Hidronefrosis.
• Riñón multiquístico displásico.
• Enfermedad renal quística.
Se han identificado muchos factores pronóstico, aunque ellos pueden cambiar cuando el tratamiento es más eficaz.
La magnitud de enfermedad al diagnóstico (estadiaje) y la histología del tumor siguen siendo las dos variables pronosticas más significantes.
La edad en el diagnóstico y el tamaño del tumor-está fuertemente asociado con recaída y tasa de muerte (Breslow el al. 1991), y la presencia de ganglio linfático positivo parece ser un factor pronóstico adverso (Jereb el al. 1980). Recientemente, se han identificado nuevos factores pronósticos biológicos del Grundy y colaboradores pusieron en correlación resultados del tratamiento -sobrevida con la presencia de anomalías genéticas específicas. En un estudio retrospectivo de 232 niños registrado en NWTS-3-4, la pérdida de la heterogocigosidad de los cromosomas 16q y lp estaba asodada con una recaída-libre y sobrevida global significativamente menor a los 2 años (Grundy et al. 1994).
El contenido de ADN en las células tumorales y el pronóstico de pacientes con T.W son controver-siales. Entre los parientes con T.W histología favorable la tetraploidía esta asociada con un resultado desventajoso en alguna serie, como es la aneuploidía en un estudio, pero no en otros (Douglass el al. 1986, Raínwater el al. 1987, Gururangan el al. 1992).
La aneuploidía frecuentemente ocurre más en tumores de histología anaplásica y la progresión a la anaplasia parece estar correlacionado con el desarrollo de anormalidades del gen p53 dentro de las células tumorales.
Con frecuencia se usa la terapia trimodal. Esta involucra lo siguiente:
Cirugía Inicial.
Nefrectomía radical, en lo posible.
Quimioterapia: usualmente actinomicina D, vin-cristina, con o sin doxorrubidna.
Radioterapia (si ésta es necesaria).
La terapia multimodal ha contribuido a incrementar la sobrevida de los pacientes con tumor de Wilms.
La aparición de la radioterapia y/o quimioterapia han sido dos de los grandes avances de este siglo, sin embargo el factor fundamental de éxito en el tratamiento del tumor de wilms continúa siendo la extracción completa del tumor, pues además establece la clasificación clínica y el pronóstico.
El cirujano desempeña un papel importante en el tratamiento del tumor de Wilms y se hace necesario cumplir el protocolo Quirúrgico, de manera estricta y debe ser llevado a cabo tan pronto haya finalizado la evaluación diagnóstica del niño y sus condiciones hemodinámicas estén estabilizadas; para comenzar la cirugía, una incisión debidamente planteada; es imperativo para prevenir complicaciones innecesarias.
Se coloca el paciente en posición levemente oblicua, con el lado afectado en plano superior y el dorso en hiperextensión, se realiza una incisión transperitoneal transversa amplia desde el extremo de la duodécima costilla del lado afectado hasta el borde externo del músculo recto anterior mayor del abdomen antero lateral, es usual que solo es necesario la transección del músculo ipsilateral; sin embargo, la ampliación torácica de la incisión subcostal o la ejecución de la incisión toraco-abdominal suelen ser útiles con masas extensas del polo superior en pacientes que son objetos de una segunda operación o cuando se precisa una sola metástasis del pulmón. (Fig. 15 y 16).
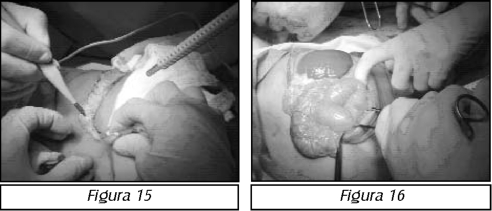
La inspección completa del contenido abdominal es de suma importancia; evaluar la extensión del tumor; el hígado, ganglios linfáticos, paraaórticos e hiliares, vena cava y riñón contra lateral deben ser inspeccionados y palpados, aunque la evaluación de los ganglios linfáticos puede ser inexacta durante la operación, la presencia de masas voluminosas es indicativa de Biopsia.
No es correcto palpar el riñón contra lateral a través del mesenterio, fascia o tejido adiposo circundante, se moviliza por completo de su envoltura, después se desplaza el colon antes de centrar la atención al riñón afectado, la biopsia está indicada al identificar cualquier lesión, después se aconseja marcar el área con clip para permitir la vigilancia radiológica y de ser necesario una segunda operación se procede de inmediato a la nefrectomía radical del riñón ipsilateral si el riñón contra lateral es normal. Se realiza un gran esfuerzo, evitando roturas, ni siembras, porque en tal caso las recidivas abdominales locales se multiplican 1, por tanto la extirpación completa es la meta: Ablación del riñón en bloque con fascia de Gerota para minimizar diseminación de células tumorales. (Fig.17,18 y 19 a y b).
La glándula adrenal es extirpada cuando el tumor involucra el polo superior renal.
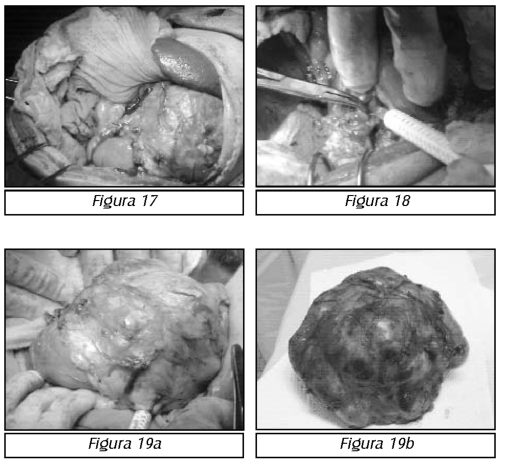
Es necesario determinar la posibilidad de resección completa, en ciertos casos no es inusual. En nuestro medio que si el tumor atraviesa la cápsula renal y se adhiera a órganos y estructuras adyacentes y los invada con compromiso de glándula adrenal, duodeno, hígado, páncreas, bazo, diafragma, colon o músculo de la pared abdominal. Aunque puede ser-llevado a cabo una disección limitada a dichos órganos con el fin de permitir la extirpación primaria del tumor no se justifica un enfoque heroico inicial por el riesgo de aumentar la Morbimortalidad, además hay consenso general de que la extirpación radical no es beneficiosa en estos casos; y una segunda y tercera operación de evaluación después de quimioterapia y/o radioterapia son beneficiosas en un número significativo de pacientes que no son erradicados en la intervención inicial.
La presencia de un trombo tumoral en la vena renal, no afecta la sobrevida, estos trombos por lo general no son invasores y se pueden extraer; 6-10% de los pacientes con tumor de Wilms tienen afección tumoral de la cava inferior; y de esta en 3% se extienden a la aurícula derecha.
Aunque es usual que sea asintomático, se debe identificar en el preoperatorio mediante técnicas ecosonográficas extracorporales. Es imperativo confirmar antes de la operación, el límite de la diseminación venosa del tumor en sentido cefálico, a fin de planear la operación apropiada.
Cuando el tumor es inoperable, debe considerarse la posibilidad de un pretratamiento con quimioterapia y/o radioterapia con el fin de reducir la masa tumoral y programar la intervención quirúrgica posteriormente; son tumores con extensión a la cava por encima de las venas suprahepáticas o una masa que cruza la línea media inextirpable o tumor de Wilms bilateral logrando entonces una reducción significativa de la masa tumoral, sin embargo el porcentaje de error diagnóstico preoperatorio es de alrededor de un 5%, pudiendo alterar los hallazgos patológicos lo que dificultaría adicionalmente la necesidad del tratamiento ulterior. El efecto más beneficioso es que el índice de ruptura quirúrgica es menor, esta conducta es muy controversial, se ha dado quimioterapia a riñones multiquísticos y el uso de biopsia percutánea o a délo abierto trae aún más discusión, una biopsia percutánea es posible que la aspiradón con aguja fina no tenga tejido sufidente para la inter-pretadón histológica y el riesgo de recidiva en el trayecto de la aguja está latente, siendo mucho mayor a cielo abierto.
CIRUGÍA CONSERVADORA
Se postula la nefrectomía pardal dado la posibilidad de que tardíamente aparezca insufidencia renal y dado el riesgo de que más adelante se desarrolle un nuevo tumor de Wilms a-b además de la buena evoludón.
EL TRATAMIENTO DE TUMOR DE WILMS BILATERAL
La mayoría de los tumores de Wilms son demasiados grandes para someterles a una nefrectomía parcial cuando acuden a nuestra consulta por lo que se hace necesarios quimioterapia previa al plantearse una drugía conservadora.
En estudios realizados por el NWTSG, la indden-cia de insuficiencia renal c En los niños con tumores unilaterales fue de 0,25% la mayoría de ellos padecía un Síndrome de Denys- Gras; Que se asoda a neuropatías intrínsecas y que se manifiesta con insufi-cienda renal en el momento del diagnóstico o que empieza progresivamente y de forma inevitable hacia la insufidencia renal terminal.
En general, el riesgo de insuficiencia renal después de tratar un tumor de Wilms unilateral es
escaso, aunque se necesita un seguimiento a largo plazo de esta constante de niños sanos para conocer los efectos tardíos del tratamiento.
Las pruebas de detección selectiva de los pacientes con riesgo elevado de padecer un tumor de Wilms( síndrome de Beckwith- Wiedemann, hemi-hipertrofia, aniridia) detectan en ocasiones una pequeña lesión, lo que plantea la conveniencia de realizar una nefrectomía parcial, aplicando quimioterapia preoperatoria a estos pacientes para hacer más fácil la cirugía.
En los pacientes con tumor de Wilms bilateral, hay que temer el desarrollo de insuficiencia renal, pues 15 años después del tratamiento, la incidencia de una nefropatía terminal se acerca al 15%; por tanto están justificados los intentos de cirugía conservadora en estos casos.
En un niño con un tumor de Wilms bilateral deben obtenerse muestras de biopsia de ambos lados para confirmar la existencia de tumor de Wilms en ambos riñones y determinar el tipo histológico de cada tumor. No debe intentarse la extirpación de las masas tumorales como primera medida; más bien se debe administrar quimioterapia preoperatoria individualizada según el grado de extensión y la histología del tumor. Pasadas seis semanas, hay que reevaluar al paciente con TAC abdominal para determinar las posibilidades de extirpar el tumor.
Algunos pacientes pueden no obtener una mejoría evidente con la farmacoterapia anticancerosa preoperatoria, lo que alcance la nueva cirugía, pues dentro de la lesión original puede haber necrosis acompañada o no de fibrosis, o bien persistencia de músculo esquelético o de otros elementos benignos, es aquí donde debe plantearse la conveniencia de la nefrectomía parcial o una extirpación en cuña del tumor, pero solamente si esto no va a comprometer la extirpación del tumor y pueden obtenerse márgenes de resección limpios.
Si el tumor no se puede someter a una resección parcial, los pacientes portadores de un tumor viable persistente deben ser tratados con una pauta distinta de fármacos antineoplásicos, acompañada o no de radioterapia.
Algunos clínicos aconsejan enuclear el tumor exclusivamente para conservar el parénquima renal, incluso cuando el tumor es de localización central, en cuyo caso no sería aconsejable la nefrectomía parcial acompañada de unas márgenes de tejido renal sano; pero la incidencia de recidivas locales era del 14%. Aunque la supervivencia total fue equiparable los pacientes con residuos y recidivas del tumor recibieron otro tratamiento para conseguir esa supervivencia. Si hay anaplasia la enucleación no sirve para combatir suficientemente el tumor.
La cirugía primaria y/o de "second look" involucrará remoción del Riñón afectado con la inspección detallada, biopsia del riñón opuesto en caso de haber afectación del mismo y exploración para la determinar la extensión de crecimiento del tumor, si hay compromiso de ganglios linfáticos y/ó metástasis hepáticas.
El T.W. fue uno de los primeros tumores tratados con terapia multimodal.
El rol de la cirugía es, hacer el diagnóstico y remover el tumor.
La radioterapia es usada en casos seleccionados aunque en estudios recientes la terapia radiante ha sido omitida en pacientes con estadios bajos de la enfermedad, evitando de esta manera las complicaciones.
Las tres drogas usadas para el tratamiento de T.W. son vincristina, dactinomicina y adriamicina. La quimioterapia del T.W. es específica según el esta-diaje. Por ejemplo un paciente con estadio I recibe solo vincristina y dactinomicina mientras que un paciente con estadio IV de enfermedad es tratado con vincristina, dactinomicina y adriamicina asociado a radioterapia.
Si un paciente tratado por ser portador de un T.W. recae, la terapia necesita ser individualizada dependiendo de la terapia inicial que él mismo recibió y de cuándo recae.
Si un paciente recae con la terapia estándar vincristina, dactinomicina y adriamicina ésta es inefectiva y hay que cambiar el esquema de quimioterapia, utilizando nuevos agentes. La combinación ICE, ifos-famida, carboplatino y etopósido es la más efectiva.
El tratamiento antes de la cirugía es infrecuente en los Estados Unidos pero se hace de rutina en Europa. El grupo de la SIOP ha sido pionero en la quimioterapia preoperatoria para T.W. Uno de los problemas con terapia pre-operatoria es que en un 6% de los casos él diagnostico es errado. La SIOP argumenta que casi todos los diagnósticos errados son en realidad neuroblastoma y sugieren que no hay ningún daño en tratarlos.
El grupo de la SIOP ha mostrado claramente que con quimioterapia preoperatoria el número de tumores que se rompen en el momento de la cirugía es reducido, sin embargo la tasa de ruptura intra-operatoria es mucho más alta que en los Estados Unidos, donde la tasa de ruptura sin quimioterapia preoperatoria es cerca de un 4% y los pacientes tienden a presentarse con estadios bajos de enfermedad.
Los estudios de la SIOP también muestran que a la quimioterapia es tan buena como la radioterapia y que el estadiaje puede disminuir con la terapia preoperatoria; Ochenta y Un por ciento de los pacientes que recibieron cuatro semanas de quimioterapia con vincristina y dactinomicina fueron en estadio I y II a la cirugía.
En los Estados Unidos, la terapia preoperatoria es usada en pacientes con enfermedad diseminada en el momento del diagnóstico, pacientes con tumores irresecables ó pacientes con enfermedad bilateral, con el objeto de disminuir la lesión tumoral lo más posible en el momento de la cirugía. La terapia para pacientes con enfermedad bilateral debe ser individualizada.
La tasa de sobrevida es mayor de un 85% con las terapias y está esencialmente basada sobre el estadiaje de la enfermedad, mientras más bajo es el estadiaje, más alta será la tasa de sobrevida.
Estadio IV 70 a 80 %
EFECTOS TARDIOS DEL TRATAMIENTO
Como a la mayoría de los niños se les realiza nefrectomía como parte de tratamiento, las complicaciones tardías incluyen problemas con el riñón remanente, por lo que en lo posible, se debe:
• Evitar trauma significativos (por ejemplo: evitar juegos violentos).
• Prevenir la aparición de infecciones recurrentes, y el desarrollo de hipertensión arterial.
La vincristina y la dactinomicina no tienen un efecto tardío significativo, a diferencia de la adriami-cina con su potencial de cardiotoxicidad.
La radioterapia tiene su efecto tardío dependiendo de la dosis y del sitio donde se dé. La radiación abdominal total puede causar fallas ováricas en la mujer, la radiación a pulmón puede causar fibrosis pulmonar, la irradiación a hueso puede alterar el crecimiento adecuado y hay un chance de desarrollar segundas neoplasias.
REALIDAD EN PAÍSES EN VÍAS DE DESARROLLO
Hay especiales problemas en el tratamiento del T.W. o cualquier otra malignidad pediátrica en países en vías de desarrollo.
Muchos pacientes se presentan con enfermedad avanzada y son más difíciles de tratar.
Muchos cirujanos y patólogos no están familiarizados con tumores pediátricos.
Los pacientes pueden tener otros problemas de salud tales como: Infecciones, parásitos y desnutrición.
Los familiares no entienden la necesidad de tratamiento y abandonan la terapia.
Sin embargo, varios países han desarrollado excelentes programas de oncología pediátrica que se dirigen a estos problemas han logrado tasas de sobrevida excelentes para los niños con T.W.
Los médicos generales y los trabajadores de la salud deben ser informados a cerca de la existencia de tumores pediátricos y de la necesidad de referirlos para su tratamiento.
El tratamiento preoperatorio puede ser utilizado si el cirujano considera que el tumor es resecable por sus grandes dimensiones.
Los patólogos tienen ahora la oportunidad de usar Internet y transmitir las fotos micrografías a centros especializados si hay dudas ó preguntas acerca del diagnóstico.
Los pediatras deben mejorar el cuidado de los niños para disminuir los otros problemas de salud y los familiares pueden ser educados para disminuir el problema de abandono de terapia.
En suma los trabajadores de la salud en estos países deben desarrollar un centro especializado en oncología pediátrica para mejorar el tratamiento y la sobrevidad de niños con éste y otros tipos de tumor.
11. Annotations: Extirpation of the Kidney. Lancet 1889, 1877.
12. Walker G:Sarcoma of the Kidney in Childhood: a critical rewiew of the pathology, symptomatology, prognosis and operative treatment as seen in 145 cases, Ann Surg 26: 529, 1897.
13. Priestley J.T. and Schulte T.L.: The treatment of Wilms tumor, Urology 47: 7, 1942.
14. Frienlander A.: Sarcoma of the Kidney treated by roentgen ray. Ann J Dis Child 23: 1916.
15. Priestley J.T.:Suvival following removal of malignant neoplasms, JAMA 113: 902, 1939.
16. Dean A.L.: Radiation treatment of the more common Kidney tumors, Am J Surg 38: 80, 1937.
17. Vaeth J.M. and Levitt S.H.:Five year results in the treatment of Wilms tumor of children J. Urol 3 : 247, 1963.
18. Gross R.E.:The surgery of infancy and childhood: its principles and techniques,Philadelphia, 1953. WB Saunders Co.
19. Färber S. Clinical and biological studies with Actinomycin .In ciba foundation symposium on aminoacids and peptides with metabolic activity. Boston, 1958. Little. Brown & Co.
20. Färber S. and others: Advances in chemotherapy of cancer in man, Adv. Cancer Res 4: 1, 1956.
21. Waksman S.A., editor: The Actinomicyns and their importance in the treatment of tumor in animal and man. Ann NY Acad Sei. 89: 283, 1960.
22. Färber S. Chemotherapy in the tretment of leukemia and Wilms tumor JAMA 8, 826, 1966.
23. Färber S. and others clinical studies of actinomicin
D. with especial reference to Wilms tumor in children. Ann NY Acad Sei 89-421, 1960.
24. Sullivan M.P. and others: Vincristina sulfate in management of Wilms tumor JAMA 202 (5): 381, 1967.
25. Sutow W.W.,Thurman W.G., and Windmiller J.: Vincristine (leurocristine) sulfate in the treatment of children with metastatic Wilms tumor, Pediatrics 12: 880, 1963.
26. Vietti T.J. and others: Vincristine sulfate and radiation therapy in metastatic Wims'tumor. Cancer 25:
12, 1970.
27. Finkleisten J.Z.,Hittle R.E., and Hammond C.D.: Evaluation of a high dose ciclophosphamide regimen in childhood tumors. Cancer 23: 1239, 1969.
28. Livingston R.B. and Carter S.K.:Single agents in cancer chemotherapy, New York 1970. IFI/Plenum Data Corp.
29. Bellani F.F., Gasparini M., and Bonadonna G.: Adriamycin in Wilms Tumor previously treated with chemotherapy, Eur J cancer 11: 593, 1975.
30. Blum R.H. and Carter S.K.: A new anticancer drug with significant clinical activity, Ann Intern Med 80: 249, 1974.
31. Di Mareo A., Gaetani J. And Scarpinato B.: Adriamicyn: a new antibiotic with antitumor activity. Cancer Chemother Rep 53: 33, 1969.
32. Ragab A.H. and others: Adriamicin in the treatment of childhood solid tumors. Cancer 36: 1572, 1975.
33. Tan C. and others: Adriamycin; an antitumor antibiotic in the treatment of neoplastic diseases, Cancer 32: 9, 1973.
34. Jeffrey S., Dome M.D., and Max J. Coppes, M.D. PH: Recent advances in Wilms tumor genetics. Current opinion in Pediatrics 2002, 14: 5-11.
35. Green D.M., Coppes M.J., Breslow N.E., et al. Wilms tumor in principles and practice of pediatric oncology. Edite by Pizzo P.A., Poplack D.G. Philadelphia. Lippincont -Raven,1997, 733-759.
36. Clericuzio C.L.: Clinical phenotypes and Wilms Tumor. Medical and Pediatric oncology 21(3): 182-187, 1993.
37. Ton C.C.T., Hirvone H., Miwa H., et al positional cloning and characterization of a paired box-and homeobox containint gen fron aniridia region Cell 1991, 67: 1059-1074.
38. Call K.M., Glaser T., Ito, C.Y. et al: Insolation and characterization of a zinc finger polipeptide gene at the human cromosome 11 Wilms tumor locus. Cell 1990, 60: 509-520.
39. Bonetta L., Kuehn S.E., Huang A., et al.: Wilms tumor locus on llpl3 defined by multiple CpG island associated transcripts. Science 1990, 250: 994-997.
40. Simone Treiger Sredni, Md.PhD and et al, Immunohistochemical detection of p53 Protein expression as a pronostic indicator in Wilms tumor. Med Pediatr Oncol 2001: 37: 455-458.
41. koufos A., Grundy P., Morgan K., et al, Familial Wiedeman-Betckwith syndrome and a second Wilms tumor locus both map to lip 15. Ann J., Hum genet 1989, 44: 711-719.
42. Ping A.J., Reeve A,E., Law D.J., et al: Genetic linkage of Beckwith-Wiedemann syndrome to lip 15. Am J Hum Genet 1989, 44: 720-723.
43. Beckwith J.B., Kitviat N.B., Bonadio J.; Neprogenic rest, nephroblastomatosis and the pathogenesis of Wilms'tumor. Pediatr Pathol 1990, 10: 1-36.
44. Charles A.K., Brown K.W., Berry P.J.: Microddi-secting the genetic events in nefrogenic rest and Wilms tumor development. Am J pathol 1998, 153-991-1000.
45. Grundy P., Koufos A., Morgan K., et al: Familial predisposition to Wilms'tumor does not map to the short arm of chromosome 11. Nature 1988, 336: 374-376.
46. Bardeesy N., Falkoff D., Petruzzi M.J., et al: Anaplastic Wilms'tumor, a subtype displaying poor prognosis, harbours p53 gene mutations. Nat Genet 1994. 7: 91-97.
47. Beniers A.J., Efferth T., Fuzesi L., et al: p53 expresion in Wilms tumor :a possible role as prognostic factor. Int J Oncol 2001, 18: 133-139.
48. Koester R., Ridder R., Kopp-Schneider A., et al: Mutational activation of the b-catenin proto-onco-gene is a common event in the development of Wilms tumors. Cancer res 1999, 59: 3880-3882.
49. Grundy P.E., Breslow N., et al: Loss of hetero-gozigosity for chromosomes 16q and lp in Wilms tumors predicts adverse outcome. Cancer Res 1994, 54: 2331-2333.
50. Grundy R.G., Pritchard J., Scambler P., et al :Loss of heterogozigosity on crhomosome 16 in sporadic Wilms tumors Br J Cancer 1998: 78: 1181 -1187.
51. Mierau G.W., Weeks D.A., Beckwith J.B. 1989 Anaplastic Wilms" tumor and other clinically aggressive childhood renal neoplasms: Ultra-structural and inmunocytochemycal features. Ultrastruct patholo 13: 225-248.
52. Amin M.B., Peralta Venturina M.N., Ro J.Y. et al 1999 clear cell sarcoma of kidney in an adolescent and in young adults. Am J Surg Pathol 23: 1455-1463.
53. Palmer N.F., Sutow Wv 1983 clinical aspects of the rhabdoid tumor of the kidney: a report of the national Wilms Tumor Study Group. Med Pediatr Oncol 11: 242-245.
Dr. Luis Benavides García
Urólogo CM Hospital Privado Barquisimeto
Dr. José González Benavides
Res. Cirugía General, IVSS, El Llanito, Caracas
REFLUJO VESICOURETERAL
INTRODUCCIÓN
Reflujo Vesicoureteral, describe el flujo retrogrado de orina desde la vejiga al tracto urinario alto, es decir uréter y usualmente al sistema colector renal. Es una anormalidad muy frecuente del tracto urinario de infantes y niños comúnmente detectada cuando éstos se someten a evaluación o bien por infección de vías urinarias1 o cuando se investigan por diagnostico antenatal de dilatación del tracto urinario.2
El reflujo, conocido desde la antigüedad, fue descrito en las escrituras de Galeno y Da Vinci,3 sin embargo, no fue hasta 1952, cuando las observaciones de Hutch permitieron apreciar la verdadera relación entre reflujo y pielonefritis crónica.4
En muchos, el reflujo se originara por una anomalía congénita de la unión uretero-vesical, en tanto que en otros el reflujo será el resultado de una alta presión de vaciado vesical, secundario a algunos procesos mórbidos por ejemplo: valvas de uretra, vejiga neurógena, etc.
El efecto deletéreo, del reflujo sobre el riñón esta establecido. Reflujo Vesicoureteral es un factor predisponente para desarrollar pielonefritis, hecho que puede generar injuria y cicatrización renal conocido esto como nefropatía de reflujo. La más seria de las consecuencias tardías de la nefropatía de reflujo es la insuficiencia renal crónica terminal. Se estima que entre un 3% a 25% de niños y de un 10% a 15% de adultos con falla renal terminal, tenían nefropatía de reflujo previa.5'6
El objetivo primario en el manejo del reflujo vesicoureteral en niños es prevenir la Pielonefritis, la cicatrización renal y otras complicaciones del reflujo, estos niños, pueden ser manejados y tratados médica o quirúrgicamente, sin embargo, hay desacuerdo con relación al óptimo manejo de tan común patología. En 1997, la A.U.A. desarrolló unas pautas de manejo tratando de buscar consenso en el enfoque del tratamiento, sin embargo el manejo actual continua generando controversias, sumado a esto, la historia natural del reflujo vesicoureteral esta siendo gradualmente rescrita con la detección perinatal del mismo, con un mejor entendimiento evolutivo de las infecciones urinarias y sus implicaciones para afectar a estos pequeños pacientes, como consecuencia de esto, el manejo y tratamiento del reflujo vesicoureteral, esta sufriendo cambios continuos y probablemente cambiara aun mas en un futuro próximo.
DATOS DEMOGRÁFICOS
La prevalencia de reflujo en niños sanos no es exactamente conocida, la mayoría la ha estimado en 1% 7 aunque otros, han considerado que sea mayor. En tanto, que los niños con infección del tracto urinario (I.T.U.) tienen un riesgo de ser portador de reflujo de un 30% a 50% de las veces, es decir, la incidencia de reflujo vesicoureteral en niños con I.T.U. oscila en 30%-50%.8'9
Reflujo vesico-renal es un hallazgo relativamente frecuente en niños con diagnostico antenatal de hidronefrósis. Se estima que entre un 10%-30% de las pielectasias y dilataciones del tracto urinario detectadas prenatalmente, son secundarias a reflujo vesicoureteral.10'11
La mayoría de estos pacientes, serán varones y tendrán reflujos bilaterales generalmente de alto grado. En contraste de lo observado, cuando se estudian niños por infección urinaria, en donde un 75-80% del diagnostico de reflujo primario, corresponderá al sexo femenino.
Reflujo pareciera tener un rasgo genético y hereditario. Recientemente se ha descubierto que este trastorno se organiza a un locus del cromosoma l.12 Reflujo vesicoureteral ocurre en familias y el mayor riesgo de reflujo es observado en hermanos de pacientes portadores de esta patología y en descendientes de mujeres con reflujo. Aunque los datos sobre la verdadera incidencia entre familiares siguen controvertidos. Algunos, han reportado una alta incidencia (51%), que recomiendan el despistaje de reflujo a los hemiarios, aunque estén asintomáticos.13
Sin embargo, los estudios de encuestas realizados por la Academia Americana de Pediatría entre urólogos pediatras revelan que solo un 20% de estos, realizan estudios rutinarios a los hermanos asin-tomático de los portadores de reflujo.14
Reflujo vesicoureteral, ha sido encontrado en riñones contralaterales de los niños que presentan Displasia Renal Multiquística y agenesia Renal en un 15% de las veces. Así mismo, puede estar influenciado por la raza, siendo mayor la incidencia en niños blancos que en los de piel oscura.
ETIOLOGIA Y PATOGENIA
Clásicamente, se considera que el mecanismo antireflujo normal esta formado por el trayecto oblicuo y submucoso del uréter al entrar a la vejiga y por la continuidad de la musculatura ureterovesical. Es decir, el mecanismo antireflujo, es debido, a la normal configuración anatómica de la Unión Uretero-Vesical, estos hechos anatómicos, recibieron mucha atención en los años 60 e inicios de los 70.15'16 En esta normal disposición anatómica, el uréter se une a la vejiga en una oblicua dirección, perforando lateralmente al Músculo Vesical (Detrusor) y discurriendo varios centímetros entre la mucosa vesical y el Detrusor (túnel submucoso) antes de abrirse al lumen vesical. Cuando la vejiga se llena o hay contracción vesical, el uréter es comprimido entre la mucosa y el músculo Detrusor, creando un mecanismo valvular, que cierra el lumen ureteral y evita el reflujo vesicoureteral de orina. Reflujo ocurre cuando el túnel submucoso es corto, esta ausente y/o hay un débil soporte del Detrusor que no permite la oclusión. En la figura 1 se aprecian algunos detalles anatómicos de la unión ureterovesical normal y anómala.
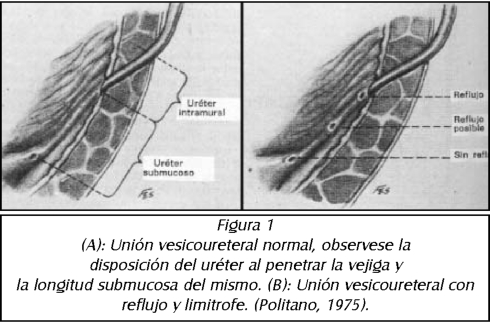
REFLUJO PRIMARIO
El Reflujo se considera primario cuando existe una anomalía congénita de la unión ureterovesical, que hace insuficiente al mecanismo valvular. El factor mas importantemente considerado para hacer una unión ureterovesical competente es la longitud del uréter submucoso con relación al diámetro del uréter. Clásicamente, se ha considerado que una relación de longitud/diámetro de 5:1 hace una unión ureterovesical competente. Esta relación, ha sido estimada por alguno, de acuerdo a la edad del niño y se supone, que la misma, debe incrementar con el progreso de la edad. La progresión de la longitud intramural e intravesical del uréter con relación al diámetro ureteral, de niños normales es vista en la tabla 1.

REFLUJO SECUNDARIO
El reflujo se considera secundario cuando existe una elevada presión intravesical, la cual desestabiliza y vence la unión ureterovesical, permitiendo la aparición de reflujo. Esta elevada presión intravesical, es secundaria a causas anatómicas o funcionales. Ambas producen las mismas consecuencias. La principal causa anatómica generadora de reflujo secundario, son las valvas de uretra posterior. Reflujo vesicoureteral, ha sido reportado entre un 19% a 72% de niños con valvas de uretra posterior. Interesantemente, se ha observado, que solo en 30% de estos, cesara el reflujo al liberar la obstrucción producida por las valvas.17
Otras causas anatómicas de reflujo secundario son uréter ectópico, ureterocele, extrofia vesical, etc.
Las causas funcionales de reflujo secundario incluyen Vejiga Neurogénica de cualquier etiología y la Disfunciones Miccionales entre las cuales se incluyen: Disinergia Vesico-Esfinteriana (síndrome Hinman-Allen), y la Inestabilidad del Detrusor. (Figura 2).
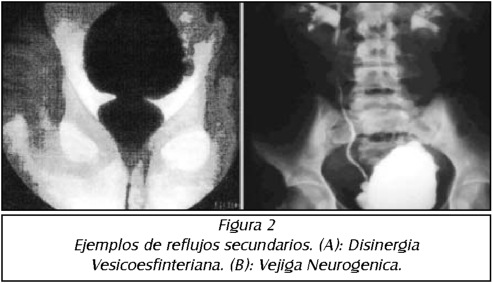
La Disinergia Vesico-Esfinteriana produce reflujo en aproximadamente 70% por ciento de las veces. En cuanto a la Inestabilidad del Detrusor, se ha reportado reflujo hasta en 50% por ciento de los niños con esta patología. Si a la instabilidad se agrega infección urinaria, que es muy probable, la posibilidad de reflujo aumentará a mas del 70% por ciento.18 De manera que el Detrusor Inestable, una causa frecuente de disfunción micdonal en niños, tiene una alta asodación a reflujo vesicoureteral que por lo demás, produce frecuente fracasos en la cirugía de reimplante, de no ser identificado y tratado adecuadamente.
CLASIFICACION Y GRADOS
La severidad del reflujo puede ser dasificada por grados. El grado de reflujo es importante porque los reflujos más severos están asociados a mayor daño al tracto superior, es dedr injuria y dcatrizadón renal. Además, el buen resultado del tratamiento guarda reladón al grado de reflujo. A su vez, el grado de reflujo es una indicadón indirecta del grado de anormalidad de la unión uretero-vesical. Varios sistemas de gradación se han utilizado en el transcurso de los años (Tabla 2). Algunos sistemas de gradación gozaron de popularidad en Europa, mientras que otros se usaron con preferenda en Norte América. En la actualidad, el sistema de gradadón mas usado es la clasificadón del comité internacional para el estudio de reflujo que data desde 1981. Esta dasificación (Figura.3) combino algunos de los criterios de las clasificadones pre-existentes para la época, y fue adoptada por el comité internadonal como su dasifi-cadón. Adualmente es la que goza de más adeptos en el ámbito mundial. La misma esta basada en los hallazgos radiológicos de una cistouretrografía micdonal convencional o standard.

CLASIFICACION INTERNACIONAL DE REFLUJO VESICOURETERAL
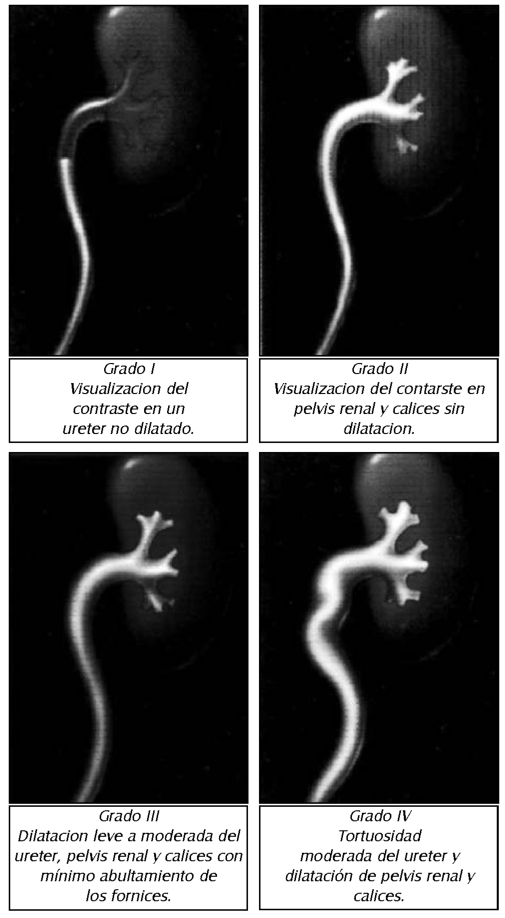
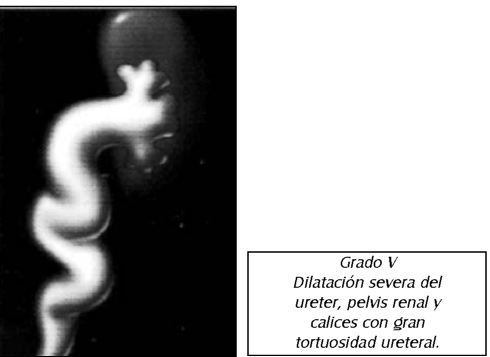
DIAGNÓSTICO
El diagnostico de reflujo vesicoureteral, se establece mayormente en niños que se estudian por infección urinaria. Sin embargo, existe un grupo de pacientes con riesgo aumentado de reflujo en quien se hace "despistaje" de reflujo aun estando asin-tomáticos, por ejemplo: hermanos de pacientes con reflujo, hidronefrósis antenatal que persiste y se evalúa después del nacimiento, riñones multiquísti-cos, riñones en herradura etc.
ESTUDIOS DE IMAGEN
Cistouretrografía Miccional (C.U.M.)
Una Cistouretrografía Miccional (C.U.M.) y un Ecosonograma con énfasis Renal, ureteral y Vesical debe ser obtenido en todo niño con infección urinaria comprobada y en los casos donde se imponga o justifique un "despistaje" de reflujo vesicoureteral. Para los casos de infección Urinaria, el tiempo cuando deba realizarse la dstografía miccional, sigue siendo controvertido. Para los que se inclinan a realizar precozmente el estudio radiológico, se recomienda que debería haber pasado la crisis febril de la I.T.U. (por lo menos 48 horas), estar en buenas condiciones generales y en un régimen de antibioticoterapia o tener un urocultivo negativo antes de obtener la C.U.M. Sin embargo, la mayor parte recomienda o prefiere realizar este estudio tardíamente, es decir 2 o 3 semanas posteriores a la infección urinaria, para permitir que se resuelva el edema y evitar detectar ligeras alteraciones y dilataciones ureterales producidas por algunas endotoxinas bacterianas.
La C.U.M. se estableció como estudio fundamental en la evaluación de niños con I.T.U. y sospecha de reflujo desde los años sesenta y continua siendo el test de elección para diagnosticar y evaluar reflujo vesicoureteral. Es un estudio ambulatorio que en la gran mayoría de los casos solo necesita de un anestésico local y requiere de varios ciclos de llenado y vaciado para considerar al estudio como adecuado. (Figura 4).
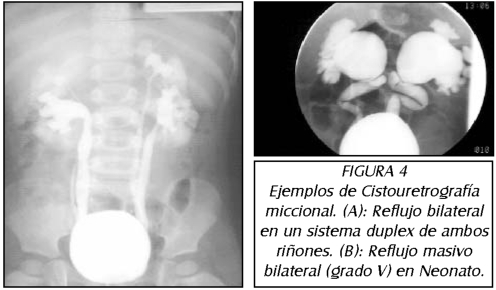
Cistografía Nuclear
La Cistografía Nuclear guarda los mismos principios de una Cistouretrografía Miccional convencional (radiológica) pero usa un radiofármaco como trazador. La dosis promedio de radiación con esta modalidad diagnostica es mucho menor que con la Cistouretrografía convencional. El promedio de la dosis de radiación con la Cistouretrografía Nuclear es de 0.3 mGy,19 en tanto que para la cistouretrografía miccional convencional o radiológica es de 1.37 mGy con 105 mm spot films y 0664 mGy con digital spot films.20
La cistografía nuclear ofrece entonces menos exposición radiológica y mayor sensibilidad diagnostica, pero tiene algunas desventajas entre las cuales se destaca que el reflujo no puede ser gradado adecuadamente, el contorno vesical no se puede distinguir nítidamente y no se puede visualizar la uretra masculina. La ventaja de la menor exposición radiológica, permite a la técnica observaciones prolongadas en la gamma cámara, lo que aumenta su sensibilidad diagnostica. Esta ventaja, hace a la Cistografía nuclear superior solo como "despistaje" y "seguimiento" particularmente en los pacientes que ya han sido sometidos a una corrección quirúrgica de reflujo. (Figura 5).
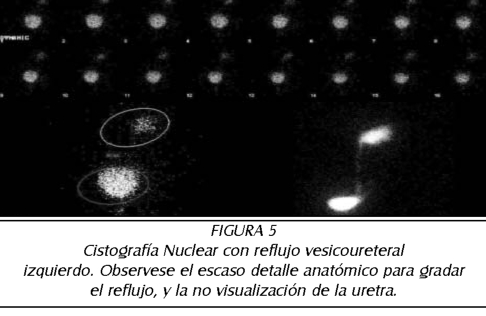
Cistografía Ultrasónica
Los primeros intentos de diagnosticar reflujo vesicouretral por ecografía datan desde 1976.21 El desarrollo de un procedimiento ultrasonográfico con un agente de contraste sonográfico para evaluar reflujo, es deseable para evitar que estos niños se expongan a la radiación. Un agente ideal para usar con ultrasonografía seria uno que fuese muy ecogéni-co en comparación al tejido que le rodea, estable y sin riesgo de efectos adversos. Algunos de estos agentes que facilitan y aumentan el diagnostico ecográfico han sido usados para este fin. Estos, se instilan intravesicalmente. La albúmina sonicada y la galactosa que contiene un agente generador de microbur-bujas de aire, son algunas de las sustancias que se han utilizado y que al momento de refluir estas microburbujas, puedan ser detectadas por ecografía. Esta novedosa modalidad diagnostica, aunque esta en desarrollo ha mostrado inicialmente cifras sorprendentes en la detección de reflujo vesicoureteral en humanos, 100% sensibilidad y 86% especificidad en algunos trabajos iniciales.22'23 Sin embargo, hay cierta incertidumbre con relación a la visión de la uretra masculina por lo que futuros estudios y ensayos prospectivos a largo plazo, se necesitarán para valorar el verdadero rol de esta modalidad diagnostica.
EVALUACIÓN DEL TRACTO URINARIO SUPERIOR
El tracto urinario alto en los pacientes con reflujo debe ser evaluado con métodos imagenológicos para constatar si hay evidencias de cicatrización renal (repercusión al tracto urinario alto o injuria renal). Además, se debe detectar si existen otras anomalías urinarias asociadas.
Los estudios de imágenes establecidos para evaluar al tracto superior de niños con reflujo son: Ultrasonido Renal, Urografía de Eliminación y la Gammagrafía o Scanning cortical Renal. Existen algunos otros estudios novedosos de imagen como son la tomografía computarizada de emisión simple de fotones con reconstrucción, La resonancia Magnética con Gadolinium-aumentado, la Sonografía Doppler de Poder y la Sonografía de contraste aumentada cuyo rol en la evaluación del tracto superior en los pacientes con reflujo, aun esta por definirse.
Ultrasonografía Renal
El ultrasonido renal, se ha convertido en la primera herramienta diagnostica, como primer paso o como estudio de elección inicial, cuando se evalúa el tracto urinario superior en niños con reflujo vesicoureteral. Es un estudio que ofrece muchas ventajas entre las que cabe destacar que es no invasivo, no es doloroso, es económico y es realizado en el consultorio. Los datos reportados por el ecosonograma son de gran valor cuando se evalúa un niño con reflujo. Tamaño renal, grosor del parénquima, presencia de grandes cicatrices, algunas anomalías renales y uretrales asociadas son algunos de los aportes de una ecosonografía bien realizada y hecha por un personal bien entrenado y con experiencia en esta área. (Figura 6).
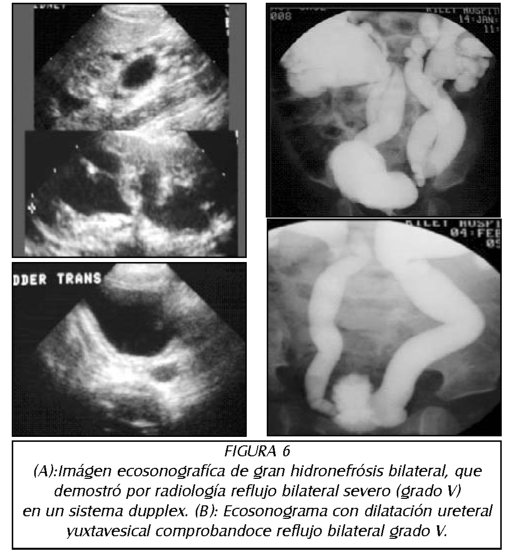
Las limitaciones de la ultrasonografía renal convencional son bien conocidas y documentadas. Entre estas, es conocida su baja sensibilidad en la detección de Cicatrices renales, Pielonefritis y en diagnosticar reflujo vesicoureteral, cuando se compara a los otros estudios.24-27
Urograf ía Excretora
La urografía de eliminación ha sido tradicionalmente el estudio mas usado para evaluar al tracto superior en niños con reflujo, dado que aporta con mucha certeza la anatomía normal del árbol urinario alto así como las presencias de variantes anatómicas. Además, simultáneamente nos ofrece una buena idea del funcionalismo renal. Es un estudio con el cual los urólogos nos sentimos cómodos y seguros dados el entrenamiento y conocimiento que tenemos de la misma al evaluar el tracto superior. Sin embargo, el estudio ha cedido espacio a medida que el desarrollo tecnológico ha aportado nuevos y mejores equipos tanto de imágenes como de función renal. En los países en desarrollo y nuestros hospitales, este estudio, continua siendo de primer orden al evaluar al tracto superior en niños con reflujo.
Gammagrafía Renal
El gammagrama o scanning renal es ahora una herramienta diagnóstica de incalculable valor al evaluar el tracto superior de los niños con reflujo vesicoureteral.
Los Radiofármacos usados para el scanning renal son el áddo dimercaptosucdnico (DMSA),
glucoheptonato y el mercaptoacetiltriglicina (MAG-3).
De estos, la gammagrafía que usa el 99m Tc-DMSA, conodda también como Scanning Cortical Renal (RCS) con DMSA es sin lugar a dudas, el estudio de imagen más aceptado y establecido para evaluar el parénquima renal.28
Algunas ventajas del Scanning Cortical Renal 99mTc- DMSAinduyen: 1. Es superior al Ultrasonido y a la Urografía de Eliminación para detectar Pielonefritis y cicatrices renales corticales. Con una sensibilidad de 92% y especificidad del 98%.29 2. Evidencia mas precozmente la presencia de dcatrices renales posterior a un episodio de Pielonefritis
Aguda, las dcatrices renales usualmente serán evidentes dentro de los primeros 3 meses. En tanto que Urográficamente lo serán más tardíamente, usualmente en 1-2 años (Figura 7). Las desventajas del Scanning Renal Cortical son, entre otras: la necesidad de un acceso endovenoso, cierta exposición a radiadón y lentitud en el proceso de escaneo, por lo tanto puede necesitar sedación con adicionales costos y riesgos.
Modernos refinamientos en la técnica de la medicina nuclear y la adidón de la tomografía computa-rizada de emisión simple fotones (SPECT) ha aumentado la sensibilidad de este estudio disminuyendo la dosis de radiadón.30
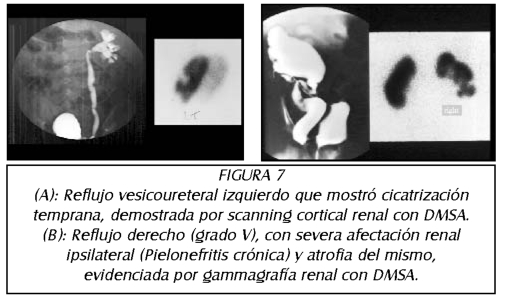
OTROS ESTUDIOS
Entre los nuevos estudios de imágenes que están desafiando los ya establecidos en la evaluación del trado superior de los niños con reflujo cabe destacar la Resonancia Magnética que usa gadolinium/ aumentado, la Sonografía Doppler de Poder, la Sonografía de Contraste aumentado y SPECT, muestran cifras de sensibilidad y especificidad muy atradivas en trabajos experimentales inidales y en estudios preliminares en la detecdón de pielonefritis aguda y dcatrización renal. Estudios prospectivos con mayor número de parientes y la prueba de tiempo redefinirá el verdadero rol de ellos al evaluar niños con esta patología.
MANEJO Y TRATAMIENTO
El objetivo principal del manejo y tratamiento en los niños con reflujo vesicoureteral es prevenir la aparición de Pielonefritis, cicatrices e injuria renal así como otras complicaciones asociadas a reflujo (hipertensión, daño renal terminal). Sin embargo, el manejo óptimo de estos niños es una continua fuente de debate. Si bien es cierto, que el tratamiento quirúrgico, es decir la reimplantación ureteral tiene altas tasas de éxito con pocas complicaciones asociadas, en manos experimentadas, no es menos cierto que el reflujo, tiene reales probabilidades estadísticas tanto de disminución como de resolución espontánea en el transcurso del tiempo. La probabilidad de resolución del reflujo en forma espontánea guarda relación con ciertas variables conocidas, como son: el grado de reflujo al momento de hacer el diagnóstico, la edad del paciente, sexo, defecto anatómico asociado a la bilateralidad o no del reflujo, entre otras cosas.
En líneas generales se puede afirmar que en los reflujos de bajo grado (1 y II), (clasificación del comité internacional), en donde el tracto superior esta indemne deben ser manejado en forma conservadora o médicamente, debido a su alto posibilidad de resolución espontánea, independientemente de la edad del niño. En otras palabras, la persistencia de reflujo a 5 años en reflujos de bajo grado (I y II) es baja. Lo contrario, es valido para los reflujos de alto grado (IV y V), en donde las posibilidades de resolución espontánea disminuyen. En consecuencia, estos reflujos son mejor manejados quirúrgicamente. (Figura 8).
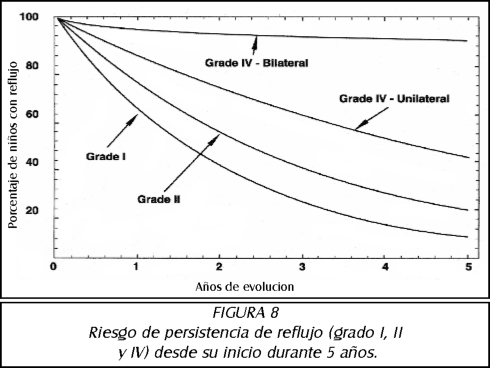
En Estados Unidos, Schawab et al, estimaron el tiempo medio de resolución espontánea de 2.7 años para reflujo grado I. En contraste, fue de 9.5 años para grado IV. 31.
Una breve consideración aparte vale la pena destacar para los reflujos grado III, que a través de los años ha sido el de manejo mas controvertido. La probabilidad de resolución espontánea depende en gran parte de las variables antes expuestas y debe ser en cada caso individualizada, dado el margen tan amplio que existe en la tasa de resolución. (12.5% -70%) (Figura 9).
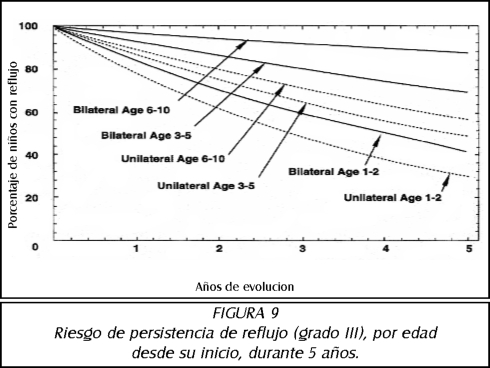
En Suecia, Wennerstrom et al, demostraron que la resolución espontánea de reflujos grado (III-V) fue de 8 años.32
Con relación al desarrollo de Pielonefritis la probabilidad de desarrollo es 2.5 veces mayor en los casos manejados con tratamiento medico que en los tratados quirúrgicamente. Sin embargo, el riesgo de desarrollar nuevas y progresivas cicatrices, hipertensión, insuficiencia renal, uremia y enfermedad renal terminal parece ser idéntico en ambos grupos.33
MANEJO MÉDICO
El manejo medico o conservador del reflujo vesicoureteral ha probado ser fiable y aplicable para muchos de los niños con esta patología y es ahora la norma para una gran parte de ellos.
La conocida asunción de que no se desarrolla cicatrización y nefropatía en los niños cuya orina permanece libre de infección, fue demostrada por los clásicos trabajos de Ransley y Risdon.34-35 Esta continúa con vigencia a pesar de las nuevas observaciones derivadas de la detección antenatal de dilatación del tracto urinario y la posterior confirmación en etapa neonatal, de la presencia de reflujo, que han revelado lo contrario. No obstante a esto último, el uso continúo de antibióticos sin infección urinaria o
antibioticoterapia profiláctica, que surgió hace casi tres décadas, constituye el mayor componente del cual disponemos, en el manejo medico o conservador de los niños con reflujo. Las otras formas de tratamiento medico y que en algunos casos se asocia a la profilaxis Microbiana son: El entrenamiento vesical y la medicación oral con anticolinérgicos. Estas últimas modalidades, no se emplean rutinariamente y los casos deben ser individualizados antes de su recomendación ya que su aplicabilidad no es extensiva a todos los pacientes portadores de reflujo. La prescripción de anticolinérgicos y la ayuda que brinda la reeducación vesical se destinara y se aplicara a ciertos niños con unos factores y condiciones conocidos, que se vinculan a reflujo.
Antibioticoterapia profiláctica
Esta forma de tratamiento se basó inidalmente de las observadones de Lenaghan et al36 que reporto que 21% de los riñones con reflujo y que eran previamente normales mostraban cicatrización renal en el seguimiento, si solo recibían antibioticoterapia en forma intermitente, es dedr solo al momento de la infección. Al igual que las observaciones de Smellie et al37 quien encontró que los niños en continua antibioticoterapia profiládica y que estuvieron libres de infección, no desarrollaron nuevas dcatrices, en el transcurso del tiempo.
De esas observaciones hasta la actualidad han pasado casi 30 años y hoy la mayoría de los urólogos pediátricos pudiéramos casi en común acuerdo hacer la siguiente premisa: "Un curso largo y continuo de antibioticoterapia es bien tolerado por la mayoría de los niños que presentan reflujo vesicoureteral".
En ese sentido, hay una variedad de medicamentos que comúnmente son usados en forma profiládica ya que alcanzan altas concentradones urinarias y efectivamente controlan a un amplio espectro de uropatógenos. Entre los más usados tenemos trimetropin-sulfametoxasol, nitrofurantoina, cefalos-porinas, amoxicilina. Estos medicamentos se dosifican una vez al día, preferiblemente una dosis noduma, especialmente, si son niños que han controlado su esfínter. Por razones obvias, se aconseja el uso del medicamento en suspensión, en dosis preestablecidas y conoddas para cada uno de ellos. Aunque de manera práctica, la dosis profiládica recomendada es un cuarto o una tercera de la dosis terapéutica, dada en una sola toma. La profilaxis debería continuarse hasta que el reflujo desaparezca. Aunque para algunos escolares cercanos a la adolescenda, que ya han tenido un periodo largo en supresión y bajo dertas condiciones de control algunos trabajos iniciales han sugerido que la suspensión de la profilaxis sin haber desaparecido el reflujo, no muestra variación cuando se compara a grupos de control que si la mantuvieron.38 Durante la profilaxis, se realizaran a intervalos variables controles de urocultivos y antibiogramas.
La antibioticoterapia profiláctica se considerara exitosa si el niño se encuentra libre de infección, no desarrolla nuevas cicatrices renales y el reflujo desaparece espontáneamente. En otras palabras, infecciones urinarias de ruptura, la aparidón de nuevas cicatrices renales o un reflujo que no desaparece a pesar de la terapia, debe considerarse como falla o fracaso del tratamiento médico.
Efectos colaterales e indeseables del medicamento, reacción alérgica o poca tolerancia, pudiera exduir a los niños del manejo medico.
La relación entre disfunciones micdonales, consti-padón, infecdones urinarias y reflujo vesicoureteral ha sido claramente establecida a través de los años.39'41 Estas disfunciones, representan un espectro del comportamiento vesical que casi siempre incluye contracdones vesicales no inhibidas acompañadas de contracdones de los músculos del piso pélvico. Hasta en un 75% de los niños con reflujo se ha demostrado contracdones no inhibidas igualmente, un 50% de las contracdones no inhibida van a desencadenar reflujo vesicoureteral. Aunque la etiología y la exacta comprensión de esta asociadón no han sido claramente establecidos, varios mecanismos se han propuesto e innumerables estudios han demostrado la relación que existe entre las disfundones micdonales y reflujo vesicoureteral.42'43
En la practica diaria, observamos con relativa fre-cuenda un marcado aumento en la resoludón de reflujo vesicoureteral cuando este esta asodado a inestabilidad vesical y los niños, son colocados en un régimen de medicadón anticolinérgica. Así mismo, un alto porcentaje de fracasos de cirugías antireflujo
o de reddivas posterior a las mismas, ocurren en reflujos con disfunciones vesicales que no han sido diagnosticadas y entre otras cosas no redbieron
medicación anticolinérgica apropiada. La principal medicación anticolinérgica sugerida ha sido el uso prolongado de Oxibutinina. La dosis recomendada para niños mayores de 5 años de edad, es de 5 mg. dos o tres veces al día aunque algunos niños requerirán un ajuste de la misma, debido a la presencia de efectos secundarios. Otros anticolinérgicos usados son la propantelina y la hiosciodamine.
ENTRENAMIENTO VESICAL
En líneas generales, algunos han considerado que las disfundones miccionales forman parte de un complejo síndrome conocido como Síndrome de Eliminación Disfundonal. Este síndrome, conlleva además del disturbio urinario, una disfundón intestinal manifestada prindpalmente como constipación y un factor común a las dos condiciones antes expuestas que es la no-relajación de la musculatura pélvica.
Un programa de re-educación vesical que abarque un esquema-horario de micciones sumado a un programa de biofeedback y reentrenamiento conductual del piso pélvico, ha sido sugerido con resultados variables, pero prometedores.44'45
TRATAMIENTO QUIRÚRGICO
El manejo quirúrgico de los niños con reflujo vesicoureteral es una opdón valida de tratamiento que debe ser considerado para algunos pacientes.
Indicadones típicas y espedficas para drugía antireflujo son: 1. Reflujo de alto grado (IV-V), especialmente si esta asociado a cambios pielonefríticos crónicos 2. Infecdones urinarias de ruptura, es decir, infecciones a pesar de la profilaxis microbiana 3. Reflujo asodado a divertículo congénito en la unión uretero-vesical 4. Alergias, Intolerancia e inconformidad con el tratamiento medico. 5. Aparidón de nuevas cicatrices renales, cicatrizadón progresiva con disminución del fundonalismo renal o falla del crecimiento renal.
Así mismo, el tratamiento quirúrgico puede estar indicado en algunas situaciones, trastornos o patologías que deben ser en cada caso particularizados antes de la dedsión quirúrgica. Estas consideraciones quirúrgicas aplican para algunas condidones tales como: riñón solitario, reflujo intrarenal, uropatía congénitamente obstrudiva del trado urinario alto simultánea con reflujo (estenosis pieloureteral), reflujos en dobles sistemas, algunos reflujos secundarios que persisten a pesar de haber-tratado la condición de base (vejiga neurogenica, valvas de uretra etc.)
El objetivo del tratamiento quirúrgico del reflujo vesico-renal es la eliminación de un reflujo que se supone, no se resolverá espontáneamente con el manejo medico de soporte, mientras ocurre la maduración trigonal y el uréter submucoso se desarrolla para hacerse competente Este manejo quirúrgico puede ser realizado por CIRUGÍA CONVENCIONAL O ABIERTA POR REPARACIÓN ENDOSCÓPICA Y en algunos centros desarrollados se esta inidando el tratamiento por CIRUGÍA LAPAROSCOPIC A.
Existen algunos hechos conocidos y esperados deL TRATAMIENTO QUIRÚRGICO que vale la pena mencionar.
EL MANEJO QUIRÚRGICO EXITOSO, es decir donde se ha logrado la cura del reflujo, no disminuye el riesgo de desarrollar nuevas dcatrices renales, infecdón urinaria baja ni de desarrollar hipertensión arterial. La figura 10 es un análisis prospectivo de cuatro estudios que miden el riesgo de desarrollar-nuevas cicatrices, cuando se compara el tratamiento quirúrgico con el manejo médico.
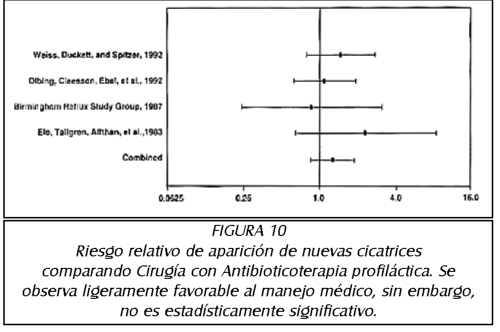
De manera similar, sucede para I.T.U. e hipertensión arterial donde los riesgos permanecen y son similares tanto en las series manejadas quirúrgicamente como en las manejadas conservadoramente, es decir no guardan diferenda significativa, tal y como lo demuestran las publicadones y artículos al respedo.46'47
Por el contrario, el riesgo de desarrollar Pielonefritis Aguda, que guarda relación con injuria renal, si es menor y significativo desde el punto de vista estadístico en las series tratadas quirúrgicamente que en las manejadas conservadoramente (figura 11). Tanto el grupo europeo como el estadounidense del Comité Internacional para el Estudio del Reflujo reportan cifras inferiores de Pielonefritis para el manejo quirúrgico. El grupo europeo reporta 9.3% de riesgo para la serie quirúrgica vs. 21.% para la serie manejada médicamente. Así mismo, el grupo estadounidense reporta un riesgo de pielonefritis 7.8% vs. 22.1 a favor de las series manejadas por cirugía.48
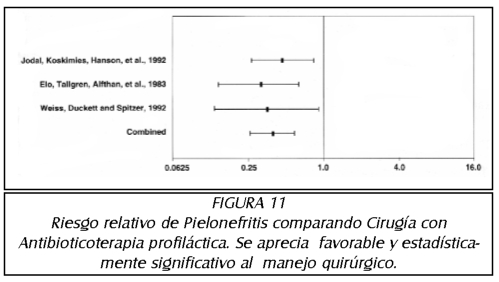
CIRUGÍA ABIERTA
Varias técnicas han sido descritas para el tratamiento quirúrgico del reflujo, la mayoría de ellas, ha sufrido modificaciones en el transcurso del tiempo. Estas técnicas clásicamente se describieron como extravesicales , intravesicales o combinadas de acuerdo al abordaje anatómico. El manejo quirúrgico abierto, incluye como característica común independientemente de la técnica empleada, modificar la unión uretero-vesical anómala, creando una nueva unión ureterovesical con una longitud suficiente del uréter intramural que permita hacer el mecanismo valvular. Esto se logra guardando una relación 4:1 a 5:1 entre el diámetro y la longitud del uréter intramural. Así como haciendo un buen soporte muscular a la nueva unión. Ureterovesical, que permita hacer la compresión del uréter. Según el reporte de las pautas del manejo del relujo de la A.U. A., publicado en 1997, La tasa global de éxito de la cirugía abierta es de 95.1 %. Esta tasa de éxito tiene variaciones cuando se agrupa por grado de reflujo, por ejemplo: para reflujo grado (I) la cirugía abierta logra la curación en un 99% de las veces. En tanto que para reflujo grado V la cesación del reflujo se consiguió solamente en un 80.7% de los casos.
A continuación describiremos algunas de las técnicas mas empleadas:
POLITAN O-LE ADBETTER
Descrita originalmente en 1958 como técnica intravesical, fue posteriormente combinada con abordaje extravesical y se uso ampliamente en la década del sesenta y setenta en casi todas las lesiones con-génitas y adquiridas del uréter inferior. Actualmente, su uso pareciera haber disminuido ante las bondades y simplicidades de las otras técnicas y la ligera tendencia de esta técnica a dar obstrucción y angulacion tanto en el nuevo hiato como suprahiatalmente. En su descripción original, politano reporto 100% de éxito en sus 23 uréteres reimplantados.49 Otros autores publicaron una tasa global de éxito de 96%,50 mientras, que algunos han reportado mayor complicaciones cuando se compara con la técnica de Cohén.51
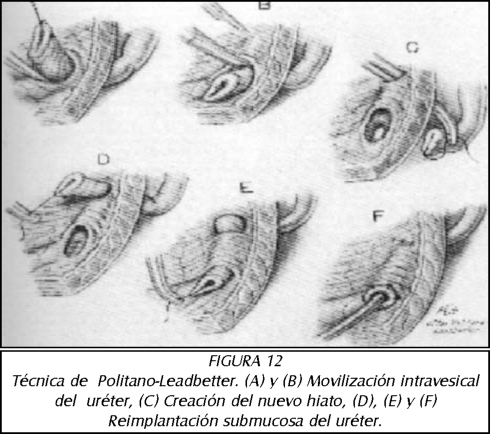
TÉCNICA DE COHEN
La técnica trigonal cruzada o de cohén fue descrita y publicada en 1975 por S.J. Cohén.52 Es una técnica intravesical sencilla que permite una fácil disección de ambos uréteres, logrando a través de sus hiatos originales una longitud ureteral suficiente que permite el entrecruzamiento submucoso de ambos uréteres a nivel del trígono vesical. Es quizás, la técnica mas empleada en la actualidad con un tasa de éxito global entre un 95% a 99%.53 Una eventual desventaja en esta técnica es la de dificultad ulterior en cateterizar retrógradamente los uréteres reimplantados.
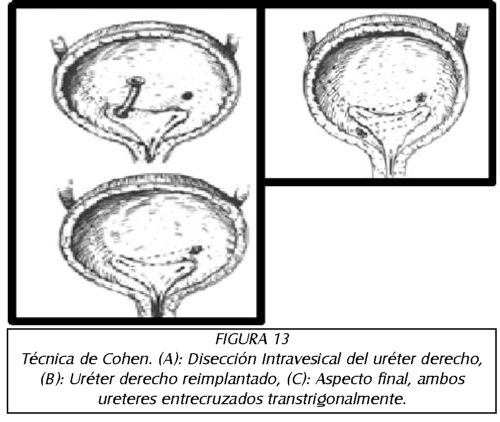
TÉCNICA DE LICH-GREGOIR
Esta técnica extravesical fue descrita originalmente en por Lich y cois en 1961 para corrección de reflujo vesicoureteral. En 1964 y 1972 Gregoir y cois le hicieron modificaciones que permitieron ampliar la utilidad y la extensión de la intervención. La técnica fue mas empleada y difundida en Europa que en nuestro continente, sin embargo con las modificaciones de Hodgson y Babbit 54, al igual que Zaontz,55 esta Detrusorrafia ha tenido auge en los últimos años y su uso ha venido en aumento progresivo, debido a algunos atractivos como es el hecho de que es menos invasiva al no haber apertura de la vejiga y mantenerse esta intacta, la hematuria post operatoria, la irritación vesical, el disconfort y espasmo de la vejiga prácticamente no se presentan y la estadía operatoria tiende a ser menor, al igual que la permanencia de la sonda. Sin embargo, entre las desventajas que se le aducen a esta técnica esta el hecho de que los pacientes presentan retención urinaria especialmente si el reimplante es bilateral. El tiempo de la retención urinaria es variable. La tasa de éxito global para esta cirugía esta entre un 94%-97%.
La figura 15 es una ilustración de las modificaciones de Hodgson y Zaontz a la técnica de Lich-Gregoir.
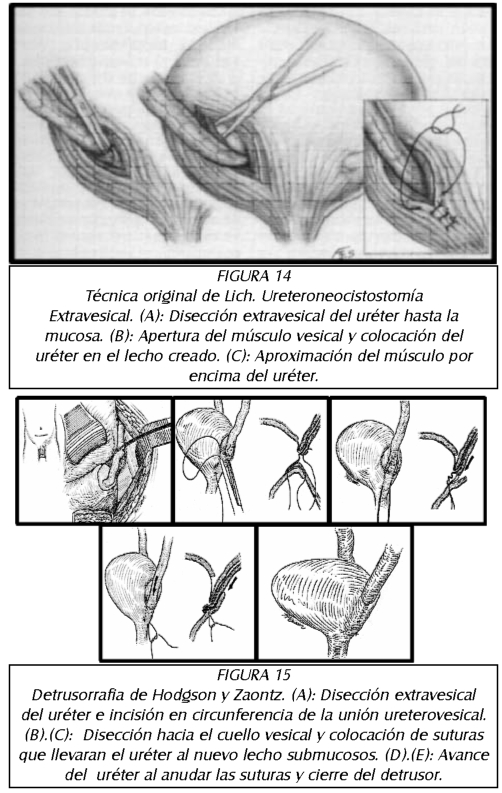
COMPLICACIONES DE LA CIRUGÍA ANTIREFLUJO (Cirugía Abierta)
Debido a que los procedimientos quirúrgicos abiertos continúan teniendo excelentes parámetros de buenos resultados, la incidencia de complicaciones de la cirugía antireflujo sigue siendo baja, aunque no despreciable. Algunas complicaciones, incluso pudieran ser evitadas. Buenos resultados son generalmente alcanzados cuando el uréter a reim-plantar es normal en calibre, en donde no existen anomalías anatómicas asociadas, si la función vesical esta normal y si no ha habido cirugías antireflujos previas.
Las complicaciones de la cirugía antireflujo pueden clasificarse en tempranas (ocurren generalmente entre las primeras horas hasta el 3er. ó 4to.
día del post operatorio) y tardías (generalmente silentes o asintomáticas). Complicaciones tempranas, pueden ser anunciada por fiebre, hipertensión, oliguria, anuria, dolor abdominal, en flanco o ángulo costovertebral. Complicaciones tardías están en relación a la obstrucción progresiva del uréter reimplantado, a la persistencia del reflujo del lado afecto, a la aparición de un nuevo reflujo contralateral y más raramente a la formación de un divertículo paraureteral.
La incidencia de obstrucción postoperatoria está entre 2% y 3% de las veces.
La aparición de reflujo contralateral tiene una incidencia aproximada de 3%-4%. En cuanto a la persistencia del reflujo, como se expuso anteriormente, tiene variaciones de acuerdo al grado del mismo y a la técnica empleada. Cifras de éxitos y fracasos fueron presentadas cuando se describió cada una de las técnicas.
La introducción de la corrección Endoscópica del reflujo, surge como procedimiento atractivo y de tercera línea frente al tradicional manejo medico y al standard tratamiento quirúrgico. La inyección de agentes, por vía Endoscópica, se conoce desde 1981, cuando Matouschek56 inyecto pasta de polite-traflouroetileno (teflón) para corregir un reflujo que persistió, después de una cirugía abierta. En 1984, O'Donnell y Puri,57 reportaron la primera serie clínica, con buenos resultados, en niños. Desde su introducción, hasta la fecha, un material ideal para ser inyectado, no ha sido identificado, pero se continúa generando investigación y a su vez, controversia con la introducción de Innovadoras y nuevas sustancias que al ser inyectadas en la unión ureterovesical, logren la corrección de este trastorno. Cada uno de estos agentes, ofrece ventajas y desventajas. La reparación Endoscópica del reflujo, supone que la implantación de alguno de ellos, en la pared vesical, debajo del orificio ureteral aumentara y alongará el uréter intramural y de esta manera, se impedirá el reflujo de orina dentro del mismo. Este mecanismo de corrección, se logra por el efecto de volumen y por la reacción local que ellas producen, debajo de la unión ureterovesical, dándole a la unión anómala, un mejor soporte y reforzamiento. (Figura 16).
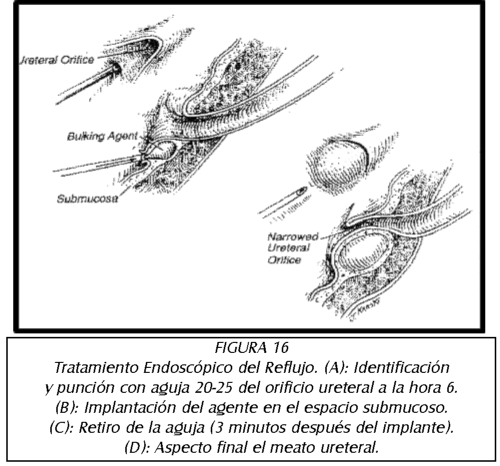
Algunos de los agentes usados, incluyen: pasta de politetrafluoroetileno (polytef, teflónTM), colágeno (autólogo y no autólogo), glutaraldeido del colágeno bovino (Gax), copolimero de ácido hialuronico/dex-tran (deflux). Partículas de polidimetilsiloxano (macroplastique). Condrocitos autólogos, grasa autóloga y músculo vesical, entre otros.
Este procedimiento, ha ganado popularidad principalmente en Europa, debido a su simplicidad de ejecución, por ser menos mórbido y mejor tolerado, además del ahorro en tiempo quirúrgico, costos y estancia hospitalaria, frente a la cirugía convencional, sin embargo, la ausencia de un biomaterial estable, algunos aspectos en relación con eficacia y resultados suboptimos especialmente a largo plazo, al igual que preocupaciones con la seguridad, de los agentes, han limitado su difusión y amplio uso, especialmente en América.
Consideraciones sobre algunos de los agentes que han recibido más atención:
Algunos estudios han demostrado que partículas de la pasta de politetrafluretileno (teflón), son capaces de migrar a órganos distantes como pulmón y cerebro58'59 además de formar grandes granulomas en el sitio de inyección.60 Un estudio multicentrico internacional reportado en 1998 con 12.251 uréteres reimplantados demostró una tasa de 75.3% de curación, tras una sola aplicación de teflón en cada paciente, sin embargo su uso ha disminuido por los temores en cuanto a la seguridad del producto.
El glutaraldeido del colágeno bovino, se absorbe progresivamente, perdiendo el efecto antireflujo. Los altos índices de éxito, reportados inicialmente no se mantienen con el tiempoól por lo cual colágeno ha perdido popularidad y aceptación en su uso.
Los condrocitos autólogos, mostraron una tasa de éxito de 83% a los 3 meses, esta tasa disminuyo a 70% al año. Se necesitará más tiempo y mayores series para ver el verdadero rol de este agente.
El polidimetilsiloxane (Macroplastique) se ha evaluado desde 1994. Es un suave elastómero sólido de silicone suspendido en un hidrogel que le sirve de vehículo, ha sido diseñado en forma de micropar-ticulas que minimiza el riego de migración. La tasa de éxito es 80%, en algunos reportes, sin embargo hay temores con silicone, en cuanto a la seguridad por no ser biodegradable y tener riesgo potencial para migrar, además se asocia con trastornos de autoinmunidad.
El copolimero de ácido hialuronico/dextran (Deflux), es el único agente aprobado recientemente por la F.D.A., para ser utilizado endoscópicamente en los casos de reflujo vesicoureteral. Las microsesferas de dextran, tiene algunas características ideales, es biodegradable, biocompatible, no tiene propiedades inmunogenicas, no se le conocen efectos migratorios, ni muestra signos de mutagenesis, es decir, muestra buen perfil de seguridad, los resultados iniciales han reportado tasas que oscilan entre 50% y 70%,62 futuros reportes y un mayor numero de pacientes se necesitaran para apreciar el verdadero rol de este agente.
La corrección laparoscopica de reflujo, ha sido descrita inicialmente con resultados variables.63'64 Técnicamente se ha demostrado que es posible realizarla y que los resultados son dependiente de una curva de aprendizaje, entre otros factores.
Lakshmanan et al65, al igual que otros han publicado una serie de reimplantes extravesicales por vía laparoscopica, con buenos resultados. Esta técnica, considerada mínimamente invasiva, por quienes la realizan no tiene todavía, gran difusión.
En la (figura 17), se aprecia la corrección laparoscopica de un reimplante por la técnica de Cohén.

Hidronefrósis o dilatación urinaria prenatal, puede representar una condición fisiológica transitoria, una obstrucción en evolución o un reflujo vesicoureteral.
La detección ultrasonografica de anomalías prenatales en el feto, ha estado en constante progreso desde su difusión en la década 1970. Hoy día se estima, que un 20% de todas las anomalías detectadas antenalmente en el feto, corresponden a la esfera urogenital.66 Así mismo, en 1% de los nacidos vivos, una anormalidad genitourinaria es detectada prenatalmente. Esta anormalidad, es manifestada en mucho de ellos, como hidronefrósis. Reflujo vesicoureteral, es la causa subyacente, de un 30% de estas hidronefrósis neonatales.67 Reflujo vesicoureteral neonatal, es una entidad clínica relativamente nueva. La primera descripción fue hecha por Finlanson y colaboradores en 1984 y la primera serie clínica fue publicada por Scott en 1987.68 La evaluación urológica, de estos pacientes, se ha centrado primariamente y hasta ahora, durante el periodo post natal. Interesantemente, hemos visto en nuestra experiencia y así lo reporta la literatura, que la historia natural del reflujo neonatal pareciera ser diferente a los reflujos de niños mayores. En su mayoría, estos pacientes son del sexo masculino, generalmente tienen reflujo bilateral de alto grado y mas del 60% de ellos, ya tienen cicatrización y daño parenquimal renal, antes de desarrollar infección urinaria69. Este daño parenquimal puede ser focalizado o difuso. Estas características encontradas y vistas en el reflujo neonatal, difieren a las encontradas en los niños de mayor edad y en los que se evalúan después de haber-tenido episodios de infección urinaria. Además, se postula que el mecanismo patológico de daño y secuela renal también pudiera ser diferente. Se con-
sidera, aunque existe debate al respecto, que la cicatrización renal observada en el neonato, es una nefropatía de reflujo congénita, caracterizada por rasgos morfológicos de displasia e hipoplasia, en tanto, la cicatrización renal adquirida, vista en niños mayores, es la comúnmente a asociada con infección urinaria y reflujo.70
Estas consideraciones, soslayaron al reflujo de orina estéril, en la patogenia de cicatrización renal.
El manejo del neonato con reflujo debe incluir la realización de un ecosonograma después del 2do día de nacimiento para corroborar si persiste la dilatación de vías urinarias, aunque se ha visto que aprox. un 40% de las ecografías realizadas a neonatos y reportadas como normales pudieran tener reflujo. De manera que debe mantenerse un régimen de antibioticoterapia en forma profiláctica en este período. La evaluación debe incluir la realización de una cistouretrografía miccional. Esta se realizara durante el primer mes de edad en todos los casos en que persista la dilatación urinaria. Si no hubiera dilatación urinaria, pero hay sospecha de reflujo por Ej.: si hay historia familiar de reflujo, si el neonato presenta signos de infección urinaria, sepsis o deterioro al estado general, si hubiere alguna otra malformación urinaria diagnosticada por ecografía neonatal etc., esta debe igualmente practicarse. Si el reflujo esta presente, se debe considerar la realización de gamma-grafía renal con DMSA En la figura 18 se esquematiza el manejo de una hidronefrósis neonatal.
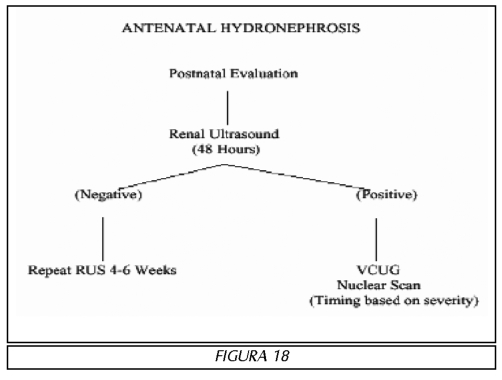
BIBLIOGRAFÍA
1. Radmayr, C., Klauser, A., Pallwein, L., Zumedden, D., Bartsch, G. and frauscher, F.: Contrast enhanced reflux sonography in children: Comparison to standard radiological imaging. J Urol, 167: 1428, 2002.
2. Sillen, U.: Vesicoureteral reflux in infants. Pediatr Nephrol, 13: 355, 1999.
3. Polk HC Jr. Notes on Galenic urology. Urol Survey 1965;15:2-6.
4. Hutch, J. A.:Vesico-ureteral Reflux in paraplegic: Cause and correction. J Urol, 167: 1410, 2002.
5. Rushton, H. G., Jr.: Vesicoureteral reflux and scarring In: Pediatric Nephrology, 4th ed. Edited by T. M. Barratt, E. D. Avner and W. E. Harmon. Baltimore: Lippincott Williams & Wilkins Co., p. 851, 1999.
6. Puri, P., Cascio, S., Lakshmandass, G. Et al Urinary tract infection and renal damage in sibling vesicoureteral reflux. J Urol, 160: 1028, 1998.
7. Arant, B. S., Jr.: Vesicoureteric reflux and injury. Am J Kidney Dis, 17: 491, 1991.
8. Medical versus surgical treatment of primary vesicoureteral reflux: report of the International Reflux Study Committee. Pediatrics, 67: 392, 1981.
9. Report of the International Reflux Study in children. Pediatrics, 88: 410, 1991.
10. Thomas, D.F.M.: Fetal uropathy. Brit. J. Urol, 66: 225, 1990.
11. Zerin, J. M., Ritchey, M. L. and Chang, A. C. H.: Incidental vesicoureteral reflux in neonates with antenatally detected hydronephrosis and renal abnormalities. Radiology, 187: 157, 1993.
12. Feather, S. A., Malcolm, S., Woolf, A. S. et al: Primary, nonsyndromic vesicoureter reflux and its nephropathy is genetically heterogenous, with a locus on chromosome 1. Am J Hum Genet, 66:1420, 2000.
13. Parekh, D. J., Pope, IV, J. C., Adams, M. C. and Brock, III, J. W.: Outcome of sibling vesicoureteral reflux. J Urol, 167: 283, 2002.
14. Ferrer, F. A., McKenna, P. H., Hochman, H. I. et al: Results of a vesicoureteral reflux practice pattern survey among American Academy of Pediatrics, Section on Pediatric Urology members. J Urol, part 2, 160: 1031, 1998.
15. Hutch, J. A.: The mesodermal component: its embryology, anatomy, physiology and role in prevention of vesicoureteral reflux. J Urol, 108: 406.1972.
16. Tanagho, E.A., Pugh RCB: The anatomy and function of de ureterovesical juction. Br J Urol, 35:151, 1963.
17. Casale, A. J.: Early ureteral surgery for posterior urethral valves. Urologic Clinics of North America, 17: 361, 1990.
18. Mayo, M. E., Burns, M. W.: Urodynamic studies in children who wet. Br J Urol, 65: 641, 1990.
19. Lowry, P. A., Pjura, G. A., Kim, E. E. and Brown, W. D.: Radionuclide imaging of the lower genitourinary tract. In: Diagnostic Nuclear Medicine, 2nd ed. Edited by A. Gottschalk, PB Hoffer, EJ Potchen and HJ Berger.Baltimore: Williams & Wilkins, 967-984, 1988.
20. Cleveland, R. H., Constantinou, C., Blickman, J et al: Voiding cystourethrography in children: value of digital fluoscopy in reducing radiation dose. AJR, 158:137,1992.
21. Tremewan, R. N., Bailey, R. R., Little, P. J. et al: Diagnosis of gross vesicoureteric reflux using ultrasonography. Br J Urol, 48: 431, 1976.
22. Atala, A., Wible, J. H., Share, J. C. et al: Comparrison of sonicated albumin enhanced sonography to fluoroscopic and radionuclide voiding cystography for detecting vesicoureteral reflux. J Urol, 160:1820, 1998.
23. Mentzel, H. J., Vogt, S., Patzer, L. et al: Contrast-enhanced sonography of vesicouretero-renal reflux in children: preliminary results. AJR Am J Roentgenol, 173: 737, 1999.
24. Smellie, J. M.: The intravenous urogram in the detection and evaluation of renal damage following urinary tract infection. Pediatr Nephrol, 9: 213, 1995.
25. Blane, C. E., DiPrieto, M. A., Zerin, J. M. et al.: Renal sonography is not a reliable screening examination for vesicoureteral reflux. J Urol, 150: 752, 1993.
26. Eggli, K. D., Eggli, D.: Color Doppler sonography in pyelonephritis. Pediatr Radiol, 22: 422, 1992.
27. Mastin, S. T., Drane, W. E., Iravani, A.: Tc-99m DMSA SPECT imaging in patients with acute symptoms or history of UTI: Comparison with ultrasonography. Clin Nucl Med, 20: 407, 1995.
28. MacKenzie, J. R.: A review of renal scarring in children. Nucl Med Commun, 17: 176, 1996.
29. Merrick, M. V., Uttley, W. S. and Wild, S. R.: The detection of pyelonephritic scarring in children by radioisotope imaging. Brit. J. Rad., 53: 544, 1980.
30. Majd, M., Rushton, H. G., Chandra, R. et al: Tc-99m-DMSA renal cortical scintigraphy for the detection of acute pyelonephritis in piglets: Comparison of planar and SPECT imaging. Europ J Nucl Med, 21: 588, 1994.
31. Schwab, C. W., Jr., Wu, H.-Y., Selman, H., Smith, G.
H. H., Snyder, H. M., Ill and Canning, D. A.: Spontaneous resolution of vesicoureteral reflux: a 15-year perspective. J Urol, 168: 2594, 2002.
32. Wennerstrom, M., Hansson, S., Jodal, U. and Stokland, E.: Disappearrence of vesicoureteral reflux in children. Arch Pediatr Adolesc Med, 152: 879,
1998.
33. AUA Pediatric Vesicoureteral Reflux Clinical Guidelines Panel: Report on the Management of Primary Vesicoureteral Reflux in Children. Baltimore: American Urologic Association, pp. 9-15, 1997.
34. Ransley, P. G. and Risdon, R. A.: reflux and renal scarring. Br J Radiol, suppl., 14: 1, 1978.
35. Ransley, P. G. and Risdon, R. A.: The pathogenesis of reflux nephropathy. Contrib Nephrol, 16: 90, 1979.
36. Lenaghan, D., Whitaker, J. G., Jensen, F. and Stephens, F. D.: The natural history of reflux and long-term effects of reflux on the kidney. J Urol, 115: 728, 1976.
37. Smellie, J., Edwards, D., Hunter, N., Normand, I. C. and Prescod, N.: Vesico-ureteric reflux and renal scarring. Kidney Int Suppl, 4: 65, 1975.
38. Cooper, C. S., Chung, B. I., Kirsch, A. J., Canning, D.A. and Snyder, H. M., III.: Outcome of stopping prophylactic antibiotics in older children with vesicoureteral reflux. J Urol, 163: 269, 2000.
39. Bauer, S. B., Retik, A. B., Colodny, A. H., Hallett, M., Khoshbin, S. and Dyro, F. M.: The unstable bladder of childhood. Urol. Clin. N. Amer., 7: 321, 1980.
40. Hinman, F. and Bauman, F. W.: Vesical and ureteral damage from voiding dysfunction boys without neurologic or obstructive disease. J. Urol., 109: 727, 1973.
41. Koff, S. A.: Relationship between dysfunctional voiding and reflux. J. Urol., 148: 1703, 1992.
42. Van Gool, J. D., Hjaimas, K., Tamminen-Mobius, T. et al: Historical clues to the complex of dysfunctional voiding, urinary tract infection and vesicoureteral reflux. The International Reflux Study in Children. J Urol, 148: 1699, 1992.
43. Koff, S.A.: Relationship between dysfunctional voiding and reflux. J Urol, 148: 1703, 1992.
44. VanGool J. D., Vijverberg, M. A. W., Messer, A. R, Elzinga-Plomp, A. and de Jong, T. R V. M.: Functional day-time incontinence :non-pharmaco-logical treatment. Scand. J. Urol. Nephrol., suppl., 141: 93, 1992.
45. McKenna, R H., Herndon, C. D. A., Connery, S. and Ferrer, F. A.: Pelvic floor muscle retraining for pediatric voiding dysfunction using interactive computer games. J. Urol. 162: 1056, 1999.
46. Birmingham Reflux Study Group. Prospective trial of operative versus non-operative treatment of severe vesicoureteric reflux in children: five years' observation. Birmingham Reflux. BMJ, 295: 237, 1987.
47. Jodal, U., Koskimies, O., Hanson, E., Lohr, G., Olbing, H., Smellie, J., Tamminen-Mobius, T.: Infection pattern in children with vesicoureteral reflux randomly allocated to operation or long-term antibacterial prophylaxis. The International reflux Study in Children. J Urol, 148: 1650, 1992.
48. Weiss, R., Duckett, J. and Spitzer, A.: Results of randomized clinical trial of medical versus surgical management of infants and children with Grades III and IV primary vesicoureteral ref. J Urol, 148: 1664, 1992.
49. Politano, V. A. And Leadbetter, W. F.: Operative technique for correction of vesicoureteral reflux. J Urol, 167: 1415, 2002.
50. Williams, D. I. and Eckstein, H. B.: Surgical treatment of reflux in children. Br. J Urol, 37: 13, 1965.
51. Carpentier, P. J., Bettink, P. J., Hop, W. G. J. et al.: Reflux: A retrospective study of 100 ureteric reim-platations by the Politano-Leadbetter method and 100 by the Cohen technique. Br. J Urol, 54: 230, 1982.
52. Cohen, S. J.: Ureterozystoneostomie: Enie neue antireflux technik. Akyuelle Urologie, 6: 1, 1975.
53. The American Urological Association Pediatric Vesicoureteral Reflux Clinical Guidelines Panel report on The Management of Primary Vesicoureteral Reflux in Children. Resolution of reflux after open surgery. TABLE E-3. 83, 1996.
54. Hodgson, N. B. and Babbitt, D. P.: Urinary tract infection in children. In: Urology. Edited by A. R. Kondall and L. Karafin. Philadelphia: Harper and Row, vol. 1, chapt. 21, 1972.
55. Zaontz, M. R., Maizels, M., Sugar, E. C., et al: Detrusorrhaphy. Extravesical ureteral advancement to correct vesicoureteral reflux in children. J Urol, part 2, 138: 947, 1987.
56. Matouschek, E.: Die Behandlung des Vesikorenalen Refluxes durch Transurethrale Einstritzung von teflonpaste. Urologe, 20: 263, 1981.
57. O'Donnell, B. and Puri, P.: Treatment of vesicoureteral reflux by endoscopic injection of Teflon. Brit. Med. J., 289: 7, 1984.
58. Malizzia, A. A., Reiman, H. M. and Myres, R. P.: Migration and granulomatous reaction after periurethral injection of polytef (Teflon). J.A.M.A., 251: 3277, 1984.
59. Aaronson, I. A., Rames, R. A. and Greene, W. B.: Endoscopic treatment of reflux: migration of Teflon to the lungs and brain. Eur. Urol., 23: 394, 1993.
60. Aragona, F., D'Urso, L., Scremin, E., Salmaso, R. and Glazel, G. P.: Polytetraflurethylene giant granuloma and adenopathy: long-term complications following subureteral polytetrafluoroethylene injection for the treatment of vesicoureteral reflux in children. J. Urol., 158: 1539, 1997.
61. Haferkamp, A., Contractor, H., Mohring, K., Staehler, G. and Dorsam, J.: Failure of subureteral bonvine collageninjection for the endoscopic treatment of primary vesicoureteral reflux in long-term follow-up. Urology, 55: 759, 2000.
62. Kolbet, G., Canning, A., Hensle, W. and Lackgren, G.: The cost-effectiveness of endoscopic injection of dextranomer/hyaluronic acid copolymer for vesicoureteral reflux. J Urol, 169: 1480, 2003.
63. Ehrlich, R. M., Gershman, A. and Fuchs, G.: Laparoscopic vesicoureteroplasty in children: initial case reports. Urology, 43: 255, 1994.
64. Atala, A., Kavoussi, L. R., Goldstein, D. S. et al: Laparoscopic correction of vesicoureteral reflux. J Urol, part 2, 150: 748, 1993.
65. Lakshmanan, Y. and Fung, L. C.: Laparoscopic extravesicular ureteral reimplantation for vesicoureteral reflux: recent technical advances. J Endourol, 14: 589, 2000.
66. Elder, J. S.: Antenatal hydronephrosis: fetal and neonatal management. Pediatr Clin North Am, 44: 1299, 1997.
67. Mevorach, R. A., Cilento, B., Zahorian, S., Badgett, C., Walker, R., Atala, A., Iannello, S. and Meyer, M.: A noninvasive test for vesico-ureteric reflux in children. BJU international, 87: 467, 2001.
68. Cendron, M.: Primary vesicoureteral reflux in the newborn: Diagnosis and renal function. Resent at the American Urological Association 97th annual meeting, Panel Discussion: Vesicoureteral reflux in the newborn. 2002.
69. Greenfield, S. P. and Wan, J.: The diagnosis and medical management of primary vesicoureteral ferflux. In: Pediatric Urology. Edited by J. P. Gearhart, R. C. Rink and P. D. E. Mouriquand. Philadelphia: W. B. Saunders Co., chapt. 25, pp. 382-410, 2001.
70. Goonasekera, C. D. A. and Dillon, M. J.: Hypertension in reflux nephropathy. BJU Int, 83: 1, 1999.
Dr. David Arana Castro
Urólogo - Cirujano de Trasplante Renal Hospital Militar de Caracas "Dr. Carlos Arvelo"
Dr. David Arana García
Residente Cirugía Hospital Pérez de León.
TRASPLANTE RENAL
HISTORIA
Uno de los capítulos más apasionantes de la historia médica mundial, es el del Trasplante de Organos, no solo por lo diverso y complejo, sino también por la permanente actualidad que desde los comienzos históricos ha representado este arte, ciencia de la medicina moderna que viene a representar la gran esperanza de vida, para enfermos en los órganos vitales han dejado de funcionar y ese cambio dramático en estos pacientes que día a día vencen la sombra de la muerte con el trasplante.
La historia le ha concedido el titulo de Padre de los Trasplantes a Alexis Carrel (1875-1944), alumno de Mathieu Jabolay en la Escuela Lionesa de Cirugía, inició sus investigaciones en 1901 sobre anastomosis vasculares, describiendo la técnica de sutura de extremo con extremo con hilos de apoyo por triangulación, estableciendo la moderna técnica de anastomosis vascular moderna.1'3 Esta técnica clásica de triangulación de Carrel se convirtió a comienzos del siglo pasado en el procedimiento básico e inicial de las anastomosis vasculares y que aún en la actualidad permanecen vigentes. Posteriormente es Emerich Ullman (1861-1937) quien realizó el primer Autotras-plante Renal experimental en el cuello de un perro.4 Ese mismo año Carrel realiza su primer Autotras-plante Renal con su propia técnica, el cual evoluciono con pérdida del injerto por complicaciones infecciosas, posteriormente se ve obligado a abandonar su escuela por severas críticas, continuando sus investigaciones en Chicago (1904-1906), para ser Jefe del Departamento de Cirugía Experimental del Instituto de Rockefeller de New York y Premio Nobel de Medicina en 1912.5
El primer homoinjerto renal fue realizado en 1933 por el cirujano ruso YuYu Voronoy (1896-1961),6 lo cual represento para su época un adelanto audaz a pesar de su fracaso. Para 1950 luego de un receso en la actividad clínica y experimental del Trasplante Renal, Lawler realiza el primer Trasplante Renal con restablecimiento de circuitos vasculares y urinarios naturales, posteriormente David Hume responsable del primer trasplante de cadáver en Los Estados Unidos (1955), reporta 9 casos de riñones trasplantados.7 Rene Küss francés y actualmente vivo, en 1951 realizó el primer Trasplante Renal de donante vivo,6 pero es solo hasta 1954 cuando Joseph Murray, John Merril y Harrison en el Hospital Peter Bent Brigham de Boston realizan entre gemelos idénticos el primer trasplante renal de donante vivo con éxito.6'7 Este grandioso éxito en el mundo del Trasplante de Organos, fue la antesala al segundo período de oro en la historia de los trasplantes, la era de la Inmunosupresión en la década de los 70, dividida en tres sub-períodos: Irradiación corporal total, Inmunosupresión química con drogas como la Azatioprina y Prednisona entre otras, y finalmente la introducción de Anticuerpos antilinfocíticos.
El primer trasplante renal de donante vivo no relacionado lo realizó Küss en 1951 posteriormente y con el advenimiento de irradiación corporal total,6 mercaptopurina y cortisona, se realizó en 1960 el primer trasplante exitoso de este tipo por el mismo Rene Küss. En esta época la sobrevida de estos injertos era similar a la de injertos procedentes de donantes cadavéricos, pero sin riesgo para el donante vivo, por lo que esta modalidad fue abandonada por un tiempo. Sin embargo con la era de la triple terapia inmunosupresora con Ciclosporina, Azatioprina y Prednisona, la sobrevida del injerto mejoró para estas dos modalidades (Cadáver y donante vivo no relacionado).
Otros aportes a resaltar se encuentran en el área de diálisis peritoneal y hemodiálisis con la actualización del riñón artificial inventado por el Dr. William Kolff (1945) durante la segunda guerra mundial en Holanda,8 preservación de órganos, selección del donante en base a la histocompatibili-dad, nuevas técnicas quirúrgicas y abordajes para la extracción multiorgánica, cirugía de banco para el aprovechamiento de mayor número de órganos y técnicas mínimamente invasiva mejorando el postoperatorio de los donantes vivos.
El Trasplante Renal no es sólo una técnica quirúrgica, sino el punto final de un cúmulo de avances
científicos, técnicas y de organización hospitalaria. En Venezuela la historia no ha sido menos interesante ni quijotesca, el trasplante surge como alternativa ideal ante la insuficiencia de un órgano cardinal para la homeostasis corporal como es el riñón. La Insuficiencia Renal Crónica Terminal, se refleja con afectación y repercusiones sistémicas como: Anemia, Inmunosupresión, Disfundón Plaquetaria, Desequilibrios Hidroelectrolíticos y del Equilibrio Áddo Base, Dislipidemia, Disfundón Sexual, Enfermedad Ulcero péptica, Arritmias, Pericarditis y Trastornos de cicatrización, siendo las prindpales causas de este estado de uremia terminal: Diabetes Mellitus, Hipertensión Arterial, Glomerulopatías, Urológicas, Misceláneas.9
Ante esta realidad y 13 años después del exitoso Trasplante Renal realizado en Boston por el grupo de Murray, se realizó el primer Trasplante renal en Venezuela año 1967 en el Hospital Universitario de Maracaibo), seguido de una lista de 8 Centros de trasplantes Venezolanos: 1968 Hospital Universitario de Caracas, 1974 Hospital Miguel Pérez Carreño, 1982 Hospital Central de Valenda, 1.983 Hospital J. M. de los Ríos, 1990 Hospital Militar Dr. Carlos Arvelo, 1991 Hospital Central de Acarigua, 1992 Hospital Antonio María Pineda, 1997 Hospital Universitario de los Andes.
A finales de la década de los 70 e inicio de los 80, se comienzan a reportar las complicaciones médico-quirúrgicas, constituyendo las Urológicas las de mayor relevanda en cuanto a sobrevida de injerto se refiere, recordando que la mayoría de estos trasplantes eran realizados por drujanos generales con conodmientos urológicos limitados, especialmente en técnicas de réimplanté Ureteral.
Posteriormente se inida una cruzada con mayor participación Urológica en la cirugía de los Trasplantes Renales, el mejor conocimiento relativo a las complicaciones urológicas, su prevención y tratamiento con técnicas Endourológicas, ubican al Urólogo en este momento en un rol protagónico dentro del Trasplante Renal. Con mayor frecuenda en las revistas urológicas actuales a nivel international, vemos publicaciones, relativas al Trasplante Renal con participadón urológica total.
La situadón de la Enfermedad Renal Crónica Terminal, las evaluadones Urológicas de la pareja Donante-Receptor, las técnicas quirúrgicas actuales de Extracdón y Trasplante Renal, el curso dínico, Inmunosupresión, la prevención y resolución de las complicaciones constituyen un capítulo en la Urología Moderna, en la cual, el Urólogo actual y del futuro debe tener conocimientos más que ideas, y es nuestro compromiso formar las futuras generaciones urológicas en este apasionante campo y mantenerlo en el presente milenio como figura estelar. Ya en la actualidad, la conceptuación de Cirujano de Trasplante ha sido sabiamente reconsiderada, traspasando ese umbral dásico del Técnico Operador y Artesano para convertirlo en un Científico Cirujano Clínico, con un armamentario de conodmientos de gran profundidad y amplitud para poder conocer y reconocer las diversas situaciones en el curso clínico del trasplante, prevenir más que resolver complicaciones tanto dínicas como quirúrgicas, manejar la preservadón de órganos y la protecdón del daño isquémico antes del trasplante
La inmunobiología en trasplante de órganos se estableció formalmente con 2 descubrimientos que merecieron sendos Premios Nobel, el primero Karl Landsteiner por el descubrimiento del sistema ABO, y el segundo Jean Dausset quien describió el primer Antígeno Leucodtario Humano (HLA).5 El Complejo Mayor de Histocompatibilidad (MHC) por sus siglas en inglés Mayor Histocompatibility Complex, es un complejo de genes que en el ser humano se localizan en el brazo corto del cromosoma 6, su fundón principal es la de presentar antígenos como fragmentos de proteínas ajenas a los Linfocitos T (Ly T), desde el punto de vista prádico estos genes son responsables del reconodmiento del injerto como extraño. Esta función se ejecuta a través de HLA, que son un conjunto de moléculas de superfide celular polimórficas, codificadas por los genes del MHC.10'11
El HLA se divide en moléculas clase I (HLA A, B, C) y dase II (HLA DP, DQ, DR). Las primeras se encuentran en la superficie de casi todas las células y funcionan para el reconocimiento de proteínas extrañas sintetizadas de modo endógeno por virus o células tumorales; las segundas se expresan en Células Presentadoras de Antígeno (APC) y el reconodmiento de moléculas del HLA clase II inida:
A) Expansión Clonal y Adivación de Ly T ayudadores CD4 +, B) Liberadón de Citoquinas reguladoras por estos últimos, C) Expansión Clonal y
Activación de Ly T dtotóxicos CD8+, D) Ayuda a la expresión en las superficies celulares de moléculas HLA clase II y la unión de proteínas con el MHC.
Los Antígenos Menores de Histocompatibilidad, son proteínas endógenas de pequeño peso molecular, que intervienen en el reconocimiento de antígenos a través de su procesamiento y presentadón a Ly T.
Las Citoquinas son moléculas reguladoras, que tienen como funciones principales las siguientes:
A) Inducen Respuestas Humorales y Celulares.
B) Inducen Activadón, Proliferación y Diferen-ciadón de Ly T, Ly B y Macrófagos (M).
C) Aumentan la Expresión de moléculas del MHC, favoreciendo Inflamación y Lesión Celular implicando a Polimorfonucleares (PMN) y Plaquetas (PLT).
D) Aumentan la Expresión de Moléculas de Adhesión Celular en el Endotelio y Células Epiteliales del Injerto.
E) Facilitan Citotoxicidad mediada por Células Natural Killers (NK) y M.
La activadón de los Ly T en el reconodmiento de tejidos e injertos extraños es un proceso complejo, que se encuentra regulado por tres señales:
A) Señal N°l: Depende de la unión de el Receptor de Célula T (TCR) y CD3 en el Ly T, al MHC dase II y Antígeno en la APC,
B) Señal N°2: Depende de las Moléculas Accesorias CD4, CD8, CD2, CD28, VLA, LFA- 1, ICAM 1 y 2, CD80, CD86,
C) Señal N°3: Dependiente de Citoquinas para la División Celular.12
En el caso de que en la presentadón antigénica se establedera solo la señal N°l, se produdría un estado de anergía clonal, definido por insensibilidad a la estimuladón antigénica, es dedr, tolerancia y finalmente apoptosis (muerte celular programada). Las moléculas mencionadas en la señalización N°2 aumentan la afinidad por el complejo TCR y CD3 con MHC y Antígeno, proporcionando además segundas señales antígeno independiente, y finalmente estabilizan la interacdón entre Ly T CD8+ y la célula diana.
Los Ly T se pueden dividir de acuerdo al patrón de comportamiento en la fase efedora de la respuesta inmune en:
A su vez los Ly T CD4+ se subdividen en:
Ly T TH1:--------Interleuquina (IL) - 2, IL -12 y
Interferón (IFN) Gamma.
Respuesta Humoral.
Ly T TH2:--------IL - 4, IL - 5, IL -10, IL 3.
Respuesta Celular.
El conocimiento de estos elementos del sistema inmunológico, es básico para comprender las bases fisiopatológicas del rechazo de órganos en cualquiera de sus formas (Hiperagudo, Acelerado, Agudo y Crónico), los principios bioquímicos y farmacológicos de la Inmunosupresión, y todas las diversas líneas de investigadón en el área de Trasplante.
DONACIÓN DE ÓRGANOS
En Venezuela la escasez de órganos es una realidad, mucho más acentuada que en otras partes del mundo como Estados Unidos, Europa e inclusive Japón donde la tasa de donantes por millón de habitantes ha ido ascendiendo. En nuestro país existen una serie de fadores limitantes, que determinan una baja tasa de donadón, entre ellos podemos mendonar:
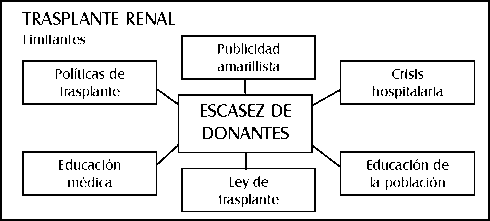
La donadón en nuestro país se encuentra condi-donada por la Mayoría de edad, el Bienestar físico y mental, ser Compatible con el receptor y tener parentesco consanguíneo hasta el quinto grado, Informadón completa acerca de los riesgos y consecuen-das de la donadón, Voluntad de donadón por escrito, Libre de coacdón física o moral. La donadón tiene carácter de Gratuidad y Revocabilidad. En el caso de cadáveres, la ley no contempla la donadón presunta, y la donadón depende de la aceptadón de los parientes.13
Estas condiciones anteriores, han sido reconsideradas pudiéndose hablar de donantes emparentados emodonalmente e indusive donantes altruistas o no relacionados, los cuales son aceptados por algunos centros de trasplante. El consenso científico actual, es que el urémico terminal tiene la posibilidad de un órgano proveniente de un donante vivo no reladonado.14'15
En este momento es una realidad que los trasplantes de donante vivo, tienen como ventajas potendales entre otras mínima inddenda de disfunción aguda de injerto, menor estrés y menor adi-vadón del sistema inmunológico por muerte cerebral con un protocolo de Inmunosupresión a corto y a largo plazo menos agresivo, menor espera pre-trasplante, mejor estudio del donante y su anatomía renovascular y la capacidad de programar el trasplante según convenienda general. Sin embargo la donación en vida, expone al donante a estrés psicológico suyo y al de su familia, morbilidad postoperatoria que ha ido disminuyendo con el uso de técnicas mínimamente invasivas, y finalmente mortalidad quirúrgica.
La obtendón de órganos procedentes de donantes vivos reladonados, representa una considerable ventaja desde el punto de vista quirúrgico. Se transforma en una drugía elediva, planificada y programada en la que contamos con un conodmiento previo de la anatomía renovascular del donante, situación que no ocurre con el donante cadavérico, cuya anatomía es desconodda y en la que las lesiones de vasos renales accesorios, polares o múltiples pueden ocurrir durante la drugía de procura.
Otra ventaja significativa del donante vivo emparentado, viene dada por su proximidad inmunológica con el receptor, lo que reduce el riesgo de rechazo. Adidonalmente a esto los tiempos de isquemia se encuentran reducidos y de esta manera, también desaparece la disfundón aguda de injerto por necrosis tubular aguda, que complica habitualmente cuando esta presente el curso del trasplante renal y su asociadón estrecha con rechazo.
De manera general, se pude establecer un algoritmo a seguir para la evaluación pre-operatoria y selección del donante vivo, el cual presentamos a continuación:
- Edad >18 años <65 años, Voluntad de donación.
- Compatibilidad ABO, Rh, Tipiaje de Tejidos, Compatibilidad HLA.
- Historia Clínica, Laboratorios: Estudio de laboratorio detallado con Recuento Sanguíneo Completo, Bioquímica Completa, Proteinurea 24 horas, Depuradón de creatinina, Orina 24 horas, Serología para HIV, VDRL, Marcadores virales para hepatitis A, B y C, Títulos de Anticuerpos para CMV, Epstein Baar.
- Examen de orina, Urocultivo, Prueba de Embarazo, PPD.
- Radiología de Tórax, Electrocardiograma, Ecosonograma Abdominal, Mamografía.
- Evaluaciones Especializadas: Ginecología, Cardiología, Psiquiatría.
- Angiografía: Selediva Renal con fase excretora.-Uro-TAC helicoidal.
Dicho algoritmo sirve de guía, el mismo debe ser individualizado y adualizado, puede ser ampliado de acuerdo a las necesidades del centro de trasplante. Cada centro tiene su propio protocolo de estudio del donante vivo, de cadáver y al receptor. Dichos criterios como veremos, son adaptados en función de ampliar el pool de donantes, mejorar la sobrevida de injerto, con tolerancia inmunológica y menor número de complicadones.
La técnica de extracción de órganos para trasplante, es muy especializada y debe ser realizada por cirujanos entrenados, ya que de este acto depende el 50% del éxito del trasplante. El Abordaje para la Nefrectomía del Donante Vivo puede ser diverso, contando como alternativas a la Lumbotomía Clásica y el Abordaje Transperitoneal Anterior hasta técnicas de Cirugía Mínimamente Invasiva, con Nefrectomía Laparoscópica Simple16-24 y Asistida25-28, Técnica Lumboscópica y Cirugía Experimental con Técnicas de Robótica, situación que ha creado abierta polémica.29
Los órganos deben ser extraídos con especial cuidado en la anatomía vascular y sus variantes. En el caso del donante vivo los principios generales consisten en: disección hiliar mínima con exposición adecuada de los elementos, preservación adecuada de la grasa perihiliar y periureteral para asegurar el suministro de sangre al uréter, se realiza la nefrectomía prefiriendo el riñón izquierdo por la mayor longitud de vena y mejor acceso a la arteria renal.
Al separar los órganos estos se perfunden ex situ bajo condiciones de hipotermia a 4°C aproximadamente con soluciones de preservación de órganos, con la Solución de Collins y posteriormente con la Solución de la Universidad de Wisconsin se extendió el tiempo de isquemia fría. Actualmente existe una línea de investigación en preservación de órganos, con el objetivo de determinar la importancia individual de los componentes de estas soluciones, para finalmente utilizar soluciones más económicas e inclusive que se puedan preparar en el centro de trasplante, siendo esto valido para el riñón extraído en condiciones óptimas con tiempo de isquemia caliente e isquemia fría cortos.
EVALUACION Y MANEJO DEL DONANTE DE CADÁVER
La utilización de órganos procedentes de donantes cadavéricos, representa la solución ideal para los receptores de trasplante, principalmente porque estos últimos en su mayoría no cuentan con un donante vivo emparentado inmunológicamente y deben esperar largas listas hasta obtener un órgano procedente de donante de cadáver compatible desde el punto de vista inmunológico para realizar el ansiado trasplante. De esta manera, se ha popularizado mundialmente la utilización de donantes cadavéricos con fines de trasplante, organizándose equipos quirúrgicos de guardia permanente, con capacidad de respuesta inmediata ante la notificación de un probable donante para proceder a la extracción de órganos en el mínimo tiempo posible.
Los eventos que siguen al diagnóstico de muerte cerebral y que son cruciales son los siguientes: Notificación al Equipo de Guardia, Evaluación del Donante y Autorización del Retiro de Organos obtenido por el equipo de trasplante, Obtención de Muestra de sangre y ganglios para análisis inmunológico y pruebas de histocompatibilidad, Coordinación entre Centros de Trasplante, Extracción de Organos, Distribución y Trasplante. La principal causa de Muerte Cerebral en Venezuela es representada por los Traumatismos Cráneo-encefáli-cos, seguidos de Accidente Cerebro-Vascular, Hipoxia - Isquemia cerebral, Tumores Cerebrales primitivos y otras. Esto se debe al grado de violencia en nuestras principales ciudades, e implica que el promedio de donantes cadavéricos es esencialmente donantes jóvenes.
Se habla de Muerte cuando todas las funciones encefálicas están perdidas en forma total e irreversible. El diagnóstico clínico de Muerte Cerebral tiene como criterios indispensables Coma de etiología conocida y ocasionada por lesión estructural e irreversible del sistema nervioso central, Ausencia de Respuesta a Estímulos Intensos, Ausencia de Reflejos de Tallo Cerebral como el fotomotor, corneal, oculo-cefálico, oculovestibular, faríngeo y traqueal, Prueba de Apnea positiva, demostrada al no producirse ningún movimiento respiratorio al separar el ventilador del paciente durante 10 minutos y oxigenación al 100%, Trazado Isoeléctrico Electroencefalográfico (excluyendo hipotermia e intoxicación por drogas como barbitúricos, benzodiazepinas y succinilcoli-na). Los mismos deben ser verificados y certificados por escrito por tres médicos diferentes al equipo de cirujanos de trasplante. Se deben determinar mediante el interrogatorio los siguientes factores ya que pueden Contraindicar de manera absoluta la donación: Cáncer (excepto piel y SNC), Infecciones: TBC, Hongos y Sepsis, Enfermedades metabólicas: DM Arterioesclerosis, Hipertensión arterial, Nefropatías o Uropatías crónicas, Uso de medicamentos depresores del sistema nervioso central.
Manejo del Donante de Cadáver
A) Intubación y asistencia ventilatoria mecánica.
B) Hidratadón, soludón 0,9% de acuerdo a PVC.
Mantener la diurésis por endma de 50cc hora.
C) Hipotensión o Shock de menos de 1 hora refractario a hidratadón, usar Dopamina a dosis Dopa (10 mcg. x Kg. x min.), alternativa Isoproterenol (1- 2 mg. en 500cc solución Dextrosa al 5%) - dosis respuesta para mantener TAS 100 mniHg. Contraindicado Levofed, Aramine o similares.
D) Foley.
En cuanto a la nefrectomía de cadáver el procedimiento se inicia con el abordaje Transperitoneal anterior, a través de indsiones amplias propias para cada centro, las incisiones Xifo-púbica, Chevron Ampliada o en Cruz con exposición de cuatro cuadrantes son ejemplo ellas, este abordaje permite amplia exposidón quirúrgica mejor control vascular, la aplicación de técnicas de extracdón multiorgánica, menor tiempo quirúrgico entre otras ventajas.
Es importante la exploración de toda la cavidad abdominal, antes de preparar el campo operatorio retroperitoneal. Luego de realizar el control vascular en Aorta proximal y cava distal y previa canulación se realiza la perfusión in situ, exduyendo el lecho esplácnico y dirigido hacia los órganos a extraer. Finalmente se realiza la nefrectomía en bloque con ligadura y división de los uréteres en la pelvis profunda para realizar la separadón y disección de ambos riñones manteniendo toda la arteria y vena renal incluyendo un adecuado Parche Aórtico y de Vena Cava, finalmente se perfunden los riñones bajo hipotermia y en condiciones óptimas existe la posibilidad ideal de perfusión continúa con la maquina de perfusión inicialmente descrita por Folkert O. Belzer, en la actualidad espedalmente modernizadas, pero con el mismo principio.
El tiempo de Isquemia Caliente corresponde al período comprendido entre la parada circulatoria y el comienzo de la hipotermia, en cambio la isquemia fría se refiere al período de conservación fría o perfusión mecánica. Existe desde el punto de vista práctica un tercer período que se denomina de recalentamiento, el cual se refiere al período desde el fin de la conservación fría o perfusión hasta la liberación del damp arterial posterior a las anastomosis vasculares; este último período se puede disminuir enfriando el riñón durante la cirugía con la bolsa hipotérmica, artefado de fabricación comerdal o en el mismo quirófano, con compresas que envuelven al riñón junto con hielo granizado. De este modo la bolsa hipotérmica representa un elemento de ayuda en la sobrevida de injerto al disminuir el tiempo de recalentamiento.
La aplicadón práctica de estos principios hace posible comprender la importanda de disminuir el tiempo de isquemia fría, fador individual importante en la sobrevida de injerto, ya que como se ha evidenciado en los diferentes estudios multivariables que la isquemia caliente es un período casi estándar y en disminudón con la mayor experienda adquirida por los diferentes cirujanos de trasplante. Sin embargo, la isquemia fría, así como la edad y la creatinina previa del donante son los factores predisponentes más importantes de Disfundón Aguda de Injerto.
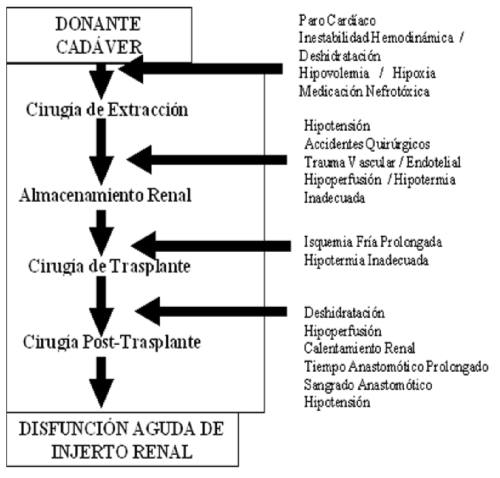
EVALUACIÓN DEL RECEPTOR Y EL TRASPLANTE RENAL
La evaluadón pre-trasplante del receptor debe ser-integral, y debe perseguir el objetivo de descartar-condiciones médicas pre-existentes o psicosociales que puedan predisponer a morbilidad y mortalidad post-trasplante. El algoritmo es particular para cada centro de trasplante, y debe ser individualizado, sin embargo, el siguiente algoritmo es una recopiladón representativa de los ítems necesarios haciendo siempre hincapié en los aspectos urológicos:
• Estudios generales Historia Clínica y Examen físico induyendo exploradón digital rectal, Rx. de tórax, Eledrocardiograma.
• Laboratorios: Estudio de laboratorio detallado con Recuento Sanguíneo Completo, Test de Coombs, Aglutininas frías.
• Bioquímica Completa, Proteinurea 24 horas, Depuración de creatinina, Orina 24 horas, Serología para HIV, VDRL, Marcadores virales para hepatitis A, B y C, Títulos de Anticuerpos para CMV, Epstein Baar.
• Urología: Examen de orina, Urocultivo, Proteinurea 24 horas, Depuración de creatinina, Orina 24 horas, ECO Renal, Antígeno Prostático Específico libre y total, Cistoscopia, Cistografía Miccional y Estudios Urodinámicos, estos últimos para reconocer las condiciones ideales de la vejiga del receptor: Capacidad Adecuada, Vaciamiento completo, Continencia, Baja Presión, Orina Estéril.
• Radiología de Tórax, Electrocardiograma, Ecosonograma Abdominal, Mamografía.
• Evaluaciones Especializadas: Ginecología, Cardiología, Psiquiatría.
• Angiografía: Selectiva Renal con fase excretora.- Uro-TAC helicoidal.
• Estudios Inmunológicos, Compatibilidad ABO, Rh, Tipiaje de Tejidos, Compatibilidad HLA.
La técnica quirúrgica del Trasplante Renal consiste en colocarlo en la fosa ilíaca del receptor, teniéndose implícitas las medidas de asepsia y antisepsia ya que se trata de un paciente inmunosuprimido. Los Factores Críticos más importantes en el Trasplante son los referentes al Receptor, Isquemia Renal Prolongada, Manejo Intr a-operatorio, Técnica Quirúrgica, Inmunosupresión.
El algoritmo de trabajo para Trasplante es el siguiente:
• Vía Central, Antisepsia.
• Intraoperatorio - Una técnica quirúrgica meticulosa, cuidando la hemostasia, el abordaje de la fosa ilíaca derecha a través de incisión en palo de golf, preparación Lecho Vascular.
• Drogas: Metilprednisolona 500mg. en 3 dosis en bolo, el uso de anticuerpos monoclonales o policlonales es opcional para cumplir la terapia cuádruple, Cefepime durante 48horas es el antibiótico utilizado.
• Cateterismo Uretrovesical, Solución Fisiológica lOOcc. Amikadna lgr. Intravesical - Clampaje Foley.
• Preparation Lecho Vascular.
• Disección y Ligadura Linfática.
• Anastomosis Vasculares con sutura vascular 6-0, Arterial: Termino-Lateral a la Arteria Ilíaca Externa, y Venosa: Termino-Lateral a la Vena Ilíaca Externa.
• Manitol 18% con la finalidad de facilitar diuresis osmótica y disminuir la incidencia de Necrosis Tubular Aguda.
• Apertura Clamps Vasculares.
• Verapamil 5mg. Intraarterial.
• Reimplante Ureteral por técnica antireflujo de Lich Gregoire modificada.
La técnica parece bastante sencilla, pero debe hacerse con mucha precisión y delicadeza, para no dañar estos delicados vasos y garantizar una buena irrigación y drenaje en el órgano trasplantado. El seguimiento del paciente es fundamental, ya que el equipo médico con experiencia puede anticipar las complicaciones, para su pronta resolución y control acertado con drogas y tecnología de punta.
El reconocimiento de tejidos extraños, se lleva a cabo por un grupo de células altamente especializadas, los Ly que envían señales de alerta y activación de otro grupo de células que producen potentes Citoquinas capaces de producir lisis celular. Gracias a los grandes avances en la investigación de estos complejos procesos, es posible interferir desde la señalización hasta finalmente el bloqueo a nivel celular de estas citoquinas moduladoras.
El método más práctico de clasificar a los agentes inmunosupresores, es a través de sus mecanismos de acción, pudiendo describir los siguientes agentes:
Inhibidores de calcineurina: Ciclosporina (8 mg. x Kg. Día) y Tacrolimus (0,15 a 0,30 mg. x Kg. BID), ameritan monitoreo farmacodnético.
La Cidosporina se une a la proteína Cidofilina y el Tacrolimus se une a la Proteína de Unión a FK (FKBP), estos complejos se unen a la calcineurina fos-fatasa de proteínas reguladoras nudeares, se inhibe su paso al núcleo y por ende bloquea la expresión de genes de IL-2, IL-4, IFN gamma y TNF alfa.
La expresión del Factor de Crecimiento Transformante beta se encuentra aumentada, y este factor esta involucrado en la toxiddad renal de Ciclosporina y Tacrolimus por fibrosis intersticial renal. La toxicidad no renal se manifiesta a diferentes sistemas como el gastrointestinal: aumento de transaminasas, hiperbilirrubinemia, litiasis vesicular, diarrea, nausea y vómitos; estética: hirsutismo, hiperplasia gingival; metabólicas: Dislipidemia, hipe-ruricemia, intoleranda glucosada; cardiotoxicidad. Los diferentes agentes inmunosupresores como veremos a continuación se asocian a mayor inddenda de infecciones por gérmenes comunes y oportunistas, así como neoplasias.
Análogo de purinas: Azatioprina (1 a 2mg. x Kg. Día).
Antimetabolito derivado de la 6-mercaptopurina, actúa bloqueando la replicadón genética. Tiene un perfil profiládico para el rechazo agudo, con importantes efectos adversos hematológicos, así como hepatitis, colestasis y pancreatitis entre otros.
Inhibidores de la síntesis de novo de purinas: Micofenolato Mofetil (MMF lgr. BID).
El MMF es inhibidor reversible de una enzima crítica en la síntesis de novo de purinas, la inosina monofosfato deshidrogenasa, esta droga tiene un efecto relativamente selectivo sobre los Ly. Otros efectos importantes son la prevención de angiopatía periférica crítica en el rechazo crónico, inhibe redu-tamiento de células mononudeares, inhibe la expresión de moléculas de adhesión vascular e intercelular. Todo esto se traduce en reducdón de la pérdida tardía de injerto. Los efedos adversos se resumen en hematológicos, infecdones y enfermedades linfoproliferativas.
Inhibidores de la proliferación celular dependiente de Citoquinas: Sirulimus (2mg. día).
Esta droga conocida también como Rapamidna, posee un efecto inmunosupresor muy potente. En el citoplasma se una a la FKBP, y a su vez se une a la proteína Blanco de Rapamidna, esta última es una quinasa que al ser bloqueada inhibe la proliferadón celular dependiente de Citoquinas a nivel general. Efectos deletéreos son: Dislipidemia, Tromboci-topenia, Leucopenia, Anemia, Microangiopatía trombótica, Ulceras Cutáneas y Linfoceles.
Esteroides: Prednisona, Metilprednisolona.
Los esteroides tienen dos mecanismos principales, estas drogas penetran el dtoplasma y se unen a los Receptores Esteroideos asodados a Proteínas de Shock Térmico, este complejo se disoda quedando solo el receptor junto al esferoide, se trastoca al núcleo donde se une a secuencia de ADN denominada Elementos de Respuesta a Glucocorticoides, así finalmente se inhibe la expresión de IL-1, IL.2, IL-3 E IL-6, TNF alfa, e INF gamma, bloqueando la adi-vación del Ly T y de células dendríticas. El segundo mecanismo es no específico produdendo linfopenia, inhibidón de la migradón de monolitos y otros efectos no específicos. Finalmente las complicaciones son ampliamente conocidas y comprenden: Osteonecrosis, Dislipidemia, Cataratas, Intoleranda glucosa-da, Infecdones e Hipertensión entre otros.
Anticuerpos Monoclonales: OKT3, Basiliximab y Daclizumab.
OKT3 (5mg. día por 10 días) es un anticuerpo monodonal xenogénico de origen murino, y por esta razón requiere de monitoreo en cuanto a su efedivi-dad por los anticuerpos anti-OKT3. Este anticuerpo tiene una serie de efectos adversos graves, los cuales se deben tener en cuenta y estar familiarizado con su manejo. Podemos mencionar al Síndrome de liberación de Citoquinas, el cual se manifiesta con la depledón de Ly T y la liberadón de TNF, IL-2 e INF gamma hada el torrente sanguíneo con todas las manifestadones secundarias como fiebre y escalofríos (considerar infecdón por Citomegalovirus); Edema Agudo de Pulmón no cardiogénico, Nefrotoxiddad, Meningitis Aséptica, Recidiva del Rechazo, Trombocitopenia, Trombosis y Microangiopatía. Basiliximab (20mg. en dos dosis separadas por intervalo de 4 días) y Daclizumab (lmg. / Kg. En 5 dosis a intervalos de 2 semanas), son anticuerpos monoclonales con espedficidad contra el receptor de IL-2, espedficamente hada su cadena alfa (CD25), de esta forma, estos anticuerpos bloquean a nivel del receptor celular las respuestas dependientes de IL-2, complementando el mecanismo de los inhibidores de caldneurina. Son utilizados en la profilaxis de episodios de rechazo agudo, junto con Ciclosporina y Esferoides. A diferenda del OKT3 completamente xenogénico, estos anticuerpos son de origen murino siendo diseñados actualmente por técnicas de genética lo que los hace menos inmunogénicos, gracias a la incorporación de partes de la molécula de Inmunoglobulina G humana. Finalmente estos anticuerpos tienen un perfil con menor inddenda de efectos adversos.
Anticuerpos Políclonales: Atgam y Timoglobulina.
El mecanismo básico de estos anticuerpos se ejerce a través de un efedo dtotóxico diredo y prolongado frente a diferentes marcadores de Ly T, seguida de linfopenia prolongada. Los efedos secundarios se relacionan con la introducdón de proteínas extrañas, así el receptor puede experimentar fiebre, escalofríos y artralgias, además es de resaltar trom-bocitopenia y leucopenia, además del riesgo incrementado de infecciones.
Entre los diferentes esquemas inmunosupresores resaltan la triple terapia con Ciclosporina, Prednisona y Azatioprina; la terapia cuádruple induye el uso de anticuerpos monodonales como Basiliximab o Dadizumab.
Las complicaciones post-trasplante, se pueden dividir en Quirúrgicas y Médicas como enumeraremos a continuación:
Vasculares: Trombosis de la Arteria Renal (Se debe considerar en rechazo Hiperagudo, rechazo Agudo o Acelerado irreversible), Estenosis de la Arteria Renal, Trombosis de la Vena Renal, Hemorragias (Frecuentemente relacionada con aneurismas micóticos).
Urológicas: Fuga Ureteral, Obstrucción Ureteral, Fuga vesical, Litiasis, Reflujo Vesicoureteral ().
Misceláneas: Linfocele.
Infecciosas: Dependen del grado de Inmunosupresión, aproximadamente el 80% de los parientes trasplantados evolucionan con cuadros infecciosos, y hasta un 40% de las muertes de los pacientes trasplantados se debe a complicaciones de este tipo. Durante el primer mes de post-operatorio las infecciones más frecuentes son las de herida operatoria, seguida de Infecciones Urinarias, Infecciones Asociadas a Catéteres, Neumonía, Infecciones Transmitidas con el Injerto.
Neoplásicas: El control central de esas complicaciones se canaliza a través del Registro Internacional de Tumor y Trasplante Israel Penn de Cindnnati, destacándose 1) Linfoma no Hodgkin; 2) Tráquea, Bronquios y Pulmones, 3) Riñón y Vejiga, 4) Colon, 5) Mama, 6) Cérvix, 7) Leucemia, 8) Linfoma del sistema nervioso central, 9) Próstata, 10) Sarcoma de Kaposi entre otros.
El concepto de Donante Marginal, se utilizó inicialmente para Donantes en Edades Extremas, sin embargo, al no parecer adecuado se introdujeron los términos aceptados de Donante Añoso: Mayor de 55 años, Donante Pediátrico: Menor de 5 años, quedando como categoría más amplia a los Injertos Subóptimos, la cual comprende a: Donantes en Asistolia; Arterias múltiples, lesionadas y reconstruidas en banco; Donantes VH C positivo y Riñones en herradura. Este tipo de donadores se han considerado para expandir el pool de donantes por las siguientes causas: Aumento del número de receptores añosos, Oferta de órganos insufidente, Mejores técnicas quirúrgicas, Mejores técnicas de preservación, Nueva era en Inmunosupresión.
Para el análisis adecuado de esta alternativa hay que recordar el concepto de Senescenda Renal. La Senescencia Glomerular empieza en la 3ra. década de vida, con una reducdón en el tamaño y número de nefronas de hasta el 50% a la sexta década. Otros cambios se representan en la Tasa de Filtradón Glomerular: Desdende al final de la 3ra. década de modo lineal y predecible, aprox. lml/min. por año. Disminución de la Masa Renal a predominio cortical. Vascular: Disminudón del Flujo Sanguíneo Renal. Tubular: Aumento del Tejido Fibroso Intersticial. Estos cambios se encuentran usualmente enmascarados por creatinina normal. Los donantes añosos tienen como desventaja la Incidencia Significativamente Mayor de Enfermedad Vascular Periférica, Cardiopatía Isquémica, Enfermedad Valvular, Arritmias, Insuficiencia Cardiaca, Enfermedades Respiratorias, Desordenes Gastrointestinales y Cáncer, y en el caso del receptor añoso debemos recordar los factores de riesgo cardiovascular: Enfermedad Cardiovascular Pre-trasplante, Diabetes, Tabaquismo, Hiperlipidemia, Hipertensión Arterial, Disfunción Plaquetaria, Hipoalbuminemia, Radicales libres de oxígeno, Infecciones por gérmenes como Chlamydia y Homocisteína.
Sin embargo, el consenso actual es que El Trasplante Renal en población de edad avanzada, es un procedimiento seguro y efectivo. La selección cuidadosa tanto del donante en edades extremas como del receptor añoso, más que un límite de edad, se debe usar como método para asegurar buena función del injerto y sobrevida del paciente trasplantado.
El futuro del Trasplante Renal, se centra en la biología molecular con las diferentes líneas de investigación y aplicaciones prácticas, para alcanzar la Tolerancia Inmunológica y Calidad de Vida del Enfermo Renal. Ante este reto el Urólogo Moderno esta obligado a conocer las actuales técnicas de Cirugía del Urémico Terminal, Evaluación y Selección de la pareja Donante - Receptor, Preservación de Organos - Isquemia Reperfusión, Cirugía Donante - Receptor, Endourología y Cirugía Mínimamente Invasiva, Manejo clínico Trasplante, Prevención y Manejo de Complicaciones Quirúrgicas y Complicaciones Médicas, Prevención y Manejo de Infección en Trasplante, Aspectos Médicos, Eticos y Legales de los Trasplantes incluyendo lo referente a Terapia Genética, Cultivos Titulares y Celulares, Xenotrasplante.
1. Küss R. P., Bourget P. - Una Historia Ilustrada del Trasplante de Organos. La Gran Aventura del Siglo. Sandoz Pharma, SAE Lucon; Pollina SA. 1992, 6-75.
2. Hamilton D. Kidney Transplantation: A history. 2nd Edition. London. Grune & Straton. 1984. 1- 13.
3. Carrel A. La Technique Opératoire des Anastomoses Vasculaire et la Transplantation des Visceres. Lyon Med. 1902; 98: 859-864.
4. Ullman E. Experimentalle Nierentransplantation Wien Klin Wschr 1902, 15: 281-285.
5. Starzl T. - History of Clinical Transplantation. World J. Surg. 24, 759 - 782, 2000.
6. González M., García B. - Trasplante Renal. Grupo Aula Médica. 2000. 1 - 14.
7. Groth C., Brent L., Calne R., Dausset J., Good R., Murray J., Shumway N., Schwartz R., Starzl T., Terasaki P., Thomas D., van Rood J. - Historic Landmarks in Clinical Transplantation: Conclusions from the Consensus Conference at the University of California, Los Angeles. World J. Surg. 24, 834 - 843,
2000.
8. Calne R. ART, SURGERY and TRANSPLANTATION. Williams & Wilkins Europe Ltd. 115-162.
1996.
9. Sellares V. - MANUAL DE Nefrología Clínica, Diálisis y Trasplante Renal. Harcourt Brace de España. 183 - 213. 1998.
10. Danovitch G. - Trasplante Renal. MARBÁN LIBROS, SL. 3era. Edición. 17 - 38. 2002.
11. Abbas A., Litchman A., Pober J. - INMUNOLOGÍA CELULAR Y MOLECULAR. INTERAMERIC AN A -McGRAW-HILL. 2da. Edición. 1995. 107-126.
12. Abbas A., Litchman A., Pober J. - INMUNOLOGÍA CELULAR Y MOLECULAR. INTERAMERIC AN A -McGRAW-HILL. 2da. Edición. 1995. 128-149.
13. Ley Sobre Trasplante de Organos y Materiales Anatómicos en Seres Humanos. Gaceta N° 4.497
14. Sankari B., Wyner L.; Streem S. - LIVING UNRELATED DONOR RENAL TRASPLANTATION. THE UROLOGIC CLINICS OF NORTH AMERICA. Vol. 21 - Num. 2 - May 1994. 293 - 298.
15. Biglin N., Gülay H., Arslan G., and Haberal M. -Living Unrelated or Second-Degree Related Kidney Transplantation. TRANSPLANTATION PROCEEDINGS. Vol. XXIII, N° 5.Oct. 1991. 2568-69.
16. Schulam P., Kavoussi L., Cheriff A., Averch T., Montgomery R., Moore R., Ratner L. - LAPARO-
SCOPIC LIVE DONOR NEPHRECTOMY: THE INITIAL 3 CASES. - THE JOURNAL OF UROLOGY. -Vol. 155 - 1857 - 1859. - Jun 1996.
17. Asolati Mv Denny Rv Matas A., Gillingham Kv Humar A., Gruessner Rv Sutherland Dv Ramcharan, T., Kandaswamy R. - LAPAROSCOPIC DONOR NEPHRECTOMY - WHAT'S IN IT FOR THE RECIPIENT?. - Supplement to Transplantation. Aug. 27-2002. Vol. 74, N°4. Abst. N° 2171.
18. Khauli R., Hussein M., Shaar A., Madi R., Medawar W., Habbai A., Dagher F. - A CONTROLLED PROSPECTIVE EVALUATION OF LAPAROSCOPIC DONOR NEPHRECTOMY VERSUS OPEN DONOR NEPHRECTOMY: IS OPEN NEPHRECTOMY STILL JUSTIFIED?. Supplement to Transplantation. Aug. 27- 2002. Vol. 74, N°4. Abst. N° 2172.
19. Dunkin B., Ciancio G., Burke G., Suzart K., Bailey R., Benett D., Miller J. - LAPAROSCOPIC DONOR NEPHRECTOMY: THE UNIVERSITY OF MIAMI EXPIRIENCE. Supplement to Transplantation. Aug. 27- 2002. Vol. 74, N°4. Abst. N° 2173.
20. Buell J., Potter S., Hanaway M., Alexander J., Munda R., Fidler J., Peddi V., Roy-Chaudhurry P., Cardi M., First M., Woodle E. - IMPLICATIONS OF OBESITY IN LAPAROSCOPIC NEPHRECTOMY DONORS. Supplement to Transplantation. Aug. 27- 2002. Vol. 74, N°4. Abst. N° 2174.
21. Waller J., Pattenden C., Broock N., Ridgway D., White S., Vietch P., Nicholson M. - A PROSPECTIVE RANDOMISED TRIAL OF LAPAROSCOPIC AND OPEN LIVE DONOR NEPHRECTOMY: EFFECTS ON POST-OPERATIVE RESPIRATORY FUNCTION. Supplement to Transplantation. Aug. 27-2002. Vol. 74, N°4. Abst. N° 2176.
22. Wali R., Ramey J., Blahut S., Ramos E., Drachenberg
C., Lu W., Lakkis J., Bartlett S., Anderson L., Weir M., Jacobs S. - RACIAL DIFFERENCES IN LAPAROSCOPIC HARVESTED LIVING-DONOR KIDNEY TRANSPLANTATION IN THE ERA OF TRIPLE INMUNOSUPPRESSION WITH TACROLIMUS
MYCOPHNOLATE MOFETIL AND STEROIDS. Supplement to Transplantation. Aug. 27- 2002. Vol. 74, N°4. Abst. N° 2177.
23. Ahlawat R. - LAPAROSCOPIC LIVE DONOR NEPHRECTOMY AND CONVENTIONAL OPEN DONOR NEPHRECTOMY: RECIPIENT OUTCOME ANALYSIS. Supplement to Transplantation. Aug. 27- 2002. Vol. 74, N°4. Abst. N° 2178.
24. Nicholson M., Waller J., Elwell R., White S., Veitch P.
- A PROSPECTIVE COMPARISON OF OPEN AND LAPAROSCOPIC LIVE DONOR NEPHRECTOMY. Supplement to Transplantation. Aug. 27- 2002. Vol. 74, N°4. Abst. N° 2179
25. Oyen O., Line P., Pfeffer P., Jorgensen P., Brekke I. -LAPAROSCOPIC LIVING DONOR NEPHRECTOMY: SIMPLIFIED HAND-ASSISTED TECHNIQUE (WITHOUT HANDPORT). Supplement to Transplantation. Aug. 27- 2002. Vol. 74, N°4. Abst. N° 2175.
26. Rajab A., Henry M., Elkhammas E., Bumgardner G., Davies E., Ferguson R., Pelletier R. - HAND ASSISTED LAPAROSCOPIC RIGTH DONOR NEPHRECTOMY. Supplement to Transplantation. Aug. 27- 2002. Vol. 74, N°4. Abst. N° 2180.
27. Rajab A., Henry M., Elkhammas E., Bumgardner G., Davies E., Ferguson R., Pelletier R. - PROSPECTIVE COMPARISON OF HAND-ASSISTED LAPAROSCOPIC VERSUS OPEN LIVING DONOR NEPHRECTOMY. Supplement to Transplantation. Aug. 27- 2002. Vol. 74, N°4. Abst. N° 2181.
28. Suzuki K., Ushiyama T., Ishikawa A., Mugiya S., Fujita K. - RETROPERTTONEOSCOPY ASSISTED LIVE DONOR NEPHRECTOMY : THE INITIAL 2 CASES. - THE JOURNAL OF UROLOGY. Vol. 158 -1353-1356. Oct. 1997.
29. Ayvazian P., Khauli R., Chow G., Ratner L., Kavoussi L. - Open versus laparoscopic donor nephrectomy. Contemporary UROLOGY. May 2001. Vol. 13 N°5. -94-108.
Dr. Ivo Rodríguez * Oncólogo-Radioterapeuta
Servicio de Radioterapia Hospital Privado Centro Médico de Caracas
En la edición anterior de Tópicos en Urología, describimos en un capítulo las consideraciones básicas de la Braquiterapia en Próstata, tema en boga en el tratamiento del Carcinoma de próstata, en la actual edición cubriremos el área de Cáncer de Vejiga y del Pene, donde la Braquiterapia o Curieterapia, como la denominan los europeos tiene un campo definido en indicaciones y resultados como tratamiento único o combinado, con las otras ramas terapéuticas oncológicas como son la cirugía, la quimioterapia, la radioterapia externa y la inmunoterapia.
Como lo indicamos en dicha edición, existen varios tipos de implantes de semillas radioactivas, de acuerda al sitio, intersticiales, intraluminales o intra-cavitarias, de alta, mediana y baja tasa de dosis según la rata de aplicación de la dosis, pre o post cargadas, para lo cual lo invitamos a leer el capítulo de Braquiterapia de Próstata, en el libro de tópicos en Urología.
El Cáncer de vejiga, ocurre especialmente después de la quinta década, más en hombres que mujeres, está relacionado al hábito de fumar, a algunos tipo de trabajo con exposi dón a ciertos produdos químicos, a procesos de irritadón crónica por patología parasitaria o de cálculos vesicales. La anatomía patológica determina que el tipo más frecuente de tumor es del tipo de células Transicionales, con grados de diferenciación, luego el Carcinoma Epidermoide, cuya etiología es el proceso irritativo crónico y por último los del tipo Adenocarcinoma, los cuales crecen del resto de la mucosa del uraco.
El crecimiento del tumor puede ser superficial, de forma plana, los cuales generalmente son múltiples,
o en tipo polipoide, el cual puede llegar a ser invasivo. Este factor, la invasión de las capas musculares de la vejiga, determina fundamentalmente la dasifi-cadón de la variante T, de tumor, y por ende modifica la clasificadón por estadios, ya que veremos que esta profundidad de invasión, más el grado de diferendación y la positividad o no del componente ganglionar son los fadores más importantes para determinar las posibilidades de control local, sobrevida libre de enfermedad y sobrevida global, además de ser fundamentales para la planificación del proceso terapéutico, sus indicaciones, sus posibles combinadones y resultados.
La determinación de varios factores para la dasi-ficación y la escogencia del esquema terapéutico adecuado conllevan a la realización de procedimientos diagnósticos como son Citoscopia, Citología Urinaria, Tacto bajo anestesia o sedación durante la citoscopia, Tomografía Axial Computada o Resonanda Magnética de Pelvis y Abdomen, Rx de Tórax, y en los actuales momentos se evalúa los beneficios del CT-PET en determinar la extensión y posible existencia de enfermedad extravesical.
Indicaciones y Contraindicaciones de la Braquiterapia
Indicaciones:
1. Tumores solitarios TI - T2.
2. Tumores de menos de 5 Cms.
Con traíndícacíones:
1. Tumores que invaden el cuello vesical.
2. Tumores que llegan a la grasa peri - vesical (T3).
3. Compromiso vesical multifocal.
4. Compromiso de ganglios linfáticos.
Técnicas de la Braquiterapia en Vejiga
La definidón del área a tratar es importante en braquiterapia, se define en Vejiga como el área de tumor, con un margen no menor de 1 cms, se debe irradiar todo el espesor de la pared vesical, en caso de ser implante posterior a dstedomia parcial se debe realizar comprometiendo toda la cicatriz con un
1 cms. de margen.
El implante se realiza en pabellón, con el paciente bajo anestesia, con un equipo conformado por el Urólogo, el Radioterapeuta y el Físico, además de otro personal médico y paramédico de un quirófano, se realiza como implante solo o posterior a cistecto-mia parcial, se pueden describir varias técnicas, las más usadas son las conocidas como de tubos plásticos los cuales pueden ser abiertos por los dos extremos, se utilizan en técnicas de carga manual o cerrados por un extremo los cuales se utilizan con las técnicas de equipos de carga por control remoto.
Las dosis a aplicar dependen de algunos factores, en primer lugar de la técnica quirúrgica realizada, luego de una cistectomia parcial, la dosis requerida es menor, a si solo se implanta posterior a una resección trans-uretral, igualmente está relacionada a la dosis pre - operatoria de Radioterapia Externa, si se utilizaron dosis bajas de 1.000 a 1.200 cGy., por tratar de tumores TI y de bajo grado, o de dosis a pelvis de 4.000 a 4.500 cGy., las cuales se usan en tumores de tipo T2 y/o de moderado o alto grado, en los primeros las dosis de Braquiterapia de tipo LDR (baja tasa de dosis) debe llegar a 6.000 a 6.500 cGy., en los que recibieron dosis altas a pelvis, el implante debe llegar a 2.500 a 3.000 cGy. Como Boost o refuerzo.
Como se ha dicho el procedimiento se lleva a cabo en pabellón, por el equipo multidisdplinario, luego el padente entra en los cuidados post implante o post cistectomia parcial, se debe dejar al padente con un foley o citostomia temporal, es importante que solo luego de 5 a 6 días post procedimiento quirúrgico, es que el paciente se le hará la planificadón y colocación de las cargas radioactivas, hacerlo antes aumentará la tasa de complicadones, el tiempo total varía con la dosis a alcanzar y puede ir de 24 a 120 horas con las cargas cuando se trata de implantes de baja tasa de dosis.
Los más reconocidos reportes de braquiterapia en Cáncer de Vejiga, se debe al grupo de Rotterdam, quienes dieron cifras de control local de 91 % para los TI, 84 % para los T2a y de 72 % para los T2b., en las series globales los parientes con TI, tiene sobrevida a los 5 años de 70 a 90 %, y a los 10 años de 72 a 78 %.
Los pacientes con tumores T2a, tienen sobrevidas de 51 a 66 %, y de 34 a 37 % a los 5 y 10 años respectivamente. Los casos con tumores T2b tiene cifras de sobrevida entre 34 a 70 % a los 5 años y recurrencias locales de hasta 15 a 28 %.
La sobrevida lograda con cirugía local más braquiterapia en casos con invasión muscular ha sido de hasta 52 a 70 % de los casos, lo cual es comparable con cistedomia radical, y superior a radioterapia externa sola.
Las complicadones son las propias de una cirugía parcial de vejiga, con ligeros aumentos por los días a pasar con las cargas radioactivas, el uso de las técnicas de tubos plásticos, ha disminuido la incidencia de fístulas y otras complicaciones que se reportaban con la técnicas de cargas directas. Las complicaciones se disminuyen si las cargas se hacen 5 días luego del implante, y si las dosis y dosimetría son las corredas. La cistitis, hematurias son normales post implante y temporales, en las series entre el 88 a 96 % de los parientes quedan con vejigas funcionales.
El cáncer de pene no es frecuente en los países occidentales, representa menos del 1 % de todos los casos de cáncer en hombres, está relacionado a virus de papiloma humano, a problemas de aseo local, fimosis. La variedad histológica más frecuente, superior al 90 % de los casos es el Carcinoma Epidermoide, otras presentaciones son el Carcinoma de Células Basales, el Melanoma Maligno y el Sarcoma. Existen variedades pre-malignas que pueden preceder al carcinoma invasivo, tales como Enfermedad de Bowen, eritroplasia de Queyrat, Sarcoma de Kaposi y Leucoplasia. Un paciente con Ca de pene debe ser estudiado para completar su estadificación con los siguientes estudios: Biopsia, Uretrocitoscopia, Ultrasonido, Tomografía de Abdomen y Pelvis, o Resonancia Magnética, si existe sospecha de nodulos linfáticos se recomienda biopsia aspiración por aguja fina, para descartar enfermedad a distancia: Rx de Tórax, Eco hepático y Gammagrama Oseo. Completados los estudios, se procede a clasificar por estadios por el esquema de la U.I.C.C., o por el sistema de Clasificación de Jackson, donde se indica la braquiterapia solo para los estadios I.
La indicación formal para tratamiento solo con braquiterapia es tumor de meno de 4 cms., que esté limitado al glande y que no sobrepase el surco balano prepucial. Si el tumor es mayor de 4 cms., y sobrepasa el glande el tratamiento es el quirúrgico con procedimiento de amputación parcial o total.
BIBLIOGRAFÍA
Indicaciones y Contraindicaciones
En algunos casos el tratamiento puede ser una combinación de Radioterapia externa y el boost o refuerzo con braquiterapia, cuando el paciente se rehúse a la posibilidad de cirugía. El manejo de los ganglios debe ser discutido en el equipo, puede ser de tipo cirugía o con radioterapia externa.
Técnica
Las técnicas de tratamiento incluyen el sistema de contactoterapia, para lesiones muy superficiales, técnica de tipo intersticial con el método clásico o con el método de aplicador de Gerbaulet. El volumen a tratar conlleva el volumen total del tumor, más un margen de no menos de 1 cms., se recomienda realizar una circuncisión previo al implante.
Dosimetria
La dosis a aplicar con baja tasa de dosis, es de aproximadamente 6.500 cGy., aplicadas a una rata de 40 cGy por hora, para un promedio de 6 a 7 días, el volumen es de aproximadamente 50 cc., Las dosis a uretra se debe considerar para evitar poblemos urinarios posteriores. Para técnica con alta tasa de dosis se ha propuesto dosis de 3.600 a 5.400 cGy con fracciones y tiempo total variable.
Resultados
Para braquiterapia las series han sido revisadas, en más de 500 pacientes de TI o T2, tratados con tasa de dosis baja, se han obtenido resultados de sobrevida total de 70 % a los 5 años, control local de 80 a 85 %, el pene ha sido conservado en más de 75 % de los casos.
Complicaciones
Infecciones, uretritis, necrosis, estenosis, y posible reducción del tamaño por fibrosis.
En resumen la braquiterapia es una opción de tratamiento para la preservación del pene en caso de carcinoma epidermoides bien seleccionados.
1. Deneve W., Lybeert M.L., Goor C, y colbs.: TI and T2 carcinoma of the urinary bladder: long term results with external, preoperative or intersticial radiotherapy. Int J Rad Oncol Biol Phys 23: 299 - 304, 1992.
2. Grossman H.B., Sandler H.M., Perez-Tamayo C.: Treatment of T3a bladder cancer with iridium implantation. Urology 41 : 217 - 220, 1993.
3. Mazeron j.J., Crook J., Chopin D.: Conservative treatment of bladder carcinoma by partial Cystectomy and intersticial iridium 192. Int J Rad Oncol Biol Phys 15: 1323- 30, 1988.
4. Rozan R., Albuisson E., Donnarieux D.,y colbs.: Intersticial iridium -192 for bladder cáncer, a multi-centric survey: 205 patients. Int J Rad Oncol Biol Phys 24: 469 - 477,1992.
5. Van der Werf-Messing B.H.P, Van Puten W.L.: Carcinoma of the urinary Bladder category T2, T3, Nx, M0 treated by external irradiation followed by Ceasium 137 implant at reduced dose. Int J Rad Oncol Biol Phys 16: 369-371, 1989.
6. Clifford Chao K.D., Perez C.A.: en Perez C.A., Brady L.W.: Priciples and Practice of Radiation Oncology. 3ra Edición, 1717-1731, Saunders-Lippincott,1997.
7. Delanes M., Malavaud V.,Douchez J., Iridium-192 intersticial radiotherapy therapy for squamous cell carcinoma of the penis. Int J Rad Oncol Biol Phys 10: 1891- 1895, 1984
8. Succhaud J.P, Kantor G., Richaud P.: Brachytherapy of the cancer of the penis. Analysis of a series of 53 cases. J. Urol 95: 27-31, 1989.
Dr. Julio César Potenziani Bigelli
Especialista urólogo Hospital Privado Centro Médico de Caracas
Br. Silvia Daniela Potenziani Pradella Estudiante de Medicina UCV.. Escuela Luis Razetti.
SÍNDROME DE HIPERPRESIÓN URETRA PROSTÁTICA
La presente monografía tiene como objetivos presentar la revisión en la literatura médica de una condición urológica que se ha denominado síndrome de hiperpresión uretra prostética en el varón joven SHUP (de 15 a 50 años), el cual está formado por dos componentes que son la disfunción del cuello vesical (disdnergia del esfínter interno-lisoesfínter) con una falla en la coordinadón que debería existir entre la contracción del detrusor al momento del expulsivo urinario y la relajación o apertura del cuello vesical para garantizar la salida de orina de la vejiga. Al no producirse éstos eventos, el padente tendrá una obstrucdón fundonal a la salida de orina de la vejiga.
El segundo componente del síndrome es la disfundón del piso pélvico muscular (hipertonía con o sin mialgia), es dedr una relajación disfundonal de dicha musculatura al momento del expulsivo urinario, con lo cual se dificultaría la salida de orina de manera expedita de la uretra prostática hacia el exterior.
Como condidón prioritaria se deberá tener un paciente sin patología neurológica alguna y con ciertas caraderísticas conductuales que las traiga desde su infancia; caraderísticas conductuales que podrían corresponder a personalidad tipo A, es decir, personas ansiosas, tensas, obsesivas y con repercusiones emodonales en varios órganos-sistemas del organismo (psicosomatismo) y que han sido equívocamente tratados a lo largo de su historia dínica debido a la carencia de diagnostico predso y definitivo. Indusive son parientes que han sido llevados a consulta médica urológica por dificultades urinarias, infecciones urinarias a repetición en la infancia, o en la adolescencia, por enuresis, por incontinencia urinaria o por haber sido niños retendonistas urinarios.
En la casuística del Dr. Potenziani J.C., han existido aproximadamente 70 casos de hombres entre 15 y
50 años, que han presentado ésta combinadón de hallazgos, con trastornos de la abertura del cuello vesical acompañado por trastornos de hipertonía o falta de relajación de la musculatura del piso pélvico, ocasionándose toda una gama de síntomas urinarios tanto de vaciamiento como de llenamiento vesical.
Combs (2005) y Donahue (2005) refieren en sendos artículos del Journal de urología de Enero 2005, que la disfunción primaria del cuello vesical con problemas en la relajación del piso pélvico muscular es una entidad inadvertida en la población infanto-juvenil que se deberá pensar más a menudo en jóvenes con sintomatología urinaria que no cede con facilidad y que sobre todo no se acompaña de hallazgos orgánicos usuales en las vías urinarias bajas.
Es un síndrome que no deberá ser confundido con la disdnergia detruso-esfinteriana externa (rabdoesfinter) usualmente de origen neurológico y ocasionado por diversas patologías.
El tratamiento del SHUP deberá adaptarse a las condiciones de cada paciente, al tipo de sintomatología que presenta, al tipo de repercusiones secundarias, al tipo de personalidad, a los tratamientos anteriormente recibidos y al grado de afectación sobre su calidad de vida al momento de la consulta médica.
La secuencia terapéutica que se recomienda en éstos pacientes comienza con tratamiento farmacológico (medicamentos alfa-1 bloqueantes adrener-gicos), terapia de tipo condudual (cambios en el comportamiento del paciente en relación a sus vías urinarias), Biofeedback para que el paciente "aprehenda" a relajar la musculatura del piso pélvico muscular y con ello eliminar uno de los dos fadores que ocasionan el síndrome, pero además la terapia condudual ayudará también a prevenir las perdidas urinarias, contrayendo voluntariamente los músculos del piso pélvico muscular y ser él quien comande a la vejiga y no lo contrario, a aumentar gradualmente la capacidad vesical (al aumentar su distensibilidad) y con ello disminuir la frecuencia y la urgencia urinaria, a disminuir la frecuencia urinaria, a mejorar la calidad de vida del padente, a tener plena conciencia de sus problemas urinarios y comprender que su aditud cambiará positivamente su calidad de vida urinaria y por ultimo a coordinar mejor su acto volitivo de la micción.
Esta condición es también denominada micciones disfuncionales con alta presión o disfunción primaria del cuello vesical (Donahue 2005), (Combs 1998,
1999, 2005), (Kaplan 1994,1996), (Trockman 1996), (Norgaard 1984), (Yang 2002), (Blaivas 1984), (Kaneko 1980), (Mayo 1982).
Hace 36 años Turner-Warwick comenzó a estudiar las disfunciones del cuello vesical en pacientes urológicos pero fue el año 1973 cuando en compañía de Whiteside revisaron y publicaron mas de 6.000 pacientes con micciones disfuncionales en su laboratorio de clínica urodinámica en el Hospital Middlesex de Londres y tomando todos los aspectos diagnósticos en un paciente con obstrucción de la salida vesical llegaron a conclusiones tan interesantes que, existen muchos puntos en común con los pacientes que en éste momento se están presentando y se ha denominado Síndrome de Hiperpresión de la uretra prostética (SHUP).
Autores como Webster (1980), Kaplan (1994,1994, 1996,1997), Yalla (1981,1981), Appel, 2000), Ikeguchi (2000), Gosling (1979), Mayo (1982) Crowe (1995), Bates (1975), Norlen (1986), Blaivas (1994, 1998) y Wein (1979, 1979), (Moon, 1997) entre otros han hablado de ésta condición muy frecuente en la vida diaria y muy poco conocida por la mayoría de los urólogos del mundo entero, exceptuando aquellos que han tenido que trabajar en áreas uroneurológicas.
Es una condición cuya fisiopatología todavía no está totalmente entendida a pesar que existen teorías bastante lógicas para su explicación, pero no hay la menor duda que es una entidad totalmente aparte de lo que la mayoría de los urólogos conocen como disdnergia vesico-esfinteriana externa que se refiere a la incoordinación detruso o vesico-esfinteriana externa (es decir la falta de coordinación entre la con-tracdón enérgica del músculo detrusor y la relajación y apertura de las fibras del rabdoesfinter (esfínter distal en el hombre) o esfínter voluntario al momento de tener que vaciar la orina (fase expulsiva) y también en la fase de almacenamiento urinario donde los eventos se invierten pero siempre de manera coordinada.
La disdnergia o disfundón del cuello vesical (lisoesfínter) es considerado un verdadero dilema diagnostico a pesar de que en nuestra casuística la sospecha dínica, la clínica del padente, el residuo urinario, la videoendoscopia, así como el estudio urodinamico sencillo y complejo podrían llevarnos al diagnostico, como veremos mas adelante.
Los estudios de flujo-presión así como la videourodinamica propordonarán la evidencia del comportamiento anómalo del cuello vesical al no abrirse satisfactoriamente, como se también se podría evidenciar por estudios radiológicos tipo dstouretro-grafía micdonal. Pero por sobre todos los argumentos anteriores la mejoría del cuadro dínico en todos sus aspedos con la administradón de fármacos alfa-
1 bloqueantes adrenergicos (argumento diagnóstico-terapéutico) darán el espaldarazo de confianza en el diagnostico
El estudio de la casuística personal del Dr. J.C. Potenziani (50 parientes en 23 años) que mostraron la combinación de disfunción del cuello vesical (lisoesfínter) con aperturas incompletas o al momento de la contracción del detrusor concomitante con la existencia de hiperadividad-hipercontradilidad o falta de adecuada relajación al momento del expulsivo urinario, del piso pélvico muscular, de diversas etiologías sobre todo la de tipo emocional-psicosomática o por hábitos conductuales, muchas veces aprehendidos desde la etapa infantil, de tipo retendonista que llevan con el tiempo a crear un patrón de relajación muscular ineficaz al momento que se está pro-dudendo la fase miccional urinaria(vaciamiento o expulsivo urinario).
TODO ESTO CREARÁ UNA HIPERPRESIÓN EN LA URETRA PROSTÁTICA QUE SE HA DENOMINADO SÍNDROME HIPERPRESIÓN URETRA PROSTÁTICA (S.H.U.P.) YA QUE DICHA URETRA QUEDARÁ ENTRE DOS ZONAS QUE FUNCIONALMENTE ESTÁN FALLANDO, A SABER: PRÓXIMALMENTE ESTÁ PRESENTE UN CUELLO VESICAL QUE NO SE RELAJA ADECUADAMENTE CREANDO NO SOLO PRESIÓN MICCIONAL ELEVADA EN VEJIGA SINO QUE TAMBIÉN AYUDARÁ CON SU APERTURA PARCIAL E INTERMITENTE A CREAR UNA BARRERA PROXIMAL Y LA NO RELAJACIÓN DEL PISO PÉLVICO MUSCULAR AL MOMENTO DE LA MICCIÓN SE CONVERTIRÁ EN LA BARRERA DISTAL URETRAL PROSTÁTICA A NIVEL DEL APEX PROSTÁTICO CON LO QUE SE CIERRA DICHO COMPARTIMIENTO (uretra prostética) Y SE ELEVARÁN LAS PRESIONES AL MOMENTO DE LA MICCIÓN (fase expulsiva) AUMENTANDO LA APARICIÓN DE REFLUJO URINARIO A LOS CONDUCTOS EYACULADORES, CON LA POSIBLE APARICIÓN
DE PROSTATITIS, VESICULITIS SEMINAL, DEFERENTI-TIS, EPIDIDIMITIS, ORQUITIS Y LAS CONSECUENCIAS QUE SOBRE LA ESFERA DE LA FERTILIDAD PODRÍAN TENER (inflamadones crónicas de vías seminales, con el deterioro de la calidad del espermograma) ASÍ COMO REPERCUSIONES EN EL ÁREA SEXUAL (por las inflamaciones seminales antes mendonadas) COMO EYACULACIÓN PRECOZ, DISFUNCIÓN ERÉCTIL DE VARIOS GRADOS Y DISMINUCIÓN DE LA LÍBIDO.
Donohoe (2005) en el Journal de Urología, revisa 34 parientes sintomáticos urinarios, con disfunción primaria del cuello vesical en niños y adolescentes y su tratamiento con fármacos alfa-1 bloqueantes adrenergicos, refiriendo que ha sido pocas veces reportado en la población pediátrica, caracterizándose por una constelación de hallazgos a nivel del cuello vesical descubiertos por videourodinamica, electromíografía y clínica.
Hace mas de 30 años atrás la obstrucción del cuello vesical era considerada mas orgánica que funcional, al punto que se creía debida a un exceso de tejido fibroso en el cuello vesical, que se ha demostrado equivocado luego de extensos estudio histológicos (Norlen 1986)-(Blaivas 1994,1998).
Otros investigadores han mencionado el factor de exceso de terminaciones aferentes simpáticas en el cuello vesical y Crowe (1995) demostró la presencia del neuropeptido Y (NPY) en la zona del cuello vesical lo que aumentaría el influjo simpático "ocluyente" de la zona de la salida vesical con las consecuencias ya mencionadas. Sin embargo existe una duda y es que muchos pacientes con disfunción del cuello vesical no responden siempre a los alfa-1 bloqueantes adrenergicos. La pregunta podría ser: ¿existirán otros mediadores neuroquímicos en la zona?
Otra teoría etiológica es la que habla a favor del psicosomatismo como determinante del mal funcionamiento del cuello vesical (personalidades tipo A), usualmente personas aprensivas, nerviosas, con temperamento perfeccionista, luchador. Esto podría estar unido no sólo a aspectos de repercusiones emo-cionales-angustia-stress sobre la normal coordinación detrusor-cuello vesical sino a aspectos también de malos hábitos de vaciamiento urinario que se "aprehenden" desde la infancia con la consecuencia de una relajación inadecuada del piso pélvico muscular, como son la disfunción del cuello vesical, la disfunción del piso pélvico muscular, los hábitos reten-cionistas urinarios, los hábitos de hipercontractilidad del piso pélvico para retardar el momento de la micción, el Síndrome de Hinman (1974, 1986) en la infancia (vejiga neurogenica no neurogenica) entre otros. De hecho en la infancia menciona Ikeguchi (2000) podría ser debido a una respuesta negativa a ciertas sensaciones asociadas al acto de la micción como por ejemplo dolor.
Esto es una parte fundamental en el síndrome de hiperpresión del compartimiento uretral posterior, ya que la falta de relajación del piso pélvico muscular es el sustrato fisiopatologico del segundo componente obstructivo del síndrome, ya que estrecha u ocluye el segmento distal de la uretra prostática (apex) impidiendo un vaciamiento urinario expedito, así como también impidiendo un normal "desalojo"o expulsión de las secreciones intraprostaticas con las consecuencias inflamatorias de la misma a corto, mediano o largo plazo.
Diokno (1979) describe la obstrucción neurogenica a nivel del esfínter liso muscular como causada por una inapropiada actividad de los receptores adrenergicos localizados en la zona del cuello vesical. Refiere que se que con inusitada frecuencia en para-pléjicos, cuadripléjicos con vejigas hiperreflexica con coordinación de esfínteres y en vejigas hipoactivas o hiporeflexicas con denervasdón esfinteriana. Esto es en el caso de pacientes neurologicamente afectados pero en parientes neurologicamente intactos o sanos se presentan usualmente con síntomas semejantes a los síntomas de afecciones prostáticas y es éste último el caso que nos atañe.
Según Hald y Bradley (1982) hay básicamente 2 teorías para ésta condición. Una primera teoría que se refiere a un arreglo anómalo de la musculatura a nivel del cuello vesical causando un estrechamiento del cuello vesical cuando la vejiga se contrae para vaciar la orina. La segunda teoría es un aumento anormal del tono en el esfínter pre-prostático debido a una hiperactividad alfa simpática. Refieren que cuando la condición se une a un crecimiento prostáti-co asintomático o no, se habla de próstata atrapada o "trapped prostate" (Turner-Warwick 1969).
Siegel en el meeting de la AUA de 1986 mencionó la disfundón miccional que ocurría por un desarreglo funcional de la coordinación refleja de la vejiga, esfínter interno-liso, esfínter externo-rabdoesfinter y piso pélvico muscular, lo cual se podría aplicar al síndrome que se está describiendo.
En la disdnergia del esfínter liso (lisoesfínter) o esfínter del cuello vesical o también llamado obstrucción primaria del cuello vesical o como lo llama Webster (1980) "disfunción del cuello vesical" o Woodside (1980) que denomina ésta condición como obstrucción disfundonal del cuello vesical, lo que sucede es que usualmente al momento del vatiamiento (fase expulsiva urinaria).
EL CUELLO VESICAL NO SE APLANA (desciende) Y POR ENDE NO PERMITE EL PASO FÁCIL DE LA ORINA HACIA LA URETRA PROSTÁTICA PROXIMAL Y DE HECHO HACIA EL RESTO DE LA URETRA PARA SALIR AL EXTERIOR Y EL NO APLANARSE NO SUCEDE DE MANERA TOTAL YA QUE EN LA PRÁCTICA EL CUELLO HACE INTENTOS POR APLANARSE Y ABRIRSE Y LO HACE DE MANERA INTERMITENTE Y ESTO QUEDA FIELMENTE REFLEJADO EN LA MORFOLOGÍA FLUJOMÉTRIC A Y SOBRE TODO Y ESTO SE UNE MUY FRECUENTEMENTE CON VOLÚMENES IMPORTANTES DE ORINA RESIDUAL CON LAS CONSECUENCIAS INFECCIOSAS LÓGICAS QUE TODOS CONOCEMOS Y ADEMÁS SE ACOMPAÑA TAMBIÉN DE GRADOS DIVERSOS DE DISFUNCIONALIDAD DEL PISO PÉLVICO MUSCULAR EVIDENCIADOS POR POTENCIALES DE EVOCACIÓN AL MOMENTO DE LA MICCIÓN Y POR BIOFEEDBACK A TRAVÉS DE SOFWARE QUE PERMITEN SU INSCRIPCIÓN EN PANTALLA.
ESTO TAMBIÉN PODRÍA UNIRSE A GRADOS MUY LEVES Y VARIABLES DE INCOORDINACIÓN CON EL RABOESFINTER POR SU CORRELACIÓN CLÍNICA-FUNCIONAL CON EL PISO PÉLVICO Y COMPARTIR EL ESTADO HIPERACTIVO O HIPERCONTRACTIL, LO CUAL FAVORECERÍA LA HIPERPRESIÓN EN LA URETRA PROSTÁTICA CON TODOS LOS SECUNDARISMOS QUE MENCIONAREMOS.
Describimos en el S.H.U.P. la mezcla de disfunción del cuello vesical (lisoesfínter) con aperturas incompletas o disdnergicas en relación a la contracción miccional del detrusor con hiperactividad-espasticidad del piso pélvico muscular de diversas etiologías sobre todo la de tipo emodonal-psico-somática por mala técnica de relajación muscular del piso pélvico al momento del vadamiento urinario o por hábitos conduduales de tipo retencionista que llevan con el tiempo a crear un patrón de relajadón muscular ineficaz al momento que están en la fase miccional urinaria.
Se crea entonces un aumento de la presión en la uretra prostática (compartimiento uretral posterior) puesto que la presión aumentará o quedará "atrapada" entre dos áreas que no funcionan adecuadamente, la primera el cuello vesical (lisoesfínter) que no se logra relajar (abrir) adecuadamente y sinergica-mente al momento del expulsivo urinario y el apex o punta de la próstata que descansa sobre la musculatura del piso pélvico, la cual por problemas de aprendizaje o de comportamiento(hábitos) del padente unido a psicosomatismo con asiento en el piso pélvico que no se relaja adecuadamente también al momento del expulsivo urinario creando entonces un área (compartimiento uretral posterior) con presiones miccionales elevadas que desencadenarán toda la sintomatología que éste síndrome o condición posee y todos los secundarismos que se podrían pro-dudr, ya que al aumentarse las presiones en la uretra prostática habrá reflujo urinario por los conductos eyaculadores con la posible aparición de prostatitis, vesiculitis seminal, deferentitis, epididimitis, orquitis y las consecuendas que dichas inflamaciones producirán en el área de la fertilidad (deterioro de la calidad seminal), y la aparición de trastornos de la esfera sexual (eyaculadón precoz, disfunción eréctil de grados diversos, y disminución de la libido, aparte de molestias dolorosas en el área hipogástrica, perineal, genital, lumbar baja y urinaria.
Aspectos como antecedentes urinarios, inclusive desde la infancia, la sintomatología que en numerosos casos por no decir en la mayoría conduce al urólogo a diagnósticos no totalmente correctos, ya que posiblemente esté diagnosticando un secun-darismo del síndrome y no el problema en sí.
El padente podría tener síntomas de vadamiento urinario y síntomas de llenamiento urinario lo cual abre un vasto panorama diagnostico.
Hallazgos endoscópicos urinarios sobre todo de la salida vesical y del interior de la vejiga, podrían también confundir al urólogo puesto que dependerá en qué momento de la vida del padente (en relación a su edad y evoludón del caso clínico) logra ser examinado y diagnosticado por su médico. No es lo mismo examinar y estudiar a un padente a los 20, 30 años que a los 40, 50 años, ya que la patología o condición de su cuello vesical habrá tenido más tiempo para ocasionar secundarismos que podrían ser no vistos en el pacientes de los 20, 30 años, como si podrían verse en pacientes de más edad.
Los hallazgos radiográficos y ecográficos son controversiales ya que dependerá del tiempo de duración del S.H.U.P., las repercusiones orgánico-fundonales en los órganos del sistema urinario.
Hald-Bradley (1982) describen la obstrucción funcional del cuello vesical como mas frecuente que la orgánica y refieren que no debe ser confundida con el diagnostico de discinergia vesico esfinteriana externa y que un terdo de los parientes de 30 a 50 años, se quejan de síntomas de prostatitis, 10% de cistitis o epididimitis pero la mayoría de los pacientes tendrán quejas de chorro débil, frecuencia y urgencia urinaria de larga data.
Según Chapple y Turner Warwick (1994) definen la obstrucción del cuello vesical como los grados variables de fracaso del cuello vesical en abrirse normalmente cuando asociadamente exista una contracción del músculo detrusor en la fase miccional o expulsiva.
Refieren que Gosling (1979) demostró que la inervación del cuello vesical y de las vesículas seminales en los hombres es adrenergico mientras que en las mujeres es colinergico. Las fibras musculares lisas de la parte distal del cuello vesical son distintas morfológicamente de las fibras del detrusor, mas pequeñas, agrupadas en pequeños hace musculares y separados por mucho colágeno a diferencia de lo que sucede en el propio músculo detrusor. Se derivan de la cápsula prostática y evitan la eyaculadón retrograda al momento de la eyaculación. Esta diferencia orgánica-funcional en relación al hombre podría explicar por qué la difunción del cuello se ve en hombres casi mayormente que en las mujeres. Casi nunca sucede como parte de un problema neurológico oculto. También refieren que raramente el comportamiento característico de un cuello vesical cambia con el tiempo. Son comportamientos que se arrastran desde la infancia hasta la adultez (agravándose con la edad).
La presentación clínica de los pacientes con cuellos vesicales discinergicos son lento comienzo miccional, chorro delgado y lento, y goteo terminal. Refieren que su chorro urinario ha sido siempre diferente a los demás (más lento, más delgado y menos vigoroso), sobre todo cuando se comparan con amigos en momentos de ir juntos a orinar.
CHAPPLE (1994) REFIERE QUE DICHOS TRASTORNOS NO DEBERÁN SER ATRIBUIDOS A TRASTORNOS FUNCIONALES HASTA TANTO NO HAYAMOS DESCARTADO CAUSAS O CONDICIONES ORGÁNICAS EVIDENTES.
Muchas veces todo comienza con una retención de orina o una imposibilidad de cateterizar fácilmente un paciente joven después de un acto quirúrgico de cualquier naturaleza.
Chapple (1994) menciona que el cuello vesical puede no abrirse satisfactoriamente en varias circunstancias como detrusor hipocontradil o acon-tractil, imposibilidad por parte del paciente de iniciar una contracción del detrusor lo cual repercutirá en que el cuello no se relajará, por ende no se abrirá; también menciona que una contracción vesical no sostenida adecuadamente resultará en un cierre precoz del cuello vesical, el cual inidalmente se había comportado estupendamente bien. También cuando hay contracciones del detrusor de baja presión habrá aperturas del cuello vesical bizarras y anormales. Otra ocasión que el cuello vesical no se relaja bien es cuando existen antecedentes quirúrgicos sobre el cuello vesical. En las mujeres sucede directamente relacionado con afecdones neurológicas.
En reladón a los hallazgos urodinámicos es indispensable como también lo decía Turner-Warwick (1973) pensar en el diagnostico, de lo contrario podría suceder que jamás podamos llegar a una conclusión dínica acertada, con las consiguientes repercusiones en la calidad de vida del paciente afedado y la frustración no sólo del padente sino del médico(s) responsable del caso, ya que no logra dar con el diagnóstico preciso y esto se traduce en tratamientos ineficaces, en esperanzas de curadón truncadas para el padente y en repercusiones anímicas de diversos grados que deberán alertarnos sobre la importancia de no sólo llegar al diagnostico, sino de hacerlo de manera rápida, ya que podríamos también tener repercusiones orgánico-funcionales irreversibles.
La típica manera de presentadón es con un hombre joven (15-50 años) (Moon, 1997), inclusive en ocasiones mas jóvenes aún (Combs, 2005), (Donahue, 2005), que se presenta al urólogo porque "siente que no orina bien" y cuando le preguntamos el por qué nos responde que "nunca en su vida" incluso desde niño a orinado con un chorro grueso como refieren tener sus amigos o hermanos. Sienten que orinan "entrecortado" de manera intermitente, con chorro delgado y lento y en ocasiones presentan urgencia urinaria al tener contacto con líquido, lavarse las manos, sentir agua correr, o tocar algo frío.
Por otro lado se presenta con molestias suprapú-bicas (en el área de proyección de la vejiga urinaria), sobre todo al momento de orinar o postmicdonal que se exacerban con estados de tensión emodonal, o con estados infecdosos urinarios, o también con estados climáticos de frío y/o lluvia. Las molestias pueden ser a nivel del pene como sensadones punzantes.
Usualmente son personas que se tienen que levantar dos o mas veces a orinar una vez dormido (nocturna), en ocasiones motivados por su incapacidad de orinar toda la orina contenida en la vejiga presentarán frecuencia urinaria.
Tienen en ocasiones motivado por sus secundaris-mos a nivel de uretra prostática, disuria, en ocasiones podrían tener molestias o inclusive dolor perineal haciendo el diagnostico de prostatitis algo frecuente, sobre todo si tenemos molestias al tacto digital prostático.
Otros molestias dadas secundariamente son molestias testiculares, epididimarias o prostáticas ya previamente mencionadas, no olvidemos que Turner Warwick (1973) llamó a ésta ultima eventualidad "trapped prostate" o próstata atrapada. También podríamos tener pacientes con epididimitis, orquioe-pididimitis, u orquitis solamente, funiculitis, quistes epididimarios, quistes en vesículas seminales, quistes en condudos eyaculadores. Todo esto concomitante con historia de infertilidad usualmente secundaria, o con historias de disfundón erédil o trastornos de la eyaculadón. Estos últimos hallazgos son ocasionados por la hiperpresión del compartimiento uretral posterior con aumento en la incidencia de reflujo urinario por los condudos eyaculadores e inflamación posible en dicha área, área de vesículas seminales, área de conducto deferente, área de epidídimos y área de testículos .
En la Universidad Johns Hopkins el Departamento de Urología en conjunto con el de
Fisiatría (Wesselmann) mendonan los síndromes de dolor redal y urogenital adarando que son bien descritos pero pobremente entendidos. Sus denominaciones son múltiples por ejemplo, vulvodinia, orquialgia, síndrome uretral, dolor peneano, prosta-todinia, coccigiodinia, dolor perineal, prododinia, prostalgia fugaz. La etiología de estos síndromes no es bien conodda. A menudo se presentan con depresión. Se están revisando los aspedos etiológicos, sus relaciones con aspedos emodonales, y se ha determinado que deben ser enfocados por un grupo multidisciplinario y su mejoría es a través de analgésicos, terapia física, soporte psicológico.
Roberts (2002) menciona en su trabajo sobre la prevalencia de síntomas como prostatitis en hombres entre 40 y 79 años, que las prostatitis crónicas son condiciones incapacitantes que están asociadas primariamente con dolor-molestias en el área urogenital, con disturbios en la función urinaria y molestias en la eyaculación. Las hipótesis que la explican son debidas a infección, inflamación en la glándula prostática o en algunos casos a espasmos de la musculatura pélvica, siendo éste según Osborn uno de los factores que hacen perseverar la sintomatología y por ende convertirse en un factor de deterioro emocional con sensadón de fracaso tanto para el paciente como para el medico tratante, recomendando relajantes musculares y otras medidas alternativas.
Hay un secundarismo que se presenta de manera habitual en hombres y mujeres cuando tienen una obstrucción de la salida vesical (como es el caso de la disfundón del cuello vesical o en este caso del síndrome de hiperpresión del compartimiento uretral posterior) y es la posibilidad de tener consecuendas sobre el funcionamiento de la vejiga que puede ser de dos tipos, o bien hipertrofiando sus paredes con la consecuencia lógica de disminudón de la capacidad funcional vesical, disminudón de la distensibilidad-compliance vesical y por ende con la aparición de hiperadividad vesical con todo su cortejo asintomáti-co o el segundo tipo de consecuencia sobre la vejiga que es la descompensadón vesical (luego de haber pasado por la primera etapa ya mendonada) con pérdida de la tonicidad vesical característica llevando esto a una vejiga de gran capaddad, muchas veces perezosa y con dificultad en lograr un vadamiento eficaz y satisfadorio con volúmenes variables de orina residual (usualmente por arriba del 25% de la capacidad funcional total) y con el cortejo asintomáti-co que acompaña ésta condidón (frecuencia urinaria, incontinencia urinaria por rebosamiento, nocturna y afectación de la calidad de vida diaria del paciente) (Blaivas, 1994), (Ikeguchi, 2000), (Wein, 1979), (Kaplan, 1994), (Potenziani, 1999, 2001, 2003), entre otros.
Lo que se refiere a trastornos de fertilidad es por las inflamaciones crónicas o crónicas reagudizadas de las áreas seminales antes mencionadas que llevan a un deterioro de la calidad seminal y por ende a una disminución de la capacitancia espermática.
Además el hecho de que la glándula prostática y las vesículas seminales puedan inflamarse podría ocasionar disfundón eréctil leve. Moderada o grave sobre todo si al hecho orgánico se le agrega el hecho psicológico. Son parientes que usualmente son tratados equivocadamente pensando en otros diagnósticos.
Esendalmente dependerá de evidencias objetivas de obstrucción de la salida vesical, tanto por flu-jometría, como por estudio de flujo presión, por volúmenes elevados de orina residual, por dstoure-trografia micdonal, por electromiografía del piso pélvico muscular y a través de respuestas clínicas satisfadorias con la utilizadón del medicamentos alfa-1 bloqueantes adrenergicos, relajantes musculares y tranquilizantes musculares. Pero sobre todo el diagnostico se hará de manera deductiva, por exclusión de patologías orgánicas y/o patologías neu-rológicas. Describiré los antecedentes más importantes por renglones:
• Urinarios.
• Nunca ha orinado bien "con fuerza".
• Chorro urinario débil.
• Chorro urinario fino.
• Chorro urinario entrecortado.
• Flujometría con patrón intermitente.
• Goteo urinario terminal.
• Inicio miccional lento y dudoso.
• Frecuencia urinaria.
• Urgencia urinaria.
• Nocturna.
• Incontinencia de urgencia.
• Hematuria (rara).
• Nunca ha orinado rápido y fuerte (como sus amigos o familiares más cercanos).
• Antecedentes de "infecciones" urinarias usualmente bajas y raras veces altas.
• Antecedentes de "infecciones" prostáticas agudas y crónicas.
• Antecedentes de "infecciones" epididimarias agudas y crónicas.
• Antecedentes de "infecciones" vesiculares seminales.
• Antecedentes de "infecciones" o inflamaciones testiculares.
• Grados diversos de disfunción erédil.
• Episodios aislados o permanentes de eyacu-ladón precoz.
• Disminución de la libido.
• Hemospermia.
• Ardor y dolor al eyacular.
• Secreción uretral de origen prostato-vesicular.
Tratamientos recibidos (como antecedentes)
• Antibioticoterapia.
• Antiinflamatorios.
• Relajantes musculares.
• Analgésicos.
• Fitoterapia.
Tratamientos diversos (acupuntura, calor local, entre otros)
• Exámenes complementarios pradicados (como antecedentes).
• Exámenes de orina y urocultivos.
• Urografía de eliminación.
• Uretrocistografia miccional.
• Videoendoscopia urinaria inferior.
• Estudio urodinámicos simples o complejos.
• Ecosonografia renal, vesical, prostática y escrotal.
• Estudios microbiológicos del aparato genital masculino y en ocasiones de la pareja(s).
• Rx simple de abdomen, Rx simple de columna vertebral.
• RMN.
• TAC abdominopélvico.
• En casos no muy claros biopsias prostáticas.
Área de la fertilidad
• Estudios de Espermograma y Espermocultivo.
• Estudios o perfiles hormonales.
SÍNTOMAS CLÍNICOS
• Área urinaria.
• Nunca ha orinado bien "con fuerza".
• Chorro urinario débil.
• Chorro urinario fino.
• Chorro urinario entrecortado.
• Flujometria con patrón intermitente.
• Goteo urinario terminal.
• Inicio miccional lento y dudoso.
• Frecuencia urinaria.
• Urgencia urinaria.
• Nocturna.
• Incontinencia de urgencia.
• Hematuria (rara).
• Nunca ha orinado como sus amigos... tan rápido, fuerte y con un chorro grueso.
• Secreción uretral de origen prostato-vesicular.
• Síntomas de hiperactividad vesical.
• Incontinencia urinaria por rebosamiento.
Área genital-anexial
• Grados diversos de disfunción eréctil.
• Episodios aislados o permanentes de eyacu-ladón precoz.
• Disminución de la libido.
• Hemospermia.
• Ardor y dolor al eyacular.
• Molestias en el área de los anexos epididimarios.
• Molestias peneanas.
• Molestias testiculares alternas.
Componente doloroso
• Molestias dolorosas en el área hipogástrica.
• Molestias dolorosas en el área lumbar.
• Molestias dolorosas en el área flanco y fosa ilíaca.
• Molestias dolorosas en el área genital.
• Molestias dolorosas en el área perineal.
• Molestias dolorosas en la zona sacrococcigea.
• Molestias dolorosas al orinar.
• Molestias dolorosas al eyacular.
Área psicológica
• Ansiedad.
• Depresión.
• Insomnio.
• Agresividad.
HALLAZGOS EN LA VIDEOENDOSCOPIA URINARIA
El hallazgo mas común en la videoendoscopia es un cuello vesical anormalmente alto con un orificio cervical normal o circunferendal pequeño, que al pedirle al padente que orine, no se aplana, es dedr no se abre de manera satisfactoria. Sin embargo Chapple (1994) menciona que no hay apariencias endoscópicas que sean patognomónicas de disdnergia o disfunción del cuello vesical.
HALLAZGOS EN LA IMAGENEOLOGÍA URINARIA Urografía de eliminación
En el cistograma a baja, mediana y máxima replección vesical podemos ver signos radiológicos
de vejiga de esfuerzo (trabeculaciones, divertículos, sáculos)
En la fase cistográfica a baja replección se observa el cuello vesical elevado, a mas de 1 cm. por arriba de la sínfisis púbica.
En la placa simple de la urografía de eliminación podríamos ver imágenes radiopacas tipo cálculos en el área de proyección de las vesículas seminales y de la glándula prostática
Si hacemos placas micdonales podríamos ver adelgazamiento del embudo normal que se debería formar en el área del cuello vesical y de la uretra prostática.
Cistouretrografía miccional
Aumento de la distancia verumontanum-cuello vesical.
Elevación del cuello vesical, visto con poco contraste o bien al principio del estudio o bien al final del estudio cuando la vejiga ha desalojado el contraste.
Adelgazamiento de la uretra a nivel de la uretra membranosa-prostática apical.
Ecosonografía vesical
Lo primero que nos llamará la atendón es la presencia de orina residual significativa, más del 25% de la capacidad fundonal máxima.
Veremos signos ecográficos de vejiga de esfuerzo (aumento del grosor de la pared vesical, sáculos vesicales, divertículos e irregularidad de la pared vesical en su contorno externo).
Ecosonografía prostática endorrectal
Veremos varios de los secundarismos del síndrome de S.H.U.P., como vesiculitis seminal crónica, quistes en vesículas seminales, quistes en los conductos eyaculadores, quistes intraprostaticos, prostatitis crónica con o sin focos de reagudizadón.
Salida vesical con embudo estrecho o inclusive sin la presencia ecográfica de embudo.
Ecografía renal
Solamente en casos muy esporádicos veremos repercusiones en el árbol urinario superior como dilatadones del sistema pielocalidano en grados diversos por la obstrucdón fundonal del cuello vesical.
HALLAZGOS EN EL ESTUDIO URODINÁMICO (Uroneurologlco)
ESTUDIO FLUJOMÉTRICO
Veremos de manera muy frecuente una morfología cistométrica multimeseta como la mostramos en el estudio de abajo, con patrón intermitente, usualmente tienen una Qmax normal (por arriba de 12 ml/seg) y un Qaverage bajo (por debajo de 10 ml/seg).
Debemos interpretar muy bien el estudio ya que un patrón intermitente no sólo es indicio de posible obstrucción sino también podría ser indicio de debilidad o disfuncionalidad del músculo detrusor (vejiga hipoactiva descompensada) o también ser debido a disfundón o disdnergia del esfínter interno (liso).
Como parte del estudio flujométrico tendremos un volumen alto de orina residual así como un score o cuestionario elevado de síntomas y/o molestias urinaria.
ESTUDIO URODINAMICO MULTICANAL
Donde veremos como es el caso del ejemplo abajo, una dstometría de vaciamiento con excelente presión vesical y presión del detrusor y cuando vemos el uroflujo está aplanado.
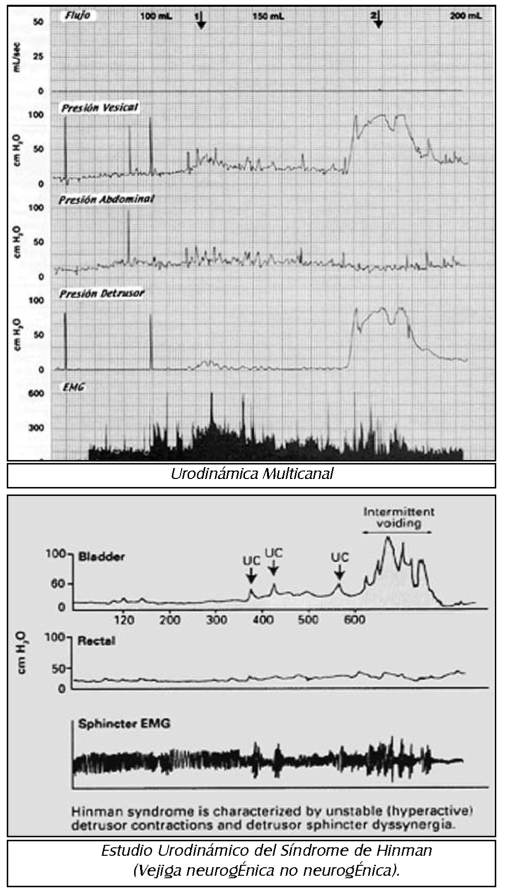
ELECTROMIOGRAFÍA-BIOFEEDBACK DEL PISO PÉLVICO MUSCULAR
Donde observaremos un incremento en la actividad de los grupos musculares que conforman el piso pélvico muscular (musculatura roja-voluntaria), es decir habrá una hiperactividad de la contractilidad muscular. Esta parte del examen puede hacerse con equipos desde sofisticados hasta muy sencillos, que hoy se consiguen de las mas diversas marcas comerciales y que además de servir para suministrar al paciente una electroestimuladón del piso pélvico muscular servirán también para obtener "de refreso" que tanta actividad de los grupos musculares hemos estimulado con la electroestimuladón y esto a su vez se podría extrapolar en hacernos saber en que estado está dicha musculatura.
Es importante aquí aclarar que debido a que el S.H.U.P. es en todo sentido una patología de "malos hábitos miccionales aprehendidos desde muy temprano en la vida de los pacientes" y que el segundo componente de hiperactividad o disfuncionalidad del piso pélvico es también un componente inusual, de mal habito, promovido en la infanda tardía, ado-lescenda y adultez temprana por estados de angus-tia-stress podríamos tener estudios urodinámicos no conduyentes, con lo cual no le debemos dar a ellos una preponderancia absoluta.
HALLAZGOS EN LOS CUESTIONARIOS DE SÍNTOMAS DE PRÓSTATA Y EN LOS CUESTIONARIOS DE SÍNTOMAS DE PROSTATITIS O EN LOS CUESTIONARIOS DE CALIDAD DE VIDA (QOL)
En todos los cuestionarios arriba mencionados tendremos una puntuadón sugestiva de afectación del área estudiada ya que como hemos mencionado anteriormente tendremos signos y síntomas compatibles con obstrucción urinaria por lo cual los cuestionarios de síntomas prostáticos darán una puntuadón elevada. Por otro lado sabemos que como secundarismo del síndrome de hiperpresión de la uretra prostática, tendremos vesiculitis seminal y prostatitis por lo cual tendremos cuestionarios de Prostatitis con puntuadón elevada y por supuesto en ambas eventualidades los cuestionarios de calidad de vida darán también puntuadones que señalan la alteradón de la misma en éstos parientes.
VARIADOS ENFOQUES DIAGNÓSTICOS DADOS A ESTE SÍNDROME
Si el síndrome de Prostatitis es denominado por algunos investigadores la "cesta de la ignorancia médica" en virtud de la cantidad de síntomas variados con que puede manifestarse clínicamente, y que logran confundir numerosas veces a los médicos que atienden a éstos pacientes, qué podríamos decir de un síndrome tan poco conocido como es el síndrome hiperpresión uretral prostática (S.H.U.P.) donde se combinan la disfunción del cuello vesical con la disfundón del piso pélvico muscular. Por lo antes
mencionado se hace difícil encontrar antecedentes de enfoques diagnósticos adecuados en éstos pacientes.
Al no saber el diagnóstico es evidente que los tratamientos dados son muchas veces equivocados y no cumplen con los objetivos terapéuticos en éste tipo de condición patológica.
Son tratados como infecciones urinarias, como prostatitis, como patologías psicosomáticas, como trastornos psicológicos de diversa índole, como procesos de tipo inflamatorio entre otros. En la variedad de Prostatitis crónica denominada Prostatodinia hoy Tipo IV (NIH 1995,1998), Schaeffer menciona que hombres con dolor prostético pero que no arroja resultados positivos en sus pruebas bacteriológicas (como el Test de Pesquisa bacteriológica genital masculino, o el análisis y cultivo de la secreción prostática posterior a masaje prostático), tienen dolor pélvico-perineal que esconde muchas veces una etiología de disturbios musculoesqueleticos que se asocian en numerosas ocasiones con "aparente obstrucción funcional del cuello vesical y de la uretra prostática". Schaeffer recomienda en casos de mialgia del piso pélvico diatermia, relajantes musculares, fisioterapia con o sin fármacos ansiolíticos y consultas psiquiátricas.
HALLAZGOS EN EL TACTO RECTAL PROSTÁTICO
El tacto prostático podría ser de gran ayuda en el diagnostico basado en el hecho que al tener el paciente síntomas urinarios bajos de tipo irritativo (de llenamiento vesical) u obstructivo (de vaciamiento vesical) podríamos inferir que se trata de una prostatitis o de una infección urinaria y tenemos la sorpresa que al palpar la próstata ésta está normal y no hay en el sedimento urinario patología infecciosa alguna.
Sabemos por supuesto que éste es el caso quizás menos frecuente ya que los pacientes usualmente se presentan con secundarismos inflamatorios-infec-ciosos de diversa índole como lo mencionamos anteriormente y con sedimento urinario alterado por el hecho de tener volúmenes residuales altos. Pero aun así debemos utilizarlo siempre como parte de nuestro examen físico, ya que de no hacerlo podríamos obviar un diagnostico que nos conduciría a otro esquema diagnostico y terapéutico.
HALLAZGOS EN EXAMENES BACTERIOLÓGICOS
Test de Meares-Stamey (1968)/Pesquisa Microbio-lógica del Ap. Genitourinario masculine (Carmona, 1988).
Cuando el paciente tiene un síndrome de prosta-titis de la variedad que fuera (como parte de secundarismos del S.H.U.P.) podremos diagnosticarlo con el Test de Meares-Stamey (1968) o con la Pesquisa microbiológica del aparato genital masculino (Carmona, 1988).
Usualmente negativo. La excepción al tenemos en los exámenes simples de orina y el análisis del sedimento urinario donde podríamos conseguir datos que nos lleven al diagnóstico de que hay una inflamación de las vías urinarias (leucocituria leve, piocituria incipiente, hematuria mínima, mucina abundante, bacterias escasas, nitritos negativos).
Usualmente son negativos para infección a menos que haya pasado mucho tiempo con el síndrome de
S.H.U.P. y esto haya ocasionado una prostatovesiculi-tis con hallazgos probables de infección seminal y dando entonces espermocultivos positivos. Dentro del test de Meares-Stamey (1968) o pesquisa microbiológica del aparato urogenital masculino (Carmona, 1988) el tercer segmento (EPS) y el cuarto segmento (VB3) podrían ser positivos para infección.
HALLAZGOS EN LOS EXÁMENES PSICOLÓGICOS
Cuando el paciente tiene tiempo con las repercusiones o secundarismos del síndrome de hiperpresión de la uretra prostática (SHUP) podríamos tener hallazgos positivos en los exámenes psicológicos ya que el no saber que se tiene, el ir de médico en médico sin obtener mejoría y el hecho de que pasa el tiempo y muchas veces se agrava la condición hace que se entre en un trastorno psicológico del cual solo con ayuda especializada podría obtener mejoría.
TRATAMIENTO FARMACOLÓGICO CON MEDICAMENTOS ALFA-1 BLOQUEANTES ADRENÉRGICOS
(inhibición de los receptores alfa-1 adrenergicos).
• Tamsulosin.
• Doxazosin.
• Terazosin.
• Alfuzosin.
• Prazosin.
Datta al igual que muchos otros investigadores refieren que los medicamentos alfa-1 bloqueantes adrenergicos serán muy útiles en casos de hipertonía estromal prostática. A tal efecto sabemos que la musculatura esfinteriana uretral está bajo control alfa-adrenérgico (Donker 1972).
En el síndrome de hiperpresión de la uretra prostática así como en casos de síndromes de prostatitis crónica habrá un aumento de la presión máxima de cierre uretral causada por hipertonía estromal prostática debido a una sobreactividad adrenérgica existente en ambos síndromes (para muchos las prostatitis serán consecuencia del S.H.U.P.).
Este aumento de presiones intrauretrales será el responsable del reflujo uretroprostatico que ocasionará síntomas en el área glandular prostática y en las áreas seminales (vesículas seminales, área deferencial y área epididimaria-testicular). Inclusive Osborn (1981) describe una incompleta tunelización del cuello vesical así como un adelgazamiento de la zona esfinteriana uretral.
Por todo lo antes mencionado cuando se disminuye la sobreactividad alfa-adrenérgica de dicha zona a través de los medicamentos alfa-1 bloqueantes adrenergicos tendremos una sustancial mejoría en los síntomas percibidos por el paciente y una mejoría en los scores no solo de síntomas sino en los scores de calidad de vida.
• Incisión(es) endoscópicas (transuretrales) de cuello vesical.
• Resección endoscópicas (transuretrales) de cuello vesical.
• Incisiones transuretrales de próstata (TUIP).
Ambos procedimientos han demostrado superioridad sobre los tratamientos farmacológicos con medicamentos alfa-1 bloqueantes adrenergicos. Pero la(s) incisión del cuello vesical ha demostrado superioridad sobre la resección de cuello y sobre las incisiones de próstata.
Alivian de manera segura la fase expulsiva urinaria es dedr disminuye la presión vesical de vaciamiento y la presión del detrusor. Mejoran los parámetros objetivos (flujometría, determinación de residuo, estudios de flujo-presión y subjetivos de calidad de vaciamiento (cuestionarios de calidad de vida).
Comentario aparte es aquel caso que se demuestre la coexistencia de cretimiento prostático con la disfunción del cuello vesical siendo entonces preferible las incisiones de cuello vesical más las incisiones prostáticas o de manera definitiva la resección transuretral prostática.
TRATAMIENTO DE LA ESPASTICIDAD MUSCULAR DEL PISO PÉLVICO
Biofeedback con técnicas asistidas de reeducación neuromuscular
Utilizado para reducir o inhibir la actividad exacerbada de la musculatura estriada de piso pélvico y con ello reducir los síntomas así como los efectos secundarios de la hipertonía del piso pélvico, entre otros los procesos inflamatorios crónicos a nivel de la glándula prostática.
Desde el año 1981 Osborn mencionaba el tratamiento de una variedad crónica inflamatoria prostática denominada prostatodinia con relajantes musculares debido a los eventos fisiológicos que rodeaban a las prostatitis crónicas, sea cual fuere su variedad. El mencionaba que en muchos casos se veían estados de espastiddad de la musculatura del piso pélvico.
Todos hemos tenido en nuestras consultas pacientes con cuadros de prostatitis crónica que han tenido torpes evoluciones clínicas, sobre todo en lo referente al aspecto dolor, ya que son pacientes que refieren síntomas molestos o dolorosos ubicados en áreas como el periné, la zona glútea, la zona lum-bosacra, el área de proyección de las estructuras seminales que no ceden de manera rápida y mucho menos con el enfoque terapéutico utilizado normalmente, como son antibióticos, antiinflamatorios, fitoterapicos, calor local, entre otros y si nos comenzarán a dar resultados aquellos tratamientos que dirijan sus efectos farmacológicos hada el alivio de el hipertonía muscular sea lisa (a través de fármacos alfa-uno bloqueantes adrenérgicos como la Tamsulosin, Alfuzosin, Doxazosin, Terazosin) o estriada, como la del piso pélvico muscular, a través de Fisioterapia, Biofeedback anorectal, Relajantes musculares estriados y ansiolíticos de diversas estructuras químicas.
El Biofeedback se presenta como una alternativa menos definitiva que la cirugía, sobre todo cuando sabemos que una de las consecuendas lógicas de la cirugía sobre el cuello vesical (sea cual sea la drugía) provocará eyaculaciones secas (por eyaculación retrogada) con las consecuencias normales sobre el área de la fertilidad, sobre el área de la sexualidad de la pareja y sobre el área emodonal del padente. No nos olvidemos que los aspedos de la sexualidad de cada ser humano son imprevisibles y las repercusiones sobre ésta área no deben ser obviados por el médico tratante.
Nadler refiere la utilizadón del Biofeedback con reeducadón neuromuscular del piso pélvico muscular, cuando el padente presenta hipertonía muscular del piso pélvico como factor contribuyente al síndrome de prostatitis crónica variedad síndrome de dolor crónico pelviano masculino con excelentes resultados. Esto por supuesto efeduado en ambientes especiales con urólogos, fisioterapeutas para asociar a dichas alternativas, técnicas de calor local en piso pélvico, ultrasonido, y ejercicios con la terapeuta física para lograr el objetivo deseado que es la rela-jadón del piso pélvico muscular, que sabemos es de una complejidad estrudural tal que lo hace todo un reto para la persona que se proponga relajar todos esos componentes musculares.
Por lo tanto las alternativas no quirúrgicas son a mi parecer las mas adecuadas para intentar una verdadera mejoría dínica, sobre todo si las combinamos con las Terapias de tipo Conductual, las cuales definimos a continuación (Potenziani-Alternativas no quirúrgicas en el tratamiento de la incontinencia urinaria de esfuerzo en la mujer-Revista de la Sodedad Venezolana de Urología 2001).
Calor Local en la zona del piso pélvico
A través de aditamentos como mantas elédricas, bolsas plásticas calientes entre otros, termoterapia (TUMT), TUNA.
Farmacoterapia
• Fármacos relajantes musculares esqueléticos.
• Fármacos ansiolíticos.
• Fármacos antinflamatorios.
• Fármacos antimicrobianos.
• Fármacos analgésicos.
• Fitofarmacos.
• Fármacos Hipouricemiantes (Allopurinol).
Terapia Física
En servicios de Fisiatría y rehabilitación con diatermia, electroestimulaciones cutáneas, ultrasonido, masajes, ejerdcios, técnicas de estiramiento = Stretching.
Tratamientos de Neuromodulación eléctrica
Interacciones mente-cuerpo (con ejerdcios de rela-jadón progresiva).
Reeducación Vesical-Terapias Conductuales
Habilidades o estrategias que el médico imparte a sus parientes para que aprendan a controlar la vejiga (y por ende el ado de la micdón-vadamiento urinario y llenamiento urinario) en relación a los factores que actúan sobre ella, y con ello evitar fundamentalmente la incontinencia urinaria (en los casos de hiperactividad vesical con disminución de la dis-tensibilidad vesical) o los episodios de infecciones urinarias por residuo urinario importante (en los casos de vejigas perezosas por hábitos retencionistas o por secundarismos neuro-urológicos) o en los casos de trastornos del vaciamiento urinario por disfunción del cuello vesical en unión o no a disfundón del piso pélvico muscular, dichos factores pueden ser numerosos, como el stress, psicosomatismo, hábitos equivocados del padente (orinador habitual, reten-cionista), alimentación irritante, antecedentes de infecdones urinarias a repetidón, sobre todo en la mujer, antecedentes de infecdones urinarias en el varón, antecedentes inflamatorio-infecciosos en el área ginecológica, antecedentes obstructivos urinarios de la salida vesical tanto en hombres como en mujeres, antecedentes quirúrgicos vesicales-prostáti-cos, uretrales, antecedentes de tratamiento con Quimioterapia y/o Radioterapia en vejiga, próstata, entre otros.
OBJETIVOS DE LA REEDUCACIÓN VESICAL
1. ENSEÑAR AL PACIENTE A PREVENIR LAS PÉRDIDAS URINARIAS CONTRAYENDO VOLUNTARIAMENTE LOS MÚSCULOS DEL PISO PÉLVICO MUSCULAR Y SER ÉL QUIEN COMANDE ALA VEJIGA Y NO LO CONTRARIO.
2. ENSEÑAR AL PACIENTE A AUMENTAR GRADUALMENTE LA CAPACIDAD VESICAL (AL AUMENTAR SU DISTENSIBILIDAD O CAPACIDAD DE LLENAMIENTO DE LA VEJIGA) Y CON ELLO DISMINUIR LA FRECUENCIA Y LA URGENCIA URINARIA Y POR ENDE LOS EPISODIOS PROBABLES DE INCONTINENCIA URINARIA
3. ENSEÑAR AL PACIENTE A DISMINUIR LA FRECUENCIA URINARIA, POR AUTOCONTROL, PSICOLÓGICO-SOMÁTICO.
4. ENSEÑAR AL PACIENTE A TENER PLENA CONCIENCIA DE SUS PROBLEMAS URINARIOS Y CAMBIAR SU ACTITUD YA QUE SON DOMINABLES.
5. CON TODO LO ANTERIOR MEJORAR LA CALIDAD DE VIDA DEL PACIENTE.
Las Terapias conductuales o reeducativas fueron ideadas para modificar el comportamiento del paciente en referencia a su esfera urinaria, para desarrollar habilidades y nuevas estrategias, para evitar las perdidas involuntarias de orina, para disminuir los episodios de urgencia urinaria, para disminuir la frecuencia urinaria y la frecuencia de los episodios de incontinencia y mejorar por ende el control vesical y para concientizar en el paciente la capacidad que tiene de lograr una mejor control en su almacenamiento y vaciamiento urinario (Potenziani,
1999), (AMA, 2001), (Berghmans, 2000), (Bo, 2004,2004), (Burgio, 1989, 1998, 2002, 2003), (Datillo, 2001), (Fantl, 1990,1991), (Goode, 2004).
Como veremos posteriormente, tanto la reeducación vesical, como las estrategias para controlar la urgencia urinaria, como la fisioterapia del piso pélvico muscular se fusionaran y sumarán sus efectos beneficiosos para la mejoría clínica del paciente y en consecuencia para una mejor calidad de vida.
Mejorarán el control vesical y serán métodos que complementarán a otros como por ejemplo la cirugía de incontinencia urinaria en la mujer, la cirugía radical de próstata, las cirugías de alivio de la salida vesical con vejigas hipertrofiadas de esfuerzo, entre ellas la mas frecuente es la cirugía por crecimiento prostático benigno, las cirugías de prolapsos del piso pélvico en la mujer, o las cirugías radicales pelvianas ginecológicas, urológicas e intestinales.
En todas las modalidades de cirugía aplicadas a pacientes con incontinencia urinaria, la trilogía de reeducación vesical, estrategias para controlar la urgencia y fisioterapia del piso pélvico muscular representarán la diferencia entre un postoperatorio exitoso y uno problemático, ayudarán a mejorar la calidad de vida diaria del paciente y sobre todo optimizará los resultados quirúrgicos.
En el caso de la incontinencia urinaria femenina, son el presente y futuro de las estrategias terapéuticas, unido a la farmacoterapia y a la cirugía en casos bien seleccionados.
La reeducación vesical forma parte de las terapias conductuales, las cuales tienen como objetivo modificar favorablemente el comportamiento de la paciente en diversas áreas de la vida diaria, con el objetivo de obtener un control sobre los episodios de incontinencia urinaria de esfuerzo, frecuencia urinaria, incontinencia de urgencia, y en aquellos casos de hiperactividad vesical caracterizada por frecuencia urinaria, urgencia urinaria, nocturia, incontinencia urinaria de urgencia.
Están considerados como terapia de primera línea en la población femenina con incontinencia urinaria de esfuerzo o mixta, (AHCPR 2001) donde se ratificó su utilidad por su fácil aplicación, bajo costo, seguridad y efectividad y no ser un procedimiento invasivo con excelentes resultados clínicos, ratificados por numerosos urólogos en todo el mundo.
Serán de gran utilidad cuando se una el entusiasmo del paciente con el del terapista, cuando el paciente siga con bastante precisión las recomendaciones de su médico-urólogo, y cuando se hagan las recomendaciones adecuadas que surjan de un análisis preciso del diario vesical así como de la entrevista con el paciente. El nivel de satisfacción logrado en nuestras pacientes es significativo ya que cuando no se logra un control absoluto de la continencia urinaria, se logrará una reducción significativa en la frecuencia urinaria y en los episodios de incontinencia urinaria, así como en los episodios de urgencia lo que sin duda mejorará la calidad de vida de nuestras pacientes.
Burgio (1989) menciona que un 75% de pacientes se sentirán mejor, un 45% podrían recaer sintomáticamente después de haber sentido mejoría, un 15% desearán retirarse de las terapias conductuales, en comparación con un 75% que desearían hacerlo con las terapias farmacológicas
Es fundamental para su realización que el paciente tenga una función cognitiva adecuada, así como un sistema urinario inferior sin perturbaciones neurourologicas para que junto a la disposición de mejorar den los mejores resultados de su aplicación. En muchas ocasiones tendremos pacientes que no contarán con mucho entusiasmo o que no tengan la capacidad para poder adquirir habilidades que le permitan cumplir con las terapias conductuales (ancianas con estados depresibles, o pacientes minusválidos, o adultos con disturbios emocionales severos por lo que no podrán aplicarse las terapias conductuales.
Muchas veces hay que advertirle a las pacientes que éstas terapias no darán resultados de inmediato, ya que requieren de tiempo y paciencia para tener una mejoría de su cuadro clínico. Muchas veces la frustración tanto del paciente como de sus médicos y familiares hace que se retire del programa de cambios conductuales.
En principio toda reeducación vesical se imple-menta en pacientes con urgencia, frecuencia, donde los intervalos miccionales son cortos y donde se quiera mejorar la sintomatología de la paciente para con ello mejorar la calidad de vida.
Si consideramos que aprox. un 50% de pacientes con Incontinencia urinaria de esfuerzo tienen síntomas de hiperactividad vesical, estaremos entonces en la necesidad de implementar reeducación vesical en ellas, que junto con las estrategias para la urgencia, las estrategias alimentarias, la fisioterapia muscular del piso pélvico y los urofármacos adecuados tendremos una verdadera mejoría que en muchísimas ocasiones alejará la sombra de la posible cirugía para la incontinencia urinaria de esfuerzo, pero de no poder evitarla, mejorará sin duda alguna los índices de éxito de aquella.
La reeducación vesical logrará la eliminación de la incontinencia urinaria en un 15-18% y la mejoría en un 50% de los casos.
MODALIDADES DE REEDUCACIÓN VESICAL
1. Micción facilitada.
2. Micciones programadas horarias.
3. Reentrenamiento progresivo de hábitos miccionales.
Para poder aplicar un determinado tipo de reeducación vesical se hace indispensable conocer el perfil miccional que presenta el paciente a través del estudio concienzudo del DIARIO VESICAL (Abrams, 1983, Larsson, 1988, Sitberg, 1997), que no es otra cosa que el perfil urinario de nuestro paciente, con las circunstancias que rodean los episodios de incontinencia urinaria, la presencia o no de urgencia, los intervalos miccionales y la cantidad de agua ingerida, así como la cantidad de orina producida en cada micción así como la cantidad de pérdidas involuntarias de orina. El diario vesical a realizarse en una a dos semanas, es la bitácora de un paciente con incontinencia urinaria donde se toman en cuenta la cantidad de líquido ingerido, el tipo de liquido ingerido, las veces que la paciente ha ido a orinar tanto en el día como en la noche, si dicha orinada la ha realizado con urgencia o normalmente. Si la ha realizado con urgencia saber si durante el episodio ha perdido orina (incontinencia en contra de su voluntad). Debemos precisar la cantidad de orina en cada micción normal o anormal y la cantidad aproximada de orina perdida durante el episodio incontinente. Es importantísimo precisar que circunstancias rodeaban al paciente en el momento de la perdida involuntaria de orina, así como es importante saber que tipo de tratamiento médico relacionado o no a las vías urinarias está tomando el paciente.
El diario vesical parece un componente simple de la valoración de la paciente incontinente, pero su trascendencia se verá reflejada no sólo en la obtención de datos de gran importancia al urólogo sino que permitirá saber la capacidad funcional vesical, el gasto urinario circadiano, la presencia de urgencia, frecuencia y nocturia, lo permitirá diagramar una reeducación vesical adecuada, permitirá sugerir cambios conductuales que mejoren a la paciente, permitirá sugerir cambios alimentarios y nos dará el sustento necesario para implantar un terapia farmacológica y sobre todo concientizará al paciente en la obtención de mejores resultados de su tratamiento para su incontinencia urinaria.
Tenemos básicamente tres tipos de reeducación vesical.
1. Micción facilitada
Al conocer el intervalo miccional, a través del diario miccional, se le recomienda a(l) la paciente acudir al baño a orinar antes de llegar al tope de dicho intervalo. Es decir si los intervalos micdonales son de tres horas, luego de lo cual se presentaría un episodio de urgenda urinaria con la posible inconti-nenda urinaria, el paciente deberá ir al baño a orinar a las 2 horas 45 minutos, o a las dos horas y media, por ejemplo. Solamente nos ayudará a evitar los episodios de incontinenda urinaria. No ayuda a solucionar un trastorno de almacenamiento vesical. Aun así mejorará la calidad de vida de las parientes que lo pongan en práctica.
¿Cuales son los factores relacionados que se consideran indispensables para que haya una respuesta adecuada al esquema de micción facilitada o prompted voiding? (Specht-Lyons, 2002).
Se coloca el nivel de evidencia después de cada factor.
1. TENER UNA CAPACIDAD VESICAL NORMAL (ENTRE 200 Y 700 CC) (A).
2. TENER ESTADO COGNITIVO NORMAL (A).
3. RECONOCER (IDENTIFICAR) NORMALMENTE LA NECESIDAD DE ORINAR (A).
4. PRESENLAR ALLA FRECUENCIA DE PELI-CIONES DE IR AL BAÑO (B).
5. COMPLELAR UN NUMERO ALLO DE SESIONES ASIGNADAS AL ESQUEMA DE MICCIÓN
FACILITADA BIEN SE A POR LAS PERSONAS AL CUIDADO DE (L) LA PACIENLE (B).
6. MENOS DE 4 EPISODIOS CADA 12 HORAS DE INCONLINENCIA URINARIA, LOS PRIMEROS 3 DIAS (A).
7. MENOS DEL 20% DE PRESENLAR EPISODIOS DE INCONTINENCIA URINARIA LOS PRIMEROS
3 DIAS DEL ENFOQUE CONDUCLUAL (B).
8. MÁS DEL 66% DE SABERSE COMPORLAR EN EL BAÑO DURANLE LOS 3 PRIMEROS DÍAS (B).
9. AL MENOS MÁS DEL 50% DE MICCIONES EN EL BAÑO DENLRO DEL RECEPLÁCULO PARA LAL FIN, DURANLE EL PRIMER DÍA DE ENFOQUE CONDUCLUAL (A).
10. CAPAZ DE MICCIONAR ADECUADAMENLE CUANDO ES ASISLIDO EN EL BAÑO (A).
11. MÁXIMO VOLUMEN ORINA DE MÁS DE 150 CC (A).
12. LENER HABILIDAD DE DEAMBULAR INDEPENDIE NLEMENLE (B).
13. PRESENLAR VOLÚMENES DE ORINA RESIDUAL POR DEBAJO DE 100 CC (A).
Los factores asociados a no tener una respuesta satisfactoria al esquema de micción facilitada son: presentar un status cognitivo deficiente (B), ser incapaz de iniciar exitosamente una incursión en el baño durante el primer día de enfoque conductual con la micción facilitada (A), presentar edad avanzada (B), presentar altos volúmenes de orina residual (A), presentar volúmenes orinados máximos bajos (A), y presentar una alta frecuencia (más del 40%) de idas al baño "seca", pero sin poder orinar adecuadamente dentro del receptáculo para tal fin (A).
LOS RESULLADOS QUE DEBERÍAMOS ESPERAR LUEGO DE IMPLEMENLAR UN ENFOQUE DE REDUCACIÓN VESICAL CON LA VARIEDAD DE MICCIÓN FACILITADA SON:
1. TRATAR DE LOGRAR UN AUMENLO DE EL NÚMERO DIARIO DE EPISODIOS URINARIOS SIN "INCONLINENCIA", ES DECIR DE LOGRAR "ESLAR SECOS" (A).
2. AUMENLAR EL NÚMERO DE MICCIONES CONLINENLES (B).
3. DISMINUIR EL AVERAGE DE MICCIONES INCONTINENTES (B).
4. IDENTIFICAR LOS PATRONES INDIVIDUALES DE INCONTINENCIA URINARIA (B).
5. SER CAPACES DE RECONOCER LA SENSACIÓN DE URGENCIA AL ORINAR (A).
SE HACE INDISPENSABLE IDENTIFICAR LOS PATRONES MICCIONALES DE CADA PACIENTE PARA OBTENER DE ELLOS LOS MAS ALTOS NIVELES DE CONTINENCIA POSIBLE CON LA MENOR NECESIDAD DE "ASISTENCIA PARAMEDICA" POSIBLE, APLICANDO LOS INTERVALOS MICCIONALES ADECUADOS PARA CADA QUIEN, DETERMINÁNDOSE LUEGO DE 1 A 2 MESES LA VIABILIDAD DE ESTOS MÉTODOS EN DICHOS PACIENTES.
SI EL PACIENTE NECESITA ACUDIR AL BAÑO CON INTERVALOS MENORES A 2 HORAS PARA PODER MANTENER LA CONTINENCIA URINARIA NO SE DEBERÍA SEGUIR UTILIZANDO ESTE ESQUEMA DE MICCIÓN URINARIA FACILITADA.
ES DE RESALTAR LA IMPORTANCIA QUE TIENE EL HECHO DE QUE EL LA(EL) PACIENTE PRESENTEN UN PORCENTAJE ELEVADO DE INTENTOS-PETICIONES DE IR AL BAÑO O DE NOTIFICAR A LA PERSONA QUE TIENE CERCA (familiares o personal de enfermería) DENOMINADO S.I.R (self-initiated request) LO QUE DETERMINARÁ UN COMPORTAMIENTO QUE INCLUYE PETICIONES VERBALES, O A TRAVÉS DE SEÑALES LUMINOSAS, O REALIZADO POR PROPIA CUENTA DEL PACIENTE. ESTO DETERMINARÁ UN AUMENTO DE LA CONCIENTIZACIÓN EN EL PACIENTE DE LA NECESIDAD DE ORINAR, LO QUE LO MANTENDRÁ ALERTA, AUMENTANDO LA POSIBILIDAD DE QUE EL PACIENTE MEJOR PERCEPCIÓN DE LAS SENSACIONES DE LLENADO VESICAL CON SU CORRESPONDIENTE INCREMENTO EN EL NÚMERO DE S.I.R. DIARIOS. ESTOS POR SUPUESTOS ESTARÍAN SUPEDITADOS AL NIVEL DE DESARROLLO COGNITIVO DE (L) LA PACIENTE, OBTENIÉNDOSE EL MAYOR NÚMERO DE S.I.R. CUANDO SE TIENE UN TEST MINI-MENTAL MAYOR DE 10 o EL(LA) PACIENTE TIENEN MENOS DE 1 AÑO VIVIENDO EN CASAS-HOGARES PARA ANCIANOS.
EXISTE EN LA LITERATURA MUNDIAL EL TERMINO "social feedback" QUE FORMA PARTE DEL PROTOCOLO DE TRATAMIENTO Y TIENE DOS MODALIDADES: EL FEEDBACK SOCIAL POSITIVO Y EL FEEDBACK SOCIAL CORRECTIVO. EL POSITIVO CONSISTE EN ELOGIAR-ESTIMULAR A LA (EL) PACIENTE PARA LOGRAR EL ÉXITO EN EL COMPORTAMIENTO DE SU ESQUEMA MICCIONAL Y SE MANTENGA SECO (sin incontinencia), TENGA EL MAYOR NÚMERO DE S.I.R., RESPONDA RÁPIDA Y POSITIVAMENTE AL ESQUEMA DE MICCIÓN FACILITADA Y PARA QUE HAYA UN REPORTE FIDEDIGNO DE SU CONDICIÓN DE CONTINENCIA URINARIA. SIN DEJAR DE LADO, EN CASO DE ESTAR PRESENTE, EL ESTÍMULO AL PERSONAL QUE SE RESPONSABILIZA DEL CUIDADO DE LA PACIENTE. EL FEEDBACK SOCIAL CORRECTIVO DEBERÁ SER UTILIZADO LO MENOS POSIBLE Y CONSISTE EN CORREGIRLOS REPORTES ERRÓNEOS DE LA CONDICIÓN DE CONTINENCIA DEL PACIENTE; REPETIR LOS ESQUEMAS DE MICCIÓN FACILITADA DOS VECES; RECORDARLE AL PACIENTE MANTENER LA VEJIGA LLENÁNDOSE DE ORINA HASTA EL MOMENTO SIGUIENTE QUE LE TOQUE IR AL BAÑO; MANTENER CONTACTO CON EL PERSONAL DE APOYO (en caso de necesitarse); ELIMINAR EPISODIOS DE INFECCION URINARIA
2. Micciones programadas horarias
Se establece un esquema estricto de micciones horarias, el cual debe seguirse a pesar de que al principio cuesta sacrificios tanto al paciente como a las personas que están cuidándolo (familiares, enfermeras, terapistas, entre otros).
El principal enemigo son los episodios de urgencia urinaria la cual se debe combatir con estrategias para controlar la urgencia, como veremos más adelante. Y con terapia farmacológica. Pero sobre todo con una gran fuerza de voluntad y superando todos los posibles efectos indeseables (incontinencia urinaria, angustia, frustración). Es muy útil en pacientes con vejiga hiperactiva "volumen dependiente".
RECOMENDARLE AL PACIENTE QUE ORINE POR RELOJ, CON UN HORARIO PREESTABLECIDO (POR SU MÉDICO AL ESTUDIAR SU DIARIO MICCIONAL) Y NO ESPERAR A ORINAR PORQUE TENGA GANAS DE ORINAR.
El diario vesical permitirá fijar una programación miccional que disminuya los fracasos, que van unidos a éstos esquemas urinarios y con esto a mantener el mayor entusiasmo posible para obtener los mejores resultados.
3. Micciones con Reentrenamientos progresivo de hábitos urinarios
Se establece un esquema de micciones basado en el problema clínico que presente el paciente, posterior a estudio preciso del diario vesical.
Se comienza por un intervalo pequeño que el paciente llevará alargando progresivamente hasta llegar a un intervalo miccional ideal de 4 horas, alargando cada semana el intervalo miccional en 15 a 30 minutos.
Debemos utilizar en éste tipo de reeducación vesical, las estrategias para la urgencia y también algún tipo de terapia farmacológica y en pocos casos terapia psicológica.
Por ejemplo, comenzar por orinar cada 45 minutos a 60 minutos, durante la primera semana, posteriormente cada hora y media durante la segunda semana, cada 2 horas la tercera semana, cada 2 horas y media la cuarta semana, cada 3 horas la quinta semana, cada 3 horas y media la sexta semana y cada
4 horas la séptima semana. El tiempo de alargue semanal dependerá del éxito tenido con el tiempo precedente.
El paciente debe tener una gran dosis de paciencia y perseverancia.
El paciente debe acudir al baño sin tener, muchas veces, ningunas ganas de orinar.
Es de gran ayuda no solo para pacientes con dis-tensibilidad vesical disminuida por etiologías diversas como obstructivas, seniles, medicamentosas, iatrogénicas, sino que se utiliza muy bien y con excelentes resultados en pacientes con incontinencia urinaria de esfuerzo.
El porcentaje de mejoría subjetiva es del 60% y la mejoría objetiva a través del estudio urodinámico es del 30 al 50%.
La reeducación vesical, la fisioterapia muscular del piso pélvico y el aprendizaje de como suprimir y superar la urgencia urinaria serán indispensables en el enfoque de una mujer con incontinencia urinaria de esfuerzo, así como de pacientes con hiperactividad vesical de etiologías diversas.
En nuestra experiencia personal los esquemas de reeducación vesical se optimizarán cuando los combinemos con terapias farmacológicas, fisioterapia muscular del piso pélvico, con o sin electroestimu-lación, con o sin biofeedback y por supuesto con estrategias conductuales para manejar la urgencia urinaria.
La gran desventaja de la reeducación vesical es que indudablemente dependerá de la insistencia del paciente ante tales recomendaciones, de su capacidad de soportar una mejoría lenta, y muchas veces con recaídas clínicas y que su eficacia dependerá también de las patologías asociadas que tenga el paciente, entre las cuales las mas perjudiciales son aquellas que afectan el área neurológica-muscular, el área de destrezas personales, el área locomotriz y el área psicológica-emodonal.
Es un procedimiento que en un bajo porcentaje cura al paciente, pero sin duda alguna logrará mejorías dínicas a veces importantes, sola o en unión de otros argumentos terapéuticos.
Sugerencias alimentarias
Es importante señalar que aun cuando el factor alimentario no es determinante en obtener mejoras sustanciales en la sintomatología del paciente afeda-do. si es un fador mas a tener en cuenta como enfoque global del padente con síndrome de hiperpresión de la uretra prostática (S.H.U.P.) en el varón, ya que ciertos alimentos, hábitos y bebidas son definitivamente irritantes para las vías urinarias (café, té, bebidas alcohólicas, picantes, encurtidos, entre otros) por lo cual deberíamos recomendar evitarlos para obtener al final una mejoría sustandal en los síntomas y por ende en la calidad de vida del padente por nosotros tratado (motivo sustancial del ado médico).
Apoyo Psicoemocional
Es imprescindible asodar nuestros esfuerzos en el área de la terapéutica para aliviar o indusive curar el síndrome de Hiperpresión del compartimiento uretral posterior, con sesiones de psicoterapia que ayuden a mejorar los efedos nocivos que la personalidad particular, con rasgos obsesivos-ansiosos, presentes en éstos pacientes, sea un factor de entorpedmiento en el camino hacia su recuperadón.
Hemos querido destacar una condidón patológica denominada síndrome de hiperpresión de la uretra prostática (SHUP) en el varón joven de 20 a 50 años, formado por dos componentes uno, la disfunción del cuello vesical (discinergia del esfínter inter-no-lisoesfinter) con fallas en la coordinación entre la contracción del detrusor al momento del expulsivo urinario y la relajación o apertura del cuello vesical, para garantizar la salida de orina de la vejiga. El paciente tendrá una obstrucción funcional a la salida de orina de la vejiga
El segundo componente del S.H.U.P. es la disfunción del piso pélvico muscular, es decir la no relajación de dicha musculatura al momento del expulsivo urinario con lo cual se obtendría la salida de orina de manera expedita de la uretra prostática hada el exterior. Como condidón prioritaria debe ser un paciente sin patología neurológica alguna y con ciertas caraderísticas conductuales que las trae desde su infanda, personalidad tipo A, personas ansiosas, tensas y con repercusiones emocionales en varios órganos-sistemas del organismo (psicosomatismo) y que han sido equívocamente tratados a lo largo de su historia dínica debido a la carencia de diagnóstico predso y definitivo.
Son parientes que han sido vistos en consultas médicas urológicas por infecciones urinarias a repetición en la infancia, enuresis, incontinencia urinaria o son niños retendonistas urinarios, que la madre se da cuenta de que casi no orinan.
El S.H.U.P. no deberá ser confundido con la disdnergia detruso-esfinteriana externa (rabdoesfin-ter) usualmente de origen neurológico.
El tratamiento del S.H.U.P. deberá adaptarse a las condiciones de cada paciente, tipo de sintomatología que presenta, tipo de repercusiones secundarias, tipo de personalidad, tratamientos anteriormente redbidos y que grado de afectación en su calidad de vida tiene al momento de la consulta médica.
La secuencia terapéutica que debe usarse en éstos pacientes son: tratamiento farmacológico (medicamentos alfa-1 bloqueantes adrenergicos), Terapia de tipo conductual (cambios en el comportamiento del padente en reladón a sus vías urinarias), Biofeedback para que el paciente "aprehenda" a relajar la musculatura del piso pélvico muscular y con ello eliminar uno de los dos fadores que ocasionan el síndrome, pero además la terapia conductual ayudará también a prevenir las perdidas urinarias contrayendo voluntariamente los músculos del piso pélvico muscular y ser él quien comande a la vejiga y no lo contrario, a aumentar gradualmente la capacidad vesical (al aumentar su distensibilidad) y con ello disminuir la frecuencia y la urgencia urinaria, a disminuir la fre-cuenda urinaria, a mejorar la calidad de vida del padente, a tener plena conciencia de sus problemas urinarios y comprender que su actitud cambiará positivamente su calidad de vida urinaria y por último a coordinar mejor su ado volitivo de la micción.
Uno de los aspectos mas devastadores de éste síndrome como es el dolor que no es intenso pero si perceptivamente molesto, persistente y resistente a numerosas formas de terapia, por lo cual ocasiona un deterioro importante de la calidad de vida de los padentes afedados y es uno de los objetivos fundamentales que debe perseguir todo urólogo que enfrente éste gran reto de pacientes con síndrome de hiperpresión del compartimiento uretral posterior.
Abrams P, Griffiths D. The assessment of prostatic obstruction from urodynamics measurements and from residual urine. Brit J Urol 51: 129, 1979.
Abrams P, Feneley R, Torrens M. Urodynamics. New York: Springer-Verlag: 15-17, 1983.
AHCPR (Agency for Healthcare Policy and Research). Urinary Incontinence in Adults. Rockville, MD, US Department of Health and Human Services, March
27, 2001. http://www.ahcpr.gov.
AMA-Behavioral Therapy for the treatment of urinary incontinence coverage update. Medicare Focus. Chicago III: American Medical Association 12-14,
2001.
Anderson R, Wise D, Meadows M. Myofascial release therapy for category III chronic prostatitis. J Urol 161 (4) 34, May 1999.
Anderson R. Management of chronic prostatitis-chronic pelvic pain syndrome Urol Clin N Am29 (1) 235-239, Feb 2002.
Andersson K. Lower urinary tract symptoms 2002: An Update on storage and voinding symptoms Urology 62 (5B) Nov 2003.
Appell RA. Voiding Dysfunction Diagnosis and treatment Huaman Press Inc, 2000.
Awad S, Downie J, Lywood D et al: Sympathetic activity in the proximal urethra in patients with urinary obstruction. J Urol 115: 545, 1976.
Axelrod S, Blaivas J. Bladder neck obstruction in women J Urol 137: 497, 1987.
Barret D. Therapy to decrease outlet resistance. Inhibition of alpha-adrenergic receptors, page 227-235. Therapy to improve bladder emptying by increasing intravesical pressure. Ch8 Pharmacologic Management of lower urinary tract emptying failure. In Pharmacology of the urinary tract and the male reproductive system. Finkbeiner A, Barbour
G,Bissada N.Appleton-Century-Crofts/NY
Bates C., Arnold E., Griffiths D. The nature of the abnormality in bladder neck obstruction. Brit J Urol 47: 651, 1975.
Berghmans L, Hendriks H, de Bie R. Conservative treatment of urge urinary incontinence in women: a systematic review of randomized clinical trials. BJU Int 85: 254-263, 2000.
Blaivas J. A timely and structured evaluation of voiding dysfunction. Issues in Incontinence Summer 1(1), 1994 Laborie Medical Technologies Corp.
Blaivas J, Norlen L. Primary bladder neck obstruction. World J urol 2: 191, 1984.
Blaivas J, Romanzi L, Heritz D: Urinary Incontinence: Pathophysiology, evaluation, treatment overview and nonsurgical treatment. In Walsh P, Retik A, Vaugh E, Wein A (eds):Campbell's Urology 7th ed. Philadelphia. WB Saunders: 1007-1043, 1998.
Bo K. Present-Day Role of conservative treatment in Urogynecology. Am J Urology Review: 2(5) Suppl 4:
20, May 2004.
Bo K. New developments in the conservative treatments of urinary incontinence in women during pregnancy and after delivery. Am J of Urology Review: 2(5) Suppl 4: 24, May 2004.
Burgio K, Matthe<ws K, Engel B. Prevalence, incidence and correlates of urinary incontinence in healthy, middle-aged women. J Urol 146: 1255-1259, 1991.
Burgio K, Goode P, Locher J, Richter H, Roth D, Wright K, Varner E. Predictors of Outcome in the Behavioral Treatment of Urinary Incontinence in Women Obstetrics & Gynecology 102: 940-947, 2003.
Burgio K, Goode P, Locher J, Wmlauf M, Roth D, Richter
H, Varner R, Lloyd L. Behavioral training with and without biofeedback in the treatment of urge incontinent orledr women. JAMA 288-2293-2299, 2002.
Burgio K, Pearce K, Lucco A. Staying dry: A practical guide to bladder control. Baltimore Md. Johns Hopkins University Press 1989.
Burgio K, Locher J, Roth D, Goode P. Psychological Improvements Associated With Behavioral and Drug Treatment of Urge Incontinence in Older Women. The Journals of Gerontology Series B: Psychological Sciences and Social Sciences 56: 46-P51, 2001.
Burgio K, Locher J, Goode P, Hardin M, McDowell B, Dombrowski M, Candib D. Behavioral vs Drug treatment for urge urinary incontinence in older women. JAMA 280: 1995-2000, 1998.
Burgio K, Goode P, Locher J, Richter H, Roth D, Clark W, Varner R. Predictors of outcome in the behavioral treatment of urinary incontinence in women. Obstet Gynecol 102: 940-947, 2003.
Burgio K, Ives DG, Locher JL, Arena VC. Treatment seeking for urinary incontinence in adults. J Am Geriatr Soc 42: 208-212, 1994.
Burgio K, Locher J, Zyczynski H, Hardin J, Singh K. Urinary incontinence during pregnancy in a racially mixed sample: Characteristics and predisposing factors. Int Urogynecol J 1996; 7: 69-70.
Carmona O, Gonzalez I, Bellorin E, Romero M. Aspectos microbiologicos de la Prostatitis Crónica.Arch Hospital Vargas 30 (1-2): 37-41, 1988.
Chapple C, Turner Warwick R. Obstrucción de la salida vesical en el varón. In Urodynamics. Principios, Practica y Aplicación, Ch 17: 233-256, 1994. Mundy A, Stephenson T, Wein A editores, Churchill Livingstone.
Combs A, Grafstein N, Horowitz M, Glassberg K. Primary baldder neck dysfunction in children and adolescents I: pelvic floor electromyography lag time-a new noninvasive method to screen for and monitor therapeutic response J urol 173: 207-211, Jan 2005.
Combs A, Weinstein R, Horowitz M, macchia R. Vasovagal reaction during videourodynam ics into the etiology of bladder neck dysfunction J Urol suppl 159: 47,abstract 172, 1998.
Combs A, Horowitz M, Glassberg K. Primary bladder dysfunction in children. J Urol suppl 161: 161 abstract 617, 1999.
Crowe R, Noble J, Robson T, Soediono P, Milroy EJG, Burnstock G. An increase of neuropeptide Y but not oxide synthase-immunoreactive nerves in the bladder neck from male patients with bladder neck dyssynergia. J Urol 154: 1231, 1995.
Datta NS. Role of alpha-blockers in the treatment of chorinic prostatitis. Urology 60 (6A): 27-28, Dec
2002.
Datillo J. A long-term study of patient outcomes with pelvic muscle re-education for urinary incontinence. J Wound Ostomy Continence Nurs 28: 199-205, 2001.
Davidson AJ,Hartman DS, Choyke PL, Wagner BJ. Radiology of the Kidney and Genitourinary Tract.Third edition. W.B Saunders Co. Chapter 19 The urinary Bladder 485.
Donohoe J, Combs A, Glassberg K. Primary bladder neck dysfunction in children and adolescents II: results of treatment with alpha-adrenergic antagonists. J Urol. 173(1): 212-216, Jan 2005.
Donker PJ, Ivanovici F, Noach EL. Analyses of the urethral pressure profile by means of electromyography and the administration of drugs. Br J Urol 44: ISO-193, 1972.
Fantl JA, Wyman JF, McClish DK, Bump RC. Urinary incontinence in community-dwelling women: clinical, urodynamic and severity characteristics. Am J Obstet Gynecol 162: 946-951, 1990.
Fantl J. Efficacy of bladder training in older women with urinary incontinence. JAMA 265: 609-613, 1991.
George NJR, Slade N; Hesitancy and poor stream in younger men with outflow tract obstruction-the anxious bladder. Brit J Urol 51: 506, 1979.
Goode P. Behavioral and drug therapy for urinary incontinence. Urology 63(Suppl 3A): 58-64, 2004.
Gosling J. La estructura de la vejiga y uretra en relacion a su funcion. Clin Urol North Am Symposium Clin Urod, 31, 1979.
Haid T. Neurogenic dysfunction of the urinary bladder. An experimental and clinical study with special reference to the ability of electrical stimulation to establish voluntary micturition. Virum, Costers Bogtrykkeri. 1969.
Haid T, Bradley WE (1982). The urinary bladder, neurology and dynamics. Baltimore, Williams & Wilkins, 1982.
Hinman F. Urinary tract damage in children who wet. Pediatrics 54:143-150,1974
Hinman F Jr. Non neurogenic bladder (the Hinman syndrome) fifteen years later. J Urol 136:769,1986
Ikeguchi EF, Te AE, Choi J, Kaplan SA. Bladder Outlet obstruction in males. Primary Bladder neck Obstruction. In Voiding Dysfunction ch 10: 225-245,
2000. Appel RA. Humana Press.
Kaneko S, Minami K, Yachiku S, Kurita T; Bladder neck dysfunction. The effect of the alpha-adrenergic blocking agent phentolamine on bladder neck dysfunction and a fluorescent histochemical study of bladder neck smooth muscle. Invest. Urol 18: 212,1980.
Kaplan S, Te A, Jacobs B. Urodynamic evidence of vesical neck obstruction in men with misdiagnosed chroinic nonbacterial prostatitis and the therapeutic role of endoscopic incision of the bladder neck. J urol Dec: 152(6 Ptl): 2063-2065, 1994.
Kaplan S, Ikeguchi E, Santarosa R, D'Alisera P, Hendricks J, Te A, Miller M. Etiology of voiding dysfunction in men less than 50 years of age. Urology Jun: 47(6): 836-839, 1996.
Kaplan S, Te A, Jacobs B. Urodynamics evidence of vesical neck obstruction in men with misdiagnosed chronic nonbacterial prostatitis and the therapeutic role of endoscopic incision of the bladder neck J Urol 152: 2063, 1994
Kaplan S, Santarosa R, Meade D'Alisera P, Fay B, Ikeguchi E, Hendricks J, Klein L, Te A. Pseudodyssinergia (contraction of the external sphinter during voiding) misdiagnosed as chronic nonbacterial prostatitis and the role of Biofeedback as a therapeutic option. J Urol Vol 157 #6: 2234-2237 Jun 1997.
Kleeman FJ The physiology of the internal sphinter J Urol 104: 549, 1970.
Krane R, Siroky M. Classification of neurourologic disorders. En Krane RJ, Siroky MB editors. Clinical Neurourology Boston Little Brown 143-157, 1979.
Krane R, Siroky M et al. Clinical urology. Phildelphia, PA, J.B. Lippincott, 1994.
Krane R, Siroky M. Classification of voiding dysfunction: Value of classification systems. En Barret
D,Wein A editores. Controversies in Neuro-Urology. New York. Churchill Livingstone 223-238, 1981.
Larsson G, Victor A. Micturition patterns in a healthy female population, studied with frequency/volume chart. Scand Journal Urol Nephrol suppl 114: 53-57, 1988.
Mayo M. Primary Bladder Neck Obstruction in men: variation in detrusor response. J Urol 128: 957-959, Nov 1982.
Meares E, Stamey T.The diagnosis and management of Bacterial Prostatitis. Br J Urol 44: 175-179, 1972.
Meares E, Stamey T: Bacteriologic localization patterns in bacterial prostatitis and urethritis. Invest. Urol 5: 492, 1968.
Moon T, Hagen L, Heisey D. Urinary symptomatology in younger men. Urology 50: 700-703, 1997.
Nadler R. Bladder training biofeedback and pelvic floor myalgia. Urology 60( 6A): 42-44, Dec 2002.
National Institutes of Health (NIH). Chronic Prostatitis Workshop. Bethesda, Md: December 7-8, 1995-1998.
Nitti V, Lefkowitz G, Ficazzola M, Dixon C. Lower urinary tract symptoms in ypung men: videourody-namic finding and correlation with non invasive measures. J Urol 168: 135, 2002.
Norgaard J, Schwartz-Sorensen S, Djurhuus J. Functional bladder neck obstruction in women Urol Int 39: 207, 1984.
Norlen L, Blaivas J. Unsuspected proximal urethral obstruction in young and middle-aged men. J Urol 135; 972, 1986.
Olsson CA, Siroky MB, Krane RJ: The phentolamine test in neurogenic ballder dysfunction J Urol 117: 418, 1977.
Osborn D, George N, Rao P, Barnard R, Reading C, Marklow C, Backlock N. Prostatodynia Physiological characteristics and rational management with muscle relaxants. Br J Urol 1891; 53: 621.
Osborn D, George N, Rao PN. Prostatodynia phisiolog-ical characteristics and rational management with muscle relaxants. Br J Urol 53: 621-623, 1981.
Potenziani J, Carmona 0,Davila H. Aspectos clínicos y microbiologicos en la Prostatitis crónica. Revista Facultad de Medicina de la Universidad Central de Venezuela. 13 (2): 89-94, Jul-Dic. 1990.
Potenziani J. Prostatitis en Población Joven Venezolana. XXII Coloquios Méd-Militares. Jun 1985.
Potenziani J.Prostatitis Aguda y Crónica en 60 pacientes. Experiencia personal. Revisión de la Literatura. XXII Coloquios Médico-Militares Junio 1985. Caracas.
Potenziani J.Prostatitis en Población Joven Venezolana. Enfermedad de Transmisión sexual? II Jomadas Interseccionales de la Sociedad Venezolana de Urología. 26 al 28 de Noviembre. 1987. Caracas.
Potenziani J. et al Morfología cistométrica urinaria en diferentes patologías ginecourológicas. Presentado en los XXII Coloquios Médico-Militares. Junio 1985. Caracas.
Potenziani J, et al. Trastornos miccionales asociados a la hiperplasia prostática benigna. Papel del músculo detrusor en los resultados de la cirugía sobre la salida vesical (revisión clínica).Revista Centro Médico Caracas 42(2): 101-106, 1997.
Potenziani J. Enfermedades de la Prostata. Editorial Ateproca Caracas-Venezuela Mayo 2001.
Publicación de www.urologiaaldia.com vol 4#2,2003 #1 zonas anatomo-topográficas de McNeal. Su importancia en la ecosonografía prostatica y su valor pronostico tanto en el crecimiento prostático benigno, prostatitis y en cancer de prostata. #2 Síndrome de Hiperpresión del Compartimiento uretral posterior (SHCUP) #3 Incontinencia urinaria . ¿Qué necesita saber la paciente? #4 Comentario de Trabajos de Investigación resaltantes . Nueva sección Capítulos en la Historia de la Medicina: Aforismos hipocrati-cos del siglo V a.c sección IV, relacionados con las vias urinarias. (2003).
Potenziani J et al. Disfunción Miccional asociada a Hiperplasia Prostática Benigna. Rol del Detrusor en el éxito o fracaso de la cirugia prostatica (revisión Clínica) Publicado en la Revista de la Facultad de Medicina de la Universidad Central de Venezuela 19 (3) 1995.
Potenziani J.C. Alternativas no quirúrgicas en el Tratamiento de la Incontinencia Urinaria de Esfuerzo (o anatómica) en la mujer. Publicado en la Revista Venezolana de Urología Tomo I 46 (1): 7-18, Mayo 2001.
Potenziani B J.C. Vejiga Hiperactiva 1-372, editorial Ateproca, Caracas 1999.
Potenziani J. et al. Doxazosin en el tratamiento de la Hiperplasia Prostatica Benigna. Estudio Multi-céntrico Venezolano. Reporte Preliminar. Rev Ven Urol 43(1-2), en-Jun 1996.
Potenziani J. et al. Trastornos Miccionales asociados a la Hiperplasia Prostatica Benigna, papel del musculo detrusor en los resultados de la cirugia sobre la salida vesical (revisión clínica y experiencia personal) Publicado en la Revista Centro Médico de Caracas 42 (2): 101-106, Nov 1997.
Potenziani J. Web Site www.urologiaaldia.com (1999).
Roberts RO, Jacobson DJ, Girman CJ, Rhodes T, Lieber MM, Jacobsen SJ. Prevalence of prostatitis-like symptoms in a community based cohort of older men. J Urol 168(6), 2467-2471, Dec 2002.
Schaeffer AJ. Prostatitis Section 9 The Urogenital Tract: 693-695. Rakel 1998 Conn's Current Therapy W. B Saunders Co. 1998.
Shei Dei Yang S, Cheng Wang C, Hsing Hsieh C, Tai Chen Yung. Alpha-1 Adrenergic Blockers in Young men with primary bladder neck obstruction. Journal of Urology, 168 (2); 571-574, Aug 2002.
Siltberg H, Larsson G, Victor A. Frequency/volume chart: the basic tool for investigating urinary symptoms. Acta Obstet Gynecol Scand Suppl 166: 24-27,1997.
Specht J, Lyons S, Maas M. Patterns and treatments of urinary incontinence on special care units. Journal of Gerontological Nursing May 28(5): 13-21, 2002.
Stem J, Schaeffer A. Chronic prostatitis. Clinical evidence 2001; 5: 599-604. BMJ Publishing Group.
Tanagho E, Meyers F. The "internal sphinter": is it under sympathetic control? Invest Urol 7: 79-89, 1969.
Thon W, Baskin L, Jonas U, Tanagho E, Schmidt R. Neuromodulation of voiding dysfunction and pelvic pain. World Journal of Urology 9: 138, 1991.
Trockman B, Gerpach J, Dmochowski R, Haab F, Zimmern P, Leach G. Primary Baldder neck obstruction: urodynamic finding and treatment results in 36 men J Urol Oct: 156 (4): 1418-1420, 1996.
Tumer-Warwick R, Whiteside C, Worth P, Milroy E, Bates C. A Urodynamic view of the clinical problems associated with bladder neck dysfunction and its treatment by endoscopic incision and transtrigonal posterior prostatectomy. British Journal of Urology 45, 44-59,1973
Turner-Warwick R, Whiteside C. Investigation and management of bladder neck dysfunction. In Modern Trends in Urology 3pp 295-311, 1969.
Turner-Warwick R. Revisión urodinamica de obstrucción al tracto de salida vesical en el varón y sus implicaciones clínicas. Clin Urol North America 6 (1) 171-192, Feb 1979.
Webster G, Lockhart J, Older R. The evaluation of bladder neck dysfunction. J Urol 123: 196, 1980.
Wein A: Pharmacologic approaches to the management of neurogenic bladder dysfunction. J of Cont Ed in Urology 18: 17,1979.
Wein A,Raezer D. Physiology of micturition.In Krane R, Siroky M (eds) Clinical neurourology Little Brown Boston 1-33, 1979.
Woodside J: Urodynamic evaluation of dysfunctional bladder neck obstruction in men J Urol 124: 673, 1980.
Yalla S, Waters W, Snyder H, Varady S, Blute R.Urodynamic localization of isolated bladder neck obstruction in men: studies with micturitional vesicourethral static pressure profile. J Urol 125: 677, 1981.
Yalla S, Blute R, Snyder H, Yap W, Fraser L, Friedman E. isolated bladder neck obstruction of undertermined etiology (primary) in adult male: recognition and management. Urology 17: 99, 1981.
Yang S, Wang C, Hsieg C, Chen Y. Alpha-1 adrenergic blockers in ypung men with primary bladder neck obstruction. J urol 168: 571, 2002.
Dr. Julio César Potenziani Bigelli
Especialista urólogo Hospital Privado Centro Médico de Caracas
Br. Silvia Daniela Potenziani Pradella Estudiante de Medicina UCV.. Escuela Luis Razetti.
VARICOCELE EN POBLACIÓN JUVENIL • Revisión de un tema controversial
CON PERMISO DE LA REVISTA VENEZOLANA DE UROLOGÍA DONDE SALIÓ PUBLICADO EN EL VOL 50 #2 JUL-DIC 2004 (1 PARTE) Y EN EL VOL 51 #1 ENERO-JUNIO 2005 (2 PARTE).
EVITAR QUE UN JOVEN SEA INFÉRTIL EN SU ADULTEZ TEMPRANA ES PERMITIRLE QUE SE REALICE COMO SER INDIVIDUAL, SER SOCIAL, Y SER QUE TRASCIENDE Y DEJA HUELLA EN EL CURSO DE SU VIDA. ESA PODRÍA SER LA MISIÓN DEL URÓLOGO EN LOS CASOS DE JÓVENES CON VARICOCELE.
INTRODUCCIÓN
El tema del varicocele en la población juvenil es controversial ya que la decisión terapéutica una vez diagnosticado, quedará supeditado al enfoque personal de cada urólogo o cirujano infantil en base a su experiencia, estudios y status del paciente que busca la atención del especialista, ya que como refiere Bong (2004) a pesar de que la prevalencia de varicocele en poblaciones juveniles alcanza el 15%, similar a la de las poblaciones adultas, también es cierto según la Organización Mundial de la Salud (WHO 1992) que el 80% de los adultos con varicocele no presentan trastornos de fertilidad.
¿Es una enfermedad progresiva? ¿Hay que proceder inmediatamente a su corrección quirúrgica? ¿Existen posibilidades ciertas de ayudar al paciente afectado? ¿Hay elementos de juicio para saber con qué pacientes debemos proceder inmediatamente a su corrección quirúrgica y/o con conducta expectante?
Creemos que estas respuestas podrían ser contestadas luego de haber revisado éste artículo de revisión de la literatura, en la cual los autores se han esmerado en buscar los elementos básicos de sustentación para dar respuesta a las preguntas previamente mencionadas.
El presente artículo podría sentar las bases por las cuales los pacientes juveniles con varicocele deberían ser tratados, para evitar el deterioro de la función tes-ticular, evitar trastornos de la histología testicular, el deterioro del volumen testicular y evitar los consabidos trastornos de la fertilidad del paciente en grados diversos.
Se define el varicocele como la dilatación anormal (más de 2-3 mm) de las venas constituyentes del plexo pampiniforme o cremasterico, y de las venas espermáticas internas, que tienen la función del drenaje venoso del testículo y que podrían no siempre llevar a un deterioro de la fertilidad del varón con parámetros seminales afectados sobre todo en el área de la movilidad de los espermatozoides, en el área de la densidad espermática (contaje espermático por ml) y de la morfología de los mismos (con la presentación de formas adntadas-tapering, englobándose todo dentro del termino oligo-zoo-astenosper-mia, así como también a la disminudón del volumen testicular por el efedo gonadotóxico conocido del varicocele sobre la espermatogenesis testicular, que ocasiona un efecto inhibitorio sobre el testículo en desarrollo del adolescente. (Fish, 2003), (Oster, 1971), (Steeno, 1976), (Kass, 1987,1995, 2001), (Lund, 1999), (Paduch, 1997, 2001, 2002), (Gorelik, 1993), (Potenziani, 2001, 2002).
Otra definición de varicocele es la de Chiou (1997) quien refiere que deben existir de 2 a 3 venas de más de 3 mm de diámetro con reflujo durante la maniobra de Valsalva por 1 segundo o más.
Varicocele subclínico se define como aquel que no ha podido ser detedado a través de un examen físico, sino a través de exámenes como ecografía escrotal, ecografía Doppler testicular, termografía escrotal, gammagrafía escrotal, venografía (Pryor, 1996). Según muchos investiga-dores su incidencia va del 24% al 83% (Gat, 2004), (McClure, 1986), (Basile-Fasolo, 1986), (Comhaire, 1976).
Gorelik (1993) y Witt (1993) definen el varicocele como son dilatadones anormales del plexo venoso pampiniforme que se consideran una lesión progresiva, resultando en un deterioro progresivo de la función testicular (espermatogénesis y esteroidogénesis)
por flujo sanguíneo refregado, aumento del calor intratesticular, y por aumento de la presión intersticial con el correr del tiempo y que el hecho de haber tenido fertilidad previa no le confiere resistencia al efecto nocivo (gonadotóxico) del varicocele sobre la espermatogenesis, agregándose que defectos moleculares-genéticos podrían determinar la extensión de la infertilidad.
El varicocele en la población juvenil, es enfocado como el varicocele en el hombre adulto y sin duda es diferente, ya que tiene sus particularidades que lo hacen especial y por ende merecedor de un enfoque terapéutico también diferente. La presencia de varicocele en un adulto infértil ya se tenía cuando era un joven, por lo tanto debemos enfocarlo de una manera más consciente de todos sus alcances negativos.
Desde el momento que sabemos que el varicocele en un joven tendrá efectos nocivos sobre el cre-cimiento-volumen testicular, sobre la histología del testículo y sobre la función del mismo, su presencia representará para el médico un reto que debe ser resuelto de la mejor manera posible y sobre todo evitándole al paciente que sufra las consecuencias del mismo (Kass, 1987, 1987, 1995, 2001). Es la causa corregible mass frecuente de infertilidad (Nabi, 2004).
Sin embargo recientemente Diamond (2004) refiere en su trabajo sobre 41 jóvenes de 7 a 19 años que ni el grado del varicocele ni los cambios en el volumen testicular se incrementaron en el correr del tiempo de manera estadísticamente significativa, lo cual podría tomarse como un argumento en contra del carácter "progresivo" de la enfermedad y por ende en un argumento en contra de proceder quirúrgicamente, o de por lo menos retardarlo, pero éste enfoque tiene sus consecuencias que pudieran ser de peso, ya que si decidimos proceder quirúrgicamente sólo ante la evidencia de un cambio del volumen testicular (más de un 20% de volumen diferencial) , o por el grado del varicocele, podríamos encontrarnos con cambios histopatológicos irreversibles del paren-quima testicular, que era lo que inicialmente queríamos evitar.
EN LOS INDICADORES DE TRATAMIENTO QUIRÚRGICO PARA VARICOCELE EN EDADES ADOLESCENTES, DEBEREMOS TENER MUCHO CUIDADO EN BASARNOS EN EL VOLUMEN TESTICULAR, ASÍ COMO EN EL GRADO CLÍNICO DE VARICOCELE, ASÍ COMO TAMBIÉN EN ESPERAR CAMBIOS EN EL
ESPERMOGRAMA YA QUE DICHOS PARÁMETROS PODRÍAN ESCONDER UN DAÑO HISTOLÓGICO IMPORTANTE EN EL PARENQUIMA TESTICULAR QUE PODRÍA SER IRREVERSIBLE A LA HORA DE SOMETER AL PACIENTE A CIRUGÍA CORRECTORA, ADEMÁS QUE EN RELACIÓN AL VOLUMEN ESPERAR A QUE EL VOLUMEN DIFERENCIAL ENTRE AMBOS TESTÍCULOS SEA DEL 20% O MAS PODRÍA RETARDARNOS LA CIRUGÍA BENEFICIOSA. POR OTRO LADO LOS GRADOS CLÍNICOS DE VARICOCELE NO TIENEN CORRELACION CON EL ALCANCE HISTOPATOLÓGICO PRODUCTO DEL VARICOCELE (efecto gonadotóxico) (Thomas, 2002), Y POR ÚLTIMO ESPERAR A QUE LOS PARÁMETROS SEMINALES ESTEN ALTERADOS (oligoastenozoospermia) DEBERÍAMOS PREGUNTARNOS INICIALMENTE, CUANDO TIENE UN JOVEN ADOLESCENTE SUS PARÁMETROS COMO EN EL VARÓN ADULTO, Y LA RESPUESTA LA OBTENEMOS DE LOS ESTADIOS DE TANNER, EN UN ESTADIO G5, COMO LO VEREMOS A CONTINUACIÓN DONDE DESPUÉS DE LOS 15 AÑOS EL VARÓN TENDRÁ EL TAMAÑO DEL PENE Y EL VOLUMEN TESTICULAR COMO UN ADULTO, LO CUAL HACE QUE EDADES POSTPU-BERALES Y ADOLESCENTES INICIALES LOS PARAMETROS SEMINALES NO SEAN UN FACTOR FIDEDIGNO A CONSIDERAR.
Greenfield (1996, 1998, 2000) menciona que existen numerosas pruebas que demuestran que el adolescente con varicocele estará asociado con futuras anormalidades de la espermatogenesis y con infertilidad por lo que se hace necesario tomar medidas preventivas y enfocar un tratamiento adecuado.
Se han hecho cuestionarios entre cirujanos pediatras, urólogos pediatras o urólogos generales o endocrinólogos, para conocer qué tipo de manejo se le podría realizar a un joven en su etapa adolescente con un varicocele y han dado resultados bastante parejos considerando la conducta quirúrgica y la conducta conservadora-expectante, tomando en cuenta varios aspectos que desarrollaremos en éste trabajo de investigación (Richter, 2001).
Es bastante generalizada la confusión de los efectos del varicocele sobre el volumen testicular, disminuyéndolo, sobre la consistencia testicular, dismi-nuyéndola-ablandándola, sobre los parámetros seminales, deteriorándolos (Nishida, 2004) y sobre la esfera del dolor en el área anexial, dando sensación de pesadez del testículo afectado y del cordón esper-mático, pero trataremos de esclarecerlo lo mejor posible, en base a la revisión y comentario de los artículos y publicaciones investigados.
La inddencia que se mendona es de un 15% de hombres de la pobladón general afedados de varicocele y según Skoog (1997) es el mismo porcentaje entre la pobladón juvenil. Sabemos que podría aparecer entre los 10 y los 15 años. Aparece en 30-45% de los hombres evaluados por infertilidad primaria y entre 45 y 80% de hombres con infertilidad secundaria.
Según la OMS-1992 descrito por Fretz (2002) la inddencia de varicocele fue de 25.4% en hombres con parámetros seminales alterados y 11.7% en hombres con parámetros seminales normales y más del 80% de los varicoceles no están asociados con infertilidad.
Según Akbay (2000) la prevalenda de varicocele en adolescentes es del 7.8% en edades de 11 a 14 años y del 14.1 % en jóvenes entre 15 y 19 años. En edades prepuberales su inddenda va del 2 al 11% (Vasavada
1997, Aragona 1998).
La mayoría de los varicoceles ocurren del lado izquierdo (80-85% de incidencia), el varicocele bilateral está presente en 15 a 20% de las veces. La inddencia del varicocele derecho sólo es extremadamente raro (2%) y un 15-17% de pacientes con varicocele serán infertiles.
En la adualidad están descritas dos modalidades anatómicas de varicocele, una extratesticular, que es la más frecuente y una variedad intratesticular descrita por Weiss en 1992 (Weiss, 1992, Diamond, 2004). Esta última se diagnostica como una lesión anecoica intratesticular con flujo activo al Doppler. Según Diamond (2004) su significación dínica no ha sido todavía descrita.
Solamente el 15 a 20% de los adultos que presentan varicocele serán infertiles (Skoog, 1997).
Siguiendo una drugía de varicocele 30 a 45% de los parientes tendrán una mejoría en los test funcionales (espermogramas computarizados, determinaciones ecosonograficas del volumen testicular, determinación de gonadotrofinas séricas, realizar test de estimulación de hormonas liberadoras de gonadotrofinas (GnRH) para identificar una disfunción de la células de Leydig y por supuesto biopsias testiculares) y de éstos un 40% o más, tendrán embarazos en sus parejas.
Los pacientes sometidos a varicoceledomía serán mejores candidatos a técnicas de reproducdón asistida.
Según Stone (1994) tendremos mejoría de los parámetros seminales en 50-70% de los casos sometidos a varicocelectomía, por cualquier técnica, y 35-50% de las parejas tendrán un embarazo siguiendo a las varicoceledomía.
Es interesante poder saber qué adolescentes con varicocele unilateral o bilateral tendrán problemas de infertilidad y quienes no, sustentado por el hecho de que todos aquellos hombres adultos que se le descubre un varicocele, fueron en su momento jóvenes adolescentes con varicocele y sabemos que no todos serán infértiles, por lo cual es importante conocer aspedos que tocan la fisiopatología, la histopatolo-gia, las repercusiones seminales y los factores diagnósticos y terapéuticos para poder tomar una decisión lo mas justa posible.
Son numerosos los investigadores que recomiendan en el varicocele en población juvenil, tratamiento precoz debido a que durante ésta etapa de la vida de un hombre , los testículos están en franco crecimiento y desarrollo y es cuando mas nocivo pueden resultar los efectos gonadotoxico del varicocele (Lenzi, 1998, Sayfan, 1997, Lund, 1999, Laven, 1992, Lemack, 1998).
En un estudio interesantes Paduch (1996) realiza una investigadón sobre 2100 estudiantes polacos de secundaria y sus conclusiones fueron que el varicocele puede causar atrofia testicular izquierda en los adolescentes. Dicha atrofia sera tiempo-dependiente y grado-dependiente. El diámetro venoso del plexo pampiniforme tiene que estar por arriba de 1.7 mm. La cirugía del varicocele restaurará el volumen testicular izquierdo y podría prevenir un status de infertilidad en el futuro. A pesar de que son premisas ya conocidas las concluye luego de un estudio con un universo bastante mayor al resto de los estudios examinados. Sin embargo Alukal (2004), refiere que en población juvenil el grado de varicocele no se correlaciona con el grado de alteración del volumen testicular (hipotrofía).
Una excelente revisión realizada por Pryor-Howard (1987) demostró que 2/3 partes de los pacientes tendrían una mejoría en los parámetros seminales después de la varicoceledomía y 40% podrán fecundar a sus parejas.
Sin duda el tener un varicocele podría ocasionar preocupadón en el paciente y en su familia por ser la causa mas frecuente de infertilidad en el hombre con repercusiones personales, familiares, étnicas y religiosas en diversas comunidades a lo largo del mundo entero. En segundo lugar es bien conocido que el efecto gonadotoxico del varicocele (efecto nocivo sobre la espermatogenesis testicular), evidenciado por la disminución del volumen testicular, con o sin repercusiones espermatogenicas (Haans, 1991), descrito por Lipshultz-Corriere (1977), la cual podría aumentar con el paso de los años, lo que haría necesario tomar una decisión lo mas pronto posible pero con las bases de conocimiento que aseguren que la decisión tomada sea la mas correcta. En tercer lugar saber que es la causa más común y fácilmente tratable de infertilidad masculina (Lipshultz, 2002). En cuarto lugar el tamaño del varicocele no tendrá correlación ni con la fertilidad (capacidad fecundati-va) del paciente, ni con los resultados obtenidos posterior al tratamiento quirúrgico (varicocelectomía), sin embargo ésta premisa tendrá sus detractores como veremos mas adelante.
Para finalizar se debe decir que el hecho de seguir viendo en los consultorios médicos y hospitalarios un gran numero de pacientes con varicocele hace pensar que no están siendo detectados en etapas precoces, es dedr en la etapa juvenil.
VARICOCELE EN LA HISTORIA DE LA MEDICINA
En la Greda Clásica se describía la asodación entre venas escrotales dilatadas y atrofia testicular del mismo lado.
En el siglo de oro del imperio romano (siglo I A.D) en el texto médico "De Medicina" Celso, famoso médico romano da crédito a los griegos en la descripción previamente mendonada aunado al hecho de que la reducdón del volumen testicular sería mas intensa si el padente tenía problemas de mala nutridón.
En el siglo XVI Ambrosio Paré (1517-1590) famoso médico-drujano renacentista describió ésta anormalidad vascular como "sangre melancólica".
El en siglo XIX el drujano británico Barfield propuso por primera vez la reladón infertilidad-varioocele.
La primera descripdón de recuperadón de la fertilidad posterior a una ligadura de varicocele fue descrito en el año 1929 por Macomber-Sanders (Potenziani, 2001, 2002).
Desde 1885 se conocen trabajos científicos que hablan de la relación entre varicocele en adolescentes y la perdida del volumen testicular y que después de haber realizado la ligadura de las venas del plexo pampiniforme dilatadas, hay un aumento del volumen testicular y la consistenda del testículo se vuelve un poco mas dura (Barwell, 1885). Bennet (1889) la denominaba como "una condición congénita raramente observada antes de la pubertad que involucra prindpalmente al testículo izquierdo".
Mendona Fretz en las Clínicas Urológicas del 2002 el terrible episodio de un cirujano francés del siglo XVIII Delpech (17772-1832) quien fue asesinado por un padente inconforme con los resultados de una cura de varicocele que le había practicado el malogrado drujano (Noske, 1999)
Se ha tratado de crear una dasificación en base al tamaño que alcanza a simple vista y a su presencia o no en base a esfuerzos (maniobras de valsalva) y al hecho de ser palpados y/o visualizados. A continuación mostramos una clasificadón útil para los parientes portadores de varicocele (Potenziani, 2001, 2002).
Varicocele subclínico o grado S: no palpable y no visible y solamente diagnosticable por ecografía escrotal, eco-doppler, venografía y que es descubierto o bien casualmente o como parte de exámenes diagnósticos de infertilidad, o por investigación de causas de disminución del volumen testicular (hipotrof ia-atrof ia).
Varicocele pequeño o grado I: Solamente palpable con maniobras de Valsalva (pujo), de tamaño pequeño y no visible.
Varicocele mediano o grado II: Palpable con el paciente de pié, sin necesidad de las maniobras de Valsalva (pujo) y de tamaño moderado. Visible a simple vista.
Varicocele grande o grado III: Visible a simple vista, sin necesidad de recurrir a la palpación, pero confirmada por ella y sin necesidad de maniobras de Valsalva (pujo). Denominado "bolsa de gusanos".
Das y colaboradores (1999) describen a través de ecografía-doppler la presencia del llamado varicocele intratesticular, el cual se diagnostica en menos del 2% de los casos con varicocele asintomático. Su apariencia ecografiíta es venas intratesticuares en forma de tubulos dilatados en la proximidad del mediastino testicular. Ocurren más frecuentemente de manera bilateral. Se asodan con varicoceles del lado derecho y menos frecuentemente con la presenda de varicocele extratesticulares. Igualmente Mehta y colaboradores (1998), refiere que los prindpales diagnósticos diferendales con el varicocele intratesticular son los quistes, hematomas, quiste epidermoide y ectasia tubular tanto testicular como epididimaria. Pourbagher y colaboradores (2003) refiere que se produce un flujo reverso cuando se le pide al padente que realice pujo o esfuerzo (maniobra de valsalva). Por ultimo O'Donnell (1998) refiere que en los antecedentes de pacientes con varicocele intratesticular es importante descartar antecedentes de orquidopexia y testículos criptorquidicos, ya que según ellos podría contribuir a la aparición de varicocele intratesticular.
ASPECTOS ANATÓMICOS-VASCULARES
La irrigación arterial viene dada por la arteria testicular, la arteria deferendal y la arteria cremasterica anastomosándose entre ellas a nivel testicular, para garantizar una excelente irrigación arterial. En reladón al drenaje venoso tendrá numerosas variaciones anatómicas de paciente en paciente. Por arriba del nivel testicular habrá una red venosa denominada plexo pampiniforme, cuyo drenaje se garantizaría por la vena testicular, las venas pudendas y las venas cremastericas.
El motivo que lleva al paciente con varicocele al urólogo de manera característica no es el dolor o molestia escrotal (que es extremadamente rara), a pesar de autores como Belani (2004) y Hauser (2001) que refieren que el dolor y la infertilidad son las causas por las cuales buscan atención médica los pacientes, sino la explicación del por qué no puede tener hijos y en ocasiones la presenda de una masa irregular y blanda en el escroto, que se confunde con patologías testiculares, o en casos de exámenes físicos de rutina en empresas (exámenes de pre-empleo) o en el servicio militar, como un hallazgo casual, así como el hallazgo de un médico general, de un pediatra o de un urólogo que examine al padente.
El examen físico deberá realizarse siempre de pié y realizando maniobras de valsalva (pedirle al padente que haga esfuerzo, que puje, que tosa), pero cuando tengamos un alto índice de sospecha, sobre todo si no hemos conseguido a la palpación indidos de varicocele debemos agregar al examen físico una ecosonografía escrotal de la cual hablaremos mas adelante.
Posterior a la confirmación de la presencia del varicocele éste deberá clasificarse por grados como los mencionamos al principio.
Según Arslan (1998) determinó que solamente varicoceles de mas de 3 mm de diámetro podrían ser detectados en el examen físico y aun más Gat (2004) determinó que en el examen físico se deja de diagnosticar varicocele derecho en más del 90% de los casos en los cuales si está presente, lo que lleva a la casi formal indicación obligatoria de ecografía, o termo-grafía o venografía (para muchos el estándar de oro).
Se deteda usualmente de manera fortuita en un examen físico de rutina, sin que nunca el paciente haya sabido de su presencia. Es importante que el paciente esté de pié durante la palpación escrotal-testicular.
Usualmente se detecta el varicocele del lado izquierdo, aun cuando en nuestra casuística hemos tenido mas de un 60% de casos con varicocele bilaterales en virtud del diagnostico ecografico. Es muy importante en éste punto predsar el volumen del testículo o bien con la ecosonografía escrotal o bien con el orquidometro de Prader (1966), que según Cayan (2002) y Costabile (1992), da los mismos resultados que con la ecografía escrotal, o los elipsoides de Nasu, que van de 1 a 30 mi y se colocan alrededor del testículo hasta conseguir el apropiado para el tamaño del testículo de cada padente, o los discos elípticos de Takahira (1983).
En relación al volumen testicular debemos saber que aumenta considerablemente al alcanzar la pubertad. Los urólogos deben tener en cuenta que el tamaño testicular es una guía fiel del grado de madurez seminal y espermatogénico. Con pocos excepciones, el paciente que tiene un volumen testicular bajo será un paciente con trastornos en los parámetros seminales y posiblemente con un bajo porcentaje de capaddad fecundativa.
ES IMPORTANTE COMPARAR EL VOLUMEN DE AMBOS TESTÍCULOS TENIENDO EL VOLUMEN TESTICULAR DERECHO COMO "PATRÓN NORMAL" PARA FIJAR UNA COMPARACIÓN CON EL IZQUIERDO. ESTO DEBERÁ OBVIARSE EN CASOS DE CIRUGÍA DE CORDÓN ESPERMÁTICO DERECHO, CIRUGÍA DE HERNIA INGUINAL DERECHA, CIRUGÍA DE CRIP-TORQUIDIA DERECHA, CIRUGÍA DE EPIDIDIMO DERECHO, O CUALQUIER CIRUGÍA QUE DE ALGUNA MANERA HAYA TOCADO LA ZONA INGUINAL, CRURAL O ESCROTAL-TESTTCULAR.
Pero existen tablas de volumen testicular de acuerdo a la edad del paciente, con la cual deberemos regirnos. Como normativa debemos saber que entre ambos testículos de un adolescente no debe haber más de 2 mi de diferencia entre uno y el otro. De manera general podríamos mencionar que el volumen testicular normal para un afroamericano y para un caucásico es de aprox. 24 ± 4cc, sabiendo que los asiáticos tienen un volumen inferior.
Otro dato importante para inferir el estado de la espermatogenesis es la consistencia del testículo. Si palpamos un testículo blando y más pequeño es casi seguro que tendremos un paciente con trastornos de la espermatogenesis. El testículo debe siempre tener una consistencia dura.
CUANDO TENGAMOS A UN ADOLESCENTE CON VARICOCELE Y POR RAZONES PROPIAS DEL MÉDICO O DEL PACIENTE-FAMILIARES NO SE DECIDA LA CORRECCIÓN QUIRÚRGICA SE DEBERÁ EVALUAR CADA 6 MESES PARA DETERMINAR SI HA HABIDO ALGUN CAMBIO EN EL VOLUMEN O EN LA CONSISTENCIA DEL TESTÍCULO Y SI SE PUEDE (lo que sería de gran ayuda) PEDIR UN ESPERMOGRAMA COMPUTA-RIZADO PARA CONTROLAR DE CERCA LAS POSIBLES CONSECUENCIAS OBJETIVAS DEL VARICOCELE COMO SON LA DISMINUCIÓN DEL VOLUMEN TESTICULAR, LA DISMINUCIÓN DE LA CONSISTENCIA DURA HABITUAL DEL TESTÍCULO ENCONTRANDO MAS BIEN UN TESTÍCULO BLANDO Y UNOS CAMBIOS SEMINALES EN EL ESPERMOGRAMA SON SIGNOS INEQUÍVOCOS DE TENER QUE SOMETER A ESE PACIENTE A CORRECCIÓN QUIRÚRGICA, MAS AÚN
SI HA HABIDO UNA DISMINUCIÓN EN EL VOLUMEN DEL TESTÍCULO BAJO OBSERVACIÓN.
Se debe medir el volumen testicular (con orquidometros de consultorio) para saber la posible repercusión en el tamaño o volumen del testículo ipsilateral al lado del varicocele. En no pocas ocasiones hemos tenido la rara asociación de infertili-dad-varicocele subclínico (solamente diagnosticado por ecosonografia escrotal) e hipotrofia testicular confirmada no sólo por la medición con el orquidometro, sino con la ayuda ecografica escrotal con transductores de 6.5 o 7.5 Mhz.
Se debe medir la diferencia entre los dos testículos (de su eje mayor o longitudinal) y si esté difiere en mas de 0.5 cm podríamos considerar como significativo el hallazgo y profundizar en el estudio del paciente (pruebas funcionales), y si hay mas de 2 cc en volumen de diferencia deberemos también investigar mas profundamente. Esta medición deberá siempre ser confirmada por mediciones ecográficas (mucho más precisas).
En el examen físico de pacientes con varicocele e infertilidad, es importante descartar otras causas de infertilidad entre las cuales las mas frecuentes y significativas son las patologías anexiales testiculares inflamatorias (epididimitis), deferendales (deferenti-tis crónica) y testiculares (volumen del testículo en base a enfermedades que haya podido tener el padente, por ejemplo orquitis urliana, orquitis bade-riana). Debemos preguntar los antecedentes de importanda en el área anexial, testicular, seminal, prostático, tanto médicos como quirúrgicos, ya que todo podría tener repercusiones en el área seminal-fertilidad que nos conlleve un cambio de actitud terapéutico y un cambio de pronostico del caso.
Gat (2004) refiere 4 modalidades diagnosticas para diagnosticar la presenda de varicocele bilateral ya que si dependiera su diagnostico solamente del examen físico el varicocele derecho subdínico se dejaría de diagnosticar en mas del 90% de los casos y del lado izquierdo en mas del 10% de los casos. No debemos olvidar que varicocele subdínicos aun siendo pequeños podrían tener una repercusión fisiopa-tologica tremenda (Dubin y Amelar 1971) (Kunnen 1992), ya que el tamaño del varicocele no se correlaciona con la patología testicular que el ocasiona.
McClure (1986), Basile-Fasolo (1986) y Comhaire (1976) refieren que el varicocele subclínico está presente en un 24% a 83% de hombres infértiles, con lo cual su búsqueda se torna una obligadón para el medico tratante.
Descartar patologías epididimarias, con aumento de volumen y consistenda de las cabezas epididimarias, las cuales estarán asociadas a patologías inflamatorias crónicas usualmente de etiología uretral-prostática-deferencial-epididimaria-testi cu-lar por infecciones de transmisión sexual (I.T.S.) o de otra naturaleza.
Se hace indispensable realizar tacto prostático para descartar patologías inflamatorias prostáticas que secundariamente puedan afectar la esfera seminal del paciente y por ende su capacidad fértil (prostatovesiculitis crónica con sus consecuencias obstructivas seminales o de disminución de la calidad seminal).
El diagnóstico diferencial es con aquellas patologías escrotales-testiculares que pudiera tener el paciente y que podrían confundir el diagnostico con un varicocele y entre ellas tendremos:
1. Quiste cordón espermático.
2. Quiste cabeza epididimaria.
3. Epididimitis crónica de la zona de la cabeza epididimaria (tumefacción indolora de la cabeza epididimaria).
4. Lipoma del cordón.
5. Hernia inguinal indirecta.
6. Hidrocele del cordón espermático.
7. Espermatocele.
El varicocele muy raramente ocasiona sintoma-tología clínica y sólo en algunos casos ocasiona una sensación de molestia consistente en pesadez del área escrotal supratesticular, aunada a largos periodos en posición de pié.
La sintomatología ocasionada por el varicocele es tema de gran controversia, ya que la mayoría de los pacientes no tienen ningún tipo de sintomatología, aun cuando tengan varicoceles grandes y los síntomas que podrían tener, son usualmente ocasionados por patologías de tipo anexial asociadas (epi-didimitis-funiculitis), o tener síntomas asociados a "sensación de pesadez" en el área de proyección del varicocele, que no es otra que la parte superior de los testículos hada la zona superior-externa de la hemi-bolsa escrotal correspondiente.
EFECTOS PATOLÓGICOS (GONADOTÓXICO) DEL VARICOCELE
LOS EFECTOS NOCIVOS DEL VARICOCELE CAUSARÁN ANORMALIDADES DEL ESPERMOGRA-MA (disminución de la motilidad, disminución de la densidad espermática, alteraciones morfológicas del espermatozoide, afedadón de la traslación del espermatozoide), CAMBIOS LUSLOPAPOLÓGICOS TESTICU-LARES (hiperplasia de las células de Leydig, disminución del numero de espermatogenias por tubulo, disminución de la spermatogenesis, detención o arresto de la maduración espermática, desprendimiento del epitelio germinal, y fibrosis interstidal), POR LO CUAL ES INNEGABLE QUE SE DEBEN EVITAR DICHOS EFECTOS YA QUE PODRÍAN AFECTAR DEFINITIVAMENTE LA CAPACIDAD FECUNDATIVA DEL JOVEN PORTADOR DE VARICOCELE.
FISIOPATOLOGÍA DE LA DISFUNCIÓN TESTICULAR
Zorgniotti y McLeod (1973) fueron los primeros que expusieron los factores que en parientes con varicocele afectarán la espermatogenesis, así como afectación del eje de las gonodatropinas, del volumen testicular, de cambios histológicos testiculares, terminando en la afectación de la fertilidad.
Los 14 factores fisiopatológicos que en la actualidad se consideran, en casos de varicocele son los siguientes:
1. Elevación de la temperatura escrotal (0.6-C-
0.8-C) ocasionando una alteración en el mecanismo de intercambio de calor, afectando la microcirculación a nivel intersticio-tubular testicular y enlenteciendo o deteniendo la espermatogenesis, con los cambios consecutivos en el espermograma (Wang, 1997).
2. Aumento de la permeabilidad vascular con excesivo fluido endotubular y excesiva matriz extracelular (Yildiz, 2003), (Salama, 2003), produciendo retención de gotas en el citoplasma del espermatozoide (Gómez, 1996), (Zini,
2000), (Keating, 1997) con niveles patológicos de especies oxigeno reactivas (ROS), anormalidades seminales y oligoastenoteratozoosper-mia (Zini). En un trabajo de Nicotina (2005) menciona las aquaporina-1 (AQP-1) como un posible factor crítico de reabsorción tanto en el compartimiento tubular como en el
extratubular, asodado con el más importante hallazgo histológico de disbalance de flujo acuoso en los compartimentios antes señalados del testículo en jóvenes adolescentes con varicocele. Redudrían la retendón de fluidos anormales en las células endotubulares y en la matriz extracelular, disminuyendo su extensión y alcance a las células de Leydig.
3. Estancamiento de sangre en el sistema circulatorio testicular con falta de oxigenadón (hipo-xia) en la espermatogonia (primera fase evolutiva o etapa primitiva del espermatozoide).
4. Reflujo venoso de metabolitos de desecho de la drculación suprarrenal y renal por la vena espermática (gonadal).
5. Supresión de la producdón de testosterona con disminución de la hormona luteinizante (LH) y son esto los casos que tratados muchas veces empíricamente mejorarán con el tratamiento a base de gonadotropinas corio-nicas humanas o citrato de domifeno, ya que au-mentarán los niveles de testosterona intratesticular.
6. Alteradón en el eje Hipotálamo-Hipófisis-Gónadas.
7. Kim (2002), Baccetti (1996) y Lin (1997) asocian varicocele con un aumento de la apopto-sis en las células germinales, visto tanto en biopsias del testículo ipsilateral al varicocele como en el contralateral y su importancia por asodarse a hipoespermatogenesis y por ende con infertilidad masculina.
8. Parientes con varicocele e infertilidad tienen niveles elevados de ROS (especies oxigeno readivas) asociados a stress oxidativo y a infertilidad por motilidad y morfología espermática alterada (Padrón, 1997), Hendin (1999).
9. Pacientes con varicocele tienen bajo niveles de TAC (capacidad antioxidante total) en su plasma seminal y son casos clínicos que se beneficiarían de la utilización de suplementos antioxidantes (Hendin, 1999).
10. Hombres infértiles con prostatitis crónica tienen bajos escores ROS-TAC.
Chen (2004) refiere que recientes estudios se ha puesto en evidencia la asociación entre disfunción espermática y excesiva producción de especies oxigeno-reactivas (ROS) (Krausz, 1994). Tener un citoplasma exiguo con una deficiente protección por los antioxidantes, convierte a los espermatozoides en estructuras muy delicadas y sobre todo vulnerables al daño oxidativo (Sanocka, 1997). Se concluye que el stress oxidativo juega un papel determinante en la disfunción espermática de varones con varicocele (Hendin, 1999).
11. La actividad física ha sido asodado con deterioro de los parámetros seminales, disminuyendo la movilidad, alteradón de la morfología (disminución de las formas normales).
12. Los fumadores tienen 2 veces mas probabilidades de tener varicocele y los fumadores que tienen varicocele tienen 10 veces mas probabilidades de tener oligospermia que los hombres con varicocele que no fuman, por un efedo directo gonadotoxico de la nicotina, así como secreción de catecolamina nicotina-inducidas por la medula suprarrenal con flujo retrogado hada los testículos y por el cadmio de los dgarrillos o por radicales libres ocasionando daño oxidativo (Chia 1994, Klaiber, 1987).
13. El varicocele se asoda con aumento de la apoptosis dentro del tejido testicular (Simsek,
1998, Hopps, 2003). Según Bacetti (1996) el porcentaje de células germinales apoptosicas aumenta un 10% en hombres con varicocele comparado con 0.1% en hombres fértiles normales. El varicocele podría inducir apoptosis por factores tipo calor, deprivación andro-genica, y acumulación de materiales tóxicos (Lúe, 1999), (Sinha-Hikim, 1995,1997), (Benoff, 1997). Incluso Simsek (1998) revelaba que el porcentaje de células apoptosicas por el total de células germinales por campo de alto poder de resoludón fue del 14.7% en hombres con varicocele comparado al 2% en hombres control. Fujisawa-Ishikawa (1999) investigaron un marcador para apoptosis entre los pacientes con varicocele reconodendo una forma soluble de Fas, entendiendo que el sistema Fas/Fas L es el mayor regulador de la espermatogenesis normal. Igual que Tanaka (2002) con resultados similares.
14. Saleh (2003) refiere que el varicocele ha sido asodado con daño al ADN espermático. El nivel de daño al ADN espermático estará relacionado a los altos niveles de stress oxidativo encontrados en el semen de hombres interfiles con varicocele.
En reladón al reflujo venoso de metabolitos tóxicos hada la vena espermática tenemos que hay 3 trabajos investigativos de 30 años atrás cuyos autores (Ito, 1982, Cohén, 1975 y Combine, 1974) mencionan en sus trabajos el reflujo de prostaglandinas E y F, catecolamina y cortisol-catecolamina respectivamente a nivel de la drculación venosa de la vena espermática interna.
En reladón a la hipoxia se han medido en la circulation venosa testicular comparadola con sangre venosa periférica parámetros como C02, 02, pH y electrolitos sin encontrar diferendas significativas. Esto se ha estado investigando desde hace más de 30 años sin haber podido encontrar una demostración de la hipoxia. Autores relevantes como Rodríguez Netto (1977) y Turner (1987) han dejado demostrado éste aspedo.
En relación a los disturbios del sistema termore-gulatorio de los testículos de los pacientes con varicocele, Zorgniotti-Mac Leod (1973) han dejado con un trabajo magistral demostrando, que al igual que otras espedes animales, una temperatura por arriba de derto grado, en reladón a los testículos, enlente-cerá o impedirá la espermatogenesis. Al someter al paciente a una ligadura de las venas dilatadas del plexo pampiniforme (varicocele), mejorará (disminuirá) la temperatura intratesticular y con ello mejorará la espermatogenesis con todas sus consecuencias positivas.
Mieusset (1995) y Simsek (1998) revelan el calor sobre los testículos causa un efedo directo sobre las células germinales alterándose el metabolismo, incre-mentádose la apoptosis, alterándose la fundonalidad de las células de Sertoli, instalándose cambios vasculares con aumento de las comunicadones arte-riovenosas, disminudón actividad enzimático en la síntesis de ADN, disminución de nutrientes y oxigeno a los testículos.
Saypol (1981) en ratones y perros, al igual que Fussel (1981) en monos y Hurt (1986) en ratones demostraron y confirmaron los hallazgos de
Zorgniotti (1973). Entonces sabemos que el aumento del flujo sanguíneo testicular interferirá con el intercambio de calor resultando en una elevación de la temperatura y en una afedadón de la espermatogénesis.
Re-Ianitelli-Cerasaro (1983) dejaron en daro los hallazgos histoquímicas en parientes con varicocele que eran subfertiles, encontrando: disminución en las reservas de glucogeno de las células de Sertoli, y un aumento en la adividad de la fosforilasa todo esto produdo del aumento de la actividad metabólica por la elevadón de la temperatura antes mencionada.
En relación a la alteración en el eje Hipotálamo-Hipófisis-Gónadas, lo podremos ver en muy esporádicos casos, donde el varicocele afede indistintamente tanto las células interstidales como el epitelio germinal. Al final del deterioro histológico tubular y germinal veremos niveles de gonadotrofinas elevadas.
El Test de estimulación GnRH según Kass (1987, 1987) podría ayudarnos en corregir precozmente un paciente con varicocele en etapas tempranas de su desarrollo, antes que sea demasiado tarde.
Pero de una manera general los niveles periféricos y en vena espermática de LH, FSH, testosterona y estradiol usualmente no varían, por lo cual Kass (1987) asevera que el eje hipotálamo-hipófisis, gónadas no se afecta por la presencia de un varicocele, del grado que fuere.
Dickerman (1978) refería que la medida de la respuesta de las gonadotrofinas a la estimuladón con GnRH era una prueba diagnostica útil para evaluar la función testicular en jóvenes prepuberales en quienes sospechemos que pueda existir una patología testicular (hallazgos histopatológicos que puedan determinar una mala respuesta a la cirugía del varicocele, así como una mala respuesta a cualquier tipo de terapia).
Bach (2004) revela que aun en varicocele unilateral en población juvenil puede causar un deterioro en la función de las células de Sertoli.
En un trabajo recientemente publicado Góes (2002) concluye que los pacientes infértiles con varicocele tienen mayores niveles de FSH y tienen además los testículos más pequeños y tienen una mas baja concentración espermática y una menor movilidad espermática cuando se compara con pacientes-control con y sin varicocele.
Cedenho (2003) en Brasil hizo un estudio redente donde analiza la capaddad del espermatozoide de penetrar la zona peludda en adolescentes que tienen varicocele comparada con aquellos adolescentes que no tienen varicocele y su conclusión fue que los espermatozoides de aquellos jóvenes con varicocele grado II, III unilateral o bilateral presentan una disminudón de la capaddad penetrante del esperma-zoide cuando entra en la zona peludda del oocito, lo que podríamos considerar otra causa mas de los que defendemos la posición de cirugía en los jóvenes con varicocele.
Lyon (1982) publicó un trabajo interesante en la revista Urology donde mendonaba un punto que a nuestro entender tiene que ser muy considerado en el enfoque terapéutico de los jóvenes con varicocele y es que en la adolescenda el testículo está en pleno y rápido credmiento por lo cual el varicocele ejercerá un efedo más dañino (efecto gonadotóxico), lo que podría inclinar la balanza hacia la correcdón mas que hacia la observadón
Solamente un 25 a 50% de los varones operados de varicocele que tienen problemas de fertilidad podrían volver a tener una fertilidad normal, lo que significaría que un 50 a 75% de varones operados de varicocele siempre tendrán algún tipo de deterioro en su capacidad fecundativa. Esto es algo que debemos advertir a nuestros parientes para no crearle al paciente expedativas que podrían no ajustarse a la realidad.
Es también sabido que una vez que el varicocele aparece en la vida de un adolescente, ya no desaparecerá jamás (no se han descrito casos de desaparición espontánea del varicocele) y por lo tanto podría presentarse la duda de a quién de los varones afectados le ocasionaría un cuadro de infertilidad y a quién no, lo que también se traduciría en a quién tratar o a quién no?
"TENER UN VARICOCELE NO SIGNIFICA QUE EL PACTENTE ES O SERÁ INFERTIL, EN CAMBIO CUANDO EL PACTENTE ES EVALUADO POR INFERTILIDAD Y SE LE DESCUBRE UN VARICOCELE, ÉSTE PROBABLEMENTE, SERÁ LA CAUSA DE DICHA INFERTILIDAD".
Se tiene la esperanza de que los tratamientos precoces podrían mejorar los resultados consistentes en: mejoría de los parámetros seminales, mejoría del volumen testicular y mejoría de la capacidad fecundativa del varón, con el consiguiente aumento del porcentaje de embarazos logrados en sus parejas.
Hay Escuelas Urológicas que recomiendan en virtud de que no todos los adolescentes con varicocele serán infértiles, estudiar a fondo e identificar lo mejor posible aquellos adolescentes en riesgo de serlo, para que sean tratados los más precozmente posibles.
Numerosos autores consideran que el grado o tamaño del varicocele no guarda relación alguna con el posible efedo dañino que produzcan sobre la espermatogenesis (efedo gonadotoxico) y sobre el volumen del testículo (Dubin-Amelar 1971).
Sin embargo es indudable el efedo deletéreo sobre el volumen testicular por parte del varicocele, principalmente del testículo izquierdo, aun cuando el mecanismo por el cual se produce permanece todavía sin explicación, por lo cual cuando vemos un testículo disminuido de volumen implicaría que su función espermatogénica y no la función hormonal está disminuida y muchas veces ausente. Steeno
(1976) afirmaba que 34% de varones entre 12 y 25 años con un varicocele grado II tenían cambios testiculares en comparación con un 81% de los que presentaban varicocele grado III. Dentro de éste ultimo grupo en edades comprendidas entre 18 y 25 años un 98% tenían cambios testiculares, confirmando que la hipotrofia testicular es un efecto inevitable de los varicoceles de grados avanzados (grado III). (Steeno 1976, Laven 1992, Turek 1995, Paduch 1997, Paduch 2001).
Es importante que descartemos cualquier otra causa que haya podido llevar al paciente a una disminución de su volumen testicular, como por ejemplo antecedentes de inflamación-infección anexial o testicular (epidídimo-orquitis), o antecedentes de haber tenido traumatismos en el área escrotal por agresiones físicas, caídas con trauma genitoescrotal o durante actividades deportivas, antecedentes de torsión testicular o los antecedentes de criptorquidia, ya que serían factores todos ellos que podrían ocasionarnos disminución de volumen testicular sin reladonarlo obligatoriamente con la presencia de varicocele (Ku).
Es importante que destaquemos que el índice de Atrofia (AI) (Thomas 2002) es determinado por la formula :

El número resultante será considerado el porcentaje de atrofia del testículo en estudio. La atrofia testicular se define como la disminución de por lo menos un 15% del testículo izquierdo en comparación al testículo derecho (Thomas, 2002).
Ku (2002) refiere que cuando hay jóvenes con varicocele éste afectará negativamente el volumen del testículo del lado afectado y a mayor grado del varicocele habrá más posibilidades de hipetropfia del testículo contralateral. El mismo autor refiere su definición de atrofia y la coloca como la disminución de 25% o más del volumen por mi en comparación con el testículo contralateral o una diferencia de 3 cm o más en el tamaño de ambos testículos.
Steeno (1976) reveló en un estudio excelente que había perdida de volumen testicular así como cambios en la consistencia del testículo (más duro), en el testículo del mismo lado del varicocele en 1/3 de los pacientes con un varicocele grado II y en un 80% de los pacientes con varicocele grado III (ambos detectados en el examen físico).
Es importante aclarar que la mayoría de los investigadores en el mundo entero consideran al testículo derecho como normal, aunque tengamos la presencia de varicocele derecho, que por razones aun no explicadas a plenitud, no sufre las mismas consecuencias deletéreas sobre el volumen testicular como ocurre con el testículo izquierdo.
Refiere Gershbein (1999) que entre un 70-80% de pacientes adolescentes con hipotrofia testicular izquierda operados de varicocele, muestran signos de aumento del volumen testicular en su período postoperatorio tardío.
Amelar-Dubin (1970) publicaban un estudio en la prestigiosa revista Fertility Sterility, donde mencionaban que aun los varicoceles subclínicos diagnosticados por eco-doppler podrían tener los mismos efectos dañinos sobre el testículo que los varicoceles de gran tamaño. Según Amelar-Dubin (1970) el varicocele subclínico tiene una incidencia del 21 al 80%.
Fariss (1981) contradice ésta hipótesis de Amelar-Dubin (1970) en un trabajo publicado en la misma revista, donde menciona que varones con grandes varicoceles tienen repercusiones seminales (parámetros seminales alterados) mas significativas que varones con varicoceles mas pequeños, sobre todo referido al contaje espermatozoico (concentración y volumen total).
McClure (1991) reporta sin embargo las mismas conclusiones que Amelar-Dubin (1970), donde se recomienda el tratamiento de los varicoceles subclínicos con mejoría de los parámetros seminales en los meses subsiguientes. Kass-Belman (1987) también comparten el criterio del diagnostico preciso y tratamiento precoz en la población de adolescentes que presenten varicocele bien sea unilateral o bilateral.
Inclusive hay numerosos autores que aseveran que los resultados de la cirugía de varicocele no serán iguales, dependiendo del volumen del varicocele. A mayor tamaño del varicocele mejores resultados postoperatorios en el área seminal (Bsat, 1988), es decir, se obtendrán mejoras sustanciales de los resultados del espermograma. En su trabajo mencionaba que aquellos pacientes con varicoceles palpables mejoraban un 85% sus parámetros seminales en cambio aquellos cuyo varicocele no era palpable mejoraban solo un 27%... Esto sin embargo tiene para nosotros un punto a rebatir y es el caso de los varicoceles bilaterales, donde sabemos que sucede exactamente lo contrario, es decir si dejamos de operar el varicocele subclínico derecho y solo operamos el varicocele clínicamente evidente izquierdo, tendremos peores resultados postoperatorios en el área seminal (parámetros del espermograma) y obtendremos peores porcentajes de embarazo en las esposas de dicho pacientes.
Belani (2004) concluyó en su trabajo sobre 65 pacientes con varicoceles unilaterales o bilaterales que los varicoceles grado III tienen unas venas del plexo pampiniforme mas grandes si las comparamos con los pacientes con varicocele grado I.
Recientemente Thomas (2002) publicó un trabajo de investigación en 124 pacientes entre 7 y 18 años concluyendo que los adolescentes con varicocele tienen un riesgo sustancial de detener su crecimiento testicular, sin tener relación con el grado de varicocele.
Hay autores que preconizan que en los jóvenes adolescentes con varicocele solamente aquellos que presentan varicocele clínicamente détectables a través de palpación deberían ser considerados
potendalmente significativos y no utilizar en lo jóvenes eco-doppler ni darle importancia a los varicoceles subdínicos. Esto también tiene un punto débil y es que la predisposición a tener el varicocele lo presentan ambos plexos pampiniformes y podría ser causa de una mejoría parcial y no de una mejoría mas completa el hecho de enfocar solamente la cura de varicocele unilateral, aun siendo un joven adolescente. Esto es por supuesto tema de debate en congresos y jornadas de urología y en el campo de la fertilidad.
Según varios autores el volumen testicular no aumentará luego de los 14 años, ya que el crecimiento testicular se completa a ésta edad y solamente la zona interstidal testicular podría seguir desarrollándose para la producdón hormonal de testosterona (Cayan, 2002, 2004).
Otro de los factores pronósticos que se manejan en la adualidad son los factores endocrinológicos donde tener un FSH por debajo de 300 ng/ml o menos de 11.7 mIU/ml podría predecir un incremento en la fertilidad postoperatoria (Marks, 1986, Yoshida, 2000).
ANORMALIDADES HISTOLÓGICAS TESTICULARES PUEDEN DEMOSTRARSE EN AMBOS TESTÍCULOS DE UN PACIENTE INFÉRTIL CON VARICOCELE UNILATERAL O BILATERAL Y SE DESCRIBEN DETENCIÓN DE LA MADURACIÓN DE LA ESPERMATOGÉNESIS, ENGROSAMIENTO MEMBRANA BASAL DE LOS TUBU-LOS SEMINÍFEROS, DISMINUCIÓN DE LA ESPERMATOGÉNESIS, HIPERPLASIA DE LAS CÉLULAS DE LEY-DIG, DISMINUCIÓN DEL NÚMERO DE CÉLULAS DE SERTOLI POR TUBULO, CAMBIOS CITOPLASMÁTICOS EN LA CÉLULAS DE SERTOLI (Agger, Charney Ibrahim, Fretz). HABRÁ TAMBIÉN CAMBIOS VASCULARES ASOCIADOS AL VARICOCELE COMO ENGROSAMIENTO ENDOTELIAL, FIBROSIS DE LA ÍNTIMA Y UN AUMENTO DEL COLÁGENO EN LA MEDIA DE VENAS, VENULAS Y CAPILARES. CUANDO TENGAMOS VARICOCELE GRADO III ENCONTRAREMOS HIPERTROFÍ A DE LAS FIBRAS MUSCULARES LISAS LONGITUDINALES (Paduch, 1999, 2001, Agarwal, 1991, Tanji, 1999, Burch, 1985, Scott, 1958, Entriby, 1967).
El determinar la histología testicular a través de la biopsia tendrá una importancia sustancial, sobre todo en casos de severa oligo-zoo-astenospermia, en aquellos casos que tenemos reducción importante del volumen testicular (hipotrofia) uni o bilateral, que nos dé la posibilidad de explicar de manera convincente una posible causa de falla en la obtendón de embarazo posterior a la cura de varicocele o una ausenda de mejoría de los parámetros seminales alterados previos a la cirugía. Si no tuviéramos hallazgos histopatológicos nunca podríamos dar una respuesta convincente a nuestros pacientes sobre todo insistimos, en aquellos casos con oligozooas-tenospermia severa.
Marmar (2004) revela que no se vieron efectos adversos en los parientes con varicocele sometidos a biopsia testicular y que sin duda forma parte del estudio de pacientes con varicocele con una o más alteraciones del espermograma.
Inclusive la biopsia testicular bilateral, nos dará la indicación para una terapia andrológica coadyuvante precisa y facilitará un pronóstico mas acertado del caso clínico. Por ultimo nos dará la posibilidad de orientar el caso hada otras técnicas de fertilización o inclusive de fertilización con semen heterólogo o inclusive de llegar a la adopción en caso de tener patrones histológicos irreversibles y no querer la pareja utilizar semen heterólogo
Se ha demostrado desde hace mas de 25 años que los cambios histopatológicos en las biopsias de parientes con varicocele unilateral, lo podrían presentar por igual los dos testículos, lo que también sería una causa para considerar la corrección bilateral del varicocele aun cuando del lado derecho lo tengamos solamente subclínico, no palpable y no visible. Sin embargo hay que decir que en la mayoría de los casos los cambios histopatológicos son principalmente del testículo afectado por el varicocele y de intensidad leve en comparación con los adultos (Kass, 2001).
Los hallazgos histopatológicos testiculares que podríamos conseguir en pacientes con varicoceles, son muchos y variados por lo cual la idea de acompañar las correcciones quirúrgicas de varicocele sean unilaterales o bilaterales, con biopsias testiculares no es para nada descabellada, ya que aquellos pacientes que usualmente no mejoran sustancialmente sus parámetros seminales, o inclusive empeoran, o tienen grandes varicoceles izquierdos con varicoceles de menor grado del lado derecho en el postoperatorio, se debe principalmente a las características histopatológicas testiculares que en ése momento presentan, y eso será la explicación a la mala respuesta a la drugía o a cualquier forma de terapia. Esto es un aspedo digno de reflexión.
Si pensamos que aprox. un 80% del volumen testicular es dado por los túbulos seminíferos, cuando tenemos una disminución del volumen testicular por la presenda de un varicocele afedará sustandalmente la masa de túbulos seminíferos y por ende afectará la espermatogenesis con todas sus consecuencias.
El varicocele ocasionará cambios vasculares como prominencias endoteliales, fibrosis de la íntima y un aumento de la cantidad de colágeno en la media de venas, vénulas y capilares (Agarwal, 1991).
Los hallazgos histopatológicos más usuales son: detendón de la maduración en la espermatogenesis, disminudón de la espermatogenesis, engrasamiento del epitelio tubular, hiperplasia de las células de Leydig, atrofia de las células de Leydig. El hallazgo de hiperplasia de las células de Leydig es de tal importancia, que se ha comprobado que su presenda limita el porcentaje de obtención de embarazos de manera dramática. No así la atrofia de las células de Leydig. Habrá esclerosis de la lamina propia peritubular con pérdida de la lámina y colágeno tipo IV (Santoro, 2000).
Burch (1985) refiere que las alteradones histológicas de las células de Sertoli, del epitelio germinal, de la barrera hemato-testicular y del intersticio con énfasis en las células de Leydig, son frecuentes en casos de varicocele. Igualmente Scott (1958) y Entriby (1967) referían que en ambos testículos con varicocele existía un desprendimiento de epitelio germinal inmaduro.
Kim (2002) en su capitulo sobre apoptosis y su importancia en la disfundón espermatogenica menciona al igual que Baccetti (1996) que en parientes con varicocele habrá un aumento de la apoptosis en las células germinales, visto tanto en biopsias del testículo ipsilateral como en el contralateral y su importancia la menciona Lin en su trabajo donde relaciona la apoptosis con estados de hipoesper-matogénesis y por ende con infertilidad masculina.
Se ha mencionado muchas veces que lo que hace a un procedimiento quirúrgico exitoso o no, es la intensidad de los cambios patológicos sobre las células de Leydig o sobre las células de Sertoli.
Johnson-Agger (1978) aseveraron que los cambios histopatológicos testiculares mejoraban notablemente después de la cirugía de varicocele, no llegando jamás a la normalidad.
Heinz (1980) hizo biopsias testiculares en jóvenes sometidos a cirugía de varicocele y encontró cambios epiteliales tubulares, cambios histológicos en el compartimiento intersticial y cambios en los vasos sanguíneos.
Cuando la severidad de los cambios histopatológicos testiculares sobre el epitelio tubular y sobre el compartimiento intersticial producto del varicocele, están muy avanzados, no serán ya reversibles, aunque se haga cirugía o cualquier otra forma de terapia.
1. Ecografía escrotal simple con transductores de 7.5 Mhz
Es el estudio más indicado para diagnosticar el varicocele, inclusive superior al propio examen físico palpatorio. Los modernos transdudores utilizan fre-cuendas de 1 a 10 MHz. Sin embargo los mas utilizados en el área escrotal son los denominados ultrasonidos de alta resolución con frecuencias de 7.5 a 10 Mhz que significaría la generación de ondas ultrasónicas entre 7.5 a 10 millones de compresiones de la onda ultrasónica por segundo (Lipshultz, 2002). La ecosonografía escrotal nos ayudará en los diagnósticos de afedadón infecdosa epididimaria, en la presencia de hidrocele, de hidrocele del cordón, de tumores testiculares, de granulosas espermáticos posterior a vasedomías donde se extravasa el liquido espermático, de quistes epididimarios, de espermato-cele ubicados en la cabeza epididimaria y por supuesto en confirmar la hipotrofia o atrofia de uno o ambos testículos. No nos olvidemos que el volumen normal testicular de un varón postúberal es de 15 a 20 cc.
Rifkin (1983), fue el primero en reportar la aplicación de la ecografía escrotal al diagnostico de varicocele. Determinará no solo la presenda de varices del plexo pampiniforme al estar éstas dilatadas por arriba de 2 a 3 mm de diámetro venoso, sino que nos dará otras informaciones de gran importancia entre las cuales tenemos el volumen testicular, detalles ecograficos del testículo en sí, descartando lesiones de ocupación de espado, características ecograficas del parénquima testicular (de gran importancia) en los pronósticos del caso clínico, caraderísticas de la presenda o no de liquido dentro de la capa vaginal testicular, patologías de la cola, cuerpo y cabeza epididimaria (diagnostico diferendal y fador pronostico), presencia o no de lesiones quisticas o tumorales en el cordón espermático, y la presencia de signos ecograficos inequívocos de inflamación-infección crónica de las áreas involucradas en la espermatogénesis y en el almacenamiento y capadtadón esper-matozoica, como son el testículo, el epidídimo, las vesículas seminales y la próstata (éstas dos ultimas estructuras vistas por la ecosonografía prostática endorredal, que forma parte de la evaluación seminal de un padente en estudio por infertilidad).
Gat (2004) refiere que el diagnóstico ecográfico de varicocele está basado en dos criterios de detección de 2 a 3 venas, uno de las cuales mida mas de 3 mm de diámetro y reflujo de mas de 1 segundo inducido por maniobra de valsalva detectado ecográficamente.
Según Lipshultz (2002,1997) la evaluadón ecográ-fica de un paciente con varicocele lleva no sólo el diagnosticar el varicocele pero tan bien el analizar la anatomía peritesticular y por eso se debe hacer con transdudores de alta resolución (6.5 a 10 Mhz), en posidón decúbito dorsal y en posición de pié, debemos pedir que el paciente haga una maniobra de Valsalva y debemos estar en capaddad de observar mas de 3 venas de 2 mm de diámetro o una vena de mas de 3 mm de diámetro. Debemos estar por ende en capaddad de diagnosticar varicoceles subdínicos para enfocar adecuadamente la terapia a seguir.
En referencia a los varicoceles subclínicos es importante aclarar que no importa el tamaño del mismo, ya que puede haber varicoceles pequeños que no se pueden palpar (subclínicos) y que causas un deterioro significativo de los patrones del espermograma, por lo cual el diagnosticarlos con ecosonografía resulta de suma importanda, así como con venografía, eco doppler, termografía y estudios con radionucleidos.
El criterio diagnostico es cuando se consiguen venas escrútales de mas de 3 mm de diámetro, con o sin maniobra de Valsalva y con o sin reflujo. Los criterios que se utilizan para determinar que podría haber varicocele es cuando tengamos mas de 3 venas dilatadas, venas de 2 a 3 mm de diámetro con reflujo y venas mas grandes de 2 mm en reposo con un aumento de diámetro mayor de 0.5 mm con maniobra de Valsalva. Y el criterio de no haber varicocele es tener venas no mayores de 2 mm en reposo.
Util en casos dudosos con los métodos convencionales, lo cual sucede en raras ocasiones. Diagnosticará el reflujo venoso tanto desde el punto de vista auditivo como impreso en el polígrafo en versión blanco-negro o en color. Podríamos utilizarlo en casos de varicocele subclínico, que no sea muy claro en la ecosonografía escrotal simple con transductores de alta resolución (6.5-7, 5-10 Mhz) y en casos donde se sospeche un varicocele bilateral y en casos donde el joven tenga varicocele izquierdo grado III, pero que no se logre demostrar con la ecosonografía escrotal estándar (Cayan, 2001).
Hay autores que no creen en la absoluta especificidad y sensibilidad del eco doppler para el diagnóstico de varicocele ya que por ejemplo Hirsch (1992) demostró en un trabajo excelente que al pedirle al padente que haga esfuerzo (Valsalva) se ocasionará un reflujo doppler-positivo en el 83% en la vena espermática izquierda y en un 59% en la vena espermática derecha en un estudio que comprendía 118 parientes sin varicocele dínicamente diagnosticable. Aun mas cuando el estudio doppler fue comparado con la venografia espermática izquierda, resultó poco útil en distinguir entre venas espermáticas competentes e incompetentes. Por lo cual tanto Lipshultz (2002) como Hirsch (1992) recomiendan utilizar el eco doppler para confirmar hallazgos físicos de varicocele y no se realizará cuando tengamos una percepción normal del cordón espermático.
Es un estudio utilizado ocasionalmente, para confirmar la presencia de un varicocele subclínico, para hacer el seguimiento de un caso clínico, o para detectar recurrencias posquirúrgicas. No está disponible de manera masiva y sobre todo tendrá utilidad solamente en casos de varicocele unilateral. Gat (2004) refiere que la termografía es más sensible y precisa que el ultrasonido-Doppler y recomienda que pudiera ser utilizado como prueba de tamizaje poblacional como modalidad única en hombres infértiles.
Gat (2004) refiere que luego de haber estudiado 195 parientes la termografía es más sensible y predsa para la detección de varicocele que el ultrasonido-doppler y que el examen físico, pudiéndose utilizar como prueba de tamizaje poblacional como modalidad única en pacientes infértiles.
Es el método mas objetivo de diagnostico de varicocele, pero es también el mas invasivo y mas costoso, por lo cual no ha tenido arraigo en la mayoría de los urólogos, aparte de necesitar de radiólogos intervencionistas muy experimentados. Se utiliza cuando al paciente se le va a realizar una embolización como opción terapéutica, útil en casos de recurrencia posquirúrgica del varicocele, donde resulte imprescindible saber si hay una vena alterna que no se ligó. Ubicará la causa y localización de la recurrencia venosa. Niedzielski (2001) determinó que la venografia intraoperatoria disminuye el porcentaje de recurrencia. Venas comunicantes derecha-izquierda podría estar presente en pacientes adolescentes con recurrencia después de varicocelectomía.
5. Gammagrafia Escrotal con radionucleidos
Tendrá aplicación solamente en casos de varicocele unilateral y tiene un alto porcentaje de falsos negativos. Minayoshi(2001) correlacionó la hemo-dinámica de los varicoceles del lado izquierdo con espermatogenesis post-varicocelectomia. Llegando a conclusiones no sustanciales y que no han sido reproducidas de manera masiva por otros investigadores.
De difícil obtención en adolescentes. En etapas puberales precoces los espermatozoides no se consiguen en el estudio seminal, pero a los 2-3 años del comienzo de la pubertad ya los parámetros seminales serán iguales a los que muestran los hombres adultos.
Chevall-Purcell (1992) recomiendan no confiarse en parámetros normales de un varicocele de un adolescente ya que el mismo podría deteriorarse y mostrar parámetros seminales bastante alterados con el correr del tiempo, por lo cual es importante hacer espermogramas periódicamente en pacientes bajo estudio por varicocele y/o por infertilidad.
INDICACIONES DE ESTUDIO Y TRATAMIENTO EN JÓVENES CON VARICOCELE
El único gran objetivo que persigue el tratamiento de los jóvenes con varicocele es preservar y/o mejorar su fertilidad, preservando lo mejor posible la función testicular, eliminado el varicocele y tratando de tener el menor porcentaje de complicaciones posibles (Cayan, 2002).
Tomando en cuenta muchos aspectos de los hallazgos clínicos, hallazgos histopatológicos sobre el testículo, antecedentes familiares directos, antecedentes de enfermedades del área genital, de antecedentes quirúrgicos, antecedentes clínicos de laboratorio, pruebas funcionales hormonales, se han colocado las indicaciones abajo indicadas.
1. Disminución del volumen testicular identificado con ecosonografia escrotal y comparado con patrones o tablas de crecimiento testicular para la edad del paciente. Inclusive según Kass el varicocele en los adolescentes induce disminución del volumen tanto del testículo derecho como del testículo izquierdo.
Aun mas, Akbay (2000) demuestra en un estudio realizado en Turquía la relación del varicocele con la atrofia testicular y refiere que por debajo de 11 años ninguno de los niños por ellos tratados tuvo atrofia testicular aun teniendo varicocele. Entre 11 y 14 años ya comienza a presentarse la atrofia en un 7.3% y aumenta a 9.3% en aquellos adolescentes entre 15 y
19 años, por lo cual podríamos inferir que deberíamos operarlos antes de la edad de 15 años para no conseguirnos con hallazgos de atrofia testicular, que pudiera en ultima instancia no ser reversible.
2. Cambios en la consistencia del testículo (reblandecimiento).
En un excelente trabajo publicado en el Journal de urología Cayan (2002, 2004) refiere que todos sus niños estudiados antes y después de la cura de varicocele adquirieron una firmeza o consistencia normal de sus testículos después de la cura de varicocele.
3. Parámetros seminales alterados en variadas formas (según Pryor, 1996), al menos 2 espemogra-mas con anormalidades persistentes en contaje, motilidad y morfología. Como en el contaje por mi (concentración), contaje total (concentración x ml del eyaculado), movilidad del espermatozoide, velocidad del espermatozoide, traslación del espermatozoide, cantidad de espermatozoides vivos o muertos, morfología espermática, y la presenda de sedimento espermático infeccioso. Lipshultz (1977, 2002) confirma que en un 50-80% de los casos habrá una mejoría de los parámetros seminales posterior al tratamiento quirúrgico y un 30 a 40% de los parientes tendrán embarazos en sus parejas posterior a la cura quirúrgica de varicocele.
Recientemente Cheval (1992) publicó un trabajo de gran importancia ya que afirma que hombres que tenían parámetros seminales normales y tenían varicocele no tratado, 77% de ellos desarrollaron alteraciones seminales sobre todo en su contaje y 88% desarrollaron alteraciones de la movilidad espermática, lo cual hace deducir que aquellos pacientes con varicocele y espermogramas normales no siempre mantendrán éstos patrones , lo cual es útil en casos de hombres con infertilidad secundaria, es dedr que ya habían tenido hijos y tienen un varicocele en su examen físico. Este puede haber originado en el tiempo alteraciones sustanciales en los parámetros seminales de contaje total, densidad espermática, movilidad, traslación y morfología.
En un trabajo de investigación de Kibar (2002) y colaboradores analiza los efectos de la varicocelecto-mia subinguinal sobre la morfología de Kruger (1993) y el resto de los parámetros seminales y concluye que sin duda hay una significativa mejoría en la densidad espermática, en la motilidad y traslación de los espermatozoides y en la morfología del mismo evaluados por la clasificación de Kruger (1993).
4. Antecedentes de biopsia testicular con afectación de la espermatogenesis (indicación no usual).
5. Varicocele grado III unilateral o bilateral.
6. Varicocele bilateral.
7. Varicocele(s) sintomático.
8. Varicocele subclínico con parámetros seminales afectados en cualquier grado.
9. Antecedentes familiares de infertilidad con o
sin antecedentes de varicocele en la familia.
10. Antecedentes del padre o del hermano con varicocele (Coleman 2001).
11. Haber tenido enfermedades del área seminal
como infecciones bacterianas, I.T.S, enfermedades virales (orquitis urliana-parotiditis), traumas escro-tales-testiculares, antecedentes de criptorquidia operada en la infancia, antecedentes de testículos retráctiles por reflejos cremastericos intensos, práctica de deportes de alto impacto. Tener hábitos tabaquicos y o hábitos de drogas.
12. Test de estimulación GnRH supranormal.
13. Razones exclusivamente cosméticas, donde el paciente le moleste verse el abultamiento en la parte superior de su escroto.
14. En casos aislados , por molestia escrotal ocasionada por el varicocele, siendo esto muy debatible sobre todo a nivel de compañías de seguros.
15. En pacientes que pudiendo ser observados, no puedan cumplir con dicha observación por estar alejados de su medico o estar en circunstancias que impidan dicho seguimiento evaluativo.
TODAS ESTAS RECOMENDACIONES TIENEN COMO OBJETIVO PRIMORDIAL, EVITAR EL DAÑO AL PARENQUIMA TESTICULAR, EVITAR QUE SE SIGA DETERIORANDO LA ESPERMATOGÉNESIS, EVITAR QUE HAGAMOS UNA CIRUGÍA PARCIAL (de un sólo lado), EVITANDO UNA HISTORIA FAMILIAR DE INFERTILIDAD, Y ESTARÍAMOS AYUDANDO A REMEDIAR UN FACTOR DE IMPORTANCIA EN LA GÉNESIS DE PARÁMETROS SEMINALES ALTERADOS YA QUE CON LOS ANTECEDENTES DESCRITOS LA PRODUCCIÓN ESPERMÁTICA PODRÍA ESTAR DETERIORADA O INCLUSIVE AUSENTE.
Las alteraciones histológicas de las Células de Sertoli, del epitelio germinal y del intersticio con énfasis en las células de Leydig, así como en la barrera hemato-testicular son fundamentales tenerlas siempre en la mente del urólogo ya que sin duda la frase de Kass (1994) entra plenamente en vigencia y refuerza lo dicho anteriormente:
"Será el grado de los cambios patológicos en la interrelación células de Leydig/células de Sertoli, lo que finalmente decída sí la cirugía será exitosa con relación a la fertilidad”.
Lo mencionado anteriormente vendría a redimen-sionar el valor de la biopsia testicular y de la histopa-tología, en casos de varicocele con contaje esper-mático bajo, o con cambios notables del volumen testicular.
El manejo del varicocele consiste básicamente en interrumpir el reflujo sanguíneo a través de la vena espermática, lo cual se consigue con cirugía en diferentes niveles y abordajes, con técnicas microquirúr-gicas o las clásicas, con procedimientos laparoscopi-cos o con técnicas de angioembolización.
El tratamiento del varicocele detendrá los efectos nocivos de éste sobre la función testicular, y en un alto porcentaje de casos mejorará la espermatogénesis así como la función de las células de Leydig. Promoverá una esteroidogenesis normal en el testículo y ayudará a mantener un nivel de testosterona sérica normal. Mientras mayor sea el varicocele reparado mayor será también la mejoría de los parámetros seminales (Brandell, 1999). Mencionaremos de manera suscinta las variedades de tratamiento, puntualizando los aspectos más resaltantes de cada uno de ellos.
Riccabona (2003) en Austria revela que al comparar cuatro técnicas de ligadura del plexo pampini-forme en varones adolescentes de edad promedio 12 años (técnica laparoscopica, técnica de Palomo (1949), técnica de Palomo modificada con ligadura de las arterias y venas suprainguinales y retroperi-toneales evitando a través de inyección de contraste los linfáticos que provienen de los testículos y la técnica de abordaje inguinal evitando la arteria testicular, en referencia a recurrencia del varicocele y desarrollo postoperatorio de hidrocele tuvo resultados significativamente diferentes en los 4 grupos. El mejor resultado tomando en cuenta los dos parámetros y la ocurrencia de hipotrofia testicular postoperatoria fue para el grupo operado con la técnica de Palomo modificada.
Tenemos básicamente 5 técnicas para el tratamiento del varicocele sea unilateral o bilateral. En primer lugar el abordaje subinguinal (Amelar-Dubin, 1975, 1977), Lipshultz, Goldstein con microscopía (1992). En segundo lugar el abordaje retroperitoneal (Palomo, 1949). En tercer lugar el abordaje inguinal (Ivanissevitch, 1960). En cuarto lugar la colocación de clips hemostáticos por vía laparoscopica (Donovan, 1992) y en quinto lugar las embolizaciones endovenosas (Kuroiwa, 1991), (Kunnen, 1992), usualmente realizadas por radiólogos invasivistas. Al respecto Nabi (2004) publica su experiencia en 102 pacientes donde demuestra que es técnicamente posible, mínimamente invasiva, es un procedimiento ambulatorio que mejorará significativamente la calidad seminal básicamente en su densidad espermática, pero no hubo mejoría en el porcentaje de embarazos conseguidos posterior al procedimiento.
LA TÉCNICA ADECUADA PARA LA CURA DE VARICOCELE ES AQUELLA QUE NO AFECTE LA FUNCION TESTICULAR, QUE ELIMINE COMPLETAMENTE EL VARICOCELE Y NO OCASIONE RECURRENCIAS Y QUE FINALMENTE OCASIONE EL MENOR POR-CENTAIE DE COMPLICACIONES POSIBLES.
Tenemos tres alternativas quirúrgicas, la vía retroperitoneal, la vía inguinal-subinguinal, la vía inguinal con ayuda de microscopio (Goldstein, 1992) y la vía laparoscopica. Las complicaciones en general con las técnicas quirúrgicas son la aparición de hidrocele en el periodo postoperatorio (3-40%), recurrencia-persistencia del varicocele (10-45%) y daño a la arteria testicular ocasionando hipotrofia o atrofia testicular consecutiva.
La relación al Hidrocele, Radmayr (2004) recomienda el uso de azul de Isosulphan para ayudar al cirujano a identificar y preservar el drenaje linfático, lo cual prevendrá la formación de hidrocele consecutiva al acto quirúrgico.
A las técnicas que no utilizan aditamentos para preservar la arteria espermática, es dedr no utilizan microscopio, se les denomina ANSP (artery nonsparing surgical procedure). Esposito (2004) hace un análisis, uniendo los resultados de 8 centros europeos de cirugía pediátrica sobre 278 niños y jóvenes operados con dicha técnica consiguiendo una incidenda en pacientes entre 7 y 17 años de un 3 a 40% de aparición de hidrocele "de novo".
La vía inguinal clásica fue descrita por Ivanissevich (1960), utilizando el mismo abordaje de la herniorrafia inguinal. Esta técnica dásica realiza una incisión sobre el anillo inguinal interno hacia el anillo inguinal externo, con abertura de la fascia del oblicuo externo, con exposición del cordón espermático y del plexo pampiniforme, con ulterior disección y sección del plexo pampiniforme venoso dilatado. Se describe un 7% de hidrocele consecutivo.
Posteriormente Amelar y Dubin (1977) hacen una modificación a la técnica clásica. Proponen la vía subinguinal la cual es más inferior a la anterior, no incide la fascia del oblicuo externo y realiza el mismo procedimiento con el plexo pampiniforme dilatado. Provee un excelente acceso a las colaterales cremas-téricas y el porcentaje de recurrencia es de menos del 10%. El tiempo de recuperación y de reintegro a las actividades del paciente es menor a 7 días. El porcentaje de atrofia testicular posquirúrgico y la formación de hidrocele es menor que con cualquier otra técnica. El tiempo operatorio es muy rápido (10 a 15 minutos por cada lado). La desventaja que se describe con ésta técnica es que al hacer el abordaje mas inferior podremos conseguir más venas por lo cual podría hacerse mas tediosa la disección y ligadura de las mimas.
La casuística de nuestro grupo por más de 20 años con la técnica subinguinal nos hace recomendarla ampliamente. Sugeriríamos para obtener un mejor resultado final los siguientes datos: Si hay varicocele bilateral, así sea subclínico el del lado derecho, operarlos en la misma sesión quirúrgica, esto favorecerá los parámetros seminales mas rápidamente que si hacemos la cirugía en dos tiempos; realizar una incisión de piel del ancho de un farabeuf, no incidir la fascia del oblicuo externo; hacer una "mínima movilización del cordón espermático" (no exteriorizar el cordón y mucho menos exteriorizar el testículo); colocar solamente un separador de Farabeuf pequeño debajo del cordón (a manera de soporte) para facilitar la cirugía y no requerir ampliaciones de la misma; abrir el músculo cremaster y cerrarlo de nuevo, postligadura y sección de las venas dilatadas del plexo pampiniforme para evitar adherencias dolorosas del cordón; evitar seccionar la mayor cantidad de linfáticos posibles al disecar lo mejor posible las venas dilatadas, para ocasionar la menor cantidad de hidroceles post-varicocelectomia, evitando la ligadura en bloque de los cordones venosos dilatados y ligando individualmente dichas venas dilatadas y cuando tengamos pacientes con oligospermia severa o con altos indicios clínicos de tener alteraciones histopatológicas del testículo y por ende de su espermatogénesis, realizar biopsia testicular bilateral "mínima" en la misma sesión quirúrgica, no alargará el tiempo quirúrgico mas allá de 5 minutos. Posteriormente recomendamos reposo relativo por 7 días y colocación de frío local inguino-escrotal y suspensión escrotal por 1 mes, evitando esfuerzos (valsalva) alrededor de 3 meses.
La técnica inguinal con microscopía de Goldstein (1992) (varicocelectomía microquirúrgica), se hace con el único objetivo de preservar la arteria espermática, cremasterica y deferencial y la mayor cantidad de conductos linfáticos posibles. Se hace una incisión transversa a nivel del anillo inguinal externo, ligando con la ayuda del microscopio todas las venas excepto las venas diferenciales. Reducirá la persistencia-recurrencia del varicocele a un 0-2%, y los porcentajes de complicaciones estarán en el orden del 1 al 5% (Chan, 2001). Tardará 25 a 60 minutos por cada lado operado, lo cual en éste aspecto la hace excesivamente larga. Sin embargo está creciendo en popularidad debido a que permitirá una mejor identificación de venas colaterales (cremastericas, extraespermatica, plexo venoso periarterial, colaterales del gubernaculum testis), a que las arterias testiculares se identifican bastante fácilmente y a que los conductos linfáticos se presevarán de la mejor manera evitando hidroceles.
Russinko (2004) y también Cayan (2004) refieren que la técnica subinguinal con microcirugía es extremadamente efectiva en la terapia quirúrgica del varicocele. Los porcentajes de recurrencia son extremadamente raros, preserva mayor la circulación linfática, lo que ocasiona menor incidencia de hidroceles postoperatorias y según el autor deberá ser la alternativa quirúrgica por excelencia en la población juvenil aquejada con varicocele.
La varicocelectomía laparoscopica realizada por primera vez en 1992 en la Universidad de Iowa por Dono van-Winfield, aislará la vena espermática interna cerca de la desembocadura de la vena renal izquierda y ocasionará bajos índices de recurrencia-persistencia (6-15%). Tiene un corto tiempo de recuperación, las complicaciones son raras (hidrocele 0-4%), no están descritas recurrencias en las series investigadas. La curva de aprendizaje puede ser variable. Puede producir enfisema escrotal, dolor en los hombros por irritación diafragmática. Es una cirugía que podría estar contraindicada en pacientes con cirugía abdominal extensa previa.
La via retroperitoneal descrita originalmente por Palomo (1949), realiza una incisión transversal paralelo al ligamento de Poupart, 3 cm por arriba del anillo inguinal interno, se llega hasta la fascia del oblicuo externo y se incide en la dirección de sus fibras, posteriormente se separan el oblicuo interno y el músculo transverso y se separa el peritoneao medialmente quedando los vasos gonadales los cuales son ligados. El porcentaje de recurrencia es del 0 al 15%, es un procedimiento bastante rápido, Se produce hidrocele en 3% a 33% de los casos (Galejs, 1997).
En la población pediátrica prepuberes y adolescentes, Pintus (Urology, 2001), demostraron en 99 pacientes pediátricos que la técnica retroperitoneal o de Palomo (1949) es el procedimiento mas efectivo para el tratamiento quirúrgico en adolescentes ya que es la que menor porcentaje de recurrencia produce (1.85%).
Según Fish (2003) la ligadura quirúrgica de un varicocele unilateral grado II-III/III en adolescentes con atrofia testicular ipsilateral resultará en reversión de la detención del crecimiento testicular ipsilateral, recrecimiento volumétrico testicular bilateral y un aumento fisiológico en la función endocrina testicular.
Embolización-Escleroterapia percutanea de las venas espermáticas internas
Es un procedimiento reciente (1978), donde se utiliza procedimiento embolizantes endovenosos con balones, alambres y soluciones esclerosantes que no comprometan las estructuras arteriales o linfáticas, ya que de ése modo tendríamos complicaciones. Se realiza o por vía retrogada (vena femoral derecha-vena cava inferior-vena renal izquierda-vena espermática interna)
Por vía anterograda (al aislar una vena del plexo pampiniforme del escroto), la colocación de un alambre o balón en la vena espermática interna. Tiene un tiempo operatorio bajo (10-15 minutos). Tiene mas bajo porcentaje de recurrencia-persistencia, excepto en casos de grandes varicoceles (grado III) donde el porcentaje de recurrencia alcanza un 25-30% y también tiene un porcentaje menor de no poderla realizar. En 1% de los casos habrá atrofia testicular por daño a la arteria espermática.
Tendremos complicación del procedimiento en aprox. 10% de los casos y tendremos éxito terapéutico en un 50%-100% de los casos. Tiene riesgo de migración a la circulación arterial pulmonar del material utilizado para ocluir las venas, se utilizan balones, alambres, contraste caliente, y soluciones de dextrosa concentrada al 70%. Se le describen dolor en flanco, infección, hidrocele dificultades en el acceso venoso, trombosis venosa profunda, perforación venosa, reacciones colaterales al material de contraste utilizado, y hematomas en el sitio de la punción, punciones arteriales y que en la practica sea imposible de practicar ( 8% a 30%) sobre todo del lado derecho.
Laparoscopia
Procedimiento con amplia aplicación en el campo urológico en los momentos actuales. Es un método exitoso para la corrección de varicocele en población adolescente-juvenil. Es una técnica rápida (aproximadamente entre 15 y 30 minutos), segura, ambulatoria y que permite un rápido retorno a las actividades habituales (entre 24 y 48 horas) y no necesita altas dosis de analgésicos. El primer procedimiento de cura de varicocele por técnica laparoscopica lo realizó Sánchez de Badajoz en 1988. Las complicaciones usuales de los métodos quirúrgicos abiertos como el hidrocele, atrofia testicular por daño arterial, son raros por vía laparoscopica (Koyle, 2002, 2004), (Pintus 2001), (Donovan, 1992), (Wuerschimmel, 1995).
McManus (2004) en su estudio sobre 72 pacientes con varicocele, comparó los resultados, tiempo quirúrgico, complicaciones y costos entre la ligadura del varicocele por vía laparoscopica y la varicocelec-tomía subinguinal bajo microscopio y llegó con su grupo a las conclusiones siguientes: el procedimiento laparoscopico resultó más corto en tiempo quirúrgico, no tuvieron varicoceles persistentes o recurrentes, hubo un caso de hidrocele consecutivo y por supuesto el costo fue menor en el caso del procedimiento laparoscopico.
TRATAMIENTO MÉDICO ANEXO AL TRATAMIENTO QUIRÚRGICO
Sin duda alguna la mayoría de andrólogos-urólo-gos en la actualidad están utilizando medicamentos como la L-Carnitina 500 mgs dos veces al día, la cual ayudará a mejorar la calidad seminal, unido a la vitamina E 400 mgs una o dos veces por día, unido a multivitamínicos de amplio espectro.
Como menciona Siddiq (2002) los espermatozoides producidos en el testículo son sometidos a modificaciones postgonadales en la cabeza y cola epididimaria antes de volverse móviles y adquirir su capacidad fecundativa.
La L-Carnitina se concentra en el lumen de la cola epididimaria entrando al espermatozoide por difusión pasiva sufriendo modificaciones bioquímicas. La L-Carnitina estará directamente involucrada en la energía del espermatozoide, en su motilidad y será muy útil en casos de infertilidad masculina idiopática y en casos donde la motilidad y morfología estén afectadas, como por ejemplo en el caso de pacientes con varicocele. Hay estudios que revelan disminución de la concentración de L-Carnitina seminal en pacientes con infertilidad y oligoas-tenospermia.
Además se le recomienda al paciente que bajo ningún concepto practique deportes que de algún modo vayan a producir traumatismos genitales, específicamente testiculares. Por otro lado se le recomienda no realizar trabajos donde haya excesiva temperatura (calor intenso) como por ejemplo cerca de hornos de fundición, ya que puede ser dañino para la espermatogénesis.
También se le recomienda al paciente que no ingiera bebidas alcohólicas o café.
Se recomienda de manera estricta que el paciente no fume y tampoco ingiera medicamentos que puedan tener repercusiones en la espermatogenesis como la cocaína, marihuana, opiáceos, agentes anti-hipertensivos (alfa-bloqueantes adrenergicos, beta-bloqueantes adrenergicos, bloqueadores de los canales de calcio, espironolactonas, diuréticos tiazidicos, agentes psicoterapéuticos como antipsi-coticos, litio, inhibidores de la MAO, fenotiazinas, antidepresivos triddicos, agentes quimioterapéuticos como antimetabolitos, agentes alquilantes, alcaloides de la Vinca, hormonas como esteroides anabo-lizantes, antiandrogenos, estrógenos, reemplazo de testosterona, antibióticos como las tetradclinas, la nitrofurantoina, la neomicina, la gentamicina, la eritromidna y medicadones como la sulfasalazina, digoxina, ciclosporina, colchicina, cimetidina, alopurinol, acetazolamida.
Además se le recomendará evitar agentes físicos como la radiadón ionizante, campos eledromagnéticos y microondas, ruido y vibradones corporales intensas. Se recomendará evitar agentes químicos como los pesticidas, los metales pesados, los gases anestésicos, los solventes orgánicos y los estrógenos medioambientales. Si tienen alguna ocupadón que represente un riesgo para su espermatogenesis es bueno que la deje, como los chóferes de maquinas industriales o de agricultura, pintores, trabajos de campo, trabajadores de imprenta, plomeros de desagües industriales o bomberos.
La recurrencia del varicocele posterior a su tratamiento, se estima entre un 0 a 17% dependiendo por supuesto del tipo de abordaje quirúrgico que se ha utilizado. Se produce usualmente por 5 causas bastante bien predsadas, a saber :
1. Por no haber ligado las "venae comitantes" (plexo periarterial de venas muy finas) que acompañan a la arteria espermática.
2. Presencia de colaterales paralelas inguinales o retroperitoneales que emergen del testículo (del gubernaculum testis) y se anastomosan a venas retrope-ritoneales ligadas pero que se anastomosan a su vez con la secdón proximal de la vena espermática interna ligada más interiormente.
3. Presencia de venas cremastericas dilatadas.
4. En varicoceles grandes grado III a menudo presentan una vena colateral posterior que atraviesa el piso del canal inguinal y entra a la vena iliaca inferiormente.
5. Presencia de venas colaterales extraesperma-tica Por supuesto al no poder identificarlas, serán las responsables de la persistencia-recurrencia del varicocele y con ello del posible fador de perturbación de la espermatogenesis o mejor aun de la no normalizadón de los parámetros seminales y por ende del funcionalismo testicular y con ello la no recuperación de su capaddad fecundativa.
RESULTADOS DEL TRATAMIENTO QUIRÚRGICO
Los riesgos del tratamiento quirúrgico en general son leves, por lo cual es una decisión usualmente fácil para el varón de la pareja infértil realizarse cirugía. En más del 80% de los casos con hipotrofia testicular, el testículo podría aumentar de volumen.
Si no hay complicaciones en la técnica quirúrgica aplicada (ligadura de arteria (s) del cordón esper-mático), se supone que no tendremos agravamiento en la disminución del volumen testicular sino con toda probabilidad tendremos todo lo contrario es dedr un aumento del volumen testicular (siempre y cuando la cirugía sea hecha en etapas precoces de la pubertad-adolescencia).
La histología testicular (espermatogenesis) deteriorada por el efedo del varicocele se estabilizará, mejorará, pero nunca se normalizará.
Los patrones seminales mejorarán en la mayoría de los hombres, pero nunca serán completamente normales, pero si lo suficiente para asegurar una viabilidad de cualquier proceso de inseminadón artificial, o fertilización in Vitro o inclusive fecundación natural.
Según la técnica quirúrgica efeduada, tendremos el correspondiente porcentaje de recurrencia. Pintus (2001) recomienda la técnica de Palomo (1949) (retroperitoneal alta pararredal) como la mejor para varicocele en adolescentes, lo cual creemos que tanto las técnicas de Ivanissevich (1960), como la técnica de Amelar-Dubin (1977) son tan buenas como la mencionada, considerando la meticulosidad y delicadeza con la que se deben hacer dichos procedimientos, sobre todo en jóvenes. La recurrencia estadísticamente reportada es del 0 al 10% (Thomas Jr., 1995,
2002) y la ocurrenda de hidrocele va del 0 al 30% y dependerá exclusivamente del tipo de cirugía efectuada. Las técnicas de abordaje diredo del cordón espermático desarrollaran mas hidrocele postoperatoria que las técnicas retroperitoneales altas, se pro-dudrá Hidrocele de una manera general en 3 a 33% de los casos (Galejs, 1997). Podría haber disminución notable del volumen testicular postdrugia (0-1%) por afectadón de la arteria testicular. La recurrencia-per-sistenda del varicocele podría verse en un porcentaje variable del 2 al 15% de los casos, lo cual no estará ligado de manera paradójica a la obtendón o no de mejores resultados en los parámetros seminales.
Se ha visto el caso de pacientes que venográfica-mente tienen persistencia o recurrencia del varicocele y sin embargo han mejorado sus parámetros seminales y por ende sus porcentajes de embarazo en sus mujeres y hemos visto también el caso contrario, es decir, casos donde el varicocele ha desapareado desde el punto de vista venográfico pero que sus parámetros seminales se han mantenido estables o inclusive han empeorado, lo que daría la pauta para no confiar en ellos como métodos de control en éstos pacientes sino mas bien a los hallazgos histopatológicos testiculares.
En la técnica subinguinal utilizada por Goldstein (1992) y Lipshultz entre otros con la ayuda de la microdrugía se producen menos complicaciones y menor inddencia de hidrocele. Vemos como en un trabajo de investigación de Merhoff (2002) menciona que el porcentaje de complicación con ésta técnica es del 2.9% sin aparición de hidrocele postoperatorio. En cambio con las técnicas sin la ayuda de la micro-cirugía el porcentaje de complicaciones es del 5.4% y aparece un 3% de hidrocele. Por lo que concluyen que el uso de magnificación del campo quirúrgico a través de lupas o con la ayuda de microdrugía podría disminuir el porcentaje de complicaciones y disminuiría la incidenda de hidrocele.
Salzhauer (2004) en su trabajo sobre "Paternidad después de reparación de varicocele en población adolescente", refiere que las varicoceledomias en la pobladón adolescente se hacen con el propósito de preservar ante la fertilidad como el volumen testicular. Aun cuando no se demostró en nuestro trabajo una relación causa-efedo, tampoco se demostró que fuera una conducta peligrosa y preserva la fertilidad.
En pacientes mayores de 12 años que tengan afedadón del volumen testicular, uni o bilateral, confirmado por ecografía escrotal de alta resolución (7.5 Mhz), unido al diagnostico de las dilataciones venosas (mayores de 2 mm de diámetro), en número de 3 ó más, con o sin alteradones de los parámetros seminales (recordar que en edades preadolescentes no tendremos resultados fiables), serán candidatos de drugía de varicocele, por la técnica que mejor domine el cirujano. Se recomienda sin embargo la técnica de mínima manipulación (subinguinal) de Amelar Dubin con o sin la ayuda de lupa. Es imprescindible seguir en el tiempo la evolución volumétrica testicular bilateral de éstos pacientes. Esperar a que se presenten alteraciones seminales es un riesgo que no se debe tomar en pacientes con varicocele juvenil.
(crecimiento en adolescencia) (1962)
En el varón tenemos los siguientes estadios:
GENITALES EXTERNOS
Estadio Gl: pene, testículo y escroto de tamaño infantil.
Estadio G2: aumento del tamaño de los testículos y el escroto (por lo general, el pene no aumenta). Piel del escroto más fina y enrojecida.
Estadio G3: continuación del aumento del tamaño de los testículos y del escroto. Aumenta principalmente la longitud del pene
Estadio G4: continuación del crecimiento de los testículos y del escroto. Aumenta la longitud y el diámetro del pene. Pigmentación de la piel del escroto.
Estadio G5: órganos genitales propios de una persona adulta, tanto por su tamaño como por su forma.
VELLO PUBICO
Estadio Pl: no hay vello púbico.
Estadio P2: crecimiento disperso de vello largo, fino, ligeramente pigmentado, liso o ligeramente rizado en la base del pene.
Estadio P3: vello más pigmentado, más denso, más rizado que se extiende por la sínfisis púbica.
Estadio P4: vello del tipo observado en una persona adulta, pero en menor cantidad.
Estadio P5: vello del tipo observado en una persona adulta, tanto por su tipo como por su cantidad.
La manifestación de pubertad en el sexo masculino es el crecimiento de los testículos como resultado del desarrollo de los conductos seminíferos. El aumento del volumen testicular va seguido de la aparición del vello púbico y del crecimiento del pene.
El crecimiento del vello axilar ocurre generalmente dos años después de que aparece el vello púbico y va seguido de la aparición de vello facial y luego de la del resto del cuerpo.
El crecimiento testicular pasa por un importante período de aceleración y puede medirse de modo más objetivo por medio de palpación comparativa con el orquidímetro de Prader, que consiste en un conjunto de modelos elipsoides de volumen conocido; es posible encontrar volúmenes de 1,2 y a veces 3 mi antes de la pubertad. Un volumen de 4 mi o más indica que la pubertad ya comenzó y los superiores a 12 mi pueden considerarse como adultos.
El vello axilar y facial aparece después del vello púbico. Los cambios de voz surgen generalmente en la fase avanzada del crecimiento genital. Todas las estructuras de la reproducción (próstata, vesículas seminales, etc.) muestran un crecimiento acentuado en la adolescencia a partir del comienzo del desarrollo testicular. La edad de la primera eyaculadón es bastante variable y corresponde generalmente con una fase avanzada de maduradón.
En lo que respecta al aumento de estatura, se observa que al iniciarse el desarrollo genital (G2), el adolescente mantiene una velocidad constante de credmiento (5 a 6 cm y 2 a 3 Kg por año).
La fase de aceleradón del crecimiento comienza cerca de un año después, cuando el adolescente se encuentra en el estadio G3. La veloddad máxima de credmiento coindde con frecuencia con el estadio G4 y va seguida de una desaceleradón gradual en el G5.
Vale la pena recordar que dertas modificaciones fisiológicas (aumento de la tensión arterial, reducción de la frecuencia cardiaca, entre otros) y otras de orden bioquímico (aumento de la fosfatasa alcalina y de la hemoglobina en el sexo masculino, entre otros) a menudo guardan mayor reladón con la fase del credmiento y la maduración sexual que con la edad cronológica.
Se debe destacar que los adolescentes cuyo proceso de maduradón se inicia más tarde que el promedio de la población presentaran también un atraso en lo que respeda a estatura, peso y otras variables del
desarrollo puberal. En el caso de los adolescentes que maduran más pronto que el promedio de la población, todos los cambios puberales ocurrirían antes y se produciría un fenotipo adulto de menor estatura que la del promedio de la población. Esas situaciones de desarrollo en que la aparición de las características puberales se adelanta o se atrasa pueden ser normales y guardan relación con características familiares y, por lo tanto, son motivos de preocupación y ansiedad para los adolescentes que continuamente se comparan con los pares de la misma edad.
Además de la consideración de los factores genéticos que pueden determinar diversos aspectos del desarrollo físico, no se puede dejar de señalar las influencias del ambiente y, en particular, del estado nutricional en el proceso de crecimiento y desarrollo del adolescente.
A continuación veremos la secuencia de acontecimientos puberales en el varón estadounidense promedio, extraído de Brookman RR, Rauh JL, Morrison JA, et al. The Princeton maturation study 1976.
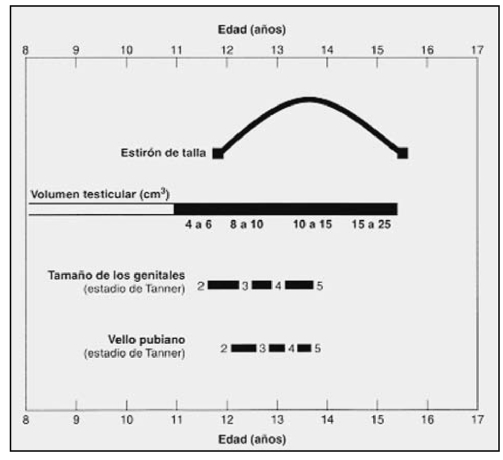
BIBLIOGRAFÍA
Agarwal S. Vascular morphology in testes of infertile males with varicocele. Indian J Med Res 94: 228-231, 1991.
Agger P, Johnson SG. Quantitative evaluation of testicular in varicocele. Fértil Steril 29: 52-57, 1978.
Andrew Eskew L, Jarow JP. Can ultrasonography advance the diagnosis of varicocele? Contemporary Urology 6 (8); 23-27, Aug 1994.
Akbay E, Cayan S, Doruk E, Duce M, Bozlu M. The prevalence of varicocele and varicocele related testicular atrophy in Turkish children and adolescents. BJU Int, 86: 490, 2000.
Alukal J, Zurakowski D, Paltiel H, Diamond D. Does adolescent grade of varicocele correlate with degree of testicular hypotrophy? J Urol 171(4): 146, May 2004.
Aragona F, Glazel G. Prepuberal varicoceles. Urology 52: 348, 1998.
Arslan H et al. Clinical value of power Doppler sonography in the diagnosis of varicocele. J Clin Ultrasound 26: 229, 1998.
Atassi O. Kass E. Testicular growth after successful varicocele correction in adolescent comparison of artery sparing techniques with the Palomo procedure J Urol 153: 482, 1995.
Baccetti B, Coolodel G, Piomboni P. Apoptosis in human ejaculated sperm cells (notulae seminologicae 9) J. Submicrose Cytol Pathol 28: 587-596, 1996.
Bach T, Pfeiffer D, Saeger U, Kuhlmann J. Baseline follicle stimulating hormone is a strong predictor for the outcome of gonadotropin-releasing-hormone test in young men with asymptomatic unilateral varicocele. Abstract # 1568, J Urol 171(4): 413, May 2004.
Badlani G. Balanitis and Balanoposthitis. The Penis and the Scrotum Chap. 7 in Current Urologic Therapy: 253. Seidmon EJ, Hanno PM.WB Saunders Co 1994.
Ball Jr T. Inflammations.Epidymitis and Orchitis. The Penis and the Scrotum Chap 7: 485, in Current Urologic Therapy : 253. Seidmon EJ, Hanno PM.WB Saunders Co 1994.
Ball Jr T. Inflammations. Epididimitis: 429 in Current Urologie Therapy 2a Ed. Edited by Kaufman J.J. WB Saunders Co 1986.
Barqawi A, Caruso A, Meacham R. Experimental varicocele induces testicular germ cell apoptosis in the rat. J Urol 171(l):501-503, Jan 2004.
Barwell R: One hundred cases of varicocele treated by the subcutaneous wire loop. Lancet 1: 978, 1885.
Basile-Fasolo C, Izzo P, Canale D, Menchini Fabris G. Doppler sonography, contact scrotal thermography and venography: a comparative study in evaluation of subclinical varicocele. Int J Fertil 30: 62, 1986.
Belani J, Yan Y, Naughton C. Does varicoceles grade predict vein numer and size microsurgical subinguinal repair? Urology 64(1): 137-139, 2004.
Bennett W: Varicocele particularly with reference to its radical care. Lancet 1: 261-268, 1889.
Benoff S, Hurley I, Barcia M, mandel P, Cooper G, Herslag A. A potential role for cadmiun in the etiology of varicocele-associated infertility. Fertil Steril 67: 336, 1997.
Bong G, Koo H. The adolescent varicocele: to treat or not to treat. Urol Clin N Am 31 (3): 509-515, Aug 2004.
Brand T, Morgan T Jr, Chatham J, Kennon W, Schwartz
B. Adrenal cortical carcinoma presenting as right varicocele. J Urol 165(2): 503, Feb 2001.
Brandel R, Shihua P, Goldstein M. Varicocelectomia. Atlas of the Urol Clin of N Am 7 (1): 145-154, April
1999.
Brendler C: Evaluation of the urologie patient. In Walsh PC, eds. Campbell's Urology, 7th ed. Philadelphia: WB Saunders. 1-142, 1997.
Bsat F, Masabni R. Effectiveness of varicocelectomy in varicoceles diagnosed by physical examination versus doppler studies. Fertil Steril 560: 321-323, 1988.
Burch J, Cromie W. Evaluation and Treatment of the preadolescent varicocele. Urol Clin NA 12(1): 3-12, Feb 1985.
Cayan S, Akbay E, Bozlu M, Doruk E, Yildiz A, Ulusoy
E. The comparison of physical examination orchidometry and color doppler ultrasonography in the diagnosis of pediatric varicocele and the measurement of testicular volumen. Abstract # 606. The Journal of Urology 165 (5). May 2001.
Cayan S, Acar D, Bozlu M, Ulger S, Doruk E, Akbay E. Adolescent varicocele repair: Experience of 84 cases at a single university hospital. Abstract # 1604. J Urol 171(4): 421, May 2004.
Cayan S, Akbay E, Bozlu M, Doruk E, Erdem E, Acar D, Ulusoy E. The effect of varicocele repair on testicular volume in children and adolescent with varicocele. J Urol 168: 731-734, 2002.
Cedenho A, Spaine D, Barradas V, Oehninger S, Srougi M. Human Sperm-Zona Pellucida binding capacity of adolescent with and without varicocele. Abstract
# 1387 AUA Program Abstracts 167 (4): 350, April 2003.
Cohen M, Plaine L, Brown J. The role of internal spermatic vein plasma cathecolamine determination in subfertile men with varicocele. Fertil Steril 1243-1249, 1975.
Coleman J, Goldstein M. The Inheritance of Varicocele. Abstract # 1368. Journal of Urology 165(5), May 2001.
Combine F, Vermeulen A. Varicocele sterility cortisol and cathecolamines. Fertil Steril 25: 88-95, 1974.
Comhaire F, Monteyne R, Kunnen M. The value of scrotal thermography as compared with selective retrograde venography of the internal spermatic vein for the diagnosis of subclinical varicocele. Fertil Steril 27: 694, 1976.
Costabile RA, Skoog S, Radowich M. Testicular volume assessment in the adolescent with a varicocele. J Urol; 147 (5): 1348, 1992.
Cozzolino DJ, Lipshultz LI. Varicocele as a progressive lesion: positive effect of varicocele repair. Hum Reprod Update 7(1): 55-58, Jan-Feb 2001.
Chan P, Goldstein M. Varicocele: Options for management. AUA News. 6(1) Jan/Feb 2001.
Charney CW. Effect of varicocele on fertility. Results of varicocelectomy. Fertil Steril 13: 47,1962.
Cheval MJ, Purcell MH. Deteriorationof semen parameters over time in men with untreated varicocele: evidence of progressive testicular damage. Fertil Steril 57: 174, 1992.
Chen SS, Huang WJ, Chang LS, Wei YH. 8-hydroxy-2-deoxyguanosine in leukocyte of spermatic vein as a biomarker of oxidative stressin patients with varicocele. J Urol 172(4) part 1 of 2: 1418-1421, Oct 2004.
Chia SE, Xu B, Ong CN. Effect of cadmiun and cigarette smoking on human semen quality. Int J Fertil Menopausal Stud 39 (5): 292-298, 1994.
Chiou K, Anderson J, Wobig R, Rosinsky D, Matamoros A Jr, Chen W et al: Color Doppler ultrasound criteria to diagnose varicoceles: correlation of a new scoring system with physical examination. Urology 50: 953, 1997.
Das KM, Prasad K, Szmigielski W, Noorani N. Intratesticular varicocele: evaluation using conventional and Doppler sonography. AJR Am J Roentgenol 173(4): 1079-1083, 1999.
Del Pizzo JJ, Jarow JP. Management of male infertility Ch 29 :335-348 in Urology for Primary Care Physicians Nseyo,Weinman, Lamm.WB Saunders Co, 1999.
Diamond DA, Zurakowski D, Atala A, Bauer SB, Borer JG, Cilenbto BG, Paltiel H, Peters CA, Retik AB. Is adoloescent varicocele a progressive disease process? J Urol 172(4) part 2 of 2:1746-1748, Oct 2004.
Dickerman Z, Landman J, Prager-Lewin R. Evaluation of testicular function in prepubertal boys by means of the lutenizing hormone-releasing hormone test. Fertil Steril 29: 655-660, 1978.
Donahue RE, Brown JS. Blood gases and pH determinations in the internal spermatic veins of subfertile men with varicocele. Fertil Steril 20: 365-369, 1969.
Donovan JF, Winfield HN. Laparoscopic varix ligation. J Urol 147: 77-81, 1992.
Dubin L, Amelar RD. Varicocelectomy as therapy in male infertility. A study of 504 cases. Fertil Steril 26: 217, 1975.
Dubin L, Amelar RD. Varicocelectomia: 986 cases in a twelve-year study. Urology 10: 446-449, 1977.
Dubin L, Amelar RD. Etiologic factors in 1294 consecutive cases of male infertility. Fertil Steril 22: 469,1971.
Dubin L, Amelar RD. Varicocele size and results of varicocelectomy in selected subfertile men with varicocele. Fertil Steril 21: 606, 1970.
Elder JS: Congenital anomalies of the genitalia. In Walsh PC, et al eds. Campbell's Urology. 7th ed. Philadelphia: WB Saunders, 1997.
Entriby AA, Girgis SM, Hernewy H, Ibrahim AA. Testicular changes in subfertile males with varicocele. Fertil Steril 18: 666-671, 1967.
Fariss BL, Fenner DK, Plymate SR. Seminal caracteris-tics in the presence of a varicocele as compared with those of expectant fathers and pre-vasectomy men. Fertil Steril 35: 325, 1981.
Fideleff HL, Boquete HR, Suarez MG, Ruibal GF, Sobrado PG, Azaretsky M, Pujol AB, Sequera AM, Giuseppucci J, Ponzio R. Controversies in the evolution of paediatric-adolescent varicocele: clinical, biochemical and histological studies. Eur J Endocrinol 143(6): 775-781, Dec 2000.
Fisch H, Hyun G, Hensle TW. Tesicular growth and gonadotrophin response associated with varicocele repair in adolescent males. BJU International 91 (1) 75-78, Jan 2003.
Fretz PC, Sandlow JI. Varicocele: current concepts in pathophysiology, diagnosis and treatment Urol Clin N Am 29(4) 921-937, Nov 2002.
Fujino A, Hirsch IH, Lipsshultz LI: An aid of transrectal ultrasonography in the evaluation of ductal abnormalities in the azoospermic patient. Jpn J Med Ultrason. 18(5): 54, 1991.
Fujisawa M, Hiramine C, Tanaka H, Okada H, Arakawa S, Kamidono S.Decrease in apoptosis of germ cells in the testes of infertile men with varicocele. World J Urol. 1999 Oct; 17(5): 296-300.
Fussel EN, Lewis RW, Roberts JA. Early Ultraestructural findings in experimentally produced varicocele in the monkey testis. J Androl 2: 111-119, 1981.
Gangai MP. Balanitis and Posthitis pag 400. Ch 7 The Penis and Scrotum in Current Urologic Therapy 2a Ed. Edited by Kaufman JJ. WB Saunders Co, 1986.
Galejs L, Hollander M. Variations in Varicocele surgery: Surveying the options. Contemp Urol. 9(7): 24-34, Jul 1997.
Gat Y, Bachar GN, Zuckerman Z, Belenky A, Gorenish M. Physical examination may miss the diagnosis of bilateral varicocele: a comparative study of 4 diagnostic modalities. J Urol 172: 1414-1417, Oct 2004.
Gat Y et al. Varicocele: a bilateral disease. Fertil Steril 81: 424, 2004.
Gershbein AB, Horowitz M, Glassberg KI. The adolescent varicocele: left testicular hypertrophy following varicocelectomy J. Urol 162: 1447,1999.
Goes PM, Pasqualotto FF, Lucon AM, Cardillo G, Arap
S. Are semen analysis, testicular volumen and hormone levels different in infertile patients with varicocele compared to fertile patients with varicocele and donors without varicocele. Abstract # 1259 AUA Program Abstracts 167 (4): 318, April 2002.
Goldstein M, Gilbert B, Dicker A. Microsurgical inguinal varicocelectomy with delivery of the testis: an artery and lymphatic sparing technique. J Urol 148: 1808-1811, 1992.
Goldstein M, Pryor JL, Schlegel PN. Evaluation and Management of the infertile male : What's new and what's important. PG Course 91 st Annual Meeting Orlando-Florida, 1996.
Gomez E et al. Development of an image analysis system to monitor the retention of residual cytoplasm by human spermatozoa: correlation with biochemical markers of the cytoplasmic space, oxidative stress and sperm function. J Androl 17: 276-287,1996.
Gorelick J, Goldstein M. Loss of fertility in men with varicocele Fertil Steril 59: 613-616, 1993.
Gorenstein A, Katz S, Schiller M. Varicocele in children: "to treat or not to treat"-venographic and monometric studies. J Pediatr Surg 21: 1046, 1986.
Greenfield A, Scott D, Pennisi D, Ehrmann I, Ellis P, Cooper L,Simpson E, Koopman P. An H-YDb epitope is encoded by a novel mouse Y chromosome gene. Nature Genet. 14: 474-478, 1996.
Greenfield A, Carrel L, Pennisi D, Philippe C, Quaderi N, Siggers P, Steiner K, Tam P, Monaco A, Willard H, Koopman P. The UTX gene escapes X inactivation in mice and humans. Hum. Molec. Genet. 7: 737-742,1998.
Greenfield A, Grimmond S, Van Hateren N, Siggers P, Arkell R, Larder R, SoaresMB, de Fatima Bonaldo M, Smith L, Tymowska-Lalanne Z, Wells C. Sexually dimorphic expression of protease nexin-1 and vani-n-1 in the developing mouse gonad prior to overt differentiation suggests a role in mammalian sexual development. Hum Mol Genet 2000; 9: 1553-1560.
Hadziselimovic F, Leibungut B, Rugna D. The value of testicular biopsy in patients with varicocele. J Urol 135:707, 1986.
Haans L, Laven J, Mali W. Testis volumes, semen quality and hormonal patterns in adolescents with and without a varicocele. Fertil Steril 56: 731, 1991.
Hauser R, Paz G, Botchan A. Varicocele: effect on sperm functions. Hum Reprod Update 7: 482-485, 2001.
Hendin B, Kolettis P, Sharma RK. Varicocele is associated with elevated spermatozoal reactive oxygen species production and diminished seminal plasma antioxidant capacity. J Urol 161: 1831-1834, 1999.
Hirsch IH, Sedor J, Jeyendran RS. The relative distribution of viable sperm in the antegrade and retrogade portions of ejaculte obtained after electrostimulations. Fertil Steril 57(2): 399, 1992.
Honig S. Ultrasonography in the care of infertile man. Contemp Urology 6 (5); 42-63 , May 1994.
Howards SS. Varicocele 457-459 in Current urologic therapy 2a ed. Ed. Kaufman J.J. WB Saunders Co
1986.
Hopps CV, Lemer ML, Schlegel PN, Goldstein M. Intraoperative varicocele anatomy: A microscopic study of the inguinal versus subinguinal approach. J Urol 170 (6) part 1 of 2: 2366-2370, Dec 2003.
Hurt GS, Howards SS, Turner TT.Repair of experimental varicoceles in the rat. Long-term effects on testicular blood flow and temperature and cauda epididymidal sperm concentration and motility J Androl. 1986 Sep-Oct; 7(5): 271-6.
Ibrahim AA, Awad HA, El-Haggar S. Bilateral testicular biopsy in men with varicocele. Fertil Steril 28: 663, 1977.
Ito F, Fuse N, Minagawa H. Internal Espermatic vein prostaglandins in varicocele patients. Fertil Steril 37: 218-222, 1982.
Ivanissevich O. Left varicocele due to reflux experience with 4470 operative cases in forty-two years. J Int Coll Surg 34: 742,1960.
Jarow JP, Ogle SR, Eskew LA. Seminal Improvement following repair of ultrasound detected subclinical varicoceles. J Urol 155: 1287,1996.
Johnson SG, Agger P. Quantitative evaluation of testicular biopsies before and after operation of varicocele. Fertil Steril 29: 58-63, 1978.
Kass E. Evaluation and Management of the adolescent with a Varicocele. AUA Upd. Series Vol IX 1990, 90-95.
Kass E, Stork B, Steinert B. Varicocele in adolescent induces left and right testicular volume loss. BJU Int 87: 499, 2001.
Kass E, Chandra R, Belman A.Testicular histology in the adolescent with a varicocele. Peds 79: 996-998, 1987.
Kass E, Freitas J, Bour J. Pituitary-gonadal function in adolescents with a varicocele. J Urol 139: 207 A, 1988.
Kass E, Marcol B. Results of varicocele surgery in adolescent: a comparison of techniques. J Urol 148: 694, 1992.
Kass E, Belman A. Reversal of testicular growth failure by varicocele ligation J Urol 137: 475-476, 1987.
Kass E, Reitelman C. Adolescent varicocele. Urol Clin North Amer 22: 151-159, Feb 1995.
Kass E. Adolescent varicocele. Pediatr Clin North Am 48: 1559, 2001.
Kass E, Reitelman C. The adolescent with a varicocele: who needs repair? Problems in Urology 8(3): 507-517, 1994.
Keating J et al. Investigation of the association between the presence of cytoplasmic residues on the human sperm midpiece and defective sperm function J reporduc Fertil 110: 71-77,1997.
Kibar Y, Seckin B, Erduran D. The effects of subinguinal varicocelectomy on Kruger morphology and semen parameters. J Urol 168(3) 1071-1074, Sep 2002.
Kim E, Barqawi A, Sea J, Meacham R. Apoptosis: Its importance in spermatogenic dysfunction Urol Clin N Am 29: 755-765, 2002.
Klaiber E, Broverman D, Pokoly T. Interrelationships of cigarette smoking , testicular varicoceles and seminal fluid indexes. Fertil Steril 47(3): 481-486, 1987.
Koyle M, Furness P III, Barqawi A. laparoscopic Palomo varicocele ligation in children and adolescents. Pediatr Endosurg Innov Tech 6: 15, 2002.
Koyle M, Oottamasathien S, Barqawi A, Rajimwale A, Furness P. Laparoscopic Palomo varicocele ligation in children and adolescents: results of 103 cases. J Urol 172(4) part 2 of 2: 1749-1752, Oct 2004.
Ku J, Son H, Kwak S, Lee N, Park Y. Impact of varicocele on testicular volume in young men: significance of compensatory hyertrophy of contralateral testis. J Urol 168(4) (part 1 of 2), 1541-1544, Oct 2002.
Kunnen M, Comhaire F. Nonsurgical cure of varicocele by transcatheter embolization of the internal spermatic vein(s) with a histoacryl tissue adhesive. In: Interventional Radiology 2nd ed. Edited by WR Castaneda-Zuniga and SM Tadaavarthy. Baltimore Williams & Wilkins Co Vol 1 part 2: 73, 1992.
Kuroiwa T, Hasuo K, Yasumori K. Transcatheter embolization of testicular vein for varicocele testis. Acta Radiol 32: 311-314, 1991.
Krausz C, Mills C, Rogers S, Tan S, Aitkin R. Stimulation of oxidant generation by human sperm suspensions using phorbol esters and formyl peptides: relationships with motility and fertilization in vitro. Fertil Steril 62: 599, 1994.
Kruger TF, Acosta AA, Simmons KF, Swanson RJ, Matta JF, Oehninger S. Predictive value of abnormal sperm morphology in in vitro fertilization. Fertil. Steril. 49, 112-117, 1988.
Kruger TF, du Toit TC, Franken DR, Acosta AA, Oehninger SC, Menkveld R, Lombard, CJ. A new computerized method of reading sperm morphology (strict criteria) is as efficient as technician reading. Fertil. Steril. 59, 202-209, 1993.
Kruger TF, du Toit TC, Franken DR, Menkveld R, Lombard CJ. Sperm morphology : assessing the agreement between the manual method (strict criteria) and the sperm morphology analyzer IVOS. Fertil. Steril. 63, 134-141, 1995.
La Rock DR, Sant GR. Lower Urinary Tract Infections in Men.Ch 13:163-169. Epididimitis in Urology for primary care physicians. Nseyo UO,Weinman E,Lamm DL eds. WB Saunders Co 1999.
Laven JS, Haans LC, Mali WP, Te Velde ER. Wensing CJ, Eimers JM. Effects of varicocele treatment in adolescents a randomized study. Fertil Steril 58: 756-762, 1992.
Lemack GE, Uzzo RG, Schlegel PN, Goldstein M. Microsurgical repair of the adolescent varicocele. J Urol 160: 179, 1998.
Lenzi A, Gandini L, Bagolan P, Nahum A, Dondero F. Sperm parameters after early left varicocele treatment. Fertil Steril 69: 347, 1998.
Lin WW, Lamb DJ, Wheeler TM. In situ end labeling of human testicular tissue demonstrates increased apoptosis in conditions of abnormal spermatogenesis. Fertil Steril 68: 1065-1069, 1997.
Lue YH, Sinha-Hikim AP, Swerdloff RS, Im P, Taing KS, Bui T. Single exposure to heat induces stage-specific germ cell apoptosis in rats: role of intratesticular testosterone on stage specificity. Endocrinology 140: 1709, 1999.
Lund L, Tang YC, Roebuck D, Lee KH, Liu K, Yeung CK. Testicular catch-up growth after varicocele correction in adolescents. Pediatr Surg Int 15; 234, 1999.
Lipschultz LI. PG Course # H0213. Advances in male infertility. 2002 AUA Annual Meeting. Orlando-Florida.
Lipschultz II, Corriere Jr JN. Progressive testicular atrophy in the varicocele patient. J Urol 117: 175, 1977.
Lyon RP, Marshall S, Scott MP. Varicocele in childhood and adolescence: Implications in adult infertility. Urol 19: 641-644, 1982.
McClure DR, Hricak H. Scrotal ultrasound in the infertile man: detection of subclinical unilateral and bilateral varicoceles J Urol 135: 711, 1986.
McClure DR, Khoo D, Jarvi K, Hricak H. Subclinical varicocele: the effectiveness of varicocelectomy J Urol 15: 789, 1991.
McManus MC, Barqawi A, Meacham RB, Furness PD, Koyle MA. Laparoscopic varicocele ligation: are there advantages compared with the microscopic subinguinal approach? Urology 64(2): 357-361, Aug 2004.
Marks JL, McMahon R, Lipshultz LI. Predictive parameters of successful varicocele repair. J Urol 136: 609-612, 1986.
Marmar JL,Nurzia M, Millan C, Benoff S. The role of testis biopsies in the work up of patients with varicoceles. Abstract # 1400. J Urol 171(4): 369, May 2004.
McFadden MR, Mehan DJ. Testicular biopsies in 101 cases of varicocele. J Urol 119: 372-374, 1978.
Mehta AL, Dogra VS.Intratesticular varicocele. J Clin Ultrasound 26(1): 49-51, 1998.
Merhoff VF, Carbone DJ. Complication rate of microsurgical varicocele ligation witout delivery of the testis. Abstract # 1230 AUA Program Abstracts 167; (4): 311, April 2002.
Mieusset R, Bujan L. Testicular heating and its possible contributions to male infertility: a review Int J Androl 18(4): 169-184, 1995.
Minayoshi K, Okada H, Fujisawa M, Yamasaki K, Kamidono S. Hemodynamic evaluation of left testicular varicocele by Scrotal scintigraphy. Eur Urol 39(1): 30-35, Jan 2001.
Monoski M, Nudell DM, Lipshultz LI. Effects of medical therapy, alcohol and smoking on male fertility. Contemporary Urology 14 (6): 57-63, Jun 2002.
Nabi G, Asterlings S, Greene DR, Marsh RL. Percutaneous embolization of varicoceles: outcome an correlation of semen improvement with pregnancy. Urology 63(2): 359-363, 2004.
Nicotina P, Romeo C, Arena S, Arena F, Maisano D, Zucarello B. Immunoexpression of aquaporin-1 in adolescent varicocele testes: possible significance for fluid reabsorption Urology 65(1): 149,152, Jan 2005.
Niedzielski J, Paduch DA Recurrence of Varicocele after high retroperitoneal repair: Implications of Intraoperative venography. J Urol 165(3): 937-940, Mar 2001.
Nishida T, Baba K, Nozawa S, Hoshino T, Matsushita T, Yomakawa K, Takahashi T, Iwamoto T. Clinical Features of fertile men and young men with a left varicocele found in epidemiological study for male reproductive health. Abstract # 1570. J Urol 171(4): 412, May 2004.
Noske HD, Weidner W. Varicocele a historical perspective. World J Urol 17(3): 151-157, 1999.
O'Brien J, Bowles B, Kamal KM, Jarvi K, Zini A. Does the gonadotropin-releasing hormone stimulation test predict clinical outcomes after microsurgical varicocelectomy? Urology 63(6): 1143-1147, Jun 2004.
O'Brien JH, Bowles B, Kamal KM, Jarvi KA, Zini A. Microsurgical varicocelectomy in couples with advanced female age: natural history in the era of art. Abstract # 1936 J Urol 171(4): 511, May 2004.
O'Donnell PG, Dewbury KC. The ultrasound appearances of intratesticular varicocoele. Br J Radiol. 71(843): 324-325, 1998.
Okuyama A, Nakamura M, Namiki M, Takeyama M, Utsunomiya M, Fujioka H, Itatani H, Matsuda M, Matsumoto K, Sonoda T. Surgical repair of varicocele at puberty: preventive treatment for fertility improvement. J Urol 139: 562-564, 1988.
Orejuela F, Lipshultz LI. Effects of working enviroment on male reproductive health. Contemporary Urology 10(9): 86-93, Sep 1998.
Oster J. Varicocele in children and adolescent. An investigation of the incidence among Danish school children Scand J Urol Nephrol 5: 27-32, 1971.
Padron OF, Brackett NL, Sharma RK. Seminal reactive oxygen species, sperm motility and morphology in men with spinal cord injury Fertil Steril 67: 1115-1120, 1997.
Paduch DA, Niedzielski J, Skoog SJ. Diagnosis evaluation and treatment of adolescent varicocele. Med Sci Monit 5: 1255, 1999.
Paduch DA, Niedzielski J. Semen analysis in young men with varicocele: preliminary study J Urol 156: 788, 1996.
Paduch DA, Niedzielski J. Repair versus observation in adolescent varicocele: a prospective study. J Urol 158 (3 pt 2): 1128-1132, Sep 1997.
Paduch DA, Davol P, Fuchs EF, Niedzielski J. Varicocele Repair in adolescent. Are we preserving fertility? Abstract # 1229 AUA Program Abstracts 167(4): 311, April 2002.
Paduch DA, Skoog SJ. Current management of adolescent varicocele. Rev Urol 3(3): 120-133, 2001.
Palomo A. Radical cure of Varicocele by a new technique: a preliminary report. J Urol 61: 604- 607, 1949
Parrott TS, Hewatt L. Ligation of the testicular artery and vein in adolescent varicocele. J Urol 152: 791,1994.
Pintus C, Rodriguez Matas MJ, Manzoni C, Nanni L, Perrelli L Varicocele in pediatric patients: comparative assessment of different therapeutic approaches. Urology 57(1): 154-158, Jan 2001.
Potenziani Julio C. Varicocele, www.urologiaaldia.com 3(2), 2001.
Potenziani Julio C. Manejo del Varicocele en adolescentes. ¿Corregir o esperar y observar? Informe Médico 4(6): 1-16, Junio 2002.
Pourbagher M, Guvel S, Pourbagher A, Kilinc
F.Intratesticular varicocele: Report of two cases. Int J Urol 10(4): 231-232, 2003.
Prader A. Testicular size: assessment and clinical importance. Triangle 1966; 7: 240-243.
Pryor JL. Aids in the evaluation of the infertile male: The varicocele dilemma and transrectal ultrasound. Evaluation and Management of the infertile male : What's new and what's important. PG Course 91 st Annual Meeting Orlando-Florida, 1996.
Pryor JL, Howards SS. Varicocele. Urol Clin North Am;
14 (3): 499, 1987.
Radmayr C, Oswald J, Schwentner C, Lunacek A, Bartsch G. The use of isosulphan blue in the micro-surgical repair of varicoceles. A prospective randomized trial. Abstract # 1166. J Urol 171(4): 307, May
2004.
Re M, Ianitelli M, Cerasaro A. Histochemical study of glycogen and phosphorylase activity on bilateral biopsies of oligospermie men with varicocele. Arch Androl 10(1); 79-83, 1983.
Riccabona M,Oswald J, Koen M, Lusuardi L, Radmayr
C, Bartsch G. Optimizing the operative treatment of boys with varicocele: sequential comparison of 4 techniques. Journal of Urology 169 (2) 666-668, Feb
2003.
Richter F, Stock JA, La Salle M, Sadeghi-Nejad H, Hanna MK. Management of prepuberal varicocele. Results of a Questionannaire study among pediatric urologist and urologist with infertility training. Abstract # 1433. The Journal of Urology 165 May 2001 (5). In Urology 58, (1): 98-102, Jul 2001.
Rifkin MD, Foy PM, Kurtz AB. The role of diagnostic ultrasonography in varicocele evaluation. J Ultrasound Med 2: 271-275, 1983.
Rodriguez Netto N, Lemos GC, De Goes GM. Varicocele relation between anoxia and hiposper-matogenesis. Int J Fertil 22: 174-178, 1977.
Russinko PJ, Caldamone AA, Sigman M. The application microsurgical varicocele repair in the adolescent patient. Abstract # 1597 . J Urol 171(4): 421, May 2004.
Scott LS. Report of Glasgow Obstetrical and Gynecological society: J Obstet Gynecol. Br Emp 65: 504, 1958.
Sadeghi-Nejad H, Oates R. Male Reproductive Dysfunction Ch 13 164-184. in Manual of Urology Siroky M, Edelstein R, Krane R. Lippincott, Williams&Wilkins, 1999.
Saleh R, Agarwal A, Sharma R. Evaluation of nuclear DNA damage in spermatozoa from infertile men with varicocele. Fertil Steril 80: 1431-1436, 2003.
Salzhauer E, Sokol A, Glassberg K. Paternity After Adolescent Varicocele Repair. Pediatrics 114 (6): 1631-1633, Dec 2004.
Sanchez de Badajoz E, Diaz Ramirez F, Marin M. Endoscopic treatment of varicocele. Arch Esp Urol 41: 15-16, 1988.
Sanocka D, Miesel R, Jedrzejczak P. Effect of reactive oxygen species and activity of antioxidant systems on human semen association with male infertility. Int J Androl 20: 255, 1997.
Salama N et al. The changes in testicular vascular permeability during progression of the experimental varicocele Eur Urol 43: 84-91, 2003.
Santoro G, Romeo C, Impellizzeri P. Ultrastructural and inmunohistochemical study of basal lamina of the testis in adolescent varicocele. Fertil Steril 73(4): 699-705, 2000.
Sayfan J, Siplovich L, Koltun L, Benyamin N. Varicocele treatment in pubertal boys prevents testicular growth arrest. J Urol 157; 1456, 1997.
Saypol DC, Howards SS, Turner TT, Miller ED Jr. Influence of surgically induced varicocele on testicular blood flow, temperature, and histology in adult rats and dogs. J Clin Invest. 1981 Jul;68(l): 39-45.
Shin D, Honig SC. Economics of treatments for male infertility Urol Clin N Am 29 : 841-853, 2002.
Siddiq FM, Sigman M. A new look at the medical management of infertility Urol Clin N Am 29: 949-963, 2002.
Sigman M, Jarrow JP. Ipsilateral testicular hypotrophy is associated with decreased sperm counts in infertile men with varicoceles. J Urol 158: 605-607, 1997.
Sinha-Hikim AP, Swerdolff RS. Temporal and stage-spe-cific effects of recombinant human follicular stimulating hormone on the maintenance of spermatogenesis in gonadotropin releasing hormone antagonist treated rat. Endrocrinology 136: 253, 1995.
Sinha Hikim AP, Rajavashisth TB, Sinha Hikim I, Lue Y, Bonavera JJ, Leung A, Wang C, Swerdloff RS. Significance of apoptosis in the temporal and stage-specific loss of germ cells in the adult rat after gonadotropin deprivation. Biology of Reproduction. 57, 1193-1201, 1997. Society for the Study of Reproduction.
Simsek F, Turkeri L, Cevik I. Role of apoptosis in testicular tissue damage caused by varicocele. Arch Esp Urol 51 (9), 947-950, 1998.
Silber SJ.The varicocele dilemma. Hum Reprod Update 7(1): 70-7, Jan-Feb 2001.
Skoog SJ, Roberts KP, Goldstein M, Pryor JL. The adolescent varicocele: what's new with an old problem in young patients?. Pediatrics 100: 112, 1997.
Schlesinger MH, Wilets IF, Nagler HM Treatment outcome after varicocelectomy. A Critical analysis Urol Clin North Am 21: 517-529, 1994.
Steeno O, Knops J, Declerck L, Adimoeljia A, van de Voorde H. Prevention of fertility disorders by detection and treatment of varicocele at school and college age. Andrology 8: 47-53, 1976.
Sposito C, Valla JS, Najmaldin A, Shier F, Mattioli G, Savanelli A, Castagnetti M, McKinley G, Stayaert H, Settimi A, Jasonni V, Guys JM. Incidence and management of hydrocele following varicocele surgery in children. J Urol 171(3): 1271-1273, March 2004.
Stone N. Varicocele: 512-516 in Current Urologie Therapy Seidmon E, Hanno P. WB Saunders, 1994.
Tanaka H, Fujisawa M, Tanaka H, Okada H, Kamidono
S.Apoptosis-related proteins in the testes of infertile men with varicocele. BJU Int. 2002 Jun; 89(9): 905-9.
Tanji N, Fujiwara T, Kaji H. Histologic evaluation of spermatic veins in patients with varicocele. Int J Urol 6(7): 355-360, 1999.
Takihara H, Sakatoku J, Fujii M, Nasu T, Cosentino MJ, Cockett ATK. Significance of testicular size measurement in andrology. I. A new orchidometer and its clinical application. Fertil Steril 1983; 39: 836-840.
Tanner J. Growth and adolescence. 2nd ed. Oxford: Blackwell Scientificts, 1962.
Thomas Jr A. Varicocele Ch 56 . 185-188 en Urology Secrets Resnick MI, Novick AC. Hanley & Belfus Inc 1995.
Thomas J, Elder J. Testicular growth arrest and adolescent varicocele: Does varicocele size make a difference? J Urol 168 (4) (part 2 of 2), 1689-1691, Oct 2002.
Turek P, Lipshultz L. The varicocele controversies II. Diagnosis and management AUA Update 1995; XIV (14): 114-119, 1995.
Turner T, Jones C, Roddy M. Experimental varicocele does not affect the blood-testis barrier, epididymal electrolyte concentrations or testicular blood gas concentrations. Biol of Reproduction 36: 926-932,
1987.
Vasavada S, Ross J, Nasrallah P, Kay R. Prepubertal varicoceles. Urology 50: 774, 1997.
Vitale M F, Pantaleo MG, Riccio A "Consideraciones sobre la patogenicidad del varicocele en el adulto. Rev Ven Urol 40(3-4): 63-69, 1990.
Wang C, McDonald V, Leung A, Superlano L, Berman N, Hull L, Swerdloff R .Effect of increased scrotal temperature on sperm production in normal men. Fertility & Sterility 68: 334-339, 1997.
Watson L, Older R. Scrotal Ultrasonography: Technique and interpretation. Contemporary Urology 6(10); 23-35, Oct 1995.
Weiss A, Kellman G, Middleton W, Kirkemo A. Intratesticular varicocele: sonographic finding in two patients. AJR Am J Roentgenol 158: 1061, 1992.
World Health Organization. The influence of varicocele on parameters of fertility in a large group of men presenting to infertility clinics. Fertil Steril 57(6): 1289-1293, 1992.
Witt M, Lipshultz L. Varicocele: a progressive or static lesion? Urology 42 (5): 541-543, 1993.
Wuerschimmel E, Linpsky H, Noest G. Laparoscopic varicocele ligation: a recommendable standar procedure with good long term results. Eur Urol 27: 18,
1995.
Yamamoto M, Hibi H, Katsuno S, Miyake K, Nagoya L. Effects of varicocelectomy on testis volumen and semen parameters in adolescent: a randomized prospective study. Med Sei 58: 127-132, 1995.
Yildiz O et al. Increased vasoconstrictor reactivity and decreased endothelial function in high grade varicocele: functional and morphological study. Urol res 31: 323-328, 2003.
Yoshida K, Kitahara S, Chiba K. Predictive indicators of successful varicocele repair in men with infertility. Int J Fertil Womens Med 45(4): 279-284, 2000.
Zini A et al. Varicocele is associated with abnormal retention of cytoplasmic droplets by human spermatozoa. Fertil.
Zorgniotti AW, MacLeod J. Studies in temperature. Human semen quality and varicocele. Fertil Steril 24: 854-863, 1973.
Dr. Julio César Potenziani Bigelli
Especialista urólogo Hospital Privado Centro Médico de Caracas
Br. Silvia Daniela Potenziani Pradella Estudiante de Medicina UCV.. Escuela Luis Razetti.
GRADO DE GLEASON Y SCORE DE GLEASON EN PACIENTES CON CÁNCER PROSTÁTICO • Significado y trascendencia
El cáncer de próstata representa para el urólogo una patología bastante frecuente y su sola mención originará un sinnúmero de preguntas tanto del paciente como del propio medico en relación a pronostico, estadio, sobrevida libre de enfermedad, sobrevida libre de recaídas bioquímicas, que sin duda se podrían contestar fácilmente o por lo menos los mejor posible siempre y cuando tengamos la mayor cantidad de parámetros a considerar en la estructura de dichas respuestas. Es por ello que desde hace muchos años, los urólogos se han valido de todos aquellos datos que pudieran científicamente, avalar las respuestas que respalden nuestras decisiones terapéuticas. Uno de los más consistentes factores o datos pronósticos ha sido, es y será el sistema de Gleason.
LA INCIDENCIA DEL CÁNCER PROSTÁTICO AUMENTA PROGRESIVAMENTE CON LA EDAD. SEGUN JEMAL (2003) LA PROBABILIDAD DE QUE UN HOMBRE POR DEBAJO DE 40 AÑOS SE LE DIAGNOSTIQUE UN CÁNCER PROSTÁTICO ES DE 1 EN 19.299 HOMBRES. LA PROBABILIDAD DEL MISMO DIAGNÓSTICO EN HOMBRES DE 40 A 59 AÑOS ES DE 1 CADA 45 HOMBRES Y PROBABILIDAD ALC AZARA LA DRAMÁTICA CIFRA DE 1 CADA 7 HOMBRES EN EDADES COMPRENDIDAS ENTRE 60 Y 79 AÑOS, LO QUE HACE IMPORTANTE PODER ADELANTARNOS A LOS HECHOS SABIENDO Y 'RECONOCIENDO' LOS FACTORES DE PELIGROSIDAD PARA EL DESARROLLO DEL MISMO. (Jemal A. Murray T et al. Cáncer Statistics CA Cáncer J Clin 53: 5-26, 2003).
EL MMAS (MASSACHUSETTS MALE AGING STUDY) (Mohr-McKinlay 2001) DETERMINARON QUE LA RESPONSABILIDAD del FACTOR HORMONAL ('T' total,libre, DHT, estradiol,androstenediona entre otros) EN OCASIONAR RIESGO DE CÁNCER DE PRÓSTATA ES DEL 11%, EN COMPARACIÓN DEL 30% DEL FACTOR NUTRICION AL Y DEL 40% DEL FACTOR "INMUTABLE" CONFORMADO POR LA EDAD, HISTORIA FAMILIAR, RAZA. (Mohr BA, Feldman HA, Kalish LA, Longcope C, McKinlay JB. Are serum hormones associated with the risk of prostate cáncer? Prospec- tive results from the Massachusetts Male Aging Study. Urology 2001; 57(5): 930-5).
LA TRASCENDENCIA Y SIGNIFICADO DE LOS GRADOS Y SCORE DE GLEASON EN PACIENTES CON CÁNCER DE PRÓSTATA ES INVALORABLE, YA QUE NO SOLO NOS PERMITIRÁ DIAGRAMAR MEJOR UNA ESTRATEGIA DIAGNÓSTICA, CLÍNICA Y QUIRÚRGICA, SINO QUE NOS PERMITIRÁ SIN DUDA ALGUNA, PRONOSTICAR LA EVOLUCIÓN DE LOS CASOS ESTUDIADOS EN EL TIEMPO, Y LAS POSIBILIDADES DE RECAÍDA BIOQUÍMICA QUE SE TRADUCIRÁN EN ESTRATEGIAS DE TRATAMIENTOS ASOCIADOS Y DE MAYOR ALERTA PARA LOS MÉDICOS A CARGO DE DICHOS CASOS.
Recordando un poco de historia el sistema histopatológico de Gleason (1974,1977) se logró basado en un estudio VACURG (Veterans Administration Cooperative Urological Research Group) sobre 4.000 pacientes estudiados entre los años 1960 y 1975.
Es el factor pronóstico mas seguro de todos los que hasta ahora han tenido los urólogos a disposición. Se han conformado nomogramas preoperatorios, nomogramas postoperatorios para determinar con precisión el porcentaje de sobrevida libre de enfermedad, el porcentaje de sobrevida libre de recaídas bioquímicas y el porcentaje de sobrevida en general, de pacientes con cáncer prostático y en todos ellos lo básico y fundamental es el sistema de gradación histológica de Gleason.
Al respecto D'Amico (Oncology, 2001) definió en el 2001 como 'Grupo de Bajo riesgo' y por ende de buen pronostico a aquellos con cáncer prostático con un PSA sérico de 10 ng/ml o menos, un Gleason Score de 6 o menos y con stadios clínicos de Tic o T2 a en el AJCC (2002) sin recaída bioquímica a 10 años de un 83%. 'Grupo de riesgo intermedio' a pacientes con PSA de 10 a 20 nf/ml, Gleason Score de 7 (3+4 ó 4+3) con estadio clínico T2b, el AJCC, sin recaída bioquímica a 10 años de un 46%. 'Grupo de riesgo elevado' con PSA de mas de 20 ng/ml, Gleason Score de 8 o más y un estadio clínico de T2c (AJCC), sin recaída bioquímica a 10 años de un 29%, lo que da una idea de la importancia actual de los sistemas de gradación de Gleason y la posibilidad de "saber" que caso clínico será de buen pronostico y no nos preocupemos o que caso a pesar de los resultados supuestamente "beneficiosos" tendremos que estar alerta, porque podría hacer recaída bioquímica y con ello cambiar totalmente el pronostico del mismo.
Goldenberg (2004) refiere que la prueba del PSA unido a los hallazgos de la histopatología del paciente puede ser de extremo valor en la estimación de la capacidad de recurrencia del tumor. Según Partin (1997) antígeno prostético es proporcional al volumen tumoral, a los hallazgos en la biopsia prostática y al score de Gleason y al estadio tumoral (Partin AW, Kattan MW, Subong EN et al. Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer. A multi-institutional update. JAMA 1997; 277:1445-51).
Naito (2005) refiere que una sustancial proporción de pacientes hacen elevaciones de PSA total por arriba de 0.2 ng/ml después de una cirugía radical, lo cual implicaría tratamientos dependientes del sitio de la recurrencia, y esto es verdaderamente difícil, con los medios tecnológicos que existen por lo cual se establece que pacientes que tienen un Score de Gleason de 7 o menos, con márgenes quirúrgicos positivos sin compromiso ni ganglionar ni de vesículas seminales y quienes desarrollan recurrencia de PSA mas allá de 1 a 2 años después de la cirugía con un tiempo de duplicación del PSA (PSADT) de más de 1 año y con PSA previo al tratamientos de menos de 1 a 1.5 ng/ml se beneficiarán de radioterapia externa con 64 Gy o radioterapia de salvamento. Pacientes en cambio con características opuestas a las expuestas previamente serán candidatos a terapia hormonal en lugar de la radioterapia.
Freedland (2002) reportó que pacientes con bajo PSA total preoperatorio tenían menos positividad en los márgenes quirúrgicos de la cirugía radical, así como menos enfermedad extracapsular, invasión a vesículas seminales y compromiso ganglionar. Solo el PSA total y el Score de Gleason predicen el tiempo de la recurrencia bioquímica y tumoral (Berger,
2003), (Alemán, 2003), (Shekarriz, 2001). Stamey (2001) refiere que los valores del PSA solamente pueden presagiar el Score patológico de Gleason, si es extremadamente alto o bajo. Entre 2 y 9 de PSA total, éste fue menos eficaz como pronosticador del grado patológico del tumor o de la recurrencia bioquímica. En la serie de Partin de hombres con Tic, la sobrevida libre de recurrencia bioquímica a 10 años en hombres cpn PSA de 10.1 a 20 fue de 61% a 94%. Para pacientes con PSa entre 4.1 y 10 los porcentajes fueron de 71% y 97%.
D'Amico estratificó los valores máximos de PSA estratificando los TIC y definiendo lo que antes mencionamos como grupos de riesgo.
Antenor-Catalona (2004) mencionan que el PSA preoperatorio, el grado de Gleason y el estadio tumoral patológico han sido considerados como pronosticadores independientes de recurrencia tumoral después de la cirugía radical prostática. El volumen tumoral, también se ha correlacionado conel PSA preoperatorio, con el grado de Gleason, con el estadio patológico, y con cáncer en las márgenes quirúrgicas (márgenes positivos) después de la cirugía radical. El volumen tumoral es proporcional al Score Gleason, pronostica estadio patológico (extensión extracapsular, extensión vesículas seminales, alcance a ganglios ileopelvicos) y se correlaciona con márgenes quirúrgicos positivos. Stamey
(1999) menciona que la capacidad de metastizar la adquiere un tumor con el tiempo y de acuerdo a su volumen y va más allá cuando afirma que los patrones grado 4 o 5 de Gleason y el volumen tumoral son los factores determinantes de la progresión tumoral. (McNeal, 1992), (Babaian, 1994), (Blackwell, 1994), (Arcangeli, 1998).
Los grados de Gleason y el Score de Gleason
(1977) en pacientes con cáncer prostático tienen relación directa con el estadio clínico-patológico de la enfermedad, para confirmar que podríamos estar en presencia de tumores localizados, con alcance de la enfermedad a estructuras cercanas y a distancia y tienen directa relación con el pronostico del caso y también con el porcentaje libre de enfermedad posterior a terapéuticas definitivas, con el porcentaje de recaídas bioquímicas y del tiempo de dicha recaída (detección de niveles de PSA por arriba de 0.2 ng/ml) del caso estudiado y con el porcentaje de sobrevida global, del paciente afectado de cáncer prostático.
VASSILIKOS (2000) REFIERE QUE A PESAR DE QUE EL CÁNCER PROSTÁTICO ESTÁ DIAGNOSTICÁNDOSE PRECOZMENTE Y QUE POR ELLO EL VOLUMEN TUMORAL ES PEQUEÑO, UN 35% A 50% DE LOS PACIENTES CON CÁNCER CLÍNICAMENTE LOCALIZADO TENDRÁN ENFERMEDAD EXTRAPROSTÁTICA SIGUIENDO A CIRUGÍA RADICAL PROSTÁTICA. ES POR ELLO QUE PARTIN (1993) REFIERE QUE LOS PRONOSTICADORES MAS IMPORTANTES DE
ENFERMEDAD PROSTÁTICA AVANZAD A (LOCAL O A DISTANCIA) SON EL SCORE DE GLEASON, EL ANTÍGENO PROSTÁTICO ESPECÍFICO Y EL ESTADIO CLÍNICO. PERO YA SE SABE QUE EL ANTÍGENO PROSTÁTICO ES MÁS UN INDICADOR CLÍNICO QUE UN INDICADOR MOLECULAR DE LOS RESULTADOS, EL SISTEMA DE GRADOS DE GLEASON ES UNA MEDIDA DE LA AGRESIVIDAD BIOLÓGICA PERO SIN DUDA LAMAS FIDEDIGNA CORRELACIÓN CON EL ESTADIO PATOLÓGICO FINAL Y POR SUPUESTO CON LOS RESULTADOS OBTENIDOS (PARTIN, 1993-1997), (KAT-TAN, 1997, 1998,1999), (STAMEY, 1999), (NELSON, 2004).
Es de gran importancia para patólogos, urólogos y médicos en general, ya que representa un aspecto relevante en el manejo de hombres con cáncer prostático, debiéndonos esforzar tanto urólogos como patólogos en realizar lo mejor posible, tanto la recolección de la muestra a nivel de nuestros consultorios, como la interpretación de la misma por parte del patólogo encargado del caso. De ésta manera evitaríamos las discrepancias frecuentes entre los resultados previos a los tratamientos definitivos, a través de la biopsia prostática, es decir de la discrepancia clínico-patológica, con la pieza definitiva quirúrgica, y el pronostico basado en la recaída bioquímica del paciente, lo cual en la practica diaria está por arriba del 40%, ocasionando inquietud tanto al paciente como al medico tratante, lo que podría atenuarse de comprender mayor la biología del tumor y con ello su carácter y comportamiento, en la cual el Sistema de Gleason es un aliado excelente.

Grados de Gleason- Score de Gleason
SE DENOMINA SISTEMA DE GLEASON A LA CALIFICACIÓN POR PARTE DEL PATÓLOGO DE LA APARIENCIA HISTOLÓGICA QUE EXHIBE EL CÁNCER PROSTÁTICO CON UNA GAMA VARIADA DE DIFERENCIACIÓN CELULAR, QUE HA PERMITIDO AGRUPARLO EN 5 GRADOS O PATRONES LO QUE REDUNDARÁ EN PODER PREDECIR EL PRONÓSTICO Y EN OPTIMIZAR LA TERAPIA A SEGUIR EN EL PACIENTE AFECTADO. LA GRADACIÓN DE GLEASON TRADUCE LA MÁS ÍNTIMA RELACIÓN ENTRE LA CONDUCTA BIOLÓGICA DEL CÁNCER PROSTÁTICO Y SU ESTRUCTURA HISTOLÓGICA, SEGÚN MERRICK (2002-2004) ES UN INDICADOR PRONÓSTICO DE LA AGRESIVIDAD BIOLÓGICA DE LA LESIÓN CANCEROSA.
El sistema de Gleason identifica 5 patrones de crecimiento del adenocarcinoma prostático invasivo, representado en una escala progresivamente decreciente de diferenciación glandular (Weidner, 1993).
SE DENOMINA SCORE DE GLEASON A LA SUMA DE LA CALIFICACIÓN DADA POR EL PATÓLOGO A LOS DOS PATRONES ARQUITECTURALES MAS PREDOMINANTES DEL CÁNCER PROSTÁTICO EN ESTUDIO. EL GLEASON SCORE PUEDE IR DE 2 A 10 CON TODAS LAS COMBINACIONES POSIBLES, QUE TENDRÁN TAMBIÉN SUS IMPLICACIONES EN EL PRONÓSTICO DEL CASO CLÍNICO EN ESTUDIO.
En relación al cáncer prostático debemos tener a nuestra disponibilidad todos los argumentos posibles que faciliten el enfoque diagnostico y terapéutico para obtener los mejores resultados en el paciente no sólo en su calidad de vida sino en el porcentaje de sobrevida libre de enfermedad en los años subsiguientes al tratamiento efectuado. Es por ello que debemos contar con factores de ayuda para realizar pronósticos acertados en pacientes portadores de cáncer prostático en etapas o estadios tempranos de la enfermedad.
EL SISTEMA GLEASON PERMITE REALIZAR UN PRONÓSTICO DEL CASO CLÍNICO DE CÁNCER PROSTÁTICO, BASADO EN LA APARIENCIA DE LA CÉLULAS. COMO REFIERE SCHWARTZ (2002) EL SISTEMA DE SCORE DE GLEASON ES OTRO NOMOGRAMA CLÍNICO PRECOZ QUE PUEDE TANTO AL MÉDICO COMO AL PACIENTE PARA REFLEIAR EL IMPACTO DEL CÁNCER PROSTÁTICO SOBRE LA SOBREVIDA A LARGO PLAZO. SU VIGENCIA UMVERS AL A LA HISTOLOGÍA PROSTÁTICA CONTEMPORÁNEA ES EL TESTIMONIO DE SU SIGNIFICACIÓN CLÍNICA.
El sistema Gleason está basado en el patrón arquitectural que adoptan las glándulas de un cáncer prostático determinado.
La capacidad que tengan las células de "un tumor prostático determinado" en semejar glándulas normales será denominado "diferenciación" y tendrá mejor pronostico que aquellas células cancerosas que no puedan semejar glándulas normales de la próstata a las cuales se les denominará "indiferendadas" con su correspondiente agresividad biológica con peor pronostico y peor sobrevida.
El patólogo examina al microscopio, muestras de la glándula prostática obtenidas por el urólogo o por el radiólogo intervencionista al ver una ecografía sospechosa de tumor prostático, con o sin eleva-dones sospechosas del antigeno prostático especifico en cualquiera de sus fracciones, y con o sin alteraciones sospechosas de cáncer prostático en el tado rectal, a través de agujas tru-cut dirigidas por ecosonografía prostática endorredal, o con las muestras redbidas después de una resecdón transuretral de próstata (RTUP) o de una cirugía abierta retropu-bica o suprapubica, efectuada o bien por credmiento prostático sintomático o bien por cáncer de próstata (cirugía radical). Sin embargo hay una discrepancia entre los resultados del Score Gleason realizados con los especímenes obtenidos por agujas de trucut y pistolas de biopsia (infragradadón) y los resultados obtenidos con la pieza definitiva extraída por drugía radical prostática. (Partin, 1997), (Brawer, 1991,1994), (Greene, 1991).
Es útil mendonar en éste punto que el padente hoy en día mas frecuente es el Tic, que no es otro que aquel hombre joven (entre 50 y 65 años) con ausenda de anormalidades al tado redal, es decir una glándula que digitalmente es normal, en ocasiones solo con un poco de credmiento prostático benigno, y/o con síndrome de prostatitis asodado, el cual no arroja tampoco ningún hallazgo que haga sospechar el cáncer ni ecosonográficamente (ecosonografía prostática endorrectal), ni tomográficamente, ni por supuesto endoscopicamente. Es dedr, solamente presentará afras de antigeno prostático fuera de rango (> de 2.5 ng/ml) o un porcentaje libre/total por debajo de 18 o de 24% de acuerdo a la edad del paciente, por lo cual habrá que realizar biopsias aleatorias y no dirigidas, pero sobre todo a las regiones externas de la zona de transidón y de la zona periférica.
Desde un punto de vista global las caraderísticas propias de cada padente en cuanto a raza y edad, son sumamente importantes en lo referente a pronóstico del cáncer prostático. La extensión del tumor, se considera otro factor relevante para poder pronosticar un caso de cáncer prostático. La localizadón del tumor, dentro de las diferentes zonas anatómico-topográficas prostáticas, descritas por McNeal (1968) es también otro dato de suma importancia.
La multifocalidad del tumor prostático, aspecto éste, que era casi exclusividad de los tumores uroteliales, está haciendo reflexionar sobre muchos aspedos que tocan el área sobre todo de la terapéutica según trabajos publicados por Stamey y McNeal de la Universidad de Stanford en California (1998, 1999), indusive su coexistenda con cuadros inflamatorios prostáticos (prostatitis) y su coexistencia con cuadros de aumento de volumen de la glándula (crecimiento prostático benigno sintomático o asintomático).
En el aspecto extensión tumoral, tendremos que considerar la invasión perineural del tumor prostático como fador pronostico importante y también la presencia de lesiones concomitantes como el ASAP (atypical small acinar proliférations) (Iczkowski-Bostwick, 1998), de PIN (Neoplasia intraepitelial prostática) (Bostwick, 1996), en un 2 a 16% de preva-lencia en la variedad de alto-grado en biopsias prostáticas y de HAA (hiperplasia adenomatosa atípica) (Helpap, 1995), deberán ser correctamente enfocadas ya que nos predicen la inminente presencia de cáncer prostático en la glándula examinada, e inclusive como en el caso de la HAA nos indicarían con bastante precisión el sitio donde pudiera estar dicho tumor, precisamente en la zona de transición, lo cual nos obligaría a cambiar estrategias ante la posibilidad de nuevas biopsias dirigidas por ecosonografía o aleatorias, para llegar al diagnóstico y con esto a un tratamiento precoz y eficaz y con ello favorecer el pronóstico del paciente afectado.
Según Borboroglu (2001) con la presencia de ASAP habrá un 40% a 60% de incidenda de cáncer prostático en biopsias sucesivas y deberían realizarse biopsias de toda la glándula prostática y no de un área en particular. Cuando hay PIN en la biopsia inicial habrá entre un 27% y un 79% de posibilidad de detectar cáncer prostático en biopsias sucesivas. En cuanto al ASAP tendremos entre un 32.2% y un 65% de posibilidades de detectar cáncer prostático en biopsias sucesivas. Cuando están presentes las dos entidades tendríamos un 51% de posibilidades de cáncer prostático en biopsias sucesivas.
El grado de diferendación celular, así como las variantes histológicas del cáncer prostático, dentro de la estructura tumoral, serán entonces aportes invalorables en la elaboración de pronósticos acertados. Dentro del tema de la biología tumoral, tendremos aspectos como las características del cultivo de células tumorales, la sensibilidad androgénica demostrada por el tumor, las cuales tendrán repercusiones en el tratamiento médico que se le pueda dar al paciente. La respuesta inmunológica y la expresión oncogénica del tumor, serán aspectos a considerar.
Sakr (2004), revela en su excelente artículo de revisión sobre potenciales marcadores patológicos para los estudios de quimioprevendon de cáncer prostático que en virtud de la caraderística de los tumores epiteliales en tener un largo periodo de latencia (ver artículos Quimioprevencion del cáncer prostático". Dr Potenziani JC. www.urologiaaldiacom), es posible sospechar su presencia en base a cambios neoplásicos microscópicos que nos pudieran confirmar la presencia de enfermedad dínica tumoral, cuando ningún otro examen disponible hasta el momento, nos logre siquiera dar pistas al respecto.
En lo referente a lesiones epiteliales atípicas de próstata, Sakr (2004) refiere que la neoplasia intraepitelial prostática (PIN) es multifocal y usualmente ubicada en la zona periférica de McNeal (1968-Stanford University), dicha lesión se adelantará 5 a 10 años al descubrimiento de un cáncer prostático, en poblaciones de alto riesgo. Tendrá el PIN cambios genéticos y moleculares similares al cáncer (alteraciones de la ploidia del DNA, anormalidades cromosómicas, supresión de apoptosis, hipermeti-lación de DNA, y aumento de todos los marcadores de la proliferación celular. Indusive estará asodado a canceres prostático moderadamente diferendados o pobremente diferenciados (es dedr de mal pronóstico). El riesgo para conseguir cáncer prostático en biopsias repetidas aumentará con la presenda de PIN de alto grado de 23% a 79%, y de manera curiosa 35% de canceres detectados en biopsias prostáticas repetidas los conseguiremos en el lado contrario al hallazgo del PIN (Shepherd, 1996).
En un excelente articulo de revisión del Dr Joniau y Van Poppel de Bélgica (2005) acerca de la importancia y del manejo dínico en los casos que aparece neoplasia intraepitelial prostática (PIN) revela que en 1986 la pareja del Dr Bostwick con el Dr McNeal describieron el criterio histopatológico para el diagnostico de lo que al comienzo se llamó 'neoplasia intraductal' clasificada en tres grados (McNeal JE, Bostwick DG. Intradudal dysplasia: A premalignant lesión of the prostate. Hum Pathol 1986; 17: 64-71). Pero serían Bostwick y Brawer quienes propusieron denominarla Neoplasia intraepitelial prostática un año después (Bostwick DG, Brawer MK. Prostatic intra-epithelial neoplasia and early invasión in prostate cáncer. Cáncer 1987; 59: 788-794). La última dasificadón en dos grados (bajo grado y alto grado) la propuso Bostwick en el año 1989. (Bostwick DG. Prostatic intraepithelial neoplasia (PIN) Urology 1989; 34:16-22).
Demostraron que en el caso de la presencia de PIN de alto grado coincidía con la presenda de cáncer prostático en 82% de los casos comparado con 43% de hiperplasia prostática benigna en parientes por arriba de 50 años.
Haggman y Oesterling (1997) describieron que el PIN de alto grado fue encontrado en 63% de los casos analizados solamente en la zona periférica del modelo de McNeal, en 36% de los casos en la zona periférica y en la zona de transición del modelo de McNeal y 1% de los casos solamente en la zona de transición. Refieren los autores la coincidencia con los porcentajes conocidos de la ubicación del cáncer prostático según las zonas anatomotopográficas en el modelo de McNeal. (Haggman MJ, Macoska JA, Wojno KJ, Oesterling JE. The relationship between prostatic intraepithelial neoplasia and prostate cáncer: critical issues. J Urol 158:12-22,1997).
Epstein (1993) afirmaba que el Score de Gleason era el mayor pronosticador de progresión y del status del margen quirúrgico en la cirugía radical, aun cuando aclaraba que tenía menos influencia que el grado de Gleason.
Otros fadores de gran ayuda en el pronostico son la citología tumoral, la ploidia, los niveles de PSA en todas sus variantes (libre, total, relación libre/total, PSAd, PSAv, PSAdT de la zona de transición y PSA complejo) y los niveles de fosfatasa árida fracción prostática y de la fosfatasa alcalina.
Lo más importante es determinar el grado de diferenciación histológica del cáncer prostático lo cual constituye la más íntima relación entre la conduda biológica del cáncer prostático y su estructura histológica. La aparición de numerosos sistemas clasificatorios de gradación para el cáncer prostático intentan correlacionar dicho sistema con la posibilidad de predecir (pronóstico), el comportamiento de dicho cáncer y selecdonar una acertada y determinada conduda terapéutica.
El sistema del Score de Gleason presenta los siguientes inconvenientes: en primer lugar tanto los grados de Gleason como el Score de Gleason son tan subjetivos que casi la mayoría de los pacientes se presentan con un score de Gleason de 6, 7 u 8 (Epstein, 1999), (Orozco, 1998), (O'Dowd, 1997), (Sakr, 2000), (Chan, 2000); los scores de 9 y 10 son muy raros de ver y los scores de 2,3 y 4 (Epstein,
1998) no deberían realizarse en biopsias prostáticas por trucut; en segundo lugar muchos patólogos no están lo suficientemente entrenados para interpretar los grados de Gleason en biopsias finas obtenidas de trucut en las biopsias aleatorias o randomizadas (Allsbrook, 1998), (Steinberg, 1997); en tercer lugar el score de Gleason no es el único método para analizar las biopsias del paciente, sobre todo con lo heterogénea de la presentación patológica de los cánceres prostáticos. Tenemos por ejemplo que los scores de Gleason 7 son tumores usualmente subestadiados por la cantidad de grado 4 y 5 de Gleason con implicaciones en el pronostico del paciente (Noguchi, 2000), (McNeal, 1992), (Stamey, 1999); en cuarto lugar usualmente cuando se compara el diagnostico realizado con la biopsia por trucut en relación al espécimen quirúrgico (pieza completa) hay usualmente infraestadiamiento (Epstein, 1996), (Bostwick, 1994), (Spires, 1994), (O'Dowd, 1997). Por lo mencionado el peligro mas inmediato en la determinación del score de Gleason es infraestadiar y eso tendrá nefastas implicaciones en subestimar los riesgos potenciales de progresión de la enfermedad y eso afectará la toma de decisión en la escogencia del tratamiento inicial, sea de la naturaleza que fuere.
El Sistema de Gleason sigue siendo sin embargo, el más ampliamente utilizado y el más aceptado entre las más variadas escuelas de patología de los principales hospitales del mundo.
La mayoría de éstos sistemas de gradación unen la conformación arquitectural del tumor, con aspectos dtológicos, los cuales, determinarán la existenda de cáncer bien diferendado los cuales exhibirán una progresión lenta, canceres pobremente diferenciados, con una rápida progresión de la enfermedad y un grupo con caraderísticas intermedias.
Desde el año 1975, un grupo de investigadores urólogos de la Administradón de los Hospitales de Veteranos de los Estados Unidos de Norteamérica (VACURG), establedó el sistema de gradación histológica de Gleason (Grados de Gleason) y lo más importante era, que reconodan a más de un (1) tipo histológico, debido a la heterogeneidad del cáncer.
El sistema de gradadón de Gleason se basa exclusivamente en los patrones arquitecturales que adoptan las glándulas del cáncer prostático. El sistema evalúa cuan efectivamente las células cancerosas prostáticas son capaces de formar estructuras "glandulares" pareadas a aquellas de la glándula prostática normal. El sistema de Gleason está basado en patrones de invasión celular tumoral y debe ser examinado por el hepatólogo respedivo con baja magnificadón.
La habilidad del tumor de "mimetizarse" en patrones glandulares "normales" es denominado "diferendación" mientras más parecido a estructuras glandulares normales sean, más "diferendado" lo que a su vez podría implicar un mejor comportamiento biológico (menos agresivos), contrariamente a lo que sucede con tumores "menos diferendados" los cuales tenderán a ser más agresivos biológicamente.
Gleason al desarrollar éste sistema descubrió que al combinar los dos patrones histológicos más comunes del cáncer prostático, en un paciente en estudio, se podría prededr aún mejor la conducta de dicho cáncer y lo denomino Score de Gleason. En el Score de Gleason el patólogo selecciona los 2 patrones histológicos predominantes y los califica del 1 al 5. Y su suma podría ir de 2 a 10 con las implicaciones correspondientes.
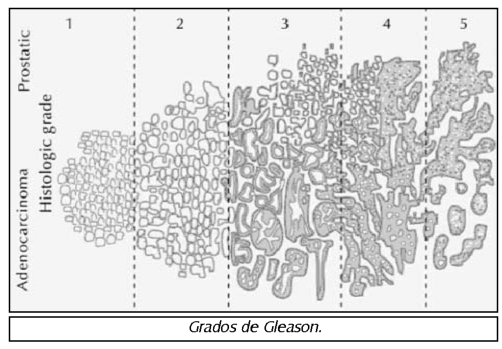
El Score Gleason calificado como 2,3, 4 se considera un patrón histológico bien diferenciado, bajo grado o grado I, el score Gleason 5,6 y 7 se considera moderadamente diferendado, intermedio o grado II y el Score Gleason 8,9 y 10 será considerado pobremente diferendado, alto o grado III. Según Epstein (2002) del Hospital John Hopkins de Baltimore, el Score Gleason 7 debería ser considerado moderadamente a pobremente diferendado o de alto grado.
Los factores finalmente más importantes en lo referente a pronostico del paciente con cáncer
prostático son: El estadio clínico de la enfermedad (estadio clínico-tumor al); el volumen estimado de la lesión cancerosa) y el tipo de patrón histológico, que presente el cáncer que se está estudiando (grado tumoral).
Este último, representado como hemos dicho por el score Gleason lo podremos correlacionar de una manera interesante, con los hallazgos clínicos, con los niveles séricos de los marcadores tumorales (PSA total, PSA libre PSA libre /total o porcentaje de PSA libre, PSA velocidad, PSA densidad, RT-PCR-PSA y la fosfatasa ácida fracción prostática), con la presencia o no de alcance local-regional o a distancia de la enfermedad (metástasis), es dedr con la progresión de la enfermedad, e inclusive con la sintomatología (nivel de dolor o de obstrucción urinaria de la salida vesical) y con un aspecto que creo, es el más importante y es su correlación con la predicción de la sobrevida de los pacientes aquejados con cáncer prostático.
Partin (1997) uno de los creadores de los nomogramas predictivos preoperatorios correlaciona el Score Gleason con la posibilidad de enfermedad tumoral órgano-confinada (OC), con la posibilidad de penetración capsular por parte del tumor (CP), con la presencia de vesículas seminales tomadas por el tumor (SV) y con la presencia de metástasis tumoral a nivel de los ganglios linfáticos ileopelvicos (LN), dándole entonces al Score Gleason una importancia definitiva para los pronósticos de los casos de cáncer prostático, sea cual fuere su estadio clínico y/o patológico. (Schwartz, 2002), (Montie, 2002).
Los Nomogramas representan un modelo estadístico que incorpora muchas variables para predecir un objetivo especifico (DiBlasio, Kattan, 2003), permitiendo una predicción mas precisa. Una amplia variedad de éstos nomogramas se han popularizado desde Kattan (1998) en el Memorial Sloan Kattering cáncer Center (www.nomograms.com).
En referencia al Score Gleason 7, el Servicio de Urología de la Universidad de Wayne State en Detroit con Narain (2000) y colaboradores, publicaron un trabajo en relación a la precisión de las biopsias prostáticas analizadas en llegar a predecir los resultados posteriores y es tal la importancia que le dan al Gleason Score 7 que dividen sus experiencias en tres grupos de pacientes, los que tienen menos de 7 de Score Gleason, los que tienen 7 los que tienen más de 7. Esto basado en el hecho de que casi la mitad de las muestras examinadas por ellos tienen 7 de Score Gleason (40-50%). Ellos revelaron que el 70.1% de paciente con menos de 7 en su Score Gleason son órgano confinados, es decir el tumor no se ha extendido mas allá de la cápsula prostática, el 44.1% con 7 de Score Gleason eran órgano confinado y el 11.6% de los que tenían mas de 7 de Score Gleason tenían enfermedad limitada a la glándula lo que hace ver la trascendencia de éste dato. Igualmente la sobrevida libre de enfermedad fue del 95.6%,81% y 43.7% en pacientes con Score Gleason de menos de 7, 7 y mas de 7 respectivamente. Inclusive el Score Gleason llega a tal punto que nos puede permitir predecir la sobrevida libre de enfermedad tanto para aquellos casos que el análisis patológico sea órgano confinado como para aquellos casos donde ha habido el diagnostico de enfermedad extraprostática y así vemos que las cifras son: 98.6%,94.6% y 84.6% para enfermedad confinada glandularmente y 87.5%, 73% y 47.8% para enfermedad extraglandular en casos de Score Gleason menos de 7, 7 y más de 7.
Shekarriz-Upadhay-Wood Jr (2000-2001) publicaron excelentes artículos acerca de considerar al score Gleason 7 como una entidad separada, más aun cuando el score Gleason es 4+3, ya que los porcentajes de tumor confinado a la glándula, así como la presencia de márgenes positivos en la cirugía radical prostática y la presencia de focos de extensión extraprostático del tumor, lo haría no sólo un tumor muy agresivo, sino que bien pudiera recibir un tratamiento diferente al que en la practica diaria se le da, como es la cirugía radical prostática. Y además se estaría hablando de un tumor con un pronóstico muy diferente a los scores Gleason 3+4, o aquellos con suma de 6 ó 5 de Score Gleason.
En universidades americanas, europeas, asiáticas y latinoamericanas consideran al Score de Gleason como el principal factor predictivo independiente en lo referente al porcentaje libre de enfermedad.
Huland (2002) refiere que los aspectos mas importantes que se deben conocer para tratar adecuadamente un paciente con cáncer prostático localizado son: precisar el status de los ganglios linfáticos ileopelvicos, precisar si hay o no penetración o trasgresión capsular prostática, y precisar el pronóstico general después del tratamiento efectuado. Y de manera muy especifica según Stamey de la Universidad de Stanford el porcentaje de Gleason grado 4 y 5 en la pieza anatomopatológica prostática es sin lugar a dudas el parámetro más importante para predecir el pronóstico del caso. Un porcentaje de cura de por lo menos 80% se alcanzaba en pacientes con 10% de enfermedad tumoral grado 4 y
5. Disminuyendo dicho porcentaje de cura con el aumento del porcentaje de presencia de Gleason grado 4 y 5. En pacientes con más de 41% de Gleason
4 y 5 el porcentaje de cura descendió al 24%.
Por otro lado el numero de biopsias con Gleason Grado 4 o 5 dominante (es decir más del 50%) tenía correlación con la sobrevida libre de recaídas bioquímicas (PSA por arriba de 0.5 ng/ml).
De allí la importancia que hoy en día se le da a que el informe del patólogo (anatomía patológica) sea lo más completo posible en referencia a la correcta gradación del Score Gleason, al porcentaje del tumor en cada espécimen enviado a él, y al porcentaje global de cáncer que tienen las piezas y en conjunto todo redundará en una mayor información que el urólogo utilizará para predecir recaídas bioquímicas, sobrevida libre de enfermedad, porcentaje de sobrevida lo que ayudará a seleccionar la terapia mas adecuada.
Los pacientes con Score Gleason 4+3 unido a la raza del paciente (afroamericanos) a la edad, al estadio clínico y a los niveles de PSA tendrán una enfermedad más avanzada, un estadio clínico-patológica mas avanzado, un PSA más alto y por supuesto mayores porcentajes de recaídas bioquímicas (dos resultados de PSA iguales o mayores de 0.2 con 6 meses de diferencia en el periodo postratamiento), que aquellos casos que tienen un Score Gleason 3+4.
Pan-Potter-Patin (2000) han propuesto un sistema que considera inclusive un tercer patrón histológico para llegar a ser aun mas preciso en el pronóstico del caso.
La discrepancia existente entre los resultados informados por el patólogo con base en la biopsia por aguja-trucut y aquellos que los determina la pieza definitiva posterior a una cirugía radical prostática según Narain (2000), así como Steinberg (1996) tienen varias explicaciones.
En primer lugar el cáncer prostático es multifocal con tumores prostáticos en varios sitios de la glándula exhibiendo patrones de Gleason diferentes, por lo cual ellos utilizan el peor Score Gleason de la muestra para dictaminar el Score Gleason global. En segundo lugar desde la aparición del PSA (1980) los cánceres prostáticos se han visto reducidos considerablemente en volumen y el material muchas veces es escaso unido a la defectuosa toma de biopsia, lo cual hace que el material que le llega al hepatólogo sea insuficiente para dar un dictamen histológico de grados de diferenciación celular; en tercer lugar los errores del hepatólogo en graduar las biopsias; en cuarto lugar un patrón que está entre dos grados en el análisis y que por la escasez del material es difícil decidirse en otorgarle un grado o score definitivo; error de muestreo por parte del urólogo-radiólogo invasivista del caso. Sin embargo en toda la literatura investigada pudimos constatar que hay una discrepancia entre los resultados del Score Gleason realizados con los especímenes obtenidos por agujas de trucut y pistolas de biopsia (infragradación) y los resultados obtenidos con la pieza definitiva extraída por cirugía radical prostática, por lo cual autores como Makhlouf (2002) recomiendan que al aumentar el numero de biopsias mejoraremos la predicción del grado patológico de Gleason y con esto tener mejores bases de decisión en la terapéutica final.
Refiriéndonos al hecho de que el hepatólogo especifique el porcentaje de tejido total de la biopsia con cáncer, su importancia radica en que se está correlacionando con la capacidad predictiva del riesgo de recaída bioquímica después de haber impartido la terapia primaria definitiva (Freedland, 2002), y a tal punto se han agrupado pacientes con bajo riesgo, pacientes con riesgo intermedio y pacientes con alto riesgo de tener la antes mencionada recaída bioquímica después de cirugía radical prostática, y todo basado originalmente en los valores del PSA y en el Gleason Score determinado en la biopsia por aguja. Igualmente saber el porcentaje de cáncer en las biopsias ha demostrado útil para predecir eventos patológicos adversos como por ejemplo márgenes quirúrgicos positivos, invasión a las vesículas seminales y enfermedad prostática tumoral que no esté confinada dentro de la cápsula prostática.
Messing (2003) revela que lo que se considera elevación del PSA o recaída bioquímica dependerá en gran parte de las características del tumor (del grado tumoral, estadio, volumen tumoral y PSA) al momento del diagnostico. Un paciente con un Score de Gleason de 10 con un PSA de 2.3 ng/ml quien alcanza un valor "nadir" de 0.7 ng/ml y que se eleva a 4.5 ng/ml tiene peor pronostico y riesgo de metástasis que aquel paciente con un Score de Gleason de 5 con un PSA de 12 ng/ml que alcanza un valor "nadir" de
0.2 ng/ml con una elevación subsiguiente de 0.8ng/ml de PSA, dándonos a entender una vez más la importancia del Sistema Gleason en el status clínico-patológico y de pronostico en pacientes con cáncer de próstata.
Por otro lado no siempre se correlacionará el nivel del PSA con la agresividad biológica del tumor. Es natural pensar que un PSA elevado se correlaciona con comportamientos biológicos mas agresivos y por ende con recaídas bioquímicas mas frecuentes luego de "tratamientos definitivos" por enfermedad órgano confinado. D'Amico (2002) acaba de demostrar que algunos casos de cáncer prostático con grados de Gleason 4 o 5 en la pieza anatómica de la cirugía a radical y un PSA total inicial de menos de 4 ng/ml podrían ser casos andrógenos-defidentes y tener una considerable disminución del porcentaje de tiempo libre de recaída bioquímica, lo cual hace que siempre estemos pendientes de la posibilidad de metástasis locales o a distanda de un cáncer prostático supuestamente órgano-confinado.
A tal efedo se consideró recaída bioquímica a la elevadón del PSA total por arriba de 0,2 ng/ml. Como punto de interés para el ledor los pacientes estudiados fueron clasificados en bajo riesgo cuando el PSA total era menor de 10 ng/ml y el Gleason score menor de 7. Parientes con riesgo intermedio eran aquellos con PSA total entre 10 y 20 ng/ml y Gleason Score de
7. Y los pacientes de alto riesgo para presentar recaída bioquímica eran aquellos que exhibían un PSA total mayor de 20 ng/ml y un Gleason Score de más de 7.
Vuelve a ser 7 la cifra del Score de Gleason, que dida la diferenda en el comportamiento biológico del cáncer prostático. D'Amico (2002) agrupa los pacientes en tres categorías por su riesgo de presentar recaída bioquímica y lo hace en base al porcentaje de positividad en las biopsias por trucut y son 34% para los grupos de bajo riesgo, 34 a 50% en los grupos de riesgo intermedio y mas de 50% de cáncer en las biopsias examinadas para ser declarado de alto riesgo para hacer recaída bioquímica en el postoperatorio.
La discrepancia entre el Gleason score de la biopsia y el Gleason Score de la pieza definitiva puede tener según Khan (2003) implicaciones en relación a la precisión de las predicciones que podamos hacer previo al tratamiento definitivo. La infragradadón previo al tratamiento definitivo en biopsias con Gleason score de 2 a 5 es del 62%, en Gleason score 6 es el 26.7% en el Gleason score de 7 es del 12%, lo que implica que a mayor Gleason score previo al tratamiento definitivo menos posibilidad tendríamos de cometer infragradadón.
Pound (1997) refiere que los factores mas seguros para ser utilizados como identificadores del sitio probable de la enfermedad recurrente den cáncer prostático son: la recurrencia del PSA, un Gleason Score 8,9 o 10, invasión de vesículas seminales y ganglios linfáticos ileopelvicos positivos. Con dicho Gleason Score 89% tenían metástasis a distancia con o sin recurrenda local, lo cual abre un paréntesis bien interesante en lo referente a la naturaleza agresiva del tumor en relación al sitio de las metástasis.
Freedland (2002) estima que el porcentaje de tejido canceroso en los especímenes de las biopsias por aguja realizados por el urólogo o por el radiólogo intervencionista es un vaticinador mas eficaz que el Score Gleason o que los valores del PSA total para predecir recaídas bioquímicas después de una cirugía radical prostática y diferenciándose de D'Amico revela que sus grupos de riesgo basados en el porcentaje de cáncer en los especímenes de biopsia son de menos del 20% para el grupo de bajo riesgo de hacer recaída bioquímica, del 20 al 55% para el grupo intermedio y 55 % o más para el grupo de alto riesgo de hacer recaída bioquímica.
Catalona (2002) en el Meeting Anual de la AUA en Orlando Florida confirmó la preocupación existente con el Score Gleason 7, al determinar que cuando el padente tiene Score Gleason 7 (3+4) el paciente tendrá un 15% de posibilidades de progresión de la enfermedad prostática a 5 años, en cambio cuando el padente tenga 4+3 tendrá un 40% de posibilidades de progresión de la enfermedad prostática. Igualmente Bianco Jr (2002, 2003) refiere que en padentes con enfermedad órgano-confinada el Score de Gleason fue el único factor pronóstico para determinar la recurrencia de la enfermedad.
Freedland (2002, 2002) confirma que el porcentaje de biopsia prostática con cáncer fue el pronosti-cador "independiente" mas consistente de la recaída bioquímica (PSA > 0.2 ng/ml) posterior a cirugía radical prostática. Mas inclusive que el PSA o el Score
Gleason per sé. Igualmente es pronosticador de la invasión tumoral a vesículas seminales, así como de enfermedad no confinada a la glándula (estadio clínico-patológico C-Dl).
Donahue-Moul (2002) del Centro de Investigaciones para Enfermedades prostáticas en Maryland puntualizan y reafirman el hecho de que es importante cuantificar el cáncer en las biopsias prostáticas para ser utilizado como un contundente factor pronostico y de estadio clínico-patológico, así como profundizar en el porcentaje de biopsias positivas para cáncer que demuestren grados de Gleason predominante 4/5 (Conrad, 2002). Creemos falta todavía mucho por investigar y analizar para estar definidos en éstos puntos.
Igualmente Grober (2002) al igual que Epstein, confirma que el patrón primario del Score Gleason en biopsias por agujas no se correlaciona con los resultados clínicos y patológicos cuando el Gleason Score es de 7.
Por otro lado Muramoto (2002) puntualiza que pacientes con cáncer prostático que tenían un
El volumen tumoral es inversamente proporcional al grado histológico de diferenciación celular, que pueda exhibir un determinado paciente con cáncer de próstata. Es decir a mayor volumen menor diferenciación celular (más indiferendados y aneu-ploides) y con ello, mayor probabilidad de diseminación local o a distancia de la enfermedad con alcance de las vesículas seminales, alcance de los ganglios ileopelvicos, o trasgresión de la cápsula prostática. El volumen tumoral está considerado, el factor pronóstico individual más importante en el porcentaje de grado de Gleason 4/5 fueron mas propensos a tener extensión extracapsular que aquellos que no tenían dicho grado de Gleason en un porcentaje de 38% vs. 11%, lo cual es bastante significativo. La presencia inclusive de un escaso número de células cancerosas con dicho grado de Gleason podría sugerirnos una agresividad biológica importante.
Se ha llegado a tal punto de profundización en lo referente al Score Gleason que ahora sabemos que en la medida que sea mas diferendado, es decir de 2 a 6 el score Gleason, la correladón entre biopsia previa a la cirugía y el score que se determina en el tumor de la pieza operatoria de la prostatedomia radical será parecido. En la medida que sea 7, 8, 9 ó 10 no habrá concordanda entre la biopsia previa y la biopsia definitiva agravando con esto el pronóstico y por ende las cifras de sobrevida libre de enfermedad. Epstein (1998) dio las siguientes afras de la correlación de la prostatectomia radical, el Score Gleason y el estadio patológico de la enfermedad (P) en 988 hombres desde 1994 a 1998 (tabla 1).

manejo y pronóstico del cáncer prostático. La sobrevida del padente, también se correladonará con el volumen tumoral. A mayor volumen menor porcentaje de sobrevida.
Albertsen (1998) publicó el análisis del riesgo de que un padente con cáncer prostático muriera de cáncer siendo manejado de manera conservadora, lo cual tiene direda relación con el grado histológico de dicho cáncer y observó como pacientes con cáncer prostático de bajo grado (Score de Gleason 2 a 5)
tendrían un riesgo mínimo de morir de cáncer prostático aun 15 años después de haberse diagnosticado (menos del 15%). En grados intermedios de Score de Gleason (6) entre un 18-30% morirían de cáncer prostático dentro de los primeros 15 años posterior al diagnostico y con grados de Score de Gleason altos (7, 8,9 y 10) existía un riesgo significativo de morir por cáncer de próstata.
Otro aporte del Score de Gleason es la determinación del porcentaje de muerte por cáncer de próstata, lo cual vemos representado en un trabajo de Sweat (2002) donde se concluye que pacientes con un Score de Gleason entre 7 y 10 tenían entre 29% y 43% de riesgo de morir de cáncer de próstata independientemente de la edad del paciente e independiente de las patologías concomitantes que pudiera tener e independiente de que tenga antecedentes de cirugía. De hecho las conclusiones son las siguientes: pacientes operados de cirugía radical de próstata con un Score de Gleason de 5 o menos tienen un riesgo de 13% o menos de morir de cáncer de próstata dentro de los siguientes 20 años del diagnostico. En la medida que aumenta el Score de Gleason tendremos resultados más ominosos. Pacientes con un Score de Gleason de 6 tienen un 15 a 19% de riesgo de morir de cáncer próstata. Cuando el Score de Gleason es de 7 o más el riesgo de morir por cáncer de próstata va del 29 al 43% aun si el cáncer fuera diagnosticado a edades tan tardías como 74 años.
De manera general se dice que cuando el paciente exhibe patrones de Gleason de cáncer prostático pobremente diferenciado tendrá 10 veces más riesgo de morir de la enfermedad prostática comparado con hombres que tienen patrones de Gleason de cáncer prostático bien diferenciados. Esto se confirma con el trabajo de Stotzer en la Universidad de Wayne State-Detroit, donde nuevamente se muestra que el Score de Gleason es un factor de vaticinio de la sobrevida libre de enfermedad. Lo vemos en sus resultados que mostramos a continuación, donde SG significa Score de Gleason o la sumatoria de los 2 patrones histológicos predominantes.
|
Estadio patológico |
SG <7 |
SG 7 |
SG >7 |
Total |
|
Organo-confinado |
98% |
94% |
79% |
96% |
|
Márgenes quirúrgicas |
88% |
79% |
63% |
82% |
|
Extensión extracapsular |
87% |
74% |
48% |
72% |
|
Vesículas seminales |
83% |
50% |
27% |
43% |
|
Ganglios linfáticos |
50% |
25% |
23% |
24% |
De acuerdo a las características que daremos a continuación el hepatólogo podrá asignar una puntuación del 1 al 5 a cada patrón predominante en la biopsia del cáncer prostático en estudio. Explicaremos como logra el patólogo dar una puntuación determinada:
1= glándulas simples pequeñas, muy cercanas unas a otras en disposición redondeada con bordes muy bien definidos.
2= glándulas simples pequeñas, no ya tan cercanas unas a otras también en disposición redondeada y con bordes sin tanta cohesión.
3A=glandulas individuales de tamaño moderado de forma irregular y con espacio entre ellas también irregular con bordes infiltrantes bien definidos.
3B= similar a 3A pero con glándulas pequeñas o muy pequeñas las cuales no forman cadenas o cordones significativos.
3C= epitelio papilar o cribiforme en cilindros y masas lisos y redondeados. Sin necrosis.
4A= glándulas pequeñas, medianas o grandes fusionadas en cordones, cadenas o masas desiguales e infiltrantes.
4B= similar a 4A pero con numerosas células claras grandes, semejando en ocasiones la imagen de los hipernefromas.
5A= No hay diferenciación glandular, en con sólidos cordones o células individuales o nidos de tumor sólido con necrosis central.
5B= adenocarcinoma anaplasico en disposición irregular.
Weidner (1993) describe el sistema de Grados de Gleason en dnco patrones que son los siguientes:
PATRÓN 1: NODULO CIRCUNSCRITO DE CÁNCER, UNIFORME, ÚNICO, SEPARADO DEL RESTO DE TEIIDO Y EN DONDE SE VEN LAS GLÁNDULAS PROSTÁTICAS EN PAQUETES MUY CERCANOS.
PATRÓN 2: NODULOS CIRCUNSCRITOS CON MÍNIMA EXTENSIÓN DE LAS GLÁNDULAS TUMOR AT ES DENTRO DEL TEJIDO PROSTÁTICO BENIGNO. LAS GLÁNDULAS SON INDIVIDUALES Y SEPARADAS POR ESTROMA Y MAS DISEMINADAS QUE EN PATRÓN 1.
PATRÓN 3: GLÁNDULAS TUMORALES INFILTRANTES DENTRO Y ENTRE LAS GLÁNDULAS PROSTÁTICAS BENIGNAS CON VARIACIÓN EN EL TAMAÑO Y FORMA DE LAS GLÁNDULAS. MUCHAS GLÁNDULAS SON MAS PEQUEÑAS QUE LAS DEL PATRÓN 1 Y 2. TAMBIÉN PODEMOS VER NODULOS CRIBIFORMES CIRCUNSCRITOS UNIFORMEMENTE.
PATRÓN 4: LAS GLÁNDULAS TUMORALES SE FUSIONAN CON BORDES MELLADOS E INFILTRANTES. LAS GLÁNDULAS NO ESTARÁN MAS SEPARADAS QUE EN LOS PATRONES 1, 2 Y 3.
PATRÓN 5: EL TUMOR NO DEMUESTRA DIFERENCIACIÓN GLANDULAR CON O BIEN MASAS SOLIDAD DE CÉLULAS TUMORALES O CÉLULAS INDIVIDUALES O TAMBIÉN PUEDE PRESENTARSE COMO CESTAS O AGRUPAMIENTOS DE CÉLULAS MALIGNAS CON NECROSIS CENTRAL.
Las células que asemejan células normales recibirán una baja puntuación, y a más alta la puntuación otorgada, más anormal serán las características de las células. A mayor Score de Gleason más agresivo será el comportamiento del cáncer prostático y por ende se correlacionará a un pronóstico también peor, con porcentaje de sobrevida libre de enfermedad, con recaídas bioquímicas totalmente diferentes.
EL SCORE DE GLEASON SERA LA SUMA DE LOS DOS PATRONES HISTOLÓGICOS CELULARES PREDOMINANTES EN LA BIOPSIA REALIZADA AL PACIENTE CON SOSPECHA DE CÁNCER.
SIN EMBARGO EL CÁNCER DE PRÓSTATA ES UNA ENFERMEDAD BASTANTE COMPLEJA, YA QUE MUCHAS VECES CON BAJO SCORE DE GLEASON LOS PACIENTES TENDRÁN UNA EVOLUCIÓN SOMBRÍA Y VICEVERSA ES DECIR PACIENTES CON ALTOS GRADOS DE GLEASON O SCORE GLEASON ALTO, TIENEN EVOLUCIONES BASTANTE ACEPTABLES. POR LO CUAL NO DEBEREMOS DARLE A LA ESCALA DE GLEASON UN VALOR ABSOLUTO. SINO MAS BIEN DEBEMOS UNIR VARIOS PUNTOS DE ANÁLISIS PARA ESTAR MAS SEGUROS DE LO QUE SE VAYA A DECIR A NUESTROS PACIENTES EN RELACION A SU PRONÓSTICO.
Teniendo por ejemplo un score de Gleason de 7 (2+5 ó 5+2). McNeal y Stamey del Departamento de Urología y Patología de la Escuela de Medicina de la Universidad de Stanford en Palo Alto California, recomiendan reportar los milímetros de cáncer de cada cilindro remitido por el urólogo, para deducir el porcentaje de cada uno de los dos patrones histológicos, ya que no es lo mismo un score de Gleason 7 (2+5) donde del grado 2 haya el 90% y del grado 5 un 10% que aquel caso que presenta un score de Gleason 7 (5+2) donde hay un 90% del grado 5 y un 10% del grado 2.
Las connotaciones en pronóstico y comportamiento biológico serán sustancialmente diferentes. En el primer caso será posiblemente un tumor confinado a la glándula (localizado=Tl-T2), en cambio en el segundo caso lo más probable es que sea un caso localmente avanzado o con alcance ganglionar, lo que podría hacer la diferencia entre practicar o no una cirugía radical prostática.
Albertsen (1998) publicó el análisis de riesgo de muerte en un paciente con cáncer prostático manejado de manera conservadora, lo cual tiene directa relación con el grado histológico de dicho cáncer los pacientes con cáncer prostático de bajo grado (score Gleason 2 a 5) tendrían un riesgo mínimo de morir de cáncer prostático aun 15 años después de haberse diagnosticado (menos del 15%).
En grados intermedios de score Gleason (6) entre un 18-30% morirían de cáncer prostático dentro de los primeros 15 años posterior al diagnostico y con grados de score Gleason altos (7, 8, 9 y 10) existía un riesgo significativo de morir por cáncer de próstata.
El grado de Gleason y la determinación del estadio local, a través del tacto prostático, favorecerán significativamente, el poder predictivo del PSA que sin duda alguna, por sí solo, está considerado el mejor predictor de las metástasis ganglionares del cáncer prostático.
De hecho se dice que cuando tengamos un PSA total por arriba de 10 ng/ml, con cáncer prostático pobremente diferenciado según el Score de Gleason y un estadio clínico C (T3), fuera de los límites prostáticos, tendremos casi con seguridad enfermedad ganglionar ileopelvica, o bien en la cadena ganglionar iliaca externa o iliaca interna (Studer, 2002).
El nomograma de Bluenstein (1994) así como los otros que existen sirven básicamente para ayudar al médico urólogo a tomar en conjunto con su paciente, la mejor decisión en cuanto a su terapia definitiva, ya que como sabemos 3 de cada 4 canceres prostáticos corresponderían a casos de cáncer órgano confinado, por lo cual hay que precisar lo mejor posible la eventualidad de que haya alcance de la enfermedad a ganglios, a vesículas seminales o haber traspasado la cápsula quirúrgica ya que en esos casos estaríamos en condiciones de ofrecer terapéuticas variadas basadas en dichas consideraciones.
Carter-Walsh-Landis (2002) publicaron un excelente trabajo acerca del manejo expectante en cáncer prostático no palpable. Y allí referían que el tratamiento era recomendado cuando se suponía que había progresión de la enfermedad, por datos obtenidos de la biopsia prostática transrectal, como Grado de Gleason de 4 o 5, más de 2 fragmentos de biopsia con cáncer, mas del 50% del volumen de los fragmentos de la biopsia positivos con cáncer. En ése mismo trabajo Cárter mencionaba lo que consideraba enfermedad curable basado en la pieza anatomopa-tológica de la cirugía radical como cáncer prostático órgano-confinado con un Score de Gleason de 7 o menos; o cáncer con extensión extraprostática y un Score de Gleason de 7 (3+4) o menos con márgenes quirúrgicos negativos, vesículas seminales negativas, y ganglios linfáticos ileopelvicos negativos; o cáncer prostático con un Score de Gleason de 6 0 menos haciendo caso omiso del status de los márgenes quirúrgicos o la extensión extraprostática si hubiera hallazgos negativos en las vesículas seminales o en los ganglios ileopelvicos.
Symon (2002), en su estudio de elevación del PSA siguiendo una cirugía radical prostática refiere entre otras de las ventajas de la gradación de Gleason, la posibilidad de saber anticipadamente la eficacia de la radioterapia en controlar o no la recurrencia local después de un tratamiento de Radioterapia.
El poder controlar la enfermedad postradioterapia es de aprox. un 40% a 50% en un estudio realizado en el Memorial Sloan Kettering cáncer Center de Nueva York, basados también en estudios realizados por Katz el año 2001. Han identificado 4 factores de riesgo para predecir el fracaso de una Radioterapia de salvamento: tener un PSA de más de
0.6 ng/ml, tener un status del margen tumoral positivo, tener un Score de Gleason de 7 o más y tener invasión de las vesículas seminales. Pacientes que tenían 0, 1 0 2 factores de riesgo tenían 4 años de sobrevida libre de recaídas bioquímicas en un 94%, 73% y 22% respectivamente.
Schachter (2004) trataron 1.074 pacientes desde 1.990 diagnosticados con cáncer prostático con Braquiterapia con o sin Radioterapia externa, en pacientes con Gleason score 7 a 10. 77.4% tenían sobrevida libre de recurrencia en un average de 4.8 años en pacientes con un Score de Gleason de 7. Cuando el Score de Gleason aumentaba 8, 9 o 10 tenían un 63,6% de sobrevida libre de recurrencia después de 5.1 años, teniendo esto últimos un PSA inicial también más alto.
Lehr (2004) ratifica la importancia del Score de Gleason al afirmar que hoy en día la mayoría de los canceres prostáticos son detectados en etapas precoces con bajos niveles seríeos de PSA, y que la variable mas decisiva en la decisión a tomar previo al tratamiento reposa en el score de Gleason. No hay duda que habrá disparidad entre las biopsias en seis sextantes y el Score de Gleason de la pieza quirúrgica de la cirugía radical. Lehr (2004) trató de demostrar con su trabajo si aumentando el numero de biopsias a 10 o 14 en áreas periféricas aumentaría también la concordancia entre el Score de Gleason de las biopsias previas a la cirugía y el score de Gleason de la pieza anatomoquirurgica y los resultados arrojaron resultados positivos, lo que redundará en una optimización de las opciones terapéuticas y por ende de los resultados finales. Estos resultados fueron ratificados por Coogan (2004).
Sved (2004) presentó una investigación en pacientes con cáncer prostático en estadio localizado con Score de Gleason 6 que usualmente son considerados de bajo riesgo de recurrencia tanto bioquímica como clínicamente posterior a terapia definitiva. Sin embargo por arriba del 60% tendrán un Score de Gleason de alto grado (> 7) en la pieza anatomoquirurgica de la cirugía radical. Tuvieron que 41% of pacientes con biopsia previa con Score de Gleason de 6 tenían riesgo aumentado de extensión extraprosta-tica y de recaída bioquímica del PSA después de la cirugía radical o de cualquier modalidad de tratamiento definitivo para su cáncer localizado de próstata, por lo cual recomienda estar alerta de la diferencia y discrepancia entre los dos análisis histopatológicos.
Fandel (2004), demostró que varios sistemas de gradación histológicas proveerán información pronostica en relación al cáncer prostático. El sistema de Gleason se basa en el patrón de crecimiento tumoral mientras que el sistema WHO utiliza los patrones nucleares y los patrones de crecimiento tumoral. El valor predictivo sobre la recurrencia tumoral de ambos sistemas fue similar en su poder de predicción. En cambio el PSA preoperatorio, el pleomorfismo nuclear y las irregularidades de la cro-matina no lo fueron.
• Solamente el 25% de hombres con invasión a vesículas seminales y ninguno con invasión a ganglios linfáticos estarán libres de progresión tumoral en los siguientes 10 años.
• Epstein demuestra el riesgo de progresión posterior a cirugía radical prostática a los 5 y a los 10 años posteriores y nos conseguimos con que los casos órgano confinados demuestran 0% de progresión a los 5 años y 17% de progresión a los 10 años, lo cual nos hace reflexionar acerca de la necesidad de mejorar los marcadores bioquímicas que tenemos a nuestro alcance en conjunto con los análisis anatomopatológicos que deberán sin duda profundizarse con métodos y pesquisas diferentes. Al tener penetración capsular bien sea focal o claramente establecida las cifras empeoran y así tenemos que a los 5 y 10 años en el primer caso focal tendremos 10 y 33% respectivamente de progresión y en el caso de penetración establecida tendremos 24 y 43% de progresión de la enfermedad, márgenes positivos arrojarán 27 y 46% de progresión de la enfermedad respectivamente a los 5 y 10 años. Un Score de Gleason 5-6 con extensión extracapsular y márgenes positivos tendrán 15 y 28% de progresión a 5 y 10 años respectivamente. Si la suma del Score de Gleason alcanza los 7 puntos ya las cifras serán alarmantes con un 17 y 52% en el caso de tener extensión extracapsular focal o establecida, márgenes positivos o negativos. Pero si la suma del Score de Gleason es de 7 con extensión extracapsular establecida y márgenes positivos la progresión a 5 años será del 50% y la progresión a 10 años será del 58%.
• Solo 50% de hombres con márgenes positivos después de cirugía radical prostática observarán progreso de la enfermedad.
• Si existen márgenes positivos en la cirugía prostática y se extrae tejido periprostático extra éste no demostrará tumor.
• El grado de Gleason, la extensión extraprostá-tica del tumor y los márgenes de resección son todos considerados factores de predicción confiables en relación al pronóstico de progresión, evidenciados por elevación del PSA total (recaída bioquímica)
• Pacientes con cáncer prostáticos Score de Gleason 2-4 no necesitarán de pronósticos porque casi todos serán curados por la cirugía radical prostática. En cambio hombres con canceres prostáticos con score de Gleason 8-10 tendrán un mal pronostico después de la cirugía radical y casi con seguridad tendrán recaída clínica y bioquímica.
• En recientes estudios se ha determinado que el volumen tumoral que se ha correlacionado bien con el estadio patológico, con el grado de Gleason y con la progresión después de cirugía radical no es un predictor independiente posterior a cirugía radical por lo tanto Epstein y Wheeler (1998) no aconsejan determinar el volumen en la pieza de cirugía radical, con propósitos clínicos.
• El Score de Gleason se utiliza para predecir metástasis ganglionares y así cuando el Score de Gleason es de 2-4 (bajo grado) habrá un 12% de posibilidades de metástasis en ganglios ileopelvicos, con un Score de Gleason de
5 a 7 (grado intermedio) podríamos tener un 35% de incidencia de metástasis ganglionares y con un Score de Gleason 8-9-10 (grado alto) tendríamos un 61% de incidencia de ganglios ileopelvicos alcanzados por la enfermedad tumoral (Murphy, 1987), (Epstein, 1998), (Gleason. 1992,1974,1966,1977), entre otros.
• Vemos como el grado de Gleason también tendrá correlación con la calidad de vida del paciente en relación a su enfermedad de base" (Kattan. 1997,1998,1999).
• Burchardt (2004), menciona que debido a la utilización del PSA y al hecho de estar más atentos, la comunidad médica está definitivamente identificando casos de cáncer prostático en etapas precoces por lo cual resulta que también serán vistos en menos láminas de las biopsias realizadas así como en menor volumen. Se utilizó un tissue microarray (TMA)
imágenes para conocer la habilidad de los patólogos alemanes en aplicar el sistema de grados de Gleason a las biopsias actuales por posible cáncer de próstata. La mayoría realiza una infragradadón de Gleason, solamente se realizó un Gleason Score corredo en el 65% de los casos. Esto es un problema para los patólogos inexpertos que deberán evaluar posibles casos de cáncer prostático de volumen muy pequeño.
NOMOGRAMAS O TABLAS DE PREDICCIÓN DE RIESGOS ESPECÍFICOS EN PACIENTES CON CÁNCER PROSTÁTICO, OTRA DE LAS APLICACIONES DEL SISTEMA Y SCORE DE GLEASON
Con el objetivo de poder predecir los resultados y riesgos de cada padente por individual, se crearon modelos estadísticos y matemáticos (nomogramas o tablas de predicción), basados en el estadio clínico (T) de la enfermedad, en el grado histológico de Gleason y en el score Gleason, determinado por las biopsias prostáticas, en los niveles séricos del PSA en todas sus fracciones utilizadas, antes de proceder con cualquier modalidad de tratamiento.
En los principales Centros Oncológicos de Estados Unidos de Norteamérica y de Europa se han ideado y conformado dichos nomogramas o tablas de predicdón, los cuales en muchos casos, sobre pre-dedan las probabilidades de alcance en las vesículas seminales o de los ganglios linfáticos ileopelvicos, por lo cual se están llevando a cabo estudios de investigación en varios países y en varias institudones de gran importanda, para definir Tablas o Nomogramas que sean mejores, más válidas y duraderas.
El pionero de las Tablas, fue el Dr Alan Partin del Johns Hopkins de Baltimore y de hecho, inidalmente se llamaban las Tablas de Partin, pero posteriormente aparederon muchas otras (Zincke, Walsh, Vijvernerg, Tempany, Schielber, Ohori, Scardino, D'Amico, Eastman, Kattan, Slawin, entre otras).
NOMOGRAMAS O TABLAS DE PREDICCIÓN EN CÁNCER DE PROSTATA
DEFINICION
UN NOMOGRAMA ES UN MODELO QUE ULILIZA UN ALGORILMO O FROMUL MALEMÁLICA PARA PREDECIR LA PROBABILIDAD DE UN RESULTADO,
OPTIMIZADO POR UNA PRECISION PREDICTIVA. (SLAWIN, 2004).
LOS NOMOGRAMAS SE UTILIZAN BÁSICAMENTE CON LOS SIGUIENTES OBJETIVOS:
1) ESTIMAR LA PROBABILIDAD DE QUE EL PACIENTE TENGA UNA ENFERMEDAD COMPLETAMENTE "ÓRGANO-CONFINADA".
2) ESTIMAR LA PROBABILIDAD DE QUE EL PACIENTE TENGA "PENETRACIÓN CAPSULAR ESTABLECIDA", CON UNA CONNOTACIÓN DE EXTENSIÓN LOCAL DE LA ENFERMEDAD.
3) ESTIMAR LA PROBABILIDAD DE QUE EL PACIENTE TENGA EXTENSIÓN DE SU CÁNCER PROSTÁTICO, HACIA LAS VESICULAS SEMINALES
4) ESTIMAR LA PROBABILIDAD DE QUE EL PACIENTE TENGA CÁNCER PROSTÁTICO EXTENDIDO HACIA LOS GANGLIOS LINFÁTICOS ILEOPELVICOS.
Partin de la Universidad Johns Hopkins, en 1993 publicó en el Journal de Urología el primer nomograma aplicado a cáncer localizado de próstata con el objetivo de prededr el estadio patológico por medio del uso del antigeno prostático específico, del estadio clínico, y del Score de Gleason, en un estudio realizado sobre 703 pacientes. Cuando se publicaron los resultados combinando éstas tres variables la infraes-timación del estadio dínico sucedió en aproximadamente un 50%, es dedr la correladón pre y postoperatoria con la pieza anatomoquirurgica y el estadio patológico no era la adecuada en la mitad de los casos, por lo cual se abocaron a crear Nomogramas que tuvieran menos infraestimadón del estadio dínico ya que el 50% de los casos T2a, T2b o Tlb tenían enfermedad no confinada a la glándula prostática.
Kattan en 1997 publicó en la revista cáncer un Nomograma que trataba de predecir el estadio patológico de casos de cáncer prostático localizado sometidos a cirugía radical y aplicándoles el Nomograma original de Partin en 697 pacientes. El índice de concordanda fue de 0.74, 0.75 y 0.76 en predicdón de extensión extracapasular, extensión a vesículas seminales y en extensión a ganglios ileopelvicos. Particularmente en precisión hacia vesículas seminales y ganglios no era preciso, ya que si la predicdón deda que había un 75% de chance de alcance ganglionar, la verdadera incidencia era del 20%, por lo cual no había concordancia, lo que dejaba abierta la puerta para nuevos y mas precisos nomogramas.
Nuevamente Partin en 1997 publica en JAMA un estudio actualizado multiinstitudonal tomando en cuenta los mismos tres parámetros de estadio clínico, score de Gleason y antigeno prostático espedfico, para prededr el estadio patológico de casos de cáncer prostático supuestamente localizado en 4133 pacientes. Hubo un 72.4% de predicciones correctas que espedficamente fueron un 67.3% enfermedad órgano confinada, un 59.6% en penetración capsular aislada, un 79.6% de compromiso de vesículas seminales, y un 82.9% de alcance a ganglios ileopelvicos, lo cual mostraba un adelanto en comparadón con los primeros Nomogramas.
Bostwick en 1996 fue el que tratando de prededr los casos de perforadón capsular, y de invasión a vesículas seminales en 314 parientes, tomó en cuenta un fador diferente como fue además del PSA y del Gleason Score el porcentaje de cáncer en los fragmentos de la biopsia, siendo considerados el PSA y el porcentaje de cáncer en la biopsia como los mas importantes predidors independientes de invasión a vesículas seminales, en casos con estadio Tic y T2c No, Mo.
Narayan y Tewari en 1998 publican en Seminarios de Urología Oncológica un Sistema de estadiamiento logrado por biopsia prostática sistemática y dirigida, y basado en el Score de Gleason, PSA sérico preoperatorio, para precisar las posibilidad de extensión extra-prostatica del cáncer, con positividad de márgenes quirúrgicos, compromiso de vesículas seminales y alcance de ganglios ileopelvicos) en pacientes con cáncer localizado de próstata, conduyendo que ése trío de fadores eran los mas adecuados para prededr dicho alcance. Resultados que se compararían al trabajo de Badalament que lo había realizado 2 años antes.
Se describirán las Tablas de Partin para entender su alcance y significación. Estas fueron realizadas y desarrolladas por un grupo de urólogos del Instituto Brady, en la Universidad Johns Hopkins de Baltimore y perfeccionadas (Polasdk, Pearson, Partin, Scardino, D'Amico, Carroll, Kattan) y se basan en análisis mul-tivariados de datos recolectados de mas de 4.000 pacientes con cáncer prostático en relación a su PSA, a su estadio clínico, a su score Gleason del tumor, así como al análisis anatomopatológico en relación a la extensión del tumor.
No debemos ver los valores de cada situación en particular, como "valores absolutos" y por lo tanto sus aportes deberían enfocarse con discreción. Es un orientador del caso clínico, no un mecanismo para decidir condudas terapéuticas.
Indudablemente estas determinaciones tendrán su influencia sobre la toma de decisiones, en cuanto a las modalidades de tratamientos que podamos aplicar en cada caso en particular.
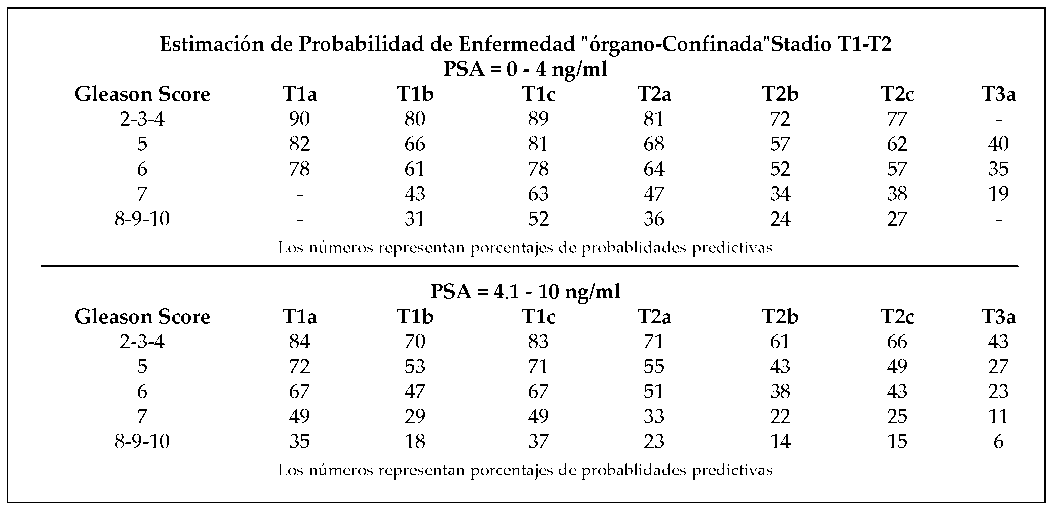

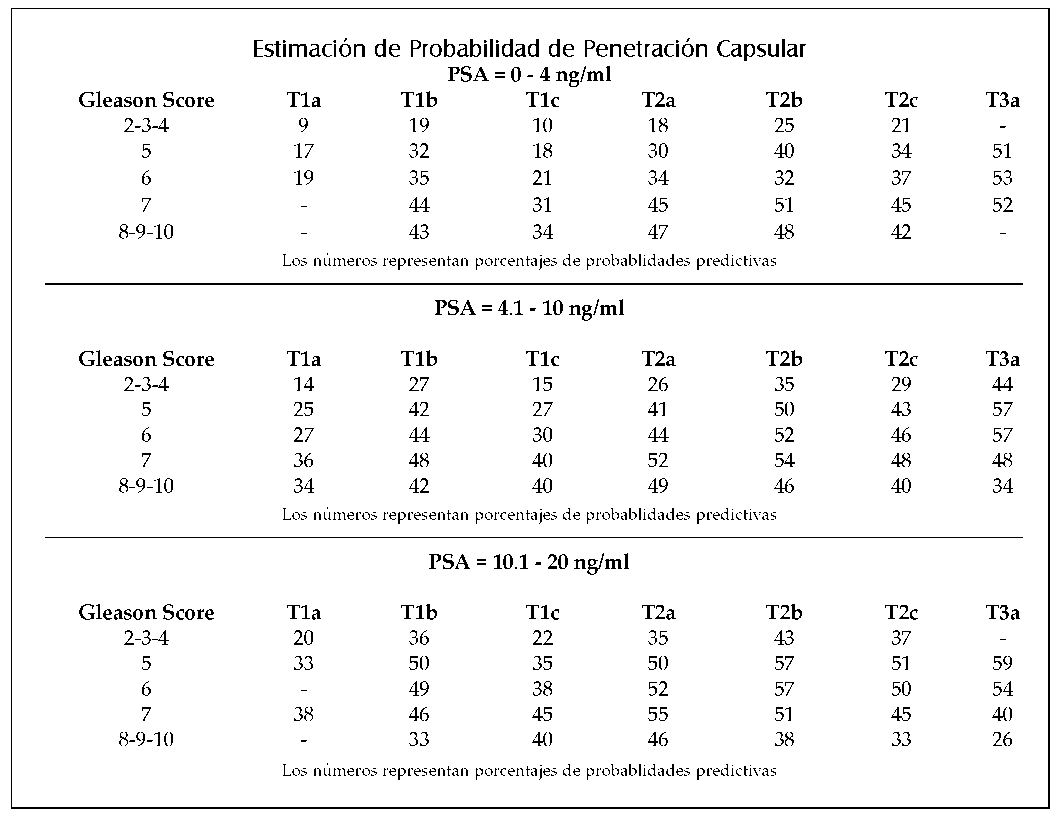

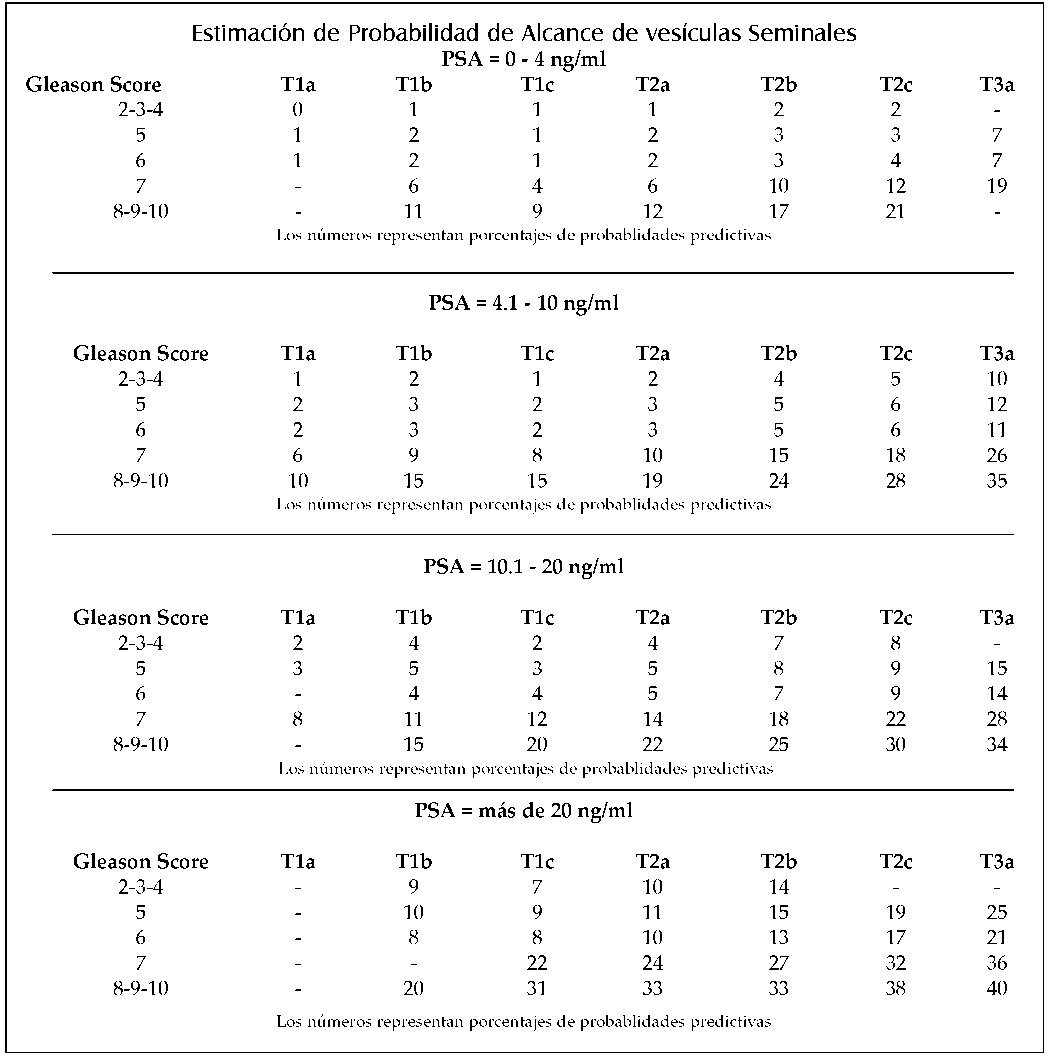
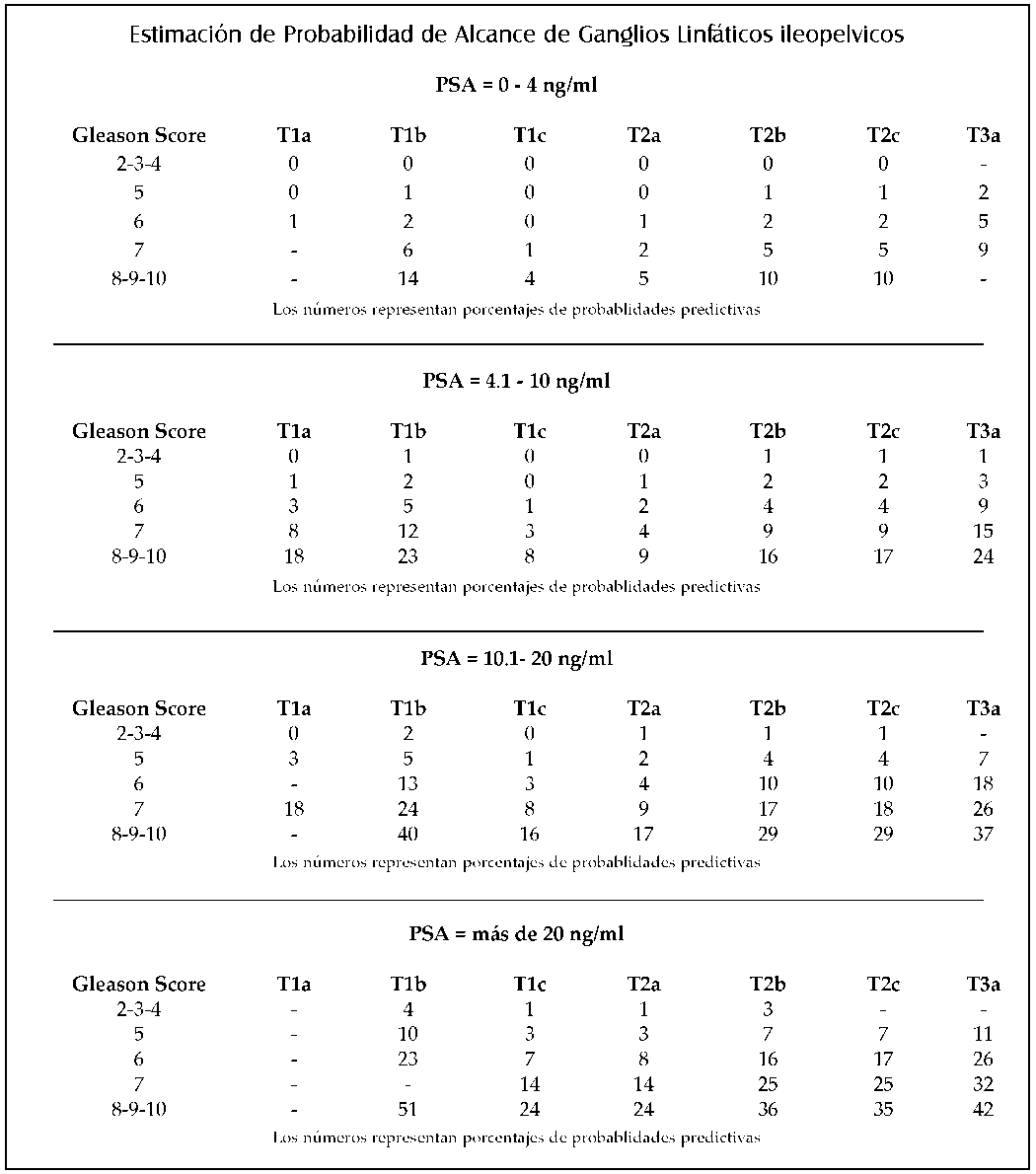
Prededr el estadio patológico de la enfermedad, podría afectar la toma de dedsiones en parientes con cáncer prostático, por lo cual éstas Tablas o Nomogramas se deberán tomar como un punto de información más que obtenemos del caso clínico de cada paciente y no darle ni un valor absoluto, ni mucho menos ser considerado como un factor determinante en la escogenda terapéutica del paciente afectado por cáncer prostático.
No solo por el tipo de terapia que podríamos impartir, sino por la variedad de terapias que un paciente determinado, podría recibir con base en el status de su enfermedad, según el cual, las Tablas o Nomogramas podrían jugar un rol decisivo. Estas tablas de predicción del estadio patológico han sido adaptadas corregidas y actualizadas por Partin, Polasdk, D'Amico, Kattan-Scardino, Slawin, entre otros.

A pesar de la importanda demostrada por el Score Gleason en lo referente a pronóstico del caso clínico con cáncer prostático, no cesan en el mundo entero, los esfuerzos para mejorar su eficacia y su predicitibilidad. Por esto es que se está pensando en modificar los dos patrones histológicos predominantes por el de tres patrones, ya que con éste, refieren Narain, Epstein y Partin entre otros, se estaría ayudando a mejorar los factores pronósticos en los porcentajes libres de enfermedad y con ello podríamos mejorar las terapias impartidas a nuestros parientes que mejoren sus expectativas de vida, ya que el paciente que sufre de cáncer de próstata es un hombre en rango de edad entre 50 y 65 años, lo cual lo hace muy joven, en etapas todavía muy productivas, donde sigue siendo un miembro útil y activo de su familia como de la sociedad donde está insertado.
BIBLIOGRAFÍA
American Joint Committee on Cancer Prostate. In AJCC Cancer Staging Manual, 6th ed: 309-316, 2002. New York: Springer-Verlag.
Albertsen P, Frybeck D, Storer B. Long-term survival among men with conservatively treated localized prostate cancer. JAMA 274: 626-631, 1995.
Albertsen P. Fine J. Prostate biopsy in the community: Who are the most likely candidates? Contemporary Urology 7 (2), 54-57, Feb 1995.
Albertsen P, Frybeck D, Storer B. The impact of co-mor-bidity on life expectancy among men with localized prostate cancer. J Urol 156: 127-132, 1996.
Albertsen P, Hanley J, Gleason D. A competing risk analysis of men age 55-74 years at diagnosis managed conservatively for clinically localized prostate cancer. JAMA 280: 975-980, 1998.
Aleman M, Karakiewicz PI, Kupelian P et al. Age and PSA predict likelihood of organ-confined disease in men presenting with PSA less than 10 ng/mL: implications for screening. Urology 2003; 62: 70-74.
Allsbrook Jr W, Lane R, Lane C, et al: Interobserver reproducibility of Gleason's grading system: urologic pathologists. Mod Pathol 11: 75A, 1998.
Allsbrook Jr W, Mangold K, Yang X, et al: The Gleason grading system: an overview. J Urologic Path 10: 141-157, 1999.
Arcangeli C, Humphrey P, Smith D, Harmon T, Shepherd D, Keetch D. Percentage of free serum prostate-specific antigen as a predictor of pathologic features of prostate cancer in a screening population. Urology 51: 558, 1998.
Babaian R, Troncoso , Steelhammer L, Lloreta-Trull J, Ramirez E. Tumor volumen and prostate specific
antigen: implications for early detection and defining a window of curability. J Urol 154: 1808, 1995.
Badalament R, Miller M, Peller P. An algorithm for predicting nonorgan confined prostate cancer using the results obtained from sextant core biopsies with prostate specific antigen level. J Urol. 1996; 156: 1375-1380, 1996.
Barry M. Natural History of Clinically localized Prostate Cancer. Seminars in Surgical Oncology 11: 3-8, 1995.
Baretton GB, Vogt T, Blasenbreu S, Lohrs U.Comparison of DNA ploidy in prostatic intraepithelial neoplasia and invasive carcinoma of the prostate: an image cytometric study. Hum Pathol 25: 506-513, 1994.
Bastacky SI, Wojno KJ, Walsh PC, Carmichael MJ, Epstein JI. Pathological features of hereditary prostate cancer. J Urol 153(3 Pt2): 987-92, Mar 1995.
Berger AP, Spranger R, Kofler K et al. Early detection of prostate cancer with low PSA cut-off values leads to significant stage migration in radical prostatectomy specimens. Prostate 2003; 57: 93-98.
Bianco FJ, Cher ML, Powell IJ, Grignon DJ, Sakr WA, Wood DP, Pontes E. Specimen Gleason Score is the only prognostic factor in pathologically organ confined prostate cancer. J Urol 167 (4) Suppl April 2002 Abstract # 1408.
Bianco F Jr, Wood D Jr, Cher M, Powell I, Souza J, Pontes J. Ten-year survival after radical prostatectomy: specimen Gleason score is the predictor in organ-confined prostate cancer. Clin Prostate Cancer. 1(4): 242-247, Mar 2003.
Blackwell KL, Bostwick DG, Myers RP, Zincke H, Oesterling JE. Combining prostate specific antigen with cancer and gland volume to predict more reali-bly pathological stage: the influence of prostate specific antigen cancer density. J Urol 151: 1565, 1994.
Bluestein D, Bostwick D, Bergstralh E, Oesterling J.Eliminating the need for bilateral pelvic lym-phadenectomy in selected patients with prostate cancer. J Urol 151: 1315-1320, 1994.
Bono AV, Celato N, Cova V, Salvadore M, Chinetti S, Novario R. Microvessel density in prostate carcinoma Prostate Cancer and Prostatic Diseases 5(2) 123-127, 2002.
Borboroglu P. Repeat biopsy strategy in patients with atypical small acinar proliferation or high grade prostatic intraepithlelial neoplasia on initial postate needle biopsy. J Urol 166 (3): 866-870, Sep. 2001.
Bostwick D, Burke H, Wheeler T, Chung L, Bookstein R, Pretlow T, Nagle R, Montironi R, Lieber M, Veltri R. The most promising surrogate endpoint biomarkers for screening candidate chemopreventive compounds for prostatic adenocarcinoma in short-term phase II clinical trials. J Cell Biochem Suppl 19: 283-289, 1994.
Bostwick D. Target populations and strategies for chemoprevention trials of prostate cancer. J Cell Biochem Suppl. 19: 191-196, 1994.
Bostwick D, Dousa M, Crawford B, Wollan P. Neuroendocrine differentiation in prostatic intraepithelial neoplasia and adenocarcinoma. Am J Surg Pathol 18(12): 1240-1246, Dec 1994.
Bostwick D: Gleason grading of prostatic needle biopsies: correlation with grade in 316 matched prostatectomies. Am J Surg Pathol 18: 796-803, 1994.
Bostwick D. Prostatic Intraepithelial Neoplasia. 38. Anatomy and Pathology of Prostate Cancer, 38B: 639. Comprehensive Texbook of Genitourinary Oncology. Vogelzang N, Scardino P, Shipley, Coffey WD. 1996. Williams&Wilkins.
Bostwick DG, Qian J, Frankel K. The Incidence of High grade prostatic intraepithelial neoplasia in needle biopsies. J Urol 154 (5): 1791-1794, Nov 1995.
Bostwick DG, Amin MB, Dundore P, Marsh W, Schultz DS. Architectural patterns of high-grade prostatic intraepithelial neoplasia. Hum Pathol, 24(3): 298-310, Mar 1993.
Bostwick DG, Qian J, Bergstralh E. Prediction of capsular perforation and seminal vesicle invasion in prostate cancer. J Urol. 155: 1361-1367, 1996.
Bostwick D. Prospective origins of prostate carcinoma. Prostatic intraepithelial neoplasia and atypical adenomatous hyperplasia. Cancer. 78: 330-336, 1996.
Bostwick DG, Qian J. Atypical adenomatous hyperplasia of the prostate. Relationship with carcinoma in 217 whole-mount radical prostatectomies. Am J Surg.Pathol 19(5): 506-18, May 1995.
Bostwick DG, Qian J, Bergstralh E, Dundore P, Dugan J, Myers RP, Oesterling JE. Prediction of capsular perforation and seminal vesicle invasion in Prostate Cancer. J Urol 155 (4): 1361-1367, April 1996.
Brawer MK, Deering RE, Brown M,Preston SD,Bigler SA. Predictors of pathologic stage in prostatic carcinoma. The role of neovascularity. Cancer 73(3): 678-687, Feb 1994.
Brawer MK. Prostatic intraepithelial neoplasia: a prema-lignant lesion. Hum Pathol 23(3): 242, 1992.
Brawer MK, Bostwick D, Montie JE, Murphy GP, Porter A. Controversies in Prostate Cancer: Diagnosis and Management. 92nd Annual Meeting AUA New Orleans, 1997.
Brawer MK, Nagle RB, Bigler SA, Lange PH, Sohlberg OE. Significance of Prostatic Intraepithelial Neoplasia on Prostate Needle Biopsy. Urology 38: 103-107, 1991.
Brawer MK. Prostatic Intraepithelial Neoplasia. Significance and Management. Problems in Urology. 4 (3): 392-407, Sept 1990.
Brawer MK. Prostatic intraepithelial neoplasia: a prema-lignant lesion. Hum Pathol 23(3): 242, 1992..
Burchardt M, Engers R, Mueller M, Burchardt T, Ackermann R, Gabbert HE, De La Taille A, Epstein JI, Rubin .Trends in Gleason Grading in germany: Evaluting using prostate cancer tissue microarrays. J Urol 171(4), April 2004, Abstract # 846.
Carter HB, Walsh PC, Landis P. Johns Hospkins University, Baltimore. Expenctant Management of Nonpalpable Prostate Cancer with curative intent: Preliminary results. J Urol 167: 1231-1234, 2002.
Antenor J, Misop H; Kimberly R, Nadler R Catalona W. Relationship between inicial prostate specific antigen level and subsequent prostate cancer detection in a longitudinal screening study. Journal of Urology. 172(1): 90-93, July 2004.
Chan T, Partin A, Walsh P, et al: Prognostic significance of Gleason score 3+4 versus Gleason score 4+3 tumor at radical prostatectomy. Urology 56: 823-827, 2000.
Cheville J, Bostwick D. Postatrophic hyperplasia of the prostate. A histologic mimic of prostatic adenocarcinoma. Am J Surg Pathology. 19(9): 1068-76, Sep 1995.
Civantos F, Soloway MS. Prostatic Pathology after Androgen Blockade: Effects on Prostatic carcinoma and on Nontumor Prostate.Advances in Anatomic Pathology. 3(4): 259-265, 1995.
Colbert D.In the right position for Radical perineal prostatectomy. Contemporary Urology 16(11): 56-57,
1994.
Conrad S, Graefen M, Pichlmeier U, Henke RP, Erbersdobler A, Hammerer PG, Huland H. Prospective validation of an algotith with systematic sextant biopsy to predict pelvic lymph node metastasis in patients with clinically localized prostatic carcinoma. J Urol 167: 521-525, Feb 2002.
Coogan CL, Latchamsetty KC, Greenfield J, Corman JM, Porter CR. Increasing the number of biopsy cores improves the accuracy of the Gleason score when compared to radical prostatectomy Gleason score. J Urol 171(4), April 2004. Abstract # 1813
Crawford D. Should androgen ablation for metastatic PCa be total ? Contemporary Urology. Nov 6 (11): 39-55, 1994.
Davidson D, Bostwick DG, Qian J,Wollan PC,Oesterling JE,Rudders RA, Siroky M, Stilmant M. Prostatic Intraepithelial neoplasia is a risk factor for adenocarcinoma: predictive accuracy in needle biopsies. 154: 1295-1299, Oct 1995.
Davidson D, Bostwick DG, Qian J, Wollan PC, Oesterling JE, Rudders RA, Siroky M,Stilmant M. Prostatic Intraepithelial neoplasia is a risk factor for adenocarcinoma: predictive accuracy in needle biopsies. 154, 1295-1299, Oct 1995.
DAmico AV: Combined-modality staging for localized adenocarcinoma of the prostate. Oncology 15: 1049-1059, 2001
DAmico AV, Whittington R, Malkowicz SB et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998; 280: 969-74.
D'Amico AV, Whittington R, Malkowicz SB. Clinical utility of the percentage of positive prostate biopsies in defining biochemical outcome after radical prostatectomy for patients with clinically localized prostate cancer. J Clin Oncol 18: 1164-1172, 2000.
D'Amico AV, Chen MH, Malcowicz SB. Lower prostate specific antigen outcome than expected following radical prostatectomy in patients with high grade prostate cancer and a prostatic specific antigen level of 4 ng/ml or less. J Urol 167: 2025-2031, 2002.
DiBlasio CJ, Kattan MW. Use of nomograms to predict the risk of disease recurrence after definitive local therapy for prostate cancer. Urology 2003; 62(Suppl 1): 9-18.)
Donahue T, Moul J. Diagnostic Accuracy of Prostate Needle Biopsy. Current Urology Reports 3: 215-221, Jun 2002.
Dugan JA, Bostwick DG, Myers RP, Qian J, Bergstralh EJ, Oesterling JE. The definition and preoperative prediction of clinically insignificant prostate cancer. JAMA 275: 288-294, 1996.
Egevad L, Granfors T, Karlberg L, Bergh A, Stattin P. Percent Gleason Grade 4/5 as prognostic actor in Prostate Cancer Diagnosed at transurethral resection. Journal Urol 168(2): 509-513, Aug 2002.
Ellis W, Brawer M. Repeat prostate needle biopsy: who needs it?J Urol 153(5): 1496-8, May 1995.
Epstein J. Diagnostic criteria of limited adenocarcinoma of the prostate on needle biopsy. Hum Pathol 26(2): 223-229, Feb 1995.
Epstein J, Pound C, Partin A. Disease progression following radical prostatectomy in men with Gleason score 7 tumors. J Urol 160: 97-101, 1998.
Epstein J: Gleason score 2-4 Adenocarcinoma of the prostate on needle biopsy. A diagnosis that should not be made. Am J Surg Path 24: 477- 478, 2000.
Epstein J, Carmichael M, Partin A, Walsh P. Is tumor volume an independent predictor of progression following radical prostatectomy? A multivariate analysis of 185 clinical stage B adenocarcinoma of the prostate with five years follow-up. J Urol 149: 1478-1481, 1993.
Epstein JI. Diagnostic criteria of limited adenocarcinoma of the prostate on needle biopsy. Hum Pathol 26(2): 223-9, Feb 1995.
Epstein J, Grignon D, Humphrey P, McNeal J, Sesterhenn
I, Troncoso P, Wheeler T. Interobserver reproducibility in the diagnosis of prostatic intraepithelial neoplasia. Am J Surg Pathol. 19(8): 873-886, 1995.
Epstein J, Markov D, Sanderson H, Partin A. Gleason Score 7 on needle biopsy: Is the prognostic difference between Gleason Scores 4+3 and 3+4 independent of the number of involved cores? J Urol 167 (4) Suppl April 2002. Abstract # 919.
Epstein J, Lecksell K, and Carter H. Prostate cancer sampled on sextant needle biopsy: Significance of cancer on multiple cores from different areas of the prostate. Urology 54: 291-294, 1999.
Fandel T, Pfnur M, Corinth C, Ansorge M, Melchior
S,Wohr M, Gillitzer R, Hampel C, Lehr H, Joachim W, Thuroff J. Predictive value of different grading systems for prostate carcinoma after radical prostatectomy. J Urol 171(4) Apr 2004. Abstract # 852.
Ferguson J,Zincke H,Ellison E,Bergstrahl E, Bostwick DG. Decreased of prostatic intraepithelial neoplasia following androgen deprivation therapy in patients with stage T3 carcinoma treated by radical prostatectomy Urology 44(1): 91-5, Jul 1994.
Freedland S, Csathy G, Dorey F, Aronson W. Clinical utility of percent prostate needle biopsy tissue with cancer cutpoints to risk stratufy patients before radical prostatectomy.Urol 60(1): 84-88, 2002.
Freedland S, Csathy G, Dorey F, Aronson W. Percent prostate needle biopsy tissue with cancer is more predictive of biochemical failure or adverse pathology after radical prostatectomy than prostate specific antigen or Gleason Score. Journal Urol 167 (2 part 1 of 2), 516-520, Feb 2002.
Gaudin PB,Sesterhenn IA,Wojno KJ,Mostofi FK,Epstein JI. Incidence and clinical significance of high grade prostatic intraepithelial neoplasia in TURP specimens. Urology 49 (4): 558-563, April 1997.
Gerber G, Chodak GW.Cellular Diagnostic Methods for Prostate Cancer. Cytology vs Core Biopsy. Problems in Urology 4 (3): 358-365, Sept 1990.
Gleason D. Histologic grading of Prostate cancer: a perspective. Hum Pathol 23: 273-279,1992.
Gleason DF, Mellinger G: The Veterans Administration Cooperative Urologic Research Group. Prediction of prognosis for prostatic adenocarcinoma by combined histologic grading and clinical stage. J Urol 111: 58-64, 1974.
Gleason D. Classification of prostate carcinomas. Cancer Chemother Rep 50: 125-128, 1966.
Gleason DF. Histologie grading and clinical staging of prostatic carcinoma in Tannenbaum M (ed): Urologic Pathology: The Prostate Philadelphia, Lea
& Febiger : 171-198,1977.
Goldenberg SL, So A. Protocols & Practices. Perspectivas on cancer management. Risk Stratification in prostate cancer. Trenes in preoperative clinical assessment. 3(4): 20-30, Oct 2004.
Greene D, Wheeles T, Egawa S, Dunn J, Scardino P. A comparison of the morphological features of Cancer arising in the Transition Zone and in the Peripheral Zone of the Prostate. J Urol 146: 1069-1076, 1991.
Greene D, Egawa S, Neerhut G, Flanagan W, Wheeler T, Scardino P. The distribution of residual Cancer in radical prostatectomy specimens in Stage A Prostate Cancer J Urol 145: 324-329, 1991.
Grober E, Nam R, Sweet J, Evans A, Jewett M, Trachtenberg J, Rosinette M, Tsihlas J. J Urol 167 (4) Suppl April 2002. Abstract # 918.
Grossfeld G, Latini D, Lübeck D, Mehta S, Carroll P. Predicting recurrence following radical prostatectomy for patients with high risk prostate cancer: Data from Capsure. J Urol 167 (4) Suppl. April 2002. Abstract # 1419
Haggman MJ,Macoska JA,Wojno KJ,Oesterling JE The relationship bet-ween prostatic intraepithelial neoplasia and prostate cancer: Critical issue. J Urol 158: 12-22, Julio 1997.
Helpap B,Bostwick D,Montironi R. The significance of atypical adenomatous hyperplasia and prostatic intraepithelial neoplasia for the development of prostate carcinoma. An Update. Virchows Arch. 426(5): 425-34, 1995.
Huland H, Graefen M, Haese A, Hammerer P, Palisaar J, Pichlmeier U, Henke R, Erbersdobler A, Huland E, Lilja
H. Prediction of tumor heterogeneity in localized prostate cancer. Urol Clin N Am 29(1): 213-222, Feb 2002.
Iczkowski K, Bassler T, Schwob V, Bassler I, Kunnel B, Orozco R, Bostwick D.Diagnosis of "suspicious for malignancy" in prostate biopsies: predictive value for cancer. Urology. 51(5): 749-757; discussion 757-758, May 1998.
Joniau S, Goeman L, Pennings J, Van Poppel H. Prostatic intraepyhelial neoplasia (PIN): Importance and
clinical Management European Urology 48: 379-385,
2005.
Kattan M, Stapleton A, Wheeler T, Scardino P. Evaluation of a nomogram used to predict the pathologic stage of clinically localized prostate carcinoma. Cancer. 1997; 79: 528-537.
Kattan MW, Eastham JA, Stapleton AM et al. A preoperative nomogram for disease recurrence following radical prostatectomy for prostate cancer. J Natl Cancer Inst 90: 766-771, 1998.
Kattan M, Wheeler T, Scardino P. Postoperative nomogram for disease recurrence after radical prostatectomy for prostate cancer. J Clin Oncol 17: 1499, 1999.
Katz M, Zelefsky M, Venkatraman E. Risk stratification predicts biochemical outcome after salvage postprostatectomy three-dimensional conformal radiation therapy. Int J Radiat Oncol Biol Phys. 51(suppl 1):170. Abstract 305, 2001.
Khan M, Partin A, Mangold L, Epstein J, Walsh P. Urology 62(5): 866-871, 2003.
Keetch D, Humphrey P, Stahl D, Smith D, Catalona W. Morphometric analysis and clinical followup of isolated prostatic intraepithelial neoplasia in needle biopsy of the prostate. J Urol 154(2Ptl): 347-51, Aug
1995.
Kupelian P. Correlation of clinical and pathologic factors with rising prostate-specific antigen profiles after radical prostatectomy alone for clinically localized Prostate Cancer. Urology 48: 249-260, 1996.
Langer JE, Rovner ES,Coleman BG,Yin D,Arger PH,Malkowicz SB, NisenbaumHL,Rowling SE, Tomaszewski JE,Wein AJ. Strategy for repeat biopsy of patients with prostatic intraepithelial neoplasia detected by prostate needle biopsy. 155: 228-231, Jan
1996.
Larsen MP, Carter HB, Epstein JI. Can Stage Al tumor extent, be predicted by transurethral resection tumor volume per cent or grade? A study of 64 stage Al Radical Prostatectomies with comparison to Prostates removed for stages A2 and B Diseases. J Urol 146: 1059-1063, 1991.
Lehr D, Moore C, Nazeer T, Karikehalli S, Mian BM. Effect of prostate sampling technique on the correlation between biopsy and prostatectomy Gleason score in the contemporary era. J Urol 171(4). April
2004. Abstract # 832
Lerner SE, Blute ML, Bergstrahl EJ, Bostwick DG, Eickholt JT, Zincke H. Analysis of Risk factors for progression in patients with pathologically confined Prostate Cancer after Radical Retropubic Prostatectomy. J Urol 156 (1): 137-143, Jul 1996.
Leventis AK, Shariat SF, Kattan MW, Butler EB, Wheeler TM, Slawin KM. Prediction of response to salvage radiation therapy in patients with prostate cancer recurrence after radical prostatectomy. J Clin Oncol 19: 1030-1039, 2001.
McNeal J. Regional morphology and pathology of the prostate Am J Clin Patol 49, 347-357, 1968.
McNeal JE. Cancer volumen and site of origin of adenocarcinoma in the prostate: relationship tol local and distant spread. Hum Pathol 23: 395, 1997.
McNeal JE: Cancer volume and site of origin of adenocarcinoma in the prostate: relationship to local and distant spread. Hum Path 23: 258- 266, 1992.
McNeal J,Bostwick D.Intraductal dysplasia: a premalig-nant lesion of the prostate. Hum Pathol 17: 64-71, 1986.
Makhlouf DA, Krupski TL, Kunkle DA, Theodorescu D. Does increasing the number of sampled cores in a prostate biopsy improve the accuracy of pathological grade and the prediction of tumor distribution? J Urol 167 (4) Suppl April 2002 Abstract 919. 18
Master V, Weinberg VK, Chi T, Carroll PR. An increasing number of prostate biopsies results in the detection of smaller volumen tumors. J Urol 171(4) April 2004 Abstract # 1832
Mehlhom J. The diagnostic value of displastic changes in the prostate. Zentralbi Pathol 137(5): 395-401, 1991.
Merrick GS, Butler WM, Galbreath RW, Lief JH, Adamovich E. Biochemical Outcome for Hormone-Naive patients with Gleason Score 3+4 versus 4+3 prostate cancer undergoing permanent prostate Brachitherapy. Urology: 60 (1): 98-103, 2002.
Merrick G,Butler W, Wallner K, Galbreath R, Adamovich E. Permanent Interstitial Brachytherapy for Clinically Organ-Confined High-Grade Prostate
Cancer With a Pretreatment PSA < 20 ng/mL. American Journal of Clinical Oncology. 27(6): 611-615, Dec 2004.
Messing EM, Thompson Jr I. Follow-up of conservatively managed prostate cancer. Watchful waiting and primary hormonal therapy. Urol Clin N Am 30 (4): 687-702, 2003.
Montie JE. Seminars in Urologie Oncology. Prostate Cancer Nomograms and Prognostic Models Michael Kattan. WB Saunders 20 (2), May 2002.
Montironi R, Magi-Galluzzi C, Muzzonigro G, Prete E, Polito M, Fabris G. Effects of combination endocrine treatment on normal prostate, prostatic intraepithelial neoplasia,and prostatic adenocarcinoma. J Clin Pathol 47(10): 906-13, Oct 1994.
Montironi R, Scarpelli M, Galluzzi CM, Diamanti L. Aneuploidy and nuclear features of prostatic intraepithelial neoplasia (PIN). J Cell Biochem Suppl 16H: 47-53, 1992.
Mostofi FK, Murphy GP, Mettlin C, Sesterhenn IA, Batsakis JG, Khaliq SU, Nadimpalli V, Tahan S, Siders DB, Kollin J. Pathology review in an early prostate cancer detection program: results from the American Cancer. Prostate 27(1): 7-12, Jul 1995.
Mostofi FK, Sesterhenn IA, Davis CJ. Prostatic intraepithelial neoplasia (PIN): morphologicalclinical significance. Prostate Suppl. 4: 71-7, 1992.
Muramoto M, Ohori M, Maru N, Scardino P, Koh H, Shaiat S, Slawin K, Wheeler TM. Does percent Gleason Grade 4/5 (% GG 4/5) in radical prostatectomy (RP) specimens add in formations to standard Gleason Score (GS). J Urol 167 (4) Suppl April 2002 Abstract # 919.16.
Murphy G: Prostate Cancer. Research Endocrin. Treatment & Histopathology. John Wiley & Sons Inc. September, 1987
Nagle RB, Petein M, Brawer M, Bowden GT, Cress AE. New relationships between prostatic intraepithelial neoplasia and prostatic carcinoma. J Cell Biochem Suppl. 16H: 26-9, 1992.
Naito S. Evaluation and Management of Prostate-specific Antigen Recurrence After Radical Prostatectomy for Localized Prostate Cancer. Japanese Journal of Clinical Oncology 2005 35(7): 365-374.
Narain V, Bianco F, Heath M, Grignon DJ, Sakr WA, Pontes JE, Wood Jr DP. How Accurately does biopsy information determine outcome. Progress and Controversies in Oncological Urology VI (Paciou VI). Renal, Bladder, Prostate and Testicular cancer and update Pathenon Publishing 2000. 113-120.
Narayan P, Tewari A. Systematic biopsy-based staging of prostate cancer: scientific background, individual variables, combination of parameters, and current integrative models. Semin Urol Oncol. 16: 172-181, 1998.
Nelson PS. Predicting prostate cancer behaviour using transcript profiles. J Urol 172(5) part 2 of 2: S28-S33, Nov 2004.
Noguchi M, Stamey T, McNeal T, et al: Preoperative prostate specific antigen does not reflect biochemical failure rates after radical prostatectomy in men with large volume cancer. J Urol 164: 1596-1600, 2000.
Obek C, Sadek S, Lai S, Civantos F, Rubinowicz D, Soloway MS. Positive surgical margins with radical retropubic prostatectomy: anatomic site-specific pathological analysis and impact on prognosis. Urology 54(4) 682-688, Oct 1999.
O'Dowd G, Veltri R, Orozco R, et al: Update on the appropriate staging evaluation for newly diagnosed prostate cancer. J Urol 158: 687- 698, 1997.
O'Dowd G, Miller M, Orozco R, et al: Analysis of repeat biopsy results within one year following a non-can-cer diagnosis. Urology 55: 553- 559, 2000.
Ohori M, Goad J, Wheeler T. Can radical prostatectomy alter the progression of poorly differentiated prostate cancer? J Urol 152 (5 pt 2): 1843-1849, 1994.
Orozco R, O'Dowd G, Kunnel B, et al: Observations on pathology trends in 62,537 prostate biopsies obtained from urology practices in the United States. Urology 51: 186-195, 1998.
Pan CC, Potter SR, Partin AW. The prognostic significan-mce of tertiary Gleason patterns of higher grade in radical prostatectomy specimens: a proposal to modify the Gleason grading system. Am J. Surg Pathol 2000; 24: 563-9.
Partin AW. Combination of Prostate-specific antigen, clinical stage and Gleason score to predict pathological stage of localized Prostate Cancer: a multiinsti-tutional update. Jama 277: 1445-1460, 1997.
Partin AW, Yoo J, Carter HB. The use of prostate specific antigen, clinical satge, and Gleason score to predict pathological stage in men with localized prostate cancer. J Urol 1993; 150: 110-114.
Partin AW, Kattan MW, Subong EN et al. Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer: a multi-institutional update (published correction appears in JAMA, 278: 118, 1997) JAMA 277: 1445-1451, 1997.
Polascik TJ, Pearson JD, Partin AW. Multivariate models as predictors of pathologic stage using Gleason score, clinical stage and serum PSA. Seminars in Urologic Oncology 1998, 1998; 16:160-171.
Pound CR, Partin AW, Epstein JI. Prostate specific antigen after anatomic radical retropubic prostatectomy. Patterns of recurrence and cancer control Urol Clin North Amer 1997;24:395-406.
Qian J, Wollan P, Bostwick DG. The extent and multicentricity of high grade prostatic intraepithelial neoplasia in clinically localized prostatic adenocarcinoma. Hum Pathol in press.
Richie JP: Management of patients with positive surgical margins following radical prostatectomy. Urol Clin North America 21: 717-723, 1994.
Sakr W, Haas G,Cassin B,Pontes J,Crissman J.The fre-cuency of carcinoma and intraepithelial neoplasia of the prostate in young male patients.J Urol 150 (2 Pt 1): 379-85, Aug 1993.
Sakr W, Grignon D, Che M, Kolizeras K, Andea A, Powell I, Cher M, Pontes J. PSA and pathological parameters of needle biopsy (BX) and radical prostatectomy specimens (RPS) across the age spectrum of African American (AA) and Caucasian (C )men: an analysis of 3049 Bx and 1862 RPS. J Urol 171(4) Apr 2004 Abstract # 1187.
Sakr W, Tefilli M, Grignon D, et al: Gleason score 7 prostate cancer: a heterogeneous entity? Correlation with pathologic parameters and disease-free survival. Urology 56: 730-734, 2000.
Schächter LR, Raboy A, Albert P. Combination radiotherapy in patients with Gleason 7 a 10 with min-imun three-year follow-up. J Urol 171(4) April 2004 Abstract # 814.
Schatzl G, Gsur A, Haidinger G, Marberger M. low serum testosterone levels and high grade prostate cancer associated with a polymorphism in the are 1 region of the prostate-specific antigen gene. J Urol 171(4) April 2004 Abstract # 593.
Schwartz E, Albertsen P. Nomograms for Clinically localized disease. Part III: Watcful Waiting Seminars in Urologic Oncology 20 (2): 140-145, May 2002.
Shekarriz B, Upadhyay J, Wood Jr DP. Gleason score 7 adenocarcinoma of the prostate. Contemporary Urology 13(6); 62-76, June 2001.
Shekarriz B, Wood Jr, D. Gleason Score 7 Adenocarcinoma of the Prostate: A Separate Entity. Contemporary Urology, 2000.
Shekarriz B, Upadhyay J, Bianco FJ Jr. Impact of preoperative serum PSA level from 0 to 10 ng/ml on pathological findings and disease free survival after radical prostatectomy. Prostate 2001; 48: 136-43.
Shepherd D, Keetch DW, Humphrey PA, Smith DS, Stahl D. repeat biopsy strategy in men with isolated prostatic intraepithelial neoplasia on prostate needle biopsy. J Urol 156(2 pt): 460-462, 1996.
Shin HJ,Ro JY. Prostatic intraepithelial neoplasia: a potential precursor lesion of prostatic adenocarcinoma. Yonsei Med J 36(3): 215-31, Jul 1995.
Symon Z. Elevated PSA Following Radical Prostatectomy? Medscape Hematol-Oncolog 5(1), 2002.
Stamey TA, Villers AA, McNeal JE. Positive surgical margins at radical prostatectomy: importance of the apical dissection. J Urol 143: 1166-1172 , 1990.
Stamey TA. Preoperative serum prostate-specific antigen (PSA) below 10 microg/1 predicts neither the presence of prostate cancer nor the rate of postoperative PSA failure. Clin Chem 2001; 47: 631-34.
Stamey TA, Freiha FS, McNeal JE, Redwine EA, Whittemore AS, Schmid HP. Localized prostate cancer. Relationship of tumor volume to clinical significance for treatment of prostate cancer. Cancer 71: 933, 1993.
Stamey TA, Sozen TS, Yemoto CM, McNeal JE. Classification of localized untreated prostate cancer based on 791 men treated only with radical prostatectomy: common ground for therapeutic trials an TNM subgroups. J Urol 159: 2009, 1998.
Stamey TA, Caldwell M, McNeal JE et al. The Prostate Specific Antigen Era in the United States is Over for Prostate Cancer: What Happened in the Last 20 Years? J Urol 2004;172(4, Pt 1 of 2): 1297-1301.)
Stamey TA, McNeal JE, Yemoto CM, Sigal BM, Johnstone IM. Biological determinants of cancer progression in men with prostate cancer. JAMA 281:1395, 1999.
Steinberg D, Sauvageot D, Epstein J. Correlation of prostate needle biopsy and radical prostatectomy. Gleason grade in academic and community settings. Med Pathol 9: 83A, 1996.
Steinberg D, Sauvageot J, Piantadosi S, et al: Correlation of prostate needle biopsy and radical prostatectomy Gleason grade in academic and community settings. Am J Surg Pathol 21: 566-576, 1997.
Stotzer M, Bianco F, Grignon D, Sakr W, Pontes E, Wood
D. Specimen Gleason Score is predictive of disease-free survival within different pathologic stages. Jurol 167(4)Sup April 2002 Abstr # 919
Studer UE. Uroweb. Highlights European Winter Forum, Davos, March 2002 .Report by Henk van der Poel. http://www.uroweb.org/index.php7tem-p lates_id=10 &id=8 &off set=1 &structure_id=204
Sved P, Manoharan M, Gomez P, Kim S, Soloway M. Limitations of biopsy Gleason grade: Implications for counseling patients with Gleason 6 prostate can-cer.J Urol 171(4) Apr 2004 Abstract # 1066.
Sweat S, Bergstralh E, Slezak J, Blute M, Zincke H. Competing Risk analysis after radical prostatectomy for clinically nonmetastatic prostate adenocarcinoma according to clinical Gleason Score and patient age. Journal Urol 168 (2): 525-529, Aug 2002.
Swindle P, Kattan M, Scardino P. Markers and meaning of primary treatment failure. Urol Clin N Am 30(2): 377-401, May 2003.
Symon S. Elevated PSA Following Radical Prostatectomy? Medscape Hematology-Oncology 5(1), 2002.
Tigrani VS, Bhargava U, Shinohara K, Presti Jr JC. Number of positive systematic sextant biopsies predicts surgical margin status at radical prostatectomy. Urology 54(4): 689-693, Oct 1999.
Troncoso Patricia. Prostatic Intraepithelial Neoplasia. The Cancer Bull 45 (5): 397-402, 1993.
Weidner N, Carroll P, Flax J, et al: Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma, Am J Pathol 143: 401-409, 1993.
Weinstein MH,Epstein JI. Significance of high grade prostatic intraepithelial neoplasia on needle biopsy. Hum Pathol 24(6): 624-9, 1993.
Wheeler TM. Clinical and pathological significance of the level and extent of capsular invasion in clinical stage T1-T2 prostate cancer. Hum Pathol 1998; 29: 856-862.
Dr. Julio César Potenziani Bigelli
Especialista urólogo Hospital Privado Centro Médico de Caracas
Br. Silvia Daniela Potenziani Pradella Estudiante de Medicina UCV.. Escuela Luis Razetti.
DISFUNCION ERECTIL POSTERIOR A CIRUGIA RADICAL PROSTATICA. MODELO DE DECISIÓN
Con la presente monografía se ha tratado de investigar material bibliográfico sobre el tema de la disfunción eréctil posterior a cirugía radical prostática, para crear una especie de consenso en los modelos de comportamiento a seguir en hombres sometidos a cirugía radical prostática con disfunción eréctil de grados variables en su periodo postoperatorio, en virtud de hasta hace poco tiempo, la conducta del cirujano era esperar a que por si sola se recuperara la función sexual, lo cual sabemos hoy en día, es una conducta inadecuada. Pero que modelo seguir en virtud de la poca bibliografía existente hasta hace apenas 1 año atrás, pues bien, luego de realizar una revisión de aspectos anatómicos, fisiológicos, fisiopa-tológicos que rodean la función eréctil, se ha querido proponer un modelo de decisión que ha dado buenos resultados por lo cual se hace ésta monografía.
Se ha tratado de dejar de lado la actitud confiada que existe entre los cirujanos-urólogos, basado en los resultados-porcentajes de complicaciones, en cuanto a la potencia sexual posterior a la cirugía radical prostática por cáncer, ya que se presentan sin duda discrepancias entre lo que se publica y se dice en conferencias y jornadas y lo que en realidad se observa en los pacientes operados día tras día, en miles de centros hospitalarios del mundo entero.
Se tratará de orientar el tema en los aspectos que de algún modo puedan darle al lector una base sustancial de manejo adecuado de la problemática una vez que estemos en presencia de ella, pero también una profilaxia lo mejor posible antes de la cirugía, tomando en cuenta los factores de riesgo de la disfunción eréctil, durante el momento quirúrgico, y sobre todo recomendaremos en el periodo postoperatorio inmediato iniciar una estimulación precoz del área sexual posterior a una cirugía de cáncer prostática que conlleva la extirpación de próstata vesículas seminales y ganglios linfáticos ileopelvicos, con o sin preservación de los haces neurovasculares, todas ellas estructuras que de algún modo afectarán la potencia sexual.
Todo lo antes mencionado sin dejar de lado el aspecto de la calidad de vida del paciente operado en todas sus facetas de vida diaria, pero sobre todo en su área sexual, ya que no pocas veces nos conseguiremos que previamente al acto quirúrgico ya existe en la pareja un deterioro de niveles diversos de su actividad sexual, la cual es muy importante que se refleje en la historia clínica para poder tener un basamento de interpretación posteriormente al evento quirúrgico.
Pareciera que al final los aspectos mas importantes que rodean la potencia sexual postoperatoria en éstos pacientes son la edad, a mas joven mejor, el estadio clínico-patológico, mientras mas localizado sea el cáncer mejor, la preservación de los haces neurovasculares realizada con la mejor técnica posible y el presentar la menor cantidad posible de factores de riesgo para la salud sexual, así como una relación de pareja satisfactoria.
La disfunción eréctil afecta a millones de hombres en todo el mundo. Desde la aparición del Sildenafil, en el trabajo magistral de Goldstein I, Lúe TF, Padma-Nathan H, Rosen RC, Steers WD, Wicker PA. Oral Sildenafil in the treatment of erectile dysfunction. Sildenafil Study Group New England Journal of Medicine 338 (20):1397-1404, May 14, 1998, se cree que el fármaco ha sido utilizado por mas de 20 millones de hombres en mas de 110 países en el mundo entero. Su aparición ha ocasionado un cambio radical por parte del hombre afectado de disfunción eréctil que ha aceptado en buscar ayuda a su problema, gracias a que con los efectos farmacológicos favorables logrados sobre la erección, se dio cuenta que sus erecciones no eran todo lo efectivas que debían ser. Sin duda éste inhibidor de la 5-fos-fodiesterasa ha logrado que se sinceraran las cifras de prevalencia e incidencia de disfunción eréctil y con ello lograr una transformación de la sexualidad humana.
La toma de los inhibidores de 5-fosfodiesterasa han demostrado que el grado de turgencia peneana que se adquiere con su ingesta, es bastante diferente al que tiene normalmente el paciente, indicando con esto que aun cuando el hombre tenga erección, en un porcentaje significativo (por arriba del 50%), habrá también grados diversos de déficit de turgencia, lo cual es una forma de disfunción sexual (disfunción de turgencia?), logrando con los fármacos mencionados, mejorar sustancialmente en ambos aspectos, es decir en la turgencia y en la erección. Vemos con frecuencia que numerosos hombres refieren despectivamente no necesitar de los argumentos farmacológicos para tener una erección.
Cuando se le administra a ese paciente "normal" un inhibidor de la 5-fosfodiesterasa y se logran erecciones mejores y con un grado de dureza y consistencia mejores, se está en presencia de una disfunción de tumescencia-turgencia con lo cual quedaría abierta la polémica de los pacientes que sin necesitar fármacos para la erección, tendrían mejores erecciones en lo que respecta a dureza y calidad de la relación. ¿Será esto una nueva y formal indicación para el uso de éstos fármacos? ¿Será que en un futuro no muy lejano estos fármacos se tomen de manera regular 3 ó 4 veces por semana, como sucede con otras patologías crónicas de nuestro organismo?
Una vez llegado a los 40 años, 1 de cada 2 hombres pueden presentar episodios de disfundón eréc-til. Menos del 4% de los hombres que sufren disfunción erédil buscan atención médica y cuando lo hideron presentaban estados mas severos de la disfundón (McCullough, 2001) y esto adquiere mayor importancia al saberse por numerosos trabajos de investigadón, entre los que destaca el de Brecher (1984) en su reporte titulado "Love, sex and aging: a Consumer's Union report". Little Brown, Boston, refería que el 80-90% de hombres por arriba de los 60 años continúan teniendo actividad sexual.
Hoy en día 152 millones de hombres en el mundo entero sufre de disfundón eréctil de los cuales solo el
15 a 20 % son tratados, existiendo 30 millones solo en lo Estados Unidos de Norteamérica, y 30 millones en Europa (ARHP, 1999), (Aytac, 1999).
Nueve de cada 10 hombres que tienen disfunción erédil no buscarán atención médica, lo cual implica que debemos realizar una extensa actividad de difusión de informadón a todo nivel en la sociedad. De hecho McCullough (2001) refiere que menos del 4% de los parientes con disfundón eréctil buscarán atención médica y cuando lo hacen son los que tienen disfundones más severas. Aun más sabemos que por debajo de 40 años 20% de hombres entre 19 y 40 años sufren de "angustia de desempeño" es decir están ansiosos de su "performance sexual". 8% tendrán disfunción erédil psicógena lo cual hace que aproximadamente Un 28% de parientes por debajo de 40 años tendrán "episodios de disfundón sexual" que los incluirá dentro del grupo de pacientes que podrían tomar fármacos que mejoren la erección.
La Asociación de Profesionales de Salud Reprodudiva (Assodation of Reprodudive Health Professionals- ARHP) en su Survey sobre Actividad Sexual, publicó en 1999 que la mayoría de las personas en la década de los cincuenta años son sexualmente activas, evidendado por la mayoría de los surveys realizados y revisados. En grupos de más edad la actividad sexual declina progresivamente. Así vemos como un 61.6% de hombres en la década de los cincuenta años son sexualmente activos, comparados con un 35.5% de hombres de 70 años o mayores. Entre las mujeres el porcentaje de aquellas sexualmente adivas en la década de los dncuenta es del 50.2% y 18.1% en las de 70 o mas años. Es mayor la actividad sexual entre hombres ancianos que entre mujeres ancianas.
La NCOA (National Council on Aging) realizó en 1998 un Survey entre ancianos norteamericanos y señaló que el 61% de hombres y 37% de las mujeres eran sexualmente adivos, así fuera solamente una relación mensual en los 12 meses previos al survey. (National Coundl on Aging. Healthy Sexuality and Vital Aging. Washington, D.C. 1998). La frecuencia de actividad sexual no solo ha declinado entre los americanos ancianos sino también entre la población masculina sexualmente adiva.
Un Survey de la ARHP preguntando si el encues-tado había estado involucrado en cualquier forma de adividad sexual, desde amoríos simples hasta "una noche de pasión" encontraron que el numero de "más de una vez por semana" había dedinado de un 52% a 41% en hombres y mujeres respedivamente en la década de los dncuenta años a un 27% y 19.5 en la década de los 70 años y mayores.
Otro Survey realizado por la AARP (American Assodation of Retired Persons), donde se preguntaba sobre alguna forma de actividad sexual, un 77.3% de hombres y un 71.7% de mujeres entre 45 y 59 años reportaron estar involucrados en actividades amatorias al menos una vez por semana comparado al 63.3% en hombres y 27.7% de mujeres enedades de 75 o mas años. El numero de hombres reportando actividad sexual al menos una vez por semana cayó de 54.8% en edades comprendidas entre 45-59 años a 19.1% en edades de 75 o más años. En las mujeres fue del 49.6% y de un 6.6% respectivamente. Un tercio de los hombres entre 45 y 59 años reportaron auto-estimulación (masturbación), cayendo a un 5% en edades de 75 o más años. (American Association of Retired Persons. AARP/Modern Maturity Sexuality Study. Washington, D.C. 1999)
Kinsey (1948) publicaba el primer estudio epidemiológico sobre comportamiento sexual masculino en Norteamérica, bastante polémico y en la actualidad por investigaciones que se han hecho poco confiable por los errores cometidos, pero en ése entonces Kinsey estudió 4108 adultos varones y menos del 1% estaban afectados de disfunción eréctil antes de los 30 años, ascendiendo a 6.7% entre 45 y 55 años, 25 % a los 65 años y más del 75% tenían disfunción eréctil luego de los 80 años. Pero uno de los errores en interpretación es que sólo 306 hombres estaban por arriba de los 55 años, lo cual eran un obstáculo para una conclusión como la que se quiso dar. Cinco años después sacó otra publicación con-troversial acerca del comportamiento sexual de las mujeres norteamericanas.
Por otro lado Spector y Carey (1990) hicieron una revisión exhaustiva de 22 estudios sobre disfunción sexual masculina y femenina entre los años 1948 y 1988 abarcando población diferente, centros hospitalarios diferentes, concluyendo que la prevalencia de la disfunción eréctil era de un 4 a un 9%.
En ésta época tenemos el mas reciente estudio epidemiológico Massachusetts Male Aging Study (MMAS) publicado por Feldman y colaboradores en el año 1994, estudiándose 1.290 hombres entre 40 y 70 años, llenando un cuestionario de aspectos sexológi-cos durante los años 1987 y 1989. La prevalencia de disfundón erédil como conclusión del estudio fue de 52% con disfundón erédil leve. Moderada y completa. Aumentando la disfundón con el paso de los años y la posibilidad de disfunción eréctil completa triplicó su incidencia de 5 a 15% entre los 40 años y los 70 años. La reladón disfundón eréctil, envejecimiento ha sido resaltado por trabajos realizados desde Kinsley (1948) pasando por Frank (1978),
Godschalk-Sison-Mulligan (1997), Eid-Mulcahy et al
(2000), Lúe (1991), entre otros. El MMAS definió la disfundón eréctil como un problema de salud publica debido a su alta prevalenda.
Godschalk (1997) de la Universidad de Virginia refería que la disfundón eréctil era el desorden más común de salud que sufría el hombre anciano. Aunque 67% de hombres de 70 años tenían disfunción eréctil su interés por los aspectos sexuales per-maneda alto y menos del 5% recibían tratamiento adecuado.
DISFUNCIÓN ERÉCTIL Y CIRUGÍA RADICAL PROSTÁTICA
Mirone y colaboradores del Departamento de clínica Urologica del Hospital Federico II de Nápoles, publican en Junio 2003 en el Journal de Andrología un enfoque sobre la disfunción eréctil posterior a cirugía radical prostática donde mendonan que en el caso de la radioterapia la disfundón eréctil posttratamiento es produdda por angiopatía microvascu-lar que causaría fibrosis cavernosa, o estenosis de las arterias pélvicas que junto a la arteriosderosis existente llevará a disfundón eréctil de tipo vascular.
Los criterios que influencian la recuperadón de la erecdón después de la cirugía incluyen la edad del padente, el tener en el periodo pre-tratamiento sea quirúrgico o radiante) erecdón fuertes, el hecho de preservar los haces nerovasculares durante la drugía, y tener cuidado con los detalles técnico-quirúrgicos que harán posible una menor afedadón de las áreas de la continencia urinaria y de la potenda sexual. Refieren que las erecciones se recuperarán en un 68% en hombres que eran potentes antes de la drugía, cuando se preservan los dos haces neurovasculares y baja a una 47% cuando se preserva un solo haz neurovascular.
Podlasek (2001) y colaboradores del Departamento de Urología y Fisiología de la Universidad Northwestern de Chicago, publicaron un trabajo de investigadón sobre los cambios de la isoforma del oxido nítrico sintetasa antes y después de la cirugía radical por cáncer prostático y los efectos que sobre la erecdón presentaba dicho cambio. La estimulación neurológica necesaria para la erección tiene en la NOS (oxido nítrico sintetasa) un factor primordial en la obtención de la misma. La NOS isoforma desciende dramáticamente en ratones de experimentación, posterior a daños de los nervios cavernosos. La NOS-II y NOS-III no cambiaron con los daños neurológicos cavernosos. También observaron una disminución de la musculatura lisa y del endote-lio de los cuerpos cavernosos. Resaltan la enorme importancia de tratar de mantener la indemnidad de ambos haces neurovasculares o de por lo menos un haz neurovascular para lograr con ello un deterioro menor de la potencia sexual en el postoperatorio.
POPULARIZACIÓN DE LA CIRUGÍA RADICAL PROSTÁTICA Y EVIDENCIA DE UN PROBLEMA IMPORTANTE: LA DISFUNCIÓN ERÉCTIL POSTOPERATORIA
Desde 1970 cuando se populariza la cirugía radical prostática retropúbica hasta 1982 todo paciente que se sometía a cirugía radical prostática estaba condenado a quedar con disfunción eréctil total. En 1982 Walsh y Donker publicaron un trabajo que sería considerado el punto de partida para realizar prostatec-tomias radicales por cáncer, con preservación de los haces neurovasculares que lograrán en un porcentaje moderado, mantener la potencia sexual, siempre y cuando la conservación de dichos haces neurovasculares no comprometa el criterio quirúrgico de radica-lidad del cáncer. Sin embargo los porcentajes de preservación de la potencia sexual en el periodo postoperatorio han sido motivo de controversia, ya que si bien por un lado la técnica de la cirugía radical ha mejorado notablemente, los porcentajes varían de serie en serie de acuerdo a los datos obtenidos de las más notables escuelas urológicas en todo el mundo. En la realidad de las consultas urológicas, las cifras siempre son peores que las que se publican en los trabajos de investigación, lo que significa que se debe siempre estar preparados para asistir a los pacientes sometidos a cirugía radical y aun cuando la misma haya salido bien, el paciente igualmente debe entrar en los protocolos o modelos de decisión de recuperación de la función sexual que se recomiendan en el mundo entero.
También de manera coincidencial el año 1982 es el año que se implanta definitivamente el uso del PSA (antígeno prostático especifico) lográndose diagnosticar el cáncer prostático mucho antes que si se esperaran resultados positivos en la ecosonografía prostática endorrectal, en los marcadores bioquímicos como la fosfatasa o inclusive en los hallazgos del tacto rectal, donde sabemos que el PSA se adelanta en años a los percibido por el dedo del urólogo. Esto hizo que los pacientes se diagnosticarán únicamente por anormalidades en el PSA (Tic) y se confirmara con la biopsia prostática con pistola de trucut donde se evidenciaba la presencia de un adenocarcinoma prostático. La casi totalidad de éstos pacientes iban directamente a la cirugía prostática radical con lo cual, se aumentó exponencialmente el numero de cirugías radicales prostáticas, practicadas en todo el mundo y con ello no sólo se alcanzaban los beneficios en cuanto al control de la enfermedad cancerosa sino que también se obtenían los efectos colaterales (adversos) que de ella derivaban como los episodios de incontinencia urinaria y la disfunción eréctil postoperatoria en grados variables de acuerdo a una serie de factores que estaremos mencionando en el curso de éste capítulo.
EL TENER AL ALCANCE EL ANTÍGENO PROSLÁ-TTCO ESPECÍFICO, SE HA FACILITADO EL DIAGNÓSTICO PRECOZ DEL CÁNCER DE PRÓSTATA EN POBLACIONES MÁS IÓVENES, QUE LO QUE SE PODÍA HACER HACE 20 AÑOS, LO QUE HA SUSCILADO LA PREOCUPACIÓN QUE CUALQUIER LRALAMIENLO QUE SE IMPLEMENTE EN ELLOS, COMO POR EJEMPLO LA CIRUGÍA RADICAL PROSLÁLICA, OCASIONE LA MENOR REPERCUSIÓN POSIBLE EN SU CALIDAD DE VIDA POSL-LRALAMIENLO, Y EN ESTO DEBEMOS DARLE UNA GRAN IMPORLANCIA A LA POLENCIA SEXUAL, YA QUE REPRESENLA UNO DE LOS PRINCIPALES CONDICIONANTES PARA UNA BUENA CALIDAD DE VIDA DE HOMBRES ENLRE 50 Y 70 AÑOS, QUE ES EL INLERVALO MÁS AFECLADO POR EL CÁNCER PROSLÁLICO.
Previamente Reiner-Walsh (1979) aclaraban con precisión la irrigación y el drenaje venoso dentro de la anatomía quirúrgica de la prostatectomia radical, con lo cual hicieron mucho mas asequible al mundo entero realizar cirugías radicales prostáticas que antes de ése descubrimiento y su difusión, era una cirugía practicada por personas muy contadas en los mejores Hospitales y Centros de Enseñanza urológica del mundo entero. Por una parte se comenzaron a realizar cirugías radicales en todo el mundo, pero también comenzaron a aparecer los problemas inherentes a dicha cirugía, con sus dos complicaciones mas frecuentes como son la incontinencia urinaria y la disfundón eréctil pardal o total.
La extensa literatura revisada nos revela que menos del 50% de los pacientes que se someten a cirugía radical retropubica con preservación de haces neurovasculares bilaterales estarán satisfechos con la calidad de sus erecciones, lo cual afectará su calidad de vida y los hará candidatos potenciales de las alternativas médico-quirúrgicas para el tratamiento de dicha complicación (Scott, 1997).
Debido a la discrepancia entre las cifras de incidencia real y publicadas de disfundón eréctil posteriores cirugía radical prostática, médicos de otras ramas (internistas, sexólogos, o urólogos no oncólo-gos, serán muchas veces los que manejen un problema autentico sobre una población cada vez más joven, debido a las mejoras en la pesquisa y detección del cáncer prostático. El problema de la disfunción erédil ocasionado por la cirugía prostática radical es de instalación súbita y es a su vez motivo de controversias ya que a pesar de que se realiza una drugía prostática con preservación de los haces neurovasculares responsables de la erecdón peneana, habrá disfundón erédil en porcentajes muy variados de acuerdo a la serie que se estudie, lo que abre una interrogante que no ha sido esdarecida todavía acerca de todos y cada uno de los factores que coincidente-mente indden en la ocurrenda final de trastornos eredivos.
ETIOLOGÍA DE LA DISFUNCIÓN ERÉCTIL
La disfunción eréctil tiene numerosas causas, pero la que nos atañe en éste articulo es únicamente la que se produce luego de cirugía radical de próstata por cáncer prostático, cirugía cada día mas frecuente en el mundo urológico gracias a los adelantos teóricos y quirúrgicos logrados por urólogos de la talla de Walsh, Stamey, Catalona, Scardino, Crawford, Thompson, de las principales escuelas urológicas norteamericanas que hideron posible su aplicación mundial.
Schwartz AN (1991) mendona una etiología neu-rogénica, arteriogenica o venogénica en la disfunción eréctil posterior a cirugía radical prostática por cáncer. La disfundón erédil neurogenica es motivada por la pérdida temporal o definitiva de inervación peneana por daño a la inervadón cavernosa. La disfundón arteriogénica es por defidenda o pérdida del flujo sanguíneo de llegada al pene unido casi siempre a daños en las arterias pudendas accesorias durante el ado quirúrgico. La disfundón de causa venogeni-ca es debida a fuga venosa durante la erección causada por disfunción cavernosa veno-oclusiva, al no existir una adecuada compresión de las vénulas de la túnica subalbuginea durante el momento erectivo. Todo esto causado por atrofia por desuso, y a disfunción del músculo liso secundario a periodos prolongados de hipoxia. Esta ultima causa se cree explique mas del 50% de casos de disfunción eréctil postcirugía radical prostática. Esto va a estar íntimamente unido a la estrategia del uso precoz de inhibidores de la 5-fosfodiesterasa como el sildenafil entre otros, ya que mantiene la ultraestructura cavernosa sin cambios definitivos deletéreos y promoverá un a rehabilitación de la función eréctil en el periodo postoperatorio
Entre los fadores que ocasionan disfunción eréctil en el postoperatorio tenemos que los nervios que controlan el flujo de sangre dentro del área peneana pueden ser resecados o severamente dañados (ligaduras) y ellos son los encargados de darle al pene la turgenda y dureza necesarias para la pene-tradón coital. Si se realiza la técnica de preservación de los haces neurovasculares el volver a tener erecciones válidas y satisfadorias tomará de 6 a 18 meses. Mendonan que de si aparecen erecciones parciales puede ser un signo esperanzador de que la función total se readquirirá en el tiempo mencionado.
Stefanovic-Corman (2002) refieren en un artículo de gran utilidad los aspectos de la disfundón sexual que derivan de variadas etiologías entre las cuales hacen hincapié en la que se presenta posterior a cirugía radical prostática por cáncer. Aseveran que la edad, los problemas cardiovasculares, las dislipi-demias y la diabetes acredentan su aparidón, así como los tratamientos para cáncer como es el caso de la enfermedad de Hodgkin y del cáncer testicular donde 1 de cada 4 hombres tratados tendrán disfunción eréctil. drugías como la dstectomia radical, la resecdón abdominoperineal para cáncer redal o la exenteradón pélvica total así como la prostatectomia radical originarán disfunción eréctil dañarán tanto la parte vascular como la parte neurológica que van hacia el pene.
Cuando los haces neurovasculares se mantienen intados a raíz de la drugía radical, los inhibidores de la 5-fosfodiesterasa podrán cumplir con su misión de fadlitar la erecdón peneana, aparte de que hay hipótesis que sostienen que dejando la inervación peneana intada también la continenda urinaria mejorará sustandalmente. En pacientes menores de 60 años con preservación de lo shaces neurovasculares en la cirugía radical prostática recuperarán la potencia en mas de un 80% de los casos. Si se preserva un haz bajara a un 50% de mantenimiento de su potencia sexual. La explicación que le da el autor a la falta de recuperación erectiva postcirugía, aun habiendo preservado los dos haces neurovasculares son: lesión leve neurológica, repercusiones psicológicas, e hipoxia transitoria de los tejidos del cuerpo cavenoso. Manifiestan que para la recuperación de la potencia en el postoperatorio recomiendan en el acto quirúrgico hemostasia meticulosa, minimizar el trauma quirúrgico a los tejidos, y nervios que llevan la información erectiva.
También consideran importante las recomendaciones o soporte psicológico al paciente y su pareja, con el objeto de disminuir las repercusiones negativas que tanto sobre el paciente como sobre la pareja tiene la cirugía radical prostática, manteniéndose una comunicación sobre los aspectos sexuales franca y abierta, en relación a temas como el deseo sexual, orgasmo, trastornos eyaculatorios y dolor al momento de intentar realizar el coito. En tercer lugar recomiendan inducir erecciones farmacológicas lo mas temprano posible en relación a la cirugía efectuada con el objetivo de evitar periodos muy largos de tiempo en hipoxia cavernosa y por ende en una mas difícil recuperabilidad erectiva natural y/ o asistida por fármacos y también una menor repercusión en los efectos de la no-erección en la longitud peneana. "Esperar y ver" tiene menos eficacia en lo concerniente a disfunción eréctil postoperatoria que actuar de inmediato con una serie de medidas. Stefanovic-Corman (2002) recomiendan precisar no solo la función sexual en el preoperatorio sino también los aspectos micdonales. Para la disfundón eréctil postoperatoria comienzan rápidamente a dar medicadones orales, supositorios intrauretrales, medicadones inyeda-bles intracavemosas, y aparatos de vado peneano.
Si los pacientes tienen buen desempeño en el pre-operatorio, si se les hizo preservadón de la iner-vadón peneana bilateral, tendrán 72% de posibilidades de tener erecciones capaces de lograr la penetración o solas o con ayuda de fármacos. Parientes previamente impotentes que no logran en el postoperatorio erecciones con terapia farmacológica, intrauetral o con aparatos de vacío peneano son candidatos a prótesis peneanas.
Numerosos autores entre ellos McCullough (2001) refieren la discrepanda existente entre los porcentajes de potencia sexual postoperatoria declarados por instituciones hospitalarias reconocidas y series particulares de cirujanos connotados. A pesar de que se reportan porcentajes del 50 al 705 de potencia posterior a cirugía radical prostática no son cifras que se acetan universalmente.
Igualmente Fowler (1993) describe una situación similar, en pacientes que reportaron complicaciones erectivas posteriores a la cirugía radical, expuestas en la National Medicare Experience: 1988-1990.
Rabbani (2004) refiere que la máxima recuperación de la función eréctil después de una cirugía radical prostática preservando ambos haces neurovasculares podría tomar hasta 4 años, pero en un 51% de pacientes se espera una recuperación normal de su función erédil.
A pesar de que varias series quirúrgicas muestran cifras halagadoras de incidencia de disfundón eréctil posterior a cirugía radical prostática, bien sea por vía retropubica (Walsh 2000) o por vía perineal y ahora por vía laparoscopica retropubica, no hay duda que el problema existe y en muchos casos son cifras preocupantes (entre 68-87%) que representan hombres que quedan con disfundón erediva completa, parcial y en pocos casos con fundón sexual satisfactoria (Geary 1995). Ellos encontraron potenda sexual postoperatoria en 32% cuando se conservaron ambos haces neurovasculares y del 13% cuando solo y haz fue conservado. Aun cuando las erecdones peneanas estén presentes, éstas no son sufidentes para una vida sexual activa y placentera para ambos integrantes de la pareja.
Para reforzar esto Kao (2000) reporta en un cuestionario autoevaluativo en parientes sometidos a cirugía prostática radical, los resultados en cuanto a incidencia de impotencia, incontinencia urinaria y estenosis uretral y reportó que en relación a la disfunción erédil postoperatoria 12% de los parientes tenían preservación de la función sexual erediva y aproximadamente 88% de 1.069 pacientes tenían disfundón eréctil.
Bahnson-Catalona (1990) refieren que aquellos pacientes que recuperan la función sexual dentro de los primeros tres meses posteriores a la cirugía radical prostática, serán pacientes que recuperaran totalmente su función sexual. Sin embargo refieren que es a partir del 6 mes cuando usualmente se recupera la fundón sexual. Si se retarda mas, aunque presenten erecdones peneanas, no recuperaran la función sexual en toda su plenitud.
DeKernion (1997) mencionaba que la potencia sexual posterior a cirugía radical retropubica por cáncer se reladonaba con el numero de haces neurovasculares preservados y con la edad del paciente. Entre 40-50 años un 80% de pacientes con preser-vadón de ambos haces neurovasculreas 80% tenían erecciones satisfadorias y 20% erecciones parciales. Entre 50-60 años con preservadón de ambos haces neurovasculares 55% tenían erecciones satisfactorias y 33% erecdones pardales. Pero si se había conservado uno de los haces neurovasculares 33% tenían erecciones satisfactorias y 33% erecciones parciales. En la década de 60-70 años las cifras bajaron considerablemente y vemos como preservando ambos haces neurovasculares 26% tenían erecdones satisfactorias y 34% erecciones pardales y cuando solamente se conservó un haz neurovascular nadie (0%) tuvo erecciones satisfactorias y 100% tuvieron erecciones parciales.
La American cáncer Sodety 2002, colaboró con un estupendo trabajo de investigación de la Dra. Schover del MD Anderson cáncer Center en Houston, donde refiere que la disfunción eréctil posterior a cirugía radical prostática ascendía a un 70-80% en hombres por arriba de 70 años aun habiéndole pradicado una técnica preservando los haces neurovasculares. Igualmente parientes sometidos a radioterapia externa tendrán disfundón eréctil hasta en un 60% una vez pasado los 2 años del tratamiento. Igualmente luego de la Braquiterapia se conseguirá una inddencia de disfunción eréctil del
20 a 40%.
El estudio denominado PCOS (Prostate cáncer Outcomes Study) fue iniciado en 1994 por investigadores del Instituto Nacional de cáncer de los Estados Unidos de Norteamérica (NCI) para observar el impacto que los tratamientos para cáncer prostático primario tenían sobre la calidad de vida de los pacientes tratados. El PCOS es un proyecto de colaboración con seis registros de cáncer que son parte del Programa SEER (Surveillance, Epidemiology, and End Results Program). Establecido éste ultimo por la NCI desde 1973 para recoger y registrar datos de cáncer sobre una base rutinaria de una población con cáncer designada en varias regiones del país. El PCOS es la primera evaluación sistemática de los aspedos de calidad de vida salud-reladonado para pacientes con cáncer prostático, en diversos centros de salud que provee un modelo para estudios y seguimiento sobre cáncer en grandes volúmenes de población.
Igualmente Stanford (JAMA, 2000) publicó los resultados de un estudio a gran escala sobre 1291 pacientes, denominado PCOS (Prostate cáncer Outcomes Study) demostrándose que el 59.9 % de los pacientes sometidos a cirugía radical prostática por cáncer localizado de próstata 18 meses después tenían una calidad de erecciones que no permitían tener relaciones sexuales y 8.4% eran incontinentes. A los 24 meses 8.7% estaban molestos por la perdida de control urinario y 41.9% reportaban que su función sexual era un problema de moderado a grave. En 65.6% de los casos donde no se hizo preservación de los haces neurológicos hubo disfundón eréctil, en un 58.6% de los casos que se hacia preservación de un haz neurovascular fueron impotentes y un 56.0% de los que se hada preservadón de los haces neurovasculares fueron importantes y sólo el 18.5% de los parientes tenían erecciones capaces de concretar una relación sexual luego de 24 meses de la operación. Esto hace que exista una reflexión interesante y es no minimizar el aspedo sexual en el periodo preoperatorio y postoperatorio, el cual se desarrolla con una gran tensión emodonal entre paciente y medico, y entre el paciente y su pareja, sino que debemos tratar de garantizar la obtención de los mejores resultados posibles en lo referente a la cirugía y a la función sexual del paciente operado. Aun así la mayoría de los hombres estaban satisfechos con la elección quirúrgica para el tratamiento de su cáncer prostático localizado.
Daniel de la Facultad de Medicina de la Universidad de Tel-Aviv (2001) y Justin Vale (2000) del Hospital de Santa Maria de Londres refieren acerca de la disfunción erédil posterior a drugía radical prostática que gracias a los adelantos en la pesquisa del cáncer prostático, los pacientes sometidos a cirugía prostática son mas jóvenes y su status sexual es también mas adecuado para que presente la menor cantidad de problemas posibles en el área sexual que los pacientes ancianos (65 años o más). Menciona Vale que la responsabilidad mayor de la disfunción eréctil postoperatoria es de tipo neurogenica, sin embargo estudios de imágenes demuestran que la causa principal podría ser vascular ya que en un 30 a 40% de pacientes se reduce sustancialmente el flujo por la arteria cavernosa (Aboseif, 1994, Zelefsky,
1998, Eid, 2000), y 25% demuestran evidencias de disfunción venooclusiva en la cavernosometrias realizadas. Esto explicaría la causa de las disfundones erectiles en pacientes con excelentes drugías de preservación de haces neurovasculares y a su vez sería la causa del porque no todos los parientes responden a la terapia farmacológica. Vale menciona que entre los argumentos terapéuticos están las inyecciones intracavernosas de alprostadil, en dosis de 5 a 40 mcg 80% de pacientes responderán a dosis de 20 mcg. Menciona también el alprostadil intrau-retral en dosis de 250 a 1000 mcg con una respuesta del 80%., sigue con los inhibidores de la 5 fosfodi-esterasa específicamente el sildenafil obteniéndose un 70% de respuesta efectiva. Menciona los aparatos de vado peneano y las prótesis peneanas
SEGÚN QUINLAN (1991) LOS TRES FACTORES RESPONSABLES DE LA POTENCIA SEXUAL POSTOPERATORIA FUERON LA EDAD DEL PACIENTE, EL ESTADIO CLÍNICO Y PATOLÓGICO Y LA PRESERVACIÓN NO SOLO DE LOS HACES NEUROVASCULARES SINO DE LAS RAMAS VASCULARES DE LOS CUERPOS CAVERNOSOS NORMALES Y ACCESORIAS.
Se debe comprender que menos del 4% de pacientes aquejados de disfundón eréctil buscan atención médica y los que lo hacen tienen una enfermedad mucho más severa. Este dato podría ser verdad en casos no reladonados a la drugía radical prostática, ya que en éste caso los controles médicos y la contestadón de cuestionarios de calidad de vida harán que el médico-urólogo esté mas enterado de todos los aspectos que circundan a parientes operados de cáncer prostático y entre ellos la potencia sexual cobra un interés inusitado y producirá acciones terapéuticas dirigidas a mantener y potenciar dicha actividad, tan importante para el hombre de todas las edades.
"Es la integración de aspectos somáticos, emocionales, intelectuales y sociales del ser sexual de manera que puedan ser enriquecedores y que favorezcan la personalidad la comunicación y el amor”.
El concepto de Salud Sexual debe incluir tres elementos básicos (Mace, Bannerman & Burton 1974):
1. Capacidad de gozar y controlar el comportamiento sexual y reproductivo de acuerdo con una ética personal y social.
2. Liberarse de sentimientos de culpa, miedo, vergüenza, falsas creencias y otros fadores psicológicos que puedan inhibir la respuesta sexual y deteriorar las relaciones sexuales.
3. Liberarse de desordenes orgánicos, enfermedades y defidencias que interfieran con las funciones sexuales y reproductivas.
DEFINICION DE DISFUNCION ERECTIL
a. Es la incapacidad del hombre de alcanzar una erección peneana como parte de un proceso global multifacético de la función sexual masculina (NIH-1992).
b. Es la repetida incapacidad por al menos 3 meses de obtener o mantener una erección peneana lo suficiente para realizar una satisfactoria relación sexual (Process of Care Consensus Panel-1999).
c. Es la incapacidad de adquirir o mantener una erección peneana capaz de producir una introducción vaginal (NIH-1993).
d. La disfundón erédil es una enfermedad mul-tifactorial. (Seftel-AUA 2001).
e. Incapacidad del padente para desarrollar la erección dentro de un contexto psicológico y conductual que pudiera coexistir con grados variables de disminución de la libido, de alteración de la capacidad orgásmica y eyacu-latoria contribuyendo cada uno de ellos al sentimiento de afedadón de la salud sexual del paciente afedado (Holmes-Kirby-Carson 1997).
f. Potencia sexual es definida como la habilidad de obtener una erecdón peneana que sea suficiente para permitir una penetración vaginal y por ende una satisfadoria relación sexual (Eastman, 1996).
g. La habilidad de alcanzar una erección peneana lo sufidentemente buena para permitir una penetración vaginal satisfadoria
luego del tratamiento definitivo del cáncer prostático localizado u órgano-confinado por cualquier modalidad terapéutica (por ejemplo cirugía radical prostática, radioterapia, braquiterapia, terapia de bloqueo androgéni-co u terapia hormonal, con factores relacionados como la edad del paciente, el estadio clínico-patológico de la enfermedad cancerosa, y la técnica quirúrgica realizada en relación a la preservación o no de los haces neurovasculares de la potencia sexual, para obtener de nuevo erecciones peneanas satisfactorias (Potenziani, 2004).
Concepto psicológico que abarca el deseo de tener relaciones sexuales.
Evento neurofisiológico relacionado con la actividad sexual que consta de tres componentes: 1. Emisión seminal que consiste en la descarga de semen en la uretra prostática. 2. Cierre del cuello vesical para facilitar la descarga de semen hada delante (al exterior) y no hacia la vejiga por tener un "efecto de dique" hacia la entrada de la vejiga urinaria. 3. Propulsión del semen hacia el meato uretral y con ello al exterior a través del concierto muscular periuretral y del piso pélvico.
Es la percepción psicológica-cerebral agradable o desagradable (disorgasmo), de la culminación de la tensión-relación sexual, usualmente acompañada de eyaculadón aun cuando no es indispensable dicho evento. Puede haber orgasmo sin eyaculadón, así como eyaculación sin orgasmo.
EPIDEMIOLOGIA DE LA DISFUNCION ERECTIL
Althof (2002) refiere que en Estados Unidos de Norteamérica existen al menos 10-20 millones de hombres experimentando disfundón eréctil.
Feldman (1994) en el Massachusetts Male Aging Study reportó que un 52% de hombres presentaban algún grado de disfundón eréctil, y la probabilidad de tener disfundón eréctil completa estaba en el orden del 15% entre 40 y 70 años.
Alumna (1999) pública el National Health and Sodal Life Survey que 31% de hombres entre 18 y 60 años habían en algún momento presentado disfunción erédil.
Braun y colaboradores (2003) publica los resultados del Cologne Male Survey en Alemania, un trabajo donde correlaciona la disfundón eréctil con el paso de los años y así vemos como 10% de disfunción eréctil en hombres entre 40-49 años, 16% entre 50-59 años, 34% entre 60-69 años y mas del 50% en hombres entre 70-80 años.
Dentro del perfil del hombre con disfunción eréctil habrá más posibilidad de tenerla cuando el hombre presenta hipertensión, enfermedades cardiacas, enfermedades prostáticas o con los tratamientos para dichas patologías, en hombres con diabetes mellitus, daño medular, esclerosis múltiple, enfermedad terminal renal y depresión.
La mitad de los hombres entre 50 a 70 años sufren de disfunción erédil, 40% de los hombres de 40 años sufren de disfundón erédil y 70% de los hombres de 70 años sufren de disfunción erédil.
Masters y Jonson (1981) hablan de un progresivo declinar de la fundón sexual de hombres maduros y sanos, evidenciado por un mayor periodo de latencia para lograr una plena erección, una reducción de la turgenda peneana, una eyaculadón con disminución de su fuerza, una disminución del volumen eyacula-torio y un mayor periodo refractario, aparte de reducdón en la sensibilidad tádil del pene, disminución de los niveles séricos de testosterona, y una elevación del tono muscular liso cavernoso.
Hellstrom (2003) refiere que la expectativa de los 170 millones de hombres que sufren de disfunción eréctil en todo el mundo es a sufrir un incremento a 322 millones para el año 2025.
Según Sadeghi-Nejad-Goldstein (1999) cuando se aplica la cirugía de preservación de haces neurovasculares en el tratamiento radical del cáncer prostático, la inddencia de disfundón erédil se presentará en un 40 a 60%.
El impado de la disfunción eréctil sobre la calidad de vida del hombre afectado es devastadora, sea cual fuere la edad, pero es obvio que mientras mas joven sea el paciente mas repercusiones tendrá sobre su esfera emodonal. En mas de un 80% de hombres por arriba de 60 años los factores de riesgo mas comunes para presentar disfundón eréctil son ateroesderosis como representante de enfermedad endotelial vascular, disfunción erédil reladonada a fármacos que ingiera el padente con repercusiones en la esfera erediva, diabetes tipo I y tipo II, fadores neurogeni-cos y traumáticos posterior a cirugía pelviana, así como factores psicogénicos.
La preservación de la potenda sexual en los casos sometidos a cirugía radical prostática por cáncer de próstata como lo definió magistralmente Catalona desde 1990 dependerá de la edad del paciente al momento de la drugía, del estadio patológico del cáncer y del numero de haces neurovasculares conservados (80% de potenda cuando se conservan los 2 haces en parientes por debajo de 60 años, 57% de potenda entre 60-69 años y 33% de potencia sobre los 70 años.
FACTORES DE RIESGO PARA LA DISFUNCIÓN ERÉCTIL
Según Padma-Nathan (2000) hay factores que aumentarán el riesgo de presentar disfundón eréctil. Ellos son hábitos alcohólicos acentuados, abuso de drogas (cocaína, heroína, marihuana) enfermedad vascular arterial coronaria, enfermedad vascular periférica, estados emodonales depresivos o ansiosos, trastornos neurológicos como el Parkinson, la esclerosis múltiple, los accidentes cerebro-vasculares, Diabetes mellitus, Hiperlipidemia, Hipertensión arterial, Hipogonadismo, disminución de testosterona sérica y el aumento de los niveles séricos de proladina, alteradones anatómicas como la enfermedad de Peyronie, hábitos Tabaquicos, Trauma pélvico o perineal o trauma medular, cirugía pelviana, cirugía medular, cirugía retroperitoneal como las linfadenedomias por cáncer de testículo, ingesta de fármacos como antidepresivos, ansiolíticos, anti-psicóticos, antiandrógenos, cirugía radical prostática cirugías radicales pelvianas, insufidencia renal crónica, obesidad, mínima adividad física. (Seftel 2004, Moyad 2004, Derby 2000, Levine 2003). En los dos últimos puntos se ha demostrado que tener actividad física reduce un 30% el riesgo para disfunción erédil y la obesidad va correlacionada con un 30% de posibilidades de desarrollar disfundón eréctil.
Mydlo (2004) revela que la obesidad aumenta el riesgo de impotencia vasculogenica al desarrollar enfermedad crónica vascular. El aumento de tejido adiposo aumentará las reservas de fadores como la aromatasa, leptina, activador-inhibidor-1 del plas-minogeno, lo que causarla resistencia a la insulina y dislipidemia con daño tisular. Al aumentarse la leptina con la obesidad así como incrementarse la resistenda a la insulina, y el riesgo cardiovascular ocasionará sin duda la aparición de disfunción eréctil (Chung).
Andersson (2003) refiere que los tres fadores involucrados en la disfundón erédil son el envejecimiento, la hipertensión y el habito tabaquico. Estos unidos a la hipercolesterolemia y a la diabetes tendrán como consecuenda procesos de aterosclerosis, de estenosis arterial y de fibrosis que sin duda reducirán la función de los nervios y deteriorará el endotelio vascular que inexorablemente llevará a insuficiencia arterial y defectos de la relajación del músculo liso, lo cual causará disfundón eréctil.
Según Seftel(2004) los factores de riesgo mas importantes son enfermedades cardiovasculares (arteriopatia coronaria), diabetes mellitus, hipertensión arterial, Hiperlipidemia, vida sedentaria, obesidad, hábitos tabaquicos, hábitos alcohólicos, síndromes depresivos, síndromes de ansiedad crónica, ataques de pánico, estos últimos tan frecuentes en el mundo de hoy lleno de exigencias y presiones y síntomas urinarios bajos irritativo-obstructivos, que hasta hace pocos años atrás no se los asociaba a disfunción eréctil y hoy en día son uno de los fadores que mas hacen propensa la aparidón de trastornos erectivos. Son éstos los fadores que debemos como cirujanos, develar antes de la drugía para poder definir los riesgos incrementados de disfunción eréctil y evitar darle a la drugía la responsabilidad total de una capaddad erediva que ya venia deficiente o con fadores que la hacían mas propensa.
Numerosos estudios reflejan que la disfunción eréctil va unida a la enfermedad cardiovascular porque ambas presentan anormalidades del endotelio, sobre todo aquel estudio epidemiológico Massachusetts Male Aging Study (MMAS, 1994-Feldman) donde se demostró consistentemente la asociadón entre enfermedad cardiovascular y disfunción erédil.
Kloner (2004) dedara que no es sorprendente que parientes con disfunción eréctil tengan una prevalencia importante de enfermedades o fadores de riesgo que afecten negativamente la función vascular, como es el caso de la hipertensión, ateroesclerosis, enfermedad arterial coronaria, hiperlipidemia, diabetes mellitus y habito tabáquico. Cardiólogos y urólogos deben estar atentos ante la presencia de enfermedad vascular y/o disfunción eréctil ya que deberán hacer despistaje de ambas entidades. Al respecto veremos en la parte de terapéutica las advertencias que se hacen a los pacientes que toman inhibidores de la 5-fosfodiesterasa en conjunto con fármacos alfa-1 bloqueantes adrenergicos por síntomas urinarios bajos molestos por una salida vesical comprometida.
ANATOMÍA DE LA FUNCIÓN ERÉCTIL
La erección es un evento complejo, involuntario, neuropsicológico, vascular mediado por hormonas que se produce al fluir sangre dentro de los cuerpos cavernosos peneanos y quedar allí por un ana oclusión de las venas que drenan dicha sangre. Al entender cómo se produce una erección peneana, sabremos enfocar mejor el tratamiento adecuado.
La sensibilidad del glande está mediado por el nervio dorsal del pene rama del nervio pudendo. La función erectiva está bajo el control del simpático y del parasimpático. Este es excitatorio, sus fibras corren adyacentes a la próstata y se unen como nervios erigentes en el hilio del pene penetrando dentro del cuerpo cavernoso. El simpático es una extensión del plexo toracolumbar y su función es inhibitoria. El flujo sanguíneo profundo del pene dependerá de la arteria pudenda interna la cual dará arterias peneanas comunes dando irrigación a la zona profunda peneana y al glande.
El drenaje venoso tiene tres sistemas: el superficial (venas superficiales), el intermedio que consta de venas emisarias, circunflejas y dorsal profunda y el sistema profundo conformado por las venas hiliares y cavernosas. Los cuerpos cavernosos son espacios lacunares donde drenan las arterias helicoidales y limitadas por la musculatura lisa intracavenosa.
Emergiendo del antes mencionado espacio lacunar veremos vénulas que al juntarse formaran las vénulas subtunicas albugineas las cuales drenaran a través de dicha túnica en la forma de venas emisarias. Cuando el pene está fláccido la musculatura lisa intralacunar estará contraída a través de estimulación alfa adrenergica. Cuando se estimulan los nervios cavernosos por efecto del bloqueo alfa adrenergico tendremos una relajación de la musculatura lisa de los sinuosides cavernosos. El espacio lacunar se dilatará al igual que las arterias helicoidales las vénulas subtunica albugínea estarán comprimidas por lo cual habrá un impedimento a la fuga o salida de sangre por vía venosa. En dicha relajación muscular lisa de los sinuosides cavernosos será iniciado por los siguientes neurotransmisores, acetilcolina, polipéptido vasoactivo intestinal (VIP), prostaglandinas vía el sistema prostaciclinas, el oxido nítrico vía el sistema nitrergico.
RESUMEN DE LOS EVENTOS QUE LLEVAN A LA ERECCIÓN PENEANA
La fisiología de la erección peneana es un evento neurovascular relacionado al status psicológico y al status hormonal de todo hombre (Rogers, 2002).
Magee (2002) refiere que la disfundón eréctil es primariamente fisiológica debido a la incapacidad del músculo liso de las sinusoides cavernosas a relajarse lo suficiente como para permitir un llenado sanguíneo sufidente para produdr turgenda y dureza peneana. Se denomina miopatia del músculo liso de los cuerpos cavernosos y forma parte del proceso de envejedmiento del hombre, y por supuesto estará favoreddo por fadores de riesgo como la diabetes, la hipertensión, los problemas vasculares (enfermedad endotelial) y los estados de hipercolesterolemia e hipertrigliceridemia.
La afluenda arterial la lleva primordialmente la arteria pudenda interna la cual se divide en tres ramas terminales que son la bulbouretral, la dorsal del pene y la cavernosa, ésta una vez dentro de los sinusoides cavernosos dará ramas arteriolares.
El drenaje venoso se logra o bien como drenaje intracavernoso donde desde espacios lacunares periféricos se convierten en vénulas subtunica albugínea las cuales discurren entre el tejido erédil periférico y la túnica albugínea. Se reúnen formando las venas emisarias las cuales se unen a vénulas extratunicas. En estados de erección peneana las vénulas de la región subtunica se adelgazan y comprimen formando la primera barrera de resistenda a la fuga venosa con el objetivo de mantener la replecdón sanguínea y con ello la erección peneana. El otro sistema de drenaje venoso es el extracavernoso donde presentará tres vías que son la vena dorsal profunda, las venas cavernosas, rural y la vena dorsal superficial. La vena dorsal profunda recibe el flujo proveniente de la región más distal de los cuerpos cavernosos a través de las venas emisarias y circunflejas. La vena dorsal profunda drena en el plexo de Santorini (vesi-coprostatico). La región más proximal de los cuerpos cavernosos se drena por las venas rural y cavernosa desembocando también en el plexo de Santorini y en la vena pudenda interna. La vena dorsal superficial drena sangre proveniente de la piel, de la uretra peneana y del glande comunicándose en su trayecto con la vena dorsal profunda.
El área neurofisiológica está representada por el área limbica y el hipotálamo responsables de las funciones cerebrales regulatorias. La vía eferente es a través de los nervios pélvicos los cuales se originan de los nervios parasimpáticos preganglionares S2-S4. La estimulación de los nervios pélvicos originará un aumento del flujo sanguíneo a través de las arterias pudendas lo cual originará una entrada de sangre dentro de los espacios cavernosos.
Durante la flaccidez peneana el músculo liso cavenoso y las arteriolas son mantenidos en estado semicontraido, influyendo la actividad miogenica intrínseca, la neurotransmisión adrenergica y el endotelio. La norepinefrina a su vez es responsabilizada en el retorno al estado de flaccidez después de la eyaculadón. Por lo cual la fundón de la norepinefrina durante la flaccidez peneana podría ser vaso-constringir las arterias cavernosas y helicoidales y contraer también el músculo liso trabecular (Carroll, 1992).
Para lograr la erección peneana con la estimulación sexual los nervios parasimpáticos transmitirán impulsos a través del plexo pélvico a las arteriolas de los cuerpos cavernosos causando liberación del oxido nítrico. Este adivará una enzima llamada guanilato ciclasa la cual resultará en un aumento de los niveles de monofosfato dclico de guanosina ó GMPc. Este causará la relajadón de la musculatura lisa de los vasos sanguíneos de los cuerpos cavernosos. El aumento del flujo sanguíneo arteriolar de 2-5 cc/min a 70-100 cc/min combinado con la odusión de la salida venosa por dilatación del tejido esponjoso de los cuerpos cavernosos resultará finalmente en una erección peneana. Durante la erección peneana la actividad colinergica es fundamental a través de 2 mecanismos de acdón, uno la inhibidón de la secreción de norepinefrina a través de receptores muscarinicos sobre terminadones nerviosas adrenergicas y con la estimulación de la liberación de oxido nítrico por parte de las células endoteliales (Carroll, 1992).
Por lo tanto la erección peneana conlleva eventos neurovasculares que relajarán el músculo liso de los cuerpos cavernosos dependiente del oxido nítrico y también de las arteriolas, lo que va seguido de un aumento del flujo sanguíneo arterial lo que lleva a la tumescenda y rigidez peneana, indispensables para una erecdón fuerte y duradera que permita una satisfadoria penetradón con una excelente reladón sexual. Cuando el hombre redbe los estímulos sexuales, los nervios cavernosos y las células endoteliales liberan oxido nítrico, que estimulará la producdón de mono-fosfato ddico de guanosina (GMPc) a través de la enzima guanil-ddasa. Ado seguido la 5-fosfodiesterasa (PDE-5) del GMPc hidrolizará al monofosfato de guanosina ddico lo que condudrá a la detumescenda (perdida de la tumescenda y rigidez peneana) y con ello la finalizadón de la fase de penetradón peneana (Chuang-Steers, 1998).
Las erecdón peneana involucra un proceso fisiológico complejo integrando el sistema nervioso central, el sistema nervioso periférico, el sistema endocrino y el sistema vascular, por lo cual es fádl comprender que sencillo es que bien sea por enfermedad, o por inferencia medicamentosa de cualquiera de los sistema mencionados, involucrará un déficit erectivo tanto en el comienzo de la erección, como en el mantenimiento de la misma, la tumescenda, el orgasmo y eyaculación. La tumescencia peneana se mantiene gracias a mecanismos hormonales y neurológicos que adúan a varios niveles del eje neurológico. La conducta sexual integra los nervios somáticos y autonómicos y numerosos sitios medulares y supramedulares en el sistema nervioso central. La erección peneana en sí, es sólo una parte mínima de todo el proceso, ya que adquirirla y mantenerla es responsabilidad de la inervadón periférica, de la irrigación arterial y de los procesos bioquími-cas-neuroendocrinos en el interior de los cuerpos cavernosos específicamente en el músculo liso de las sinusoides cavernosas. Estímulos tádiles, olfatorios y visuales son importantes en la consecudón de una erecdón. Sistema hipotalámico, limbico, centros pre-ópticos mediales, núcleos paraventriculares, área hipotalamica anterior todos ellos integrados serán los directores de orquesta en conseguir una erección además de coordinar los eventos autonómicos asociados a la respuesta sexual en sí.
Resumiendo la estimulación sexual originará la secreción de neurotransmisores de las terminaciones nerviosas cavernosas y de factores de relajación de las células endoteliales en las sinusoides cavernosos. La oxido nítrico sintetasa produce oxido nítrico de la arginina, produciéndose un producto bioquímica que relaja el músculo liso como es el monofosfato cíclico de guanosina (cAMP) el cual funciona a través de los canales de calcio y de las proteínas quinasas. Se relajará el músculo liso de las arterias y arteriolas supliendo de sangre al tejido eréctil y lográndose un aumento del flujo sanguíneo. Por otra parte se relajará también la musculatura lisa de los sinusoides cavernosos (50 % de su totalidad es músculo liso) aumentando su capacidad de albergar sangre, con un llenado rápido y una expansión satisfactoria. Se comprimirán las vénulas entre la túnica albugínea y al comprimirse se ocluyen y cierran la salida venosa, lográndose la erección con la turgencia debida (100 mmHg). El reflejo bulbocavernoso activado por estimulo sexual contrae la musculatura isquiocaver-nosa comprimiéndose la base de los cuerpos cavernosos lográndose entonces una erección plena con dureza satisfactoria para poder penetrar a cabalidad con una presión de 20 cmHg, cesando la llegada y la salida de sangre. Cuando los neurotransmisores cesan de secretarse empieza la detumescenda al ocurrir la eyaculadón, por estimulo simpático. Al contraerse la musculatura lisa trabecular se reabren las venas y la sangre comienza a salir y se obtiene la flacddez.
Mas del 85% de las disfundones erectiles son de origen orgánico, por enfermedad vascular, o bien por un flujo arterial defidente, denominándose disfunción erédil arteriogenica o por un bajo nivel de "secuestro sanguíneo" en los sinusoides cavernosos (por disfunción veno-odusiva). Se dice que en hombres con disfundón eréctil de origen vascular habrá una combinadón de ambas entidades. El restante 15% se deberá a causas psicogénicas por o bien un estado ansioso importante con un tono simpático elevado que entorpecerá la normal relajación vascular, factor de suma importanda para la obtención de erecciones efectivas, o estados depresivos que numerosas veces no se logran identificar con facilidad, dificultando su diagnostico y por ende su mejoría en ambas entidades.
ETIOLOGÍA DE LA DISFUNCIÓN ERÉCTIL
De manera general tenemos que las causas mas comunes de disfundón eréctil son: abuso alcohólico, ansiedad, enfermedad coronaria, diabetes mellitus, anormalidades endocrinológicas, hipertensión arterial, insuficiencia hepática, fármacos como los antidepresivos, antihipertensivos, antiarrítmicos, antihiper-lipidemicos, antimicóticos, anticonvulsivantes, antiandrógenos, antihistamínicos, antiinflamatorios no esteroides. Enfermedad vascular periférica, insufi-cienda renal, hábitos tabaquicos, drugía pélvica o perineal, trauma pélvico o perineal.
Pero siendo mas detallados tenemos que las causas de disfundón erédil son no orgánicas (psicó-genas), orgánicas y mixtas.
Dado que se está enfocando específicamente la disfundón eréctil posterior a drugía radical es menester hablar del estado emodonal que usualmente tiene un padente que va a ser operado de cáncer de próstata, donde por numerosas fuentes le llega al padente la informadón de una posible "finalizadón" de sus actividades sexuales. Es por ello que sin duda alguna a todos los parientes que a ser operados de cirugía radical prostática se les deberá dar consejos reconfortantes, hablarle de todas las posibilidades terapéuticas que tendría una posible falla de su adividad sexual y más aun, si fuera el caso por el tipo de padente, se le deberá recomendar psicoterapia de apoyo por profesionales dedicados a ése campo. Nunca subestimar la ayuda a éste tipo de pacientes. No inferir que son "fuertes" y por ello saldrán adelante, ya que estaremos perdiendo muchas veces, un tiempo precioso que pudiera ser la diferencia entre la "recuperación o no" de su actividad eréctil postoperatoria.
El fador psicogénico juega y jugará siempre un fador importante en la génesis y manteniendo de las dificultades erectivas en el postoperatorio de parientes sometidos a prostatedomia radical por cáncer de próstata.
CAUSAS ORGÁNICAS DE DISFUNCIÓN ERÉCTIL
1. Causas inflamatorias, representabas por síndrome de prostato-vesiculitis crónica con focos de reagudizadón.
2. Causas de tipo mecánico por replección incompleta de los cuerpos cavernosos por dificultad mecánica en desplegarse satisfactoriamente debido a causas como por ejemplo las placas de Peyronie que limitan la expansión de la fascia de Buck que recubren a los cuerpos cavernosos, por lo cual habrá una replección sanguínea parcial con la consiguiente falta de turgencia en dichos cuerpos cavernosos lo que redundara en déficit erectivo y con ello a la disfunción eréctil, agravada y mantenida por factores psicoemocionales.
3. Causas posquirúrgicas como la cirugía radical de próstata con o sin preservación del haz neurovascular que controla la potencia sexual, cirugía vascular periférica o aórtica, trasplante renal, irradiación pélvica, shunts caverno-espongioso o safeno cavernosos en el tratamiento del priapismo, procedimientos neuroquirurgicos como las laminectomias, rizotomias, neurectomia pudenda. Resección abdominoperineal de recto, esfinterotomia transuretral, orquidectomia en casos de cáncer de testículo o de cáncer prostático, implante de 1125 (Braquiterapia), Cistoprosta-tectomia, uretroplastia perineal, uretrotomia transuretral, resección prostática transuretral para enfermedad benigna prostática (RTUP).
4. Causas oclusivas vasculares por trastornos arterioescleroticos a nivel de la circulación aortoiliaca, iliaca y pudenda.
5. Causas traumáticas donde quede afectado o bien el haz neurovascular periprostatico o bien por causas traumáticas a nivel de la medula toraco-lumbo-sacra donde se verá afectado el circuito neurológico de la potencia sexual, la mas frecuente de las causas traumáticas la vemos representada por las fracturas de pelvis, traumas perineales sobre todo antes de la pubertad representados usualmente por caída en horcajadas en bicicleta. Causas neurológicas o bien por enfermedades que afectan la inervación medular o bien por trastornos a cualquier nivel neurológico (cerebral, tallo cerebral, cerebelo, medula espinal en sus diferentes secciones y aferenda y eferencia neurológica) y de los nervios periféricos, representada por enfermedades como esderosis múltiple, acddentes vasculares cerebrales, entre otras, Enfermedad de Alzheimer.
6. Causas Farmacológicas o Químicas representadas por fármacos que tendrán repercusiones en el área sexual en general (psicofármacos, antihipertensivos, narcóticos, anticolinérgicos, antidepresivos, antihistamínicos, fenotiazinas, agentes hiperprolactinemicos, estrógenos, halo-peridol, metoclopramida, opiáceos, imiprami-na, reserpina, alfametil dopa, agentes bloqueantes del sistema simpático como bloqueantes alfa-adrenergicos, reserpina, cloni-dina,guanetidina, bloqueantes beta-adrener-gicos; agentes variados como el ácido epsilon aminocaproico, naproxen, tiazidas, y digoxi-na, antagonistas H2 como la cimetidina y la ranitidina. Agentes citotóxicos como la dclo-fosfamida, el Metotrexate. Agentes utilizados para bloqueo androgénico de cáncer de próstata como análogos LHRH tipo goserelin, leuprolide o antiandrógenos como la flutami-da, el acetato de ciproterona, la bicalutamida, entre otros. Srilatha publica en Urology 2004 un trabajo sobre los efectos negativos que pueden causar los tratamientos con estrógenos y fitoestrogenos en predisponer la disfunción erédil ya que pueden causar cambios fisiopatologicos en los receptores que median en la función erédil (ER-alfa y ER-beta), por lo cual es importante tenerlo en cuenta cuando estamos tratando o recomendando éstos pro-dudos naturales en pacientes con trastornos de su esfera sexual.
7. Causas endocrinológicas como la diabetes mellitus donde sea cual sea la edad del paciente afedado, éste verá adelantado el momento en el cual empiece a presentar problemas de disfunción erédil, no olvidemos que hay aproximadamente 154 millones de diabéticos en el mundo entero (OMS) y para el año 2025 se proyecta que habrá mas de 300 millones de diabéticos en el mundo, hipogo-nadismo hipogonadotropico, hipogonadismo hipergonadotropico, hiperprolactinemia.
8. Causas psicogénicas representando hasta un 50% de la incidenda de disfundón erédil. Debemos adarar que muchas causas orgánicas se entremezclarán con factores psicológicos que reforzarán y mantendrán el problema
erectivo. La depresión producirá una disminución de los niveles de testosterona causados por niveles elevados de factor secretor de corticotropina (CRF).
9. Causas crónicas como enfermedades sistémi-cas, insuficiencia renal crónica, insuficiencia hepática, enfermedad pulmonar obstructiva crónica, Hemocromatosis.
10. Causas variadas: fármacos como el Baclofen, inhibidores de la anhidrasa carbónica, los fármacos antiinflamatorios no esferoides (AINES), el hábito del tabaco, el hábito alcohólico, pacientes con trastornos del sueño (insomnio de diversas causas), pacientes con SIDA, enfermedad de Peyronie y fibrosis sub-clínica de los cuerpos cavernosos, Epispadia y Priapismo. Pacientes con hiperplasia prostática benigna de gran volumen con o sin inflamación asociada, además de la presencia de cáncer prostático, incluyendo los tratamientos respectivos a las tres condiciones prostáticas (bien sea prostatitis, cáncer o hiperplasia prostática) tanto con los medicamentos alfa-1 bloqueantes adrenergicos, como los bloqueantes de la 5-alfa reductasa, como los antiandrógenos o fármacos anticardnogeni-cos utilizados para el cáncer prostático.
11. Causada por Enfermedades sistémicas como la ateroesclerosis, la diabetes mellitus, la hipertensión arterial, el infarto de miocardio, la esderoderma, entre otras ya nombradas arriba.
12. Causas Nutricionales como deficiencias proteicas, deficiencias de Zinc.
13. Causas Hematológicas como anemia de células falciformes, drepanodtosis, leucemias.
14. Causas Infecciosas como Brucelosis, Tuberculosis y Tripanosomiasis
Sabiendo las posibles causas etiológicas de la disfundón erédil es importante que al padente que vaya a ser operado de cirugía radical de próstata lo enfoquemos y evaluemos como si se tratara de un paciente con disfundón erédil antes incluso de ser operado, es decir, deberíamos hace un examen medico exhaustivo, donde los antecedentes médicos y la historia sexual sean preponderantes, sobre todo hacia tres áreas como la cardiovascular, la neurológi-ca y la genitourinaria. No podemos sólo realizar la labor de pesquisa del cáncer y posteriormente la cirugía radical sin considerar las posibles secuelas que estemos originando en el curso de nuestro tratamiento. El urólogo debe abaracar también éstos campos. La sexualidad, la continencia urinaria, los aspedos psicológicos personales y de la pareja, a través de nuestro estudio, entrar en las consideraciones de profilaxis cardiovascular y neurológica son de vital importanda. Urólogo no es sólo el que opera, sino el que enfoque globalmente al padente en todas las áreas donde nuestro tratamiento pueda repercutir.
Bodie (2003) recomienda inclusive que las pruebas de laboratorio sean dirigidas a identificar los factores de riesgo que puedan beneficiarse de las modificaciones en el estilo de vida del padente y en las terapias farmacológicas que pueda estar tomando el padente. Los dos objetivos que según Bodie se persiguen en las pruebas de laboratorio son determinar la presencia y severidad de las enfermedades sistémicas y endocrinológicas, los niveles de Testosterona sérica, descartar disfunciones hipofisiarias, determinar niveles de TSH, colesterol sérico en todas sus fracdones, hemoglobina Ale.
FISIOPATOLOGÍA DE LA DISFUNCIÓN ERÉCTIL POSTERIOR A CIRUGÍA RADICAL PROSTÁTICA
La fisiopatología de la disfunción eréctil específicamente en los casos de drugía radical prostática fue descrita magistralmente por Burnett (2003) donde menciona que hay factores no-neurogenicos, fadores de eficacia variable en la practica de la cirugía preservadora de acuerdo al drujano que la pradica, mecanismos neurogenicos a pesar de haberse realizado supuestamente con el cuidado de preservar la inervación.
Entre los fadores no-neurogenicos que entorpecen la recuperadón de la erección en el postoperatorio están los fadores psicológicos por la ansiedad generada por la drugía, por la ansiedad generada por la enfermedad de base, por la ansiedad generada por la posibilidad de quedar con trastornos de conti-nenda urinaria o con trastornos de erección y la ansiedad generada por la situadón del futuro de la pareja y de las consideradones que pudiera tener con
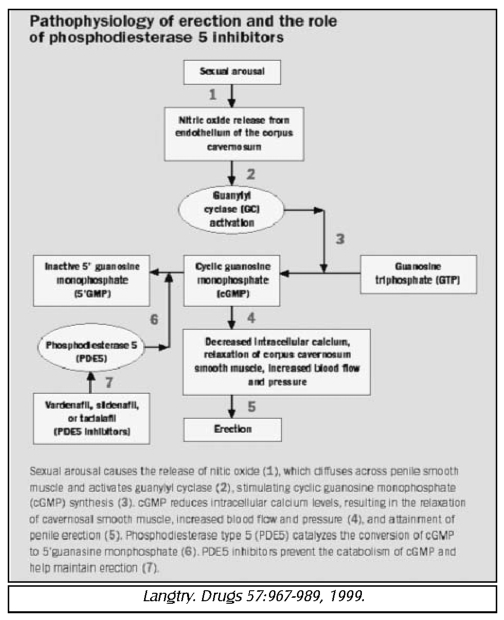
el padente su esposa, que a nuestro modo de ver es de vital importanda.
Tenemos también las etiologías vasculares como por ejemplo arterias pudendas internas accesorias como única fuente de suministro al pene y ser éstas traumatizadas o induso ligadas en el acto operatorio.
Entre los factores neurogenicos tenemos la exdsión amplia de los haces neurovasculares como parte de la cirugía extirpativa prostática con criterios de control oncológico. Pero también podríamos tener daños neurológicos inadvertidos en la cirugía, por estiramiento de la estrudura neurológica, daños térmicos por el eledrocauterio, efedos isquémicos sobre las estructuras nerviosas con consecuenda de hemostasia no cuidadosa, no selectiva, y por efectos inflamatorios locales en respuesta al acto quirúrgico "per sé".
Habrá fenómeno de "neuropraxia", habrá además degeneración walleriana, conexiones nerviosas interrumpidas, impidiendo las fundones neuroregulado-ras o neuroexdtatorias normales de dichas estructuras. Habrá también cambios metabólicos que acompañen los eventos de injuria previamente mencionados, y así tendremos degeneración nerviosa,
con destrucción de los tejidos erectiles. Habrá cambios atrofíeos y fibróticos en el pene por dege-neradón de las terminadones nerviosas y por deterioro del músculo liso de los cuerpos cavernosos, e infiltración con colágeno del tejido erédil (Burnett,
2003).
Todo lo mencionado es bastante frecuente ya que dependerá de la habilidad y experienda del cirujano, donde su curva de aprendizaje variable, ocasionará cirugías no exentas de traumatismos o exeresis de estruduras vitales para la erección, con lo cual es fádl determinar que después de numerosas drugías el cirujano deje de ser un factor de deterioro de la función sexual. Esto también tendrá sus repercusiones en el área de las recaídas bioquímicas (elevación del PSA en el postoperatorio precoz o tardío de los parientes).
Según Mulhall (2004) del MSK cáncer Center en su conferencia de Estrategias neuroprotedoras en cirugía radical prostática (AUA 2004) mendona en los aspectos de neuroanatomía funcional que los nervios cavernosos están combinados el componente simpático y el parasimpático y éstos últimos representados por los nervios NANC son eredógenos., en cambio el componente simpático son eredolíticos. Mantener la indemnidad de los nervios cavernosos será útil para la producción de NOS/NO, para la integridad muscular lisa cavernosa, y para la salud endotelial. Refiere, como lo diremos a continuación que las estrategias neuroprotectoras en parientes sometidos a cirugía radical prostática por cáncer son cuatro: realizar una cirugía que cuide la indemnidad de los haces neurovasculares, realizar estimulaciones de los haces intraoperatoria, poder implementar cuando sea necesario la interposición de injerto sobre los nervios cavernosos, y realizar neuromodulación farmacológica (inmunofilinas). En cuanto al valor predictivo de la neuroestimulación, éste se podría incrementar con agentes neuroprotectores o neu-rotróficos (FK506, Rapamycina, Minocyclina, Eritro-poietina, inhibidores de la 5-fosfodiesterasa), y con rehabilitación peneana de tipo farmacológica.
El Sildenafil como neuroprotedor ha sido estudiado por Zhang (Stroke 33:2675,2002), se ha probado en pacientes con ACV por 7 días después del accidente vascular comenzando entre 2 a 24 horas después del ACV (favorecerá la recuperadón funcional en test neurológicos).
En la rehabilitación peneana, parte del objetivo de ésta monografía, tendremos al Sildenafil como base de numerosos estudios en lo concerniente a la recuperación temprana de la capacidad erectiva del paciente operado. Considerado como un protector endotelial, ya que en estudios Fase III ha influido en disminuir los eventos miocárdicos, induciendo una mejoría en el flujo sanguíneo en casos de diabetes y de ataques isquémicos cardiacos por aterosclerosis, mejorará también las erecciones nocturnas peneanas,
lo que se traducirá en mayor oxigenación de los sinusoides musculares lisos y por ende se convertirá en un protector endotelial y en un factor de regeneración neuronal, lo que se traducirá en longevidad de la función sexual.
PREVENCIÓN DE LA DISFUNCIÓN ERÉCTIL RELACIONADA CON LA CIRUGÍA RADICAL PROSTÁTICA
EL HECHO DE TENER COMO OBJETIVO PRIMORDIAL LA CURACIÓN DEL CÁNCER PROSTÁTICO, NO DEBE HACERNOS MENOSPRECIAR LOS EFECTOS DE DICHOS TRATAMIENTOS SOBRE LA CALIDAD DE VIDA POSTOPERATORIA DE ESTOS PACIENTES. CADA DÍA LOS PACIENLES DIAGNÓSLICOS CON CÁNCER PROSLÁLICO SON MAS JÓVENES Y POR ENDE LENDRÁN UNA MAYOR CANLIDAD DE SOBREVIDA Y SOBRE LODO ESLARÁN EN EDADES DONDE LA ACTIVIDAD PRODUCLIVA, SOCIAL, FAMILIAR Y SEXUAL DEBEN SER AFECLAD AS LO MENOS POSIBLE, POR LO CUAL DEBEMOS REALIZAR EL MAYOR ESFUERZO POSIBLE Y LOGRAR QUE LOS TRATAMIENTOS OCASIONEN LAS MENORES CONSECUENCIAS POSIBLES, CON LOS EFECLOS MEJORES, RESALLANDO LOS ASPECLOS EMOCIONALES Y SEXUALES PARA UNA VIDA AGRADABLE Y DE CALIDAD (Potenziani, 2004).
Basándonos en que la función eréctil es un proceso neurovascular modulado por aspectos psicológicos y hormonales, y que factores cavernosos, arteriales, venosos, hormonales, neurológicos y psicológicos podrían desembocar en disfundón erédil deberemos investigar con una detallada historia medica, quirúrgica y sexual los antecedente del paciente para poder llegar a la identificadón de la causa que origina el problema erectivo.
Uno de los aspectos que frecuentemente afecta a los pacientes operados de cáncer prostático a través de drugía radical retropubica, es un status ansioso con un excesivo tono adrenergico (Christ, 1990) que lleve a una inadecuada relajación muscular lisa trabecular y esto llevará a enfermedad venoodusiva causando al final una disfunción erédil. Posterior a cirugía radical por cáncer prostático los parientes desarrollarán en mas del 30% enfermedad venoodusiva sumándose a la disfunción neurogenica y vascular que podría ser el substrato de la disfunción erédil de dichos pacientes.
EXISLE UNA REALIDAD Y ES EL HECHO DE QUE UN 50% APROXIMAD AMENLE DE HOMBRES POR ARRIBA DE 40 AÑOS PODRÍAN LENER DISFUNCIÓN ERECTIL, POR LO CUAL NOS PREGUNLAMOS ¿POR QUÉ DEBEMOS DARLE A LA CIRUGÍA RADICAL LODO EL PESO DE LA RESPONSABILIDAD DE LA DISFUNCIÓN ERÉCTIL, CUANDO PODRÍAMOS LENER PACIENLES PREVIAMENTE AFECTADOS, AUN CUANDO NO LO HEMOS ACLARADO SUFICIENLEMENLE, POR LO CUAL, CONSIDERAMOS BÁSICO DELERMI-NAR CON EXACLILUD LA EXISLENCIA O NO DE UNA DISFUNCIÓN ERÉCLIL, PARA QUE DE ESA MANERA LENGAMOS UN ENFOQUE FISIOPALOLÓGICO Y TERAPÉUTICO COMPLELAMENLE DIFERENLE.
Hollenbeck (2003) refieren como conclusión que los tres fadores que mas peso tienen en la salud sexual posterior a una cirugía radical prostática son independientemente la edad del paciente, la técnica de la preservadón de los haces neurovasculares y el tamaño o volumen prostático.
McCullough (2001) del Departamento de Urología de la Escuela de Medicina de la Universidad de New York, publicó en la Clínicas Urológicas de Norteamérica como prevenir y manejar la disfundón eréctil consecutiva a una drugía radical prostática. El presentar disfunción eréctil dependerá de la experiencia del cirujano con dicha cirugía radical, de si el procedimiento de preservación de la inervadón está bien lograda o no, del estadio dínico y patológico de la enfermedad, de la edad del padente y de la potenda erectiva antes de ser operado, y nosotros le agregaríamos las enfermedades coexistentes que pueda tener el padente, sobre todo a nivel cardiovascular, vascular periférico y endocrinológico, así como a enfermedades emo-donales que lo estén afedando y por supuesto al grado de motivadón sexual que tenga el padente, en cuanto a sus caraderísticas en el área intima y al lugar que han ocupado dichas adividades en la vida del padente. Me Cullough refiere que las erecdones naturales se recuperarán hasta en 24 meses, y se podría adelantar dicho proceso con inyecdones intracavernosas.
Menos del 50% de los hombres buscarán ayuda médica después de presentar disfunción eréctil. El sildenafil será efectivo en la medida que las lesiones neurológicas "recuperables" se subsanen. Pasados dos años la recuperación natural y la posible respuesta a fármacos como el sildenafil, vardenafil o tadalafil, así como alprostadil intracavernoso, son improbables, quedándonos otros argumentos terapéuticos como la prótesis peneana.
La cirugía radical prostática por cáncer ocasionará grados diversos de disfunción eréctil ya que los nervios que comandan la erección peneana serán lesionados de manera leve, moderada o grave durante la disección, aparte del hecho de que puedan ser removidos como indicación formal del cirujano del caso al considerar que uno o ambos de los haces neurovasculares puedan estar involucrados en la extensión de la enfermedad cancerosa que motiva la cirugía. Mulhall (2002) del Centro Médico de la Universidad de Loyola en Maywood estados Unidos de Norteamérica publica en el Journal Urology un trabajo sobre 96 hombres con una edad promedio de 54 años quienes se sometieron a cirugía preservando haces neurovasculares y sin tomar ningún tipo de terapia farmacológica. Concluye que a mayor tiempo de duración de la disfunción eréctil mayor riesgo de padecer una fuga venosa, lo que hace improbable su recuperación "ad integrum".
UNO DE LOS FACLORES MAS IMPORLANLES A CONSIDERAR ES SELECCIONAR ADECUADAMENTE AL PACIENTE QUE SERÁ SOMETIDO A CIRUGÍA RADICAL. TRATAR DE QUE SEA UN PACIENTE CON ENFERMEDAD VERDADERAMENTE ÓRGANO-CONFINADA DONDE PODAMOS PRESERVAR LA INERVACIÓN ERECTIVA SIN RIESGO DE COMPROMETER ONCOLÓGICAMENTE LOS RESULTADOS DE LA CIRUGÍA, UNIDO AL HECHO DE QUE SERÁN ENTONCES PACIENTES QUE NECESITEN MENOS LA AYUDA DE TRATAMIENTOS COADYUVANTES QUE TAMBIÉN ALTEREN LA FUNCIÓN SEXUAL.
Aparte de ésta situación tenemos que cualquier tratamiento de tipo coadyuvante como la radioterapia, la braquiterapia, la criodrugía o las terapias farmacológicas antiandrogenicos con las cuales queramos obtener un bloqueo androgenico total, van a impedir que haya una recuperadón "ad integrum" de la capaddad erectiva del padente, ya que en grados variables también afedarán su fundonamiento. La radioterapia tendrá una repercusión sobre la erecdón tardía, mientras que la drugía la tendrá inmediatamente.
Aun cuando se hayan conservado los haces neurovasculares durante los 3 a 12 meses siguientes a la cirugía el padente probablemente no será capaz de tener erecdones espontáneas efectivas. Podría haber turgenda mas no una erección lo sufidentemente dura y duradera para garantizar una relación sexual satisfadoria. En esto jugará un rol preponderante la edad del paciente, la realización o no de cirugía preservando la inervadón erectiva y el status eredi-vo que tenia el padente antes de la cirugía radical.
Sarti (2000) y colaboradores de la Catedra de Urología de la Universidad de los Estudios de Verona, Italia evalúa el tratamiento farmacológico posterior a cirugía radical de próstata con disfunción eréctil. Revela un dato que es trascendental en el enfoque de los pacientes porstatectomizados radicales y es que sólo el 42% de los parientes evaluados estaban de verdad fuertemente motivados a reemprender una rehabilitación sexual completa con fármacos en su periodo postoperatorio. El 43% seleccionó como primera alternativa el citrato de sildenafil, no tuvieron ningún resultado beneficioso con la terapia oral. En cambio con el alprostadil intracavernoso, aun en bajas dosis, obtuvieron un 100% de respuestas erectiles positivas.
ES FUNDAMENTAL CONOCER DE VERDAD EL STATUS DEL PACIENTE ANTES DE LA CIRUGÍA RADICAL, Y AÚN MAS ES IMPORTANTE CONOCER LA VERSIÓN DE LA MUJER DEL PACIENTE QUE SE SOMETERÁ A CIRUGÍA RADICAL, YA QUE EN MUCHOS CASOS, HABRÁ DISFUNCIÓN SEXUAL (EYACULATO-RIA, ERECTIVA, DISFUNCIÓN DE TUMESCENCIA, DISFUNCIÓN DE LÍBIDO, Y DISFUNCIÓN SEXUAL DE LA PAREJA CON APATIÍA Y FALTA DE ESTÍMULO DE PAREJA) QUE HACE QUE POR SUPUESTO DESPUÉS DE LA CIRUGÍA RADICAL, NO PUEDA HABER UNA "SANA" RECUPERACIÓN DE UN FUNCIÓN SEXUAL PREVIAMENTE INEXISTENTE.
INCLUSIVE UN ALTO PORCENTAJE DE PACIENTES SOMETIDOS A CIRUGÍA RADICAL DE PRÓSTATA TENDRÁN GRADOS VARIABLES DE DISFUNCIÓN ERÉCTIL O DE TUMESCENCIA, EVIDENCIADOS POR LA RESPUESTA DE LOS PACIENTES A CUESTIONARIOS HABITUALES COMO EL IIEF (ÍNDICE INTERNACIONAL DE LA FUNCION ERÉCTIL).
UNA CIERTA CANTIDAD DE PACIENTES EN SU PERÍODO POSTOPERATORIO NO TENDRÁN INTENCIONES DE REEMPRENDER UNA ACTIVIDAD SEXUAL NORMAL DEBIDO A QUE EN LA PAREJA EL DETERIORO DE LA MISMA ANTES DE LA CIRUGÍA HABÍA
SIDO "TOLERADA Y ACEPTADA" POR AMBOS INTEGRANTES DE LA PAREIA, CON LO CUAL ALTERAR "ESTA COSTUMBRE" PUDIERA NO SOLO SER INFRUCTUOSA PARA EL MÉDICO SINO TRAUMÁTICA PARA LA PAREIA EN CUESTIÓN. (Potenziani, 2004).
CUESTIONARIOS NECESARIOS PARA LA EVALUACIÓN DE LA FUNCIÓN ERÉCTIL (IIEF, IIEF-5, GAQ, SEP)
Se hace indispensable evaluar los resultados de las diferentes modalidades de tratamiento que ofrezcamos a nuestros pacientes con disfundón erédil en general (no sólo a los sometidos a drugía radical prostática) y para ello tenemos el índice Internadonal de Fundón erédil (IIEF), el Perfil de Encuentro Sexual (SEP) y el GAQ (Global Assesment Question).
El IIEF se debería realizar antes de comenzar una terapia definitiva y posterior a la misma. Consiste de 15 preguntas autoevaluativas que toman en cuenta cinco áreas de la función sexual masculina: la función erédil, la fundón orgásmica, el deseo sexual, la satisfacción con la relación sexual y una evaluación general. (Cappelleri, 1999), (Rosen-Cappelleri, 2002).
Una versión breve del IIEF ha sido muy útil para estudios dínicos sobre grandes masas de población (filtros poblacionales) (Rosen, 2001). Es un Test breve y fádl de utilizar.
El SEP (Sexual Encounter Profile) se realiza después de cada intento de relación intima. Es un cuestionario conteniendo 7 preguntas que permitirán a los parientes mantener un diario de sus eventos sexuales. Las preguntas más utilizadas para diagnosticar y evaluar los tratamientos de disfunción erédil son la pregunta 2 y la 3. La SEP 2 dice: ¿Fue Ud. capaz de introducir su pene dentro de la vagina de su pareja? Y la pregunta SEP3 dice: ¿Su erecdón duró lo suficiente para completar satisfactoriamente su relación sexual?
El GAQ (Global Assesment Question) evalúa la mejoría en la calidad de las erecciones y se realiza al final del tratamiento o en la última visita médica luego de suspender la terapia que se esté dando.
El parámetro que usualmente se toma en cuenta en el IIEF es el correspondiente del área de la función eréctil, además de las respuestas positivas a dos preguntas del SEP como fueron la capacidad de penetración y la capacidad de mantener la erección que permitan mantener una relación sexual lo mas exitosa posible. Igualmente el porcentaje absoluto de respuestas afirmativas del GAQ nos dará también un indicio de la mejoría que pudo haberse obtenido con el tratamiento.
Estos auto-cuestionarios sobre función sexual como hemos visto se dividen en tres categorías que son: cuestionarios autoadministrados, diarios de eventos y entrevistas estruduradas. Los más utilizados en estudios validados han sido los cuestionarios autoadministrados, ya que son estandarizados, de bajo costo y permiten conocer la fundón sexual pasada y presente del paciente encuestado, además de ser utilizados en estudios de filtros poblacionales sobre función sexual masculina y femenina. Es muy utilizado en estudios clínicos multicentricos (Rosen, 1997) (Rosen, 2000).
El Brief Male Sexual Fundion Inventory (BMSFI) (O'Leary 2003), (Rosen, 1996) es un cuestionario de
11 preguntas que nos permitirá conocer muchos componentes de la fundón sexual incluyendo manejo sexual, erección, eyaculadón, problemas sexuales y satisfacdón general. Tiene un alto grado de consis-tenda, fádl de utilizar, discrimina validamente tres áreas como son la función eréctil, los problemas sexuales y a satisfacdón general. Su mayor desventaja que restringe la evaluación de la fundón orgásmica y falla en evidenciar la sensibilidad de la respuesta a los tratamientos.
Tenemos otro cuestionario que es el Sexual Health Functioning Questionnaire (Corty, 1996), cuestionario autoevaluativo de 18 preguntas sobre la función sexual en áreas como la erección, orgasmo, deseo y satisfacción.
Por otro lado es útil mendonar que tenemos también cuestionarios de función sexual femenina que pudieran ser necesarios en caso de tener altos índices de sospecha de que la pareja femenina tiene trastornos de la esfera sexual que no sólo pudiera confundir al dínico-sexólogo-urólogo en cuanto a la respuesta adecuada o no que sigue su paciente recientemente operado de drugía radical prostática, sino que al no tener una parte femenina sana la recu-perabilidad de nuestros padentes operados se verá severamente afedada. Aquí sería útil aplicar estos cuestionarios que los vamos solamente a mencionar: Female sexual fundion index (FSFI), (Rosen, 2000), el
Brief Sexual Function Index for women (BISF-W) (Taylor, 1994).
Tenemos también el Derogatis Sexual Function Inventory (DSFI) (Derogatis, 1979) (Derogatis, 1997), donde se evalúa la función sexual masculina y femenina, con 245 preguntas que necesitan aproximadamente 1 hora para su contestación y que toma en cuenta muchos aspectos de la función sexual incluyendo experiencia, manejo, actitud, síntomas psicológicos, rol sexual, definiciones, fantasías, imagen corporal, satisfacción sexual entre otros aspectos.
Por ultimo tenemos otro cuestionario que nos evalúa la satisfacción al tratamiento recibido denominado Erectile Dysfunction Inventory of Treatment Satisfaction (EDITS) (Althof 1999). Cuestionario que mide la satisfacción sexual de ambos integrantes de la pareja.

REHABILITACIÓN DE LA FUNCIÓN SEXUAL POSTOPERATORIA
Es importante que el paciente tenga erecciones frecuentes en el preoperatorio para prevenir la disfunción eréctil postoperatoria. La tesis es que al existir erecciones repetidas habrá mayor irrigación sanguínea y con ello mayor oxigenación de los tejidos ayudándose también con erecciones nocturnas peneanas.
Prácticamente todos los pacientes sometidos a cirugía radical prostática tendrán grados variables de disfundón eréctil, algunos de manera temporal otros de manera definitiva, pero la fundón sexual en si desde el punto de vista de "performance sexual" según numerosos autores, nunca más será la misma, por lo cual es importante rehabilitar precozmente al paciente con todos los argumentos posibles, sin esperar, como hacen muchas escuelas urológicas, a que pase un tiempo prudendal.
Pues bien en base a una investigadón exhaustiva, actualmente se recomienda comenzar inmediatamente (en el primer mes de postoperatorio), con los argumentos que harán posible una recuperadón al daño neurológico eredivo, que o bien de manera directa o bien por maniobras quirúrgicas de separación de estruduras anatómicas, se producen en la cirugía radical prostática.
Numerosos trabajos de investigación, mencionados anteriormente, hablan de una lenta recuperadón neurológica (entre 18 y 24 meses), ya que no existe solo un daño neurológico sino que son varios fadores que se suman, entre otros el daño vascular (venoso y arterial) ya que por arriba del 50% de los parientes operados tendrán disfunción venooclusiva, aparte de daños neurológicos por isquemia arterial (como la arteria pudenda accesoria), así como detalles técnicos quirúrgicos (mencionados a continuación) y fadores de índole psicológico y dínico que hemos detallado con anterioridad.
DURANTE EL ACTO QUIRÚRGICO
Se comienza con la realizadón de un ado quirúrgico limpio, anatómico y sin dañar los tejidos que manipulamos, sobre todo en lo referente a la disección de los haces neurovasculares de la glándula prostática en sus aspedos laterales medio-apicales,
involucrando no solo el despegamiento de los haces del aspecto lateral sino, el corte del apex prostático al momento de comenzar el despegamiento apico-basal, así como el despegamiento final del área basal de la próstata en su relación con las vesículas seminales y el cuello vesical, lográndose que la potencia sexual se conserve en porcentajes variables que van de un 20 a un 70%.
Kim (2002) refiere estadísticas que demuestran que si durante la cirugía ambos haces neurovasculares son preservados la potencia sexual se podría mantener en un 30-60% llegándose en casos excelentes a un 71% de potencia sexual. Si se conserva solamente un haz neurovascular la potencia podría mantenerse en un 20 a 60%. Si ambos haces neuovasculares son resecados bien sea intencionalmente por criterio quirúrgico o porque no se realiza una cirugía con preservación de la inerbadón erectiva es prádi-camente imposible que haya una sana recuperación natural de la erección peneana (Quinlan, 1991; Catalona, 1999).
Walsh (2000) por su parte hace la recomendación de filmar una operación para poder saber donde cada cirujano pudiera estar fallando y que modificaciones en la técnica de cada quien hay que realizar para lograr disminuir las afras de disfunción erédil que obedezcan a fallas del propio drujano, acelerando la curva de aprendizaje. Es sabido que para todo cirujano sus primeras 50 a 100 prostatectomias tendrán un porcentaje mayor de disfunción eréctil postoperatoria que al adquirir cada vez mas experienda mejorarán notablemente las afras de potencia sexual en el periodo posterior a cirugía radical prostática.
Rogers (2002) menciona que durante la drugía radical prostática los nervios pelvianos autonómicos transcurren a milímetros del aspedo posterolateral de la capsula prostática, por lo cual se pueden accidentalmente lesionar bien sea por sección de los mismo o bien por elongación de los mismos. Esto tendrá sus implicaciones en la esfera erectiva peneana.
Seftel (2004) refiere que la disfunción erédil postoperatoria puede sobrevenir por un daño inadvertido a la irrigadón arterial pelviana durante la drugía radical retropubica, considerando que la irrigación arterial peneana proviene de tres ramas como son la arteria bulbo uretrales, las arterias cavernosas, la arteria dorsal y la cuarta e inusual rama podría ser la arteria pudenda interna accesoria, la cual tiene un recorrido que podría ser afedado por la cirugía radical prostática. Por supuesto debemos saber que si luego de la drugía radical prostática hemos ocasionado un daño a la irrigadón antes mencionada, habrá insuficiencia vascular por lo cual la rigidez peneana no será lo completa y sufidente para garantizar una penetración peneana exitosa y en estos casos la terapia medica cualquiera sea, no dará resultados y serán pacientes que se tendrán que colocar prótesis peneana para tratar su disfundón eréctil postoperatoria.
Otro dato que pudiera ser de utilidad es que una vez secdonado el complejo dorsal del pene en su porción proximal, suturarlo sobre la vejiga en forma de
V y no en forma vertical ya que con ello pudiéramos comprometer la inervadón erectiva. Otro punto a tener en cuenta es al momento de cortar el apex prostático es bueno pensar que el haz neurovascular podría estar incursionando en la línea media y debemos evitar secdonar la uretra demasiado posteriormente, e igualmente cuando coloquemos los puntos posteriores no debemos hacerlo con puntos muy posteriores abarcando mas allá de la uretra porque podríamos estar involuaando el o los haces neurovasculares que preservan la potenda sexual (Kim, 2002).
A pesar de que la hemostasia es exigida para minimizar la inflamadón y edema postoperatorio que por supuesto abarcaría también los haces neurovasculares y llevaría a una más lenta recuperación de la adividad sexual, no debemos llevarla a cabo con cauterio sino solamente con suturas hemostáticas o clips hemostáticos (Kim, 2002).
Es fundamental adarar con el paciente si antes de ser operado existía una buena capacidad erediva. Según Hollenbeck-Sanda (2003), podría haber un paralelismo entre la obtendón del control urinario con el regreso de la adividad sexual, sin embargo ésta experiencia no ha sido compartida por la mayoría de los drujanos que enfrentamos día a día casos quirúrgicos de cáncer prostático.
Durante el ado quirúrgico es importante considerar el llamado Mapeo Nervioso que ayudará a preservar la función sexual. En esto momentos se está llevando a cabo un estudio nadonal multicentrico norteamericano (Chang, 2003) para considerar la confiabilidad e implantadón del método (CaverMap
Surgical Aid) para ayudar a que la disfundón erédil postoperatoria se presente en el menor numero de casos posible.
El aditamento se utilizará en el momento de extra separando la glándula prostática de ambos haces neurovasculares a los lados de la misma. Este aditamento estimulará eléctricamente a baja dosis (20 miliamperios) los nervios que bordean la próstata y mide la respuesta eréctil de los mismos a través de un anillo colocado alrededor del pene que detedará la respuesta erédil al estimulo provocado. Esto ayudará a crear un mapa neurológico que evitará en la mejor manera posible, el daño a dichas estructuras y con ello producir el mejor porcentaje de potencia sexual postoperatoria posible. Lo que se aclara con el método es que no se debe utilizar cuando el cáncer prostático se haya extendido mas allá de los limites de la capsula prostática.
Otra alternativa que está bajo estudio es la colo-cadón de Injertos nerviosos de nervio sural en el área de los haces neurovasculares prostáticos (Cui, 2004, Perrote 2000, Kim-Scardino 2001, Kim 1999, Singh
2004) Con esto se logrará aumentar el control quirúrgico del cáncer prostático (al extirpar los haces neurovasculares que como sabemos podría ser un sitio favorable para la extensión extraprostatica del cáncer), disminuir la posibilidad de presentar disfunción erédil y mejorar la calidad de vida del padente afectado.
DESPUES DE LA CIRUGÍA RADICAL PROSTÁTICA POR CÁNCER LOS NERVIOS CAVERNOSOS MOSTRARÁN DIFERENTES GRADOS DE NEUROPRAXIA O DENERVACIÓN INHERENTE AL ACTO QUIRÚRGICO EXTIRPATIVO EN SI. ESTO OCASIONARÁ UNA DISMINUCIÓN EN LA SÍNTESIS DEL ÓXIDO NÍTRICO EN LOS SINUSOIDES CAVERNOSOS (musculatura lisa),
Y HABRÁ TAMBIÉN UN AUMENTO EN LA EXPRESIÓN DEL FACTOR BETA DE TRANSFORMACIÓN DE CRECIMIENTO (TGFb). EN EL PEOR DE LOS ESCENARIOS ESTO CONLLEVARÍA A FIBROSIS DE LA MUSCULATURA LISA CAVERNOSA, ATROFIA PENEANA, ENCOGIMIENTO PENEANO, CAMBIOS FIBRÓTICOS COMO LOS EXHIBIDOS POR LA ENFERMEDA DE PEYRONIE, Y DESARROLLO DE DISFUNCIÓN CORPORAL VENO-OCLUSIVA LO QUE CONLLEVARÍA A MAYOR LENTITUD DE LA RECUPERACIÓN DE LA ACTIVIDAD SEXUAL, O A LA TOTAL DISFUNCIÓN ERÉCTIL REFRACTARIA A TRATAMIENTOS MÉDICOS, DEJANDO SOLAMENTE LA OPCIÓN DE LA COLOCACIÓN DE PRÓTESIS PARA SUBSANAR LO MECIONADO ANTERIORMENTE (Kim, 1999).
La estimuladón farmacológica de la función sexual en el periodo preoperatorio y en el postoperatorio inmediato, mediato y tardío será fundamental. Mientras mas precozmente se comience la terapia farmacológica en el periodo postoperatorio inmediato o aunantes si ya el padente presentaba problemas, más probable será el chance de recuperar su adividad erédil y con ello una vida sexual normal. Esto se logrará con argumentos farmacológicos (Vardenafil, Sildenafil, Tadalafil), fármacos por vía intrauretral, fármacos por vía intracavernosa, fármacos tópicos peneanos, medicina alternativa representada por fármacos a base de hierbas (Gingko Biloba, mezdas de agentes herbarios, tribulus terrestris), Yohimbina, L-Arginina, y con argumentos tipo Psicoterapia de apoyo, Fisioterapia-Rehabilitación del piso pélvico muscular, como lo presentaremos a continuación.
TRATAMIENTO DE LA DISFUNCIÓN ERÉCTIL POSTERIOR A CIRUGÍA RADICAL PROSTÁTICA
Montorsi (1997) publica el primer trabajo que enfocaba la prevención farmacológica temprana en el postoperatorio de la disfundón erédil, con inyección intracavernosa de Alprostadil, en los primeros 60 días después de la cirugía radical prostática, obteniéndose un 67% de retorno de la erección en comparación con un 20% sin tratamiento posquirúr-gico. Recordemos que previo a ésta experiencia normalmente se esperaban de 6 a 12 meses para considerar el problema de la disfunción erédil postoperatoria y darle alternativas de tratamiento.
Hoy sabemos que las erecdones obtenidas pro-dudrán un efecto protector sobre los tejidos musculares lisos cavernosos, mejorando el retorno a la normalidad del proceso eredivo. En ése entonces había dudas de la eficada del tratamiento por vía oral para tal fin. Refiere Montorsi que la cirugía con preservación bilateral de los haces neurovasculares es mejor que la preservadón de un solo haz para la recuperabilidad de las erecciones. Recomienda lentes de visión magnificada durante el acto quirúrgico para poder realizar una cirugía mas neuropreservati-va, así como también consideraba que era importante realizar una selección predsa de los parientes, para estar seguros de que su estadio clino-patológico final siguiera estando en los estadios localizados (T1-T2) y además de estar seguros de la función sexual previo al acto quirúrgico. Refiere que es trascendental lograr erecciones en el primer año del postoperatorio para una recuperadón total de la fundón sexual. Refiere que en hombres de mas de 65 años no es razonable discutir la aplicadón de la preservadón de haces neurovasculares, lo cual por supuesto es discutible, ya que cada paciente es un caso particular y en el área intima-sexual más todavía.
Recomienda Montorsi (1997) monitorear de cerca al paciente, verlo mensualmente y hablarle del tema y estimularlo-entusiasmarlo al máximo así como también a su pareja. Recomienda utilizar alprostadil intracavernoso al mismo tiempo con terapia oral con Vardenafil, Sildenafil o Tadalafil ya que la diferenda con la tádica de esperar y observar es estadísticamente significativa, en la recuperadón de las erecciones. Se les coloca Alprostadil dos veces a la semana por 2 a 3 meses siguientes a la cirugía, comenzando inmediatamente a la retirada de la sonda, evitando con esto la fibrosis cavernosa por la ausencia de tumescenda-erección.
Las terapias orales son muy útiles en parientes jóvenes y en quienes se ha hecho preservación de ambos haces neurovasculares. Reoxigenarán la musculatura lisa cavernosa y evitarán la fibrosis subsiguiente debida a isquemia prolongada por la ausencia de erecciones.
Implantes de nervio sural parecen dar algún tipo de resultado en casos donde se extirparon deliberadamente los haces neurovasculares, sin estar comprometidos por la enfermedad, pero no estarán indicados los implantes de nervio sural si el tumor prostática no tiene un estadio clínico-patológico localizado (Tic, de bajo grado Score de Gleason menor de 7 y antígeno prostático especifico (PSA) menor de 10 ng/ml) ya que de no ser así estaría indicando un tumor extraglandular-no localizado (T3-T4) y no sería indicación quirúrgica de implante. Se espera recuperación erediva dentro de los 12 meses siguientes al implante.
El Programa de Medicina Sexual del Hospital Presbiteriano de New York siguiendo drugías radicales de próstata, les informa a los pacientes de las complicaciones habituales de dicha cirugía entre las cuales destaca la disfunción sexual, incluyendo problemas erectivos eyaculatorios y orgásmicos. Recomiendan a los cirujanos ocasionar el menor trauma posible. A los pacientes les recomiendan comenzar terapia para promover las erecciones dentro de los primeros 60 días del postoperatorio, dándole terapias orales, un inhibidor de la 5-fosfodiesterasa alprostadil intrauretral, o alprostadil intracavernoso. Si fallan con éstas tres opciones van a terapia de vacío peneano o colocación de prótesis peneana. Se les recomienda tratar de lograr 2 a 3 erecciones por semana y continuar éste esquema hasta el año y medio posterior a la cirugía.
ES IMPORTANTE MENCIONAR QUE LAS MODALIDADES COMBINADAS ESTÁN SURGIENDO CON FUERZA EN EL TRATAMIENTO DE LA DISFUNCIÓN ERÉCTIL POSTERIOR A CIRUGÍA RADICAL PROSTÁTICA. LA MON OTER API A ESTA DESAPARECIENDO PARA DEIARLE PASO ALA TERAPIA CON VARIOS ELEMENTOS FARMACOLÓGICOS, INCLUSIVE POR VÍAS DIFERENTES (INTRACAVERNOSA, ORAL, INTRAURE-TRAL) MEDICINA ALTERNATIVA, TERAPIAS REHABILITANTES DEL PISO PÉLVICO, PSICOTERAPIA DEL PACIENTE Y SU PAREIA, CON LO CUAL LOGRAREMOS MEIORES Y MÁS RÁPIDAS RECUPERACIONES DEL PACIENTE CON DISFUNCIÓN ERÉCTIL POSTERIOR A CIRUGÍA RADICAL.
En el resumen general al final de la monografía se darán los pasos a seguir en pacientes con disfunción eréctil, considerando que se deben puntualizar, no sólo el tipo de terapia médica a seguir sino se deberán tomar en cuenta todos los fadores etiopato-genicos de la disfunción eréctil para evitar su impado negativo en pacientes operados con cirugía radical debido a cáncer de próstata.
Los investigadores del Centro Médico de la Universidad de Pittsburgh a través de Kim (J Urol 2003) y colaboradores han demostrado que la terapia genética del fador neurotrofico podría ser buena para el tratamiento de disfundón erédil de origen neurogenico por daño infligido a las estructuras nerviosas durante el acto quirúrgico, utilizando como vector al virus del herpes simple genital. Trasportado a las vías autonómicas postganglionares a través de una inyecdón dentro del cuerpo cavernoso o alrededor del nervio cavernoso.
En relación al uso de inhibidores de la 5-fosfodiesterasa en pacientes prostatedomizados con cirugía radical por cáncer prostático se produjeron numerosos trabajos de investigadón, realizados con el fármaco que para ese entonces existía en el mercado mundial como era el Sildenafil. Marks (1999) determinó la eficacia del mismo evaluando la correlación existente entre el paciente y la percepción de su pareja en los resultados del tratamiento.
Setenta y cuatro pacientes completaron un cuestionario validado de función sexual (IIEF) antes y después de 4 a 6 semanas del periodo de tratamiento. El Sildenafil mejoró las erecciones en un 71% y 95% de acuerdo a las respuestas 3 y 4 del IIEF (International Index Erectile Function). Pacientes con la mejor preservación de sus erecciones (severidad clase I) exhibieron también la mejor respuesta al Sildenafil. Mientras que hombres que no tenían erecciones (severidad clase IV) fueron los que exhibieron la peor respuesta al medicamento y los que no deseaban continuar con el tratamiento. Pacientes sometidos a cirugía radical prostática por cáncer fueron relativamente refractarios al Sildenafil excepto 2 de 5 que fueron si métodos a cirugía de preservación de haces neurovasculares. Concluía que los resultados del tratamiento eran predecibles de acuerdo al sistema de clasificación de severidad de la disfunción eréctil, teniendo un fallo al no considerar entidades como la diabetes y enfermedad vascular que son factores importantes de fallo eréctil en el hombre.
Zippe (2000) en su trabajo de investigación describía los efectos del Sildenafil en casos de cirugía radical prostática con preservación de haces neurovasculares de manera unilateral o bilateral. El fármaco fue eficaz en el grupo de preservación bilateral de los haces neurovasculares, con un 72% obteniendo suficiente rigidez peneana para proceder a una penetración. Solo 50% con procedimiento quirúrgico de preservación de un solo haz neurovascular respondieron al Sildenafil.
Zippe (2000) determinó que el tiempo transcurrido entre la cirugía radical prostática y el inicio de la terapia con Sildenafil no influenciará el porcentaje de respuesta positiva al fármaco mencionado pero si la dosis con 71% de pacientes requiriendo 100 mgs para obtener el edecto deseado.
Zagaja (2000) reportó en su trabajo de investigación que aquellos pacientes quienes no habían todavía readquirido su función sexual, no respondían al Sildenafil hasta nueves meses después de la cirugía radical, debiéndose según su criterio, a neuropraxia prolongada. Por todo esto recomendaban comenzar inmediatamente al acto quirúrgico a tratar al paciente con Alprostadil tópico o en inyecciones intracavernosas, para estimular la vasculatura peneana y prevenir la perdida de elasticidad y la fibrosis cavernosa.
Montorsi (2004) refiere que luego de haber revisado la literatura de Medline y CancerLit (1997-2003) así como los Journal europeos de la especialidad y el International Journal of Impotence Research en el mismo periodo de tiempo. Refiere que la apropiada selección de pacientes y la depuarada técnica quirúrgica son sin duda, los mayores determinantes de la función eréctil postoperatoria. La apoptosis de las células musculares lisas de los sinuosides cavernosos jugará un rol decisivo en el desarrollo de la disfunción veno-oclusiva cavernosa posterior a la cirugía radical prostática. La profilaxia farmacológica y el tratamiento de la disfunción eréctil en el periodo postoperatorio son efectivos y seguros. Menciona la neuroprotección y la reconstrucción neurológica como prometedoras en el tratamiento de la disfunción eréctil post-quirúrgica.
Meyer (2003) del Instituto Urológico de Bristol en el Reino Unido, reporta la utilidad de la medida específica de la Calidad de Vida (QOL) (ED-EQoL) después de cirugía radical prostática en 89 pacientes. Además se les preguntaba en un segundo cuestionario si habían sido advertidos antes de operarse de las posibles consecuencias de la operación sobre la esfera erectiva. Un 76% de los pacientes que eran potentes antes de la operación fueron impotentes después de la misma. La calidad de vida en un 72% fue moderada a severamente afectada, lo que conlleva un enfoque preoperatorio diferente al actual, ya que es importante advertir al paciente de dichos cambios y encauzarlo a que reciba en el periodo postoratorio inmediato el o los tratamientos que se tengan que administrar para revertir su deteriorada calidad de vida.
Raina (2003) del Instituto Urológico Glickman de la Cleveland Clinic Foundation estudió 102 pacientes utilizando terapia intracavernosa para los casos de disfundón erédil posterior a cirugía radical prostática. Se les hacia previo a la cirugía Cuestionario del índice Internacional de Fundón Erédil (IIEF) con el Cuestionario Condensado IIEF-5 referido como Sexual Health Inventory of Men (SHIM) para determinar la eficada del medicamento. El promedio de éste Cuestionario Condesado IIEF-5 fue de 21.75± 5.23 que diminuyó después de la drugía a 4.23±3.48 y aumentó a 19.46±8.78 posterior al tratamiento con fármacos intracavernosos. 68% de los parientes obtuvo y mantuvo sus erecciones lo suficientemente buenas para llevar a cabo una relación sexual y 48% continuaron la terapia por largo tiempo (aprox 3.7±1.9 años). Un 52% de los pacientes descontinuaron la terapia. No hubo diferencias en el Cuestionario Condensado (SHIM) entre pacientes sometidos a cirugía preservadora de nervios y los que no la tuvieron, como tampoco hubo diferencias entre los diferentes tipos de medicaciones utilizadas. Las inyecciones intracavemosas según Raina proveerán eficacia a largo plazo y serán cumplidas en más de un 70% de los pacientes y deberán ser consideradas una opción salvadora en pacientes sometidos a cirugía prostática radical que han fallado en la terapia oral y como una opción de primer orden en pacientes sometidos a cirugía no conservadora de los haces neurovasculares como parte de la cirugía radical prostática por cáncer.
Burnett (2003) del Departamento de Urología James Buchanan del Brady Institute en el Johns Hopkins Medical Center promueve la recuperación de la función neurológica de los haces neurovasculares cavernosos después de haber sometidos a los pacientes a cirugía radical prostática. Refiere que a pesar de que su apliquen criterios quirúrgicos de preservación de los haces neurovasculares en la cirugía radical prostática por cáncer y que con ellos se ha mejorado los porcentajes de recuperación erectiva postoperatoria muchos pacientes experimentarán todavía un retardo en la obtención de su función sexual, o inclusive una erección incompleta o fallida de manera definitiva. Entendiendo que uno de los fundamentos fisiopatologicos es la presencia de neuropatía se han comenzado a explorar nuevas estrategias terapéuticas para promover la recuperación funcional de la inervación cavernosa. Inicialmente se sigue indicando preservar al máximo la integridad del mismo durante la cirugía, y la interposición de injertos de nervio y tratamiento neuropaticos que persiguen reconstruir y regenerar las estructuras neurologías dañadas.
Zippe (2001) del Laboratorio de Investigaciones Andrológicas-Urológicas de la Cleveland Clinic Foundation expone sus modelos a seguir en pacientes con disfunción eréctil posterior a cirugía radical prostática. Reflexión que aun cuando la prostatectomía radical es el tratamiento standard para los estadios localizados (T1-T2) del cáncer prostático, en algunas series investigadas la disfunción eréctil postoperatoria llega hasta un 90%, por lo cual la mayoría de los hombres necesitarán de tratamientos adyuvantes para seguir siendo sexual-mente activos. Los tratamientos aplicados varían desde aditamentos de vacío, inyecciones intracaver-nosas de fármacos vasoactivos, colocación intraure-tral de sustancias vasoactivas con porcentajes de respuesta a ésos métodos de un 50 a un 70%. Zippe refiere que a pesar de los medianos resultados obtenidos su cumplimiento a largo plazo es malo y cerca de la mitad de los pacientes abandonan dichas estrategias. Aconseja que estas opciones sean imple-mentadas en el periodo postoperatorio inmediato para facilitar la recuperación de la actividad sexual a través de la oxigenación peneana, la cual prevendrá la fibrosis cavernosa. Cuando se tienen pacientes con preservación total o parcial de los haces neuovascu-lares podría ser efectivo el sildenafil, para promover el retorno precoz de la función sexual.
Baniel (2001) del Instituto Urológico del Centro Medico Rabin en Israel publica un enfoque de tratamiento progresivo local para 85 pacientes estudiados con disfunción eréctil después de cirugía radical prostática. El tratamiento se ofrecía en 4 fases progresivas si la previa fallaba. En la fase I se utilizaban aditamentos de vacío para lograr la erección, en la fase II se le daba al paciente Sildenafil oral, en la fase III se colocaban inyecciones intracavemosas de sustancias vasoactivas para lograr la erección y en la fase IV se combinaban inyección intracavernosa más aditamentos de vacío. Todos los pacientes fueron monitoreados durante 1 año. De los 85 pacientes, 78 (92%) respondieron a los aditamentos de vacío para lograr la erección y sólo 11 pacientes (14%) estuvieron de acuerdo en continuar éste tratamiento en sus hogares. De los 74 pacientes restantes que no siguieron utilizando los aditamentos de vacío peneano 69 de ellos se les dio Sildenafil y 14 (20%) tuvieron respuesta positiva y lograron erecciones. 60 pacientes fueron tratados con inyección intracavernosa y 51 pacientes (85%) tuvieron respuesta positiva, y 4 de los 9 fracasos de la fase III pasaron a la fase IV con la combinación aditamentos de vacío + inyección intracavernosa respondiendo positivamente. Solamente 5 pacientes fallaron en las 4 fases. Al cabo de 1 año 76 de 80 pacientes continuaban exitosamente sus tratamiento en el hogar, 7 (9%) con el aditamento de vado, 11 (14%) con el Sildenafil, 54 (71%) con la inyecdón intracavernosa y 4 (5%) con la combinación aditamento de vacío peneano + inyección intracavernosa. Las cifras finales mostraban que éste enfoque progresivo dio resultados en 80 de 85 parientes (94%) y después de 1 año 76 de 80 (95%) continuaron respondiendo bien y no dudaron en afirmar que el más efectivos de los cuatro métodos fue la inyección intracavernosa con sustancias vasoactivas.
Vale (2000) del Hospital St Mary's de Londres, Reino Unido, refiere que debido a la detección precoz del cáncer unido al aumento de casos de cirugía radical prostática, el aspecto calidad de vida se ha redimensionado. Refiere que la disfundón erédil posterior a drugía radical ocurre en un 30 a 70% y en un 30% después de tratamientos con radioterapia. Aun cuando se asumía que la disfundón erédil era debida a daño neurológico hoy en día una considerable propordón se debe a causas vasculares. Ellos están utilizando como tratamiento de primera línea los inhibidores de la 5-fosfodiesterasa, específicamente Sildenafil, siempre y cuando no hay contraindicaciones (ataque isquémico cardiaco, tratamiento con nitratos. Mejorará la fundón erédil en un 70% de los pacientes posterior a radioterapia y en menor porcentaje después de cirugía radical (40-50%). Mendona otros tratamientos como auto-inyec-ción intracavernosa o intrauretral de Alprostadil y otros serán candidatos a utilizar aditamentos de vado peneano. Si todo esto fallara el padente deberá ser tratado con prótesis peneana.
Mulcahy (2000) del Departamento de Urología de la Universidad de Indiana en Estados Unidos de Norteamérica refiere el incremento sustandal de la cirugía radical prostática y por ende de sus consecuencias como es la disfunción eréctil. Los tratamientos orales, intrauretrales e intracavernosos son útiles en la medida que se hayan respetado los haces neurovasculares. Recomienda inyecciones intracaver-nosas de fármacos vasoactivos después de 2 meses de hábese completado la drugía radical, resultando en un mayor porcentaje de normalización de la función sexual dentro del primer año. Refiere también del uso de aditamentos de vacío peneano y de las prótesis peneanas que aun cuando son costosas cuenta con un 85% de satisfacción en la pareja que la adopta, la más alta entre todas las alternativas terapéuticas para pacientes con disfunción erédil posterior a drugía radical.
Stanford (2000) del Fred Hutchinson cáncer Research Center de la Universidad de Washington en Seattle, Estados Unidos de Norteamérica. El estudio denominado PCOS (Prostate Cáncer Outcomes Study) fue seguido por 24 meses y se basaba en pacientes de 6 regiones de los Estados Unidos de Norteamérica con un total de 1.291 pacientes de raza afroamericana, blanca e hispánica. Entre 39 y 79 años con cáncer prostático localizado diagnosticado entre Octubre 1994 y Odubre 1995 a los cuales de les había practicado cirugía radical prostática dentro de los primeros 6 meses del diagnostico. Se les controló los cambios de su función sexual y urinaria a los 6,12 y 24 meses después del diagnostico. Luego de 18 meses 8,4% estaban incontinentes y 59.9% tenían disfundón eréctil importante. La recuperabilidad de su función sexual para aquellos parientes que previamente a la cirugía estaban potentes dependía del tipo de cirugía practicada, es decir, tenían impotencia el 65.6% de los que se habían sometido a técnicas no preservadoras de los haces neurovasculares, 58.6% quedaban impotentes cuando solamente se preservaba un haz neurovascular y 56.0% quedaban impotentes cuando eran preservados ambos haces neurovasculares. Luego de 18 meses de la cirugía 41.9% de los pacientes refirieron que su desempeño sexual les resultaba un problema moderado o grave. La función sexual y urinaria varió con la edad, es dedr, 39.0% de hombres por debajo de 60 años vs 15.3% -21.7% de hombres mas viejos estaban potentes a los 18, eses o mas. Un 13.8% de hombres de 75-79 años vs 0.7%-3.6% de hombres mas jóvenes experimentaron los mas altos niveles de incontinenda urinaria a los 18 o más meses y la función sexual varió también por la raza, 38.4% de hombres afro americanos reportaron erecdones consistentes a los 18 o más meses vs 25.9% de hispanos y 21.3% de hombres blancos.
Litwin (1999) del Departamento de Urología de la Universidad de California, realiza un trabajo de investigación donde mide los efectos de los tratamientos impartidos a padentes con cáncer localizado de próstata. Los tratamientos seleccionados fueron Radioterapia externa versus prostatectomia radical con o sin preservación de haces neurovasculares y se evaluaron los efectos sobre la función sexual en los 2 primeros años después del tratamiento definitivo. Fueron 438 pacientes que se evaluaron con cuestionarios de calidad de vida salud-relaciona-dos, y para minimizar las influencias de otros factores se ajustaron edad, comorbilidad, salud general y tratamientos previos para disfundón eréctil. Todos los parientes fueron extraídos de CapSURE (Cáncer of the Prostate Strategic Urologic Research Endeavor) estudio observadonal longitudinal de pacientes con cáncer de próstata a nivel nacional, creado desde 1995 habiendo enrolado en el mismo mas de 11.000 parientes y convirtiéndose en el mayor proveedor de datos disponibles hoy en día sobre cáncer de próstata. La función sexual mejoró en el tiempo durante el primer año en todos los grupos de tratamiento, sin embargo durante el segundo año la función sexual comenzó a declinar en el grupo sometido a radioterapia, sobre todo los ancianos que luego de dos años tenían una función sexual severamente deteriorada. Los pacientes ancianos sometidos a cirugía radical experimentaron un retorno mínimo de su función sexual. La misma fue mejorada por el uso de técnicas de preservación neurológica o aditamentos para la erección.
Montorsi (2005) publica en el AUA News de marzo 2005 sus recomendaciones antes de asistir al AUA en San Antonio de Texas 2005 sobre el tópico de la disfunción eréctil siguiendo a cirugía radical, coincidiendo con el modelo de decisión descrito en ésta monografía, dándole importancia en primer lugar a la experiencia del cirujano actuante en los resultados finales de dicha cirugía radical. Seguidamente se refiere a la importancia de administrar el alprostadil intracavernoso tan pronto como sea posible, usualmente al final del primer mes de postoperatorio en dosis de 5 microgramos. Se indicarían de dos a tres inyecciones semanales de 5 microgramos para poder obtener tumescencia peneana. También se refiere a los inhibidores de la 5 fosfodiesterasa, a la hora de acostarse para facilitar las erecciones nocturnas peneanas y con ello mantener la función basal de los cuerpos cavernosos. Al respecto Padma-Nathan (2003) recomienda dar 50 a 100 mgs de sildenafil a la hora de acostarse, todas las noches por espacio de 9 meses, siendo los resultados significativamente diferentes en el grupo con el fármaco (27% de respuesta) vs el grupo placebo (4% de respuesta). Ambos confirman que se debe advertir al paciente que deben esperarse de 12 a 24 meses de postoperatorio para tener una respuesta clínica. Usualmente ambos refieren que debe tratarse con las dosis máximas de cada uno de los inhibidotes de la 5 fosfodiesterasa (20 mgs de Vardenafil, 20 mg de Tadalafil o 100 mgs de Sildenafil) se haya hecho o no la conservación de los haces nerovasculares (nerve sparing).
MODELO DE REHABILITACIÓN SEXUAL EN PACIENTES SOMETIDOS A CIRUGÍA RADICAL PROSTÁTICA POR CÁNCER LOCALIZADO
Trataremos de puntualizar en orden de importancia lo que consideramos de ayuda en la rehabilitación erectiva posterior a cirugía radical prostática con preservación de los haces neurovasculares. Sin embargo la necesidad de aplicar cada una de las alternativas terapéuticas mencionadas a continuación dependerá de las circunstancias particulares de cada paciente.
ES FUNDAMENTAL QUE PRECISEMOS LA RESPUESTA SEXUAL A LOS DIFERENTES TIPOS DE TRATAMIENTO CON EL ÍNDICE INTERNACIONAL DE LA FUNCIÓN ERÉCTIL, PERFIL DE ENCUENTRO SEXUAL (SEP) PARA MEDIR EL ÉXITO DE LA PENETRACIÓN Y EL MANTENIMIENTO DE LA ERECCIÓN (SEP 2 Y SEP 3) Y EL CUESTIONARIO DE EVALUACIÓN GLOBAL (GAQ) QUE NOS DETERMINA LA MEIORÍA DE LA ERECCIÓN EN EL ÚLTIMO MES.
1. TERAPIA FARMACOLOGICA INYECTABLE INTRACAVERNOSA
Representan la primera línea de ataque en pacientes sometidos a cirugía radical prostática con preservación de los haces neurovasculares que llevan la potencia sexual.
Se deben comenzar inmediatamente a la retirada de la sonda (es decir inmediatamente después de 15 días de operado).
La dosificación que estamos utilizando es de 2 a 3 inyecciones a la semana por espacio de 8 semanas, de Caverjet® (Alprostadil) 5 a 10 mcg por sesión, unido a fármacos inhibidores de la 5- fosfodiesterasa, para luego pasar a una fase donde sólo los fármacos erec-togenos orales (inhibidores de la 5-fosfodiesterasa). Los inhibidores de la PDE-5 se dan desde el comienzo en dosis máximas, es dedr, 100 mgs de Sildenafil o 20 mgs de Vardenafil o 20 mgs de Tadalafil.
Las inyecciones intracavemosas y los inhibidores PDE-5 tienen como objetivo producir tumescencia peneana.
El Alprostadil intracavernoso tiene un porcentaje alto de respuesta farmacológica, obteniéndose erección satisfactoria en un 70-80 % de los casos en los siguientes 30 a 120 minutos de aplicada, en condiciones normales y en un 50-60% después de cirugía radical.
ES IMPORTANTE SABER QUE EL ALPROSTADIL INTRACAVERNOSO SE UTILIZA CON BASTANTE ÉXITO EN LOS CASOS POSTERIORES A LA CIRUGÍA RADICAL PROSTÁTICA DONDE NO HA PODIDO REALIZARSE PRESERVACIÓN DE LA INERVACIÓN, YA QUE NO DEPENDERÁ SU ÉXITO DE LA ACTIVIDAD DEL ÓXIDO NÍTRICO.
Se utilizan las prostaglandinas (PGE-1 o Alprostadil o Caverject®, el clorhidrato de Papaverina y la Fentolamina (Regitina®). Sin embargo tiene un porcentaje de abandono del tratamiento del 40% a pesar de un porcentaje de eficacia de un 70-80%.
Sus efectos colaterales son erección mantenida por más de 4 horas (Priapismo), fibrosis cavernosa que en casos leves requerirá de procedimientos tipo fístulas cavernoespongiosas, en casos graves requerirá de la colocación de prótesis peneana.
La papaverina podría ocasionar alteración de la función hepática. También podríamos ver mareos, palpitaciones con el uso de estos medicamentos.
Las intracavernosas pueden hacerse con Alprostadil (Caverject) ®, papaverina (30 mgs/ml), prostglandinas El 10-20 microgramos/ml) y fento-laminas (1 mgs/ml) denominada Trimix®.
Se están haciendo estudios de investigación con dos nuevos fármacos para terapia inyectable intracavernosa como son el Moxislyte y el Forskolin y se mencionan cifras del 80% en obtención de erecciones. Es importante que se valoren la calidad de las erecciones obtenidas con un registro de erecciones nocturnas con RigiScan.
2. TERAPIA FARMACOLOGICA ORAL
A) INHIBIDORES DE LA 5-FOSFODIESTERASA
LA TERAPIA ORAL CON FÁRMACOS INHIBIDORES DE LA 5-FOSFODIESTERASA, ADMINISTRADOS POSTERIOR A CIRUGÍA RADICAL PROSTÁTICA POR CÁNCER TENDRÁ COMO OBJETIVO, LOGRAR ERECCIONES EFECTIVAS EN EL MENOR TIEMPO POSIBLE Y EN EL MEJOR DE LOS CASOS, LOGRAR GRADOS VARIABLES DE RESPUESTA TUMESCENTE PENEANA QUE OCASIONE LA OXIGENACIÓN DE LAS TRABECU-LAS DE MÚSCULO LISO CAVERNOSO Y CON ELLO SE PUEDA RECUPERAR LA FUNCIÓN ERÉCTIL DE MANERA PRECOZ Y MANTENIDA EN EL TIEMPO.
Es importante que tengamos siempre presente ante la mala respuesta clínica a los fármacos inhibidores de la 5-fosfodiesterasa el no inferir que la causa de la mala respuesta es por causa de la cirugía radical, aun cuando hayamos hecho una cirugía con preservación de los haces neurovasculares y con los cuidados de rigor para preservar la función sexual.
Estos pacientes deberán repetir dosificación de fármacos, deberá intentarse con fármacos intracaver-nosos, deberá lograrse un estado de relajación a través de psicoterapia de apoyo individual y a la pareja, deberán recomendarse circunstancias y situaciones adecuadas para llevar a cabo la relación intima (en lo posible con el estomago vacío, y sin estar cansado). Previamente deberemos realizar una historia médica detallada, una historia sexual detallada, determinar los niveles séricos de testosterona, una evaluación cardiovascular extensa y detallada, y por supuesto un examen físico completo, para detectar otras enfermedades asociadas, y corregir causas reversibles.
Una advertencia general al uso de inhibidores de la 5-fosfodiesterasa es que no deben ser tomados en conjunto con medicamentos alfa-1 bloqueantes adrenergicos, utilizados para aliviar los síntomas molestos urinarios ocasionados por una salida vesical obstructiva. Medicamentos como el Sildenafil, el Vardenafil y el Tadalafil no deberán tomarse dentro de las 4 primeras horas que siguen a la ingesta de un alfa-1 bloquearte adrenergico, debido al peligro de los efectos colaterales como la hipotensión postural. Luego de los estudios de USPI (United States Package Insert), donde se probó Doxasosin. Tamsulosin y Tadalafil conjuntamente con alfa-1 bloqueantes, se concluyó que el Tamsulosin es el fármaco mas seguro para ser administrado con alfa-1 bloqueantes en aquellos pacientes que lo necesiten por causas urológicas y no urológicas.
Referiremos que siempre que estemos comenzando un periodo de tratamiento con fármacos inhibidores de la 5-fosfodiesterasa, tengamos una conversación con el cardiólogo del paciente, ya que siempre será útil, aun cuando la seguridad de los fármacos podría inducirnos a tener una conducta mas confiada, ya que los detalles de los tratamientos que está llevando adelante el paciente, sobre todo en edades ancianas, podría de alguna manera afectar la eficacia y seguridad de la prescripción hada su disfunción erédil, sobre todo cuando el paciente tiene otras enfermedades asociadas que impliquen tratamientos farmacológicos.
a) Vardenafil
El dorhidrato de Vardenafil (Levitra®) es otro inhibidor de la 5-fosfodiesterasa, su potenda es diez veces mayor que la del Sildenafil en tejidos humanos, a pesar que su estructura química es muy parecida y su selectividad por la PDE-5 es dos veces y cuatro veces mayor para la PDE-6 y la PDE-1 respectivamente.
Actúa en un 74% de los pacientes desde la primera ocasión, siendo necesaria la estimulación sexual para que sea eficaz. Se absorbe rápidamente y las concentraciones plasmáticas máximas pueden conseguirse al cabo de 15 minutos de la ingesta. La vida media de eliminación plasmática es de 4-5 horas.
Es rápidamente absorbido por el tracto gastrointestinal. La eliminación del Vardenafil ocurre casi exclusivamente por biotransformadón. Su dosifi-cadón va de 5 a 20 mgs lográndose el efecto deseado sobre a erecdón peneana.
Estará contraindicado en hombres tomando nitratos, y en pacientes con hipersensibilidad conocida, también se contraindica en hombres mayores de 75 años y pacientes que toman ritonavir, indinavir, ketoconazol, e itraconazol.
De los hombres que responden a Levitra (20 mgs) en la primera oportunidad, el 91% continuaron respondiendo en el tiempo. Se obtuvo erección entre 15 y 25 minutos después de la ingestión.
Young (2001) y colaboradores en conjunto con el Grupo de Estudio Internacional del Vardenafil publicaron en el Journal de Urología un trabajo donde demuestran la mejoría significativa de la disfunción erédil de acuerdo al índice Internadonal de Función erédil (IIEF). Sus conclusiones fueron que el vardenafil en cualquier dosificación mejorará todos los aspedos de la disfunción erédil comparado con el grupo placebo, dando seguridad y manteniendo los efectos beneficiosos en el tiempo.
Según Moore-Donatucci (2003), (Donatucd 2000), hay que enfocar siempre tres variables en el uso de fármacos mejoradores de la función eréctil y son: calidad de erecdón, satisfacción de la experienda sexual y habilidad para la eyaculadón.
En un estudio retrospedivo presentado en el Meeting de la AUA 2002 en Orlando-Florida, Donatucd y colaboradores del Vardenafil European and National Group determinaron que en hombres con disfundón eréctil de diversas etiologías desde leve a severa en dos estudios randomizados, doble ciego fase III. De etiología orgánica había 672 parientes, disfunción eréctil psicógena 185 parientes y disfunción eréctil mixta 500 pacientes (1.357 pacientes en total). La calificación de la erección fue severa en 533 pacientes, moderada en 415 pacientes, ligera-moderada en 298 pacientes y leve en 8 pacientes. Sin considerar etiología o dosis el vardenafil mejoró de manera estadísticamente significativa, siendo bien tolerado, mejorando todos los parámetros, con el aumento de la dosis e igualmente todos los efedos adversos aumentaron también con el aumento de las dosis. Los efectos colaterales más comunes fueron cefaleas, vasodilatadón, rinitis y didpepsia.
En un estudio realizado sobre 800 hombres con disfunción eréctil administrándosele Vardenafil (Levitra®), demostró su eficacia desde la primera dosis, 74% tomando 20 mgs y 77% tomando 10 mgs fueron capaces de tener relaciones intimas en su primer intento comparado con 45% tomando placebo. En subsecuentes intentos de relación intima recibiendo tratamiento, se produjo un 91% de penetración exitosa. Estos resultados fueron presentados en el lOth Congreso Mundial de la Sociedad Internacional para la Investigación Sexual e Impotencia escenificado en Montreal.
Además en un segundo estudio se ha demostrado que el Vardenafil tomado en dosis de 10 y 20 mgs por
12 semanas reporta mejorías en las erecciones en 71% de los casos en comparación al 12% del grupo placebo y disminución de los síntomas depresivos que acompañan a los hombres con disfunción eréctil posterior a cirugía radical prostática (10- Congreso Mundial de la Sociedad Internacional para la Investigación Sexual e Impotencia (ISSIR) escenificado en Montreal) en Septiembre 2002 y presentado por el Dr. Gerald Brock, del Departamento de drugía, División de urología del Centro de Salud St Joseph's de Londres, Ontario, Canadá. El fármaco mantiene su eficacia con el uso repetido.
Pryor publica en el año 2002 en el Journal Internacional de Impotencia una actualización sobre la experiencia clínica del vardenafil, refiriendo que la farmacocinética del vardenafil ubica la máxima concentración plasmática después de dosis orales de 20 y 40 mgs a las o.7 y o.9 horas. La vida media fue de 4 a 5 horas y que aun después de 24 horas se encontraron cantidades mínimas del fármaco en la
circulación sanguínea. Refiere que la eficacia del Vardenafil no fue afectada ni por la edad del paciente ni por la severidad, ni por las diferentes etiologías de la disfunción eréctil.
Porst y colaboradores en conjunción con el Grupo de Estudio Internacional de Vardenafil refiere en la Revista Europea de Urología del año 2001 que el Vardenafil mejorará la función eréctil sea cual sea la severidad, etiología o edad del paciente. Se realizó sobre 580 pacientes siendo el Vardenafil bien tolerado, y efectivo aun en dosis de 5 mgs. Resultó efectivo tanto en disfunciones erectiles psicogénicas como orgánicas, y en todos los grupos et arios.
El Vardenafil es extremadamente efectivo en pacientes con disfundón eréctil siguiendo a drugía radical prostática encontrándose que el 71% de pacientes reportan mejoría significativa en las erecciones con dosis de 20 mgs versus 12% en hombres tomando placebo. Por lo tanto destacamos que Levitra podría ser especialmente efediva en tratar tipos espedficos de disfunción erédil como por ejemplo la que deriva de la cirugía radical prostática. La dosis clínicamente segura y efectiva es la quinta parte de la utilizada por el Sildenafil (Porst) y la potenda es aprox. 10 veces de la del Sildenafil (Saenz de Tejada).
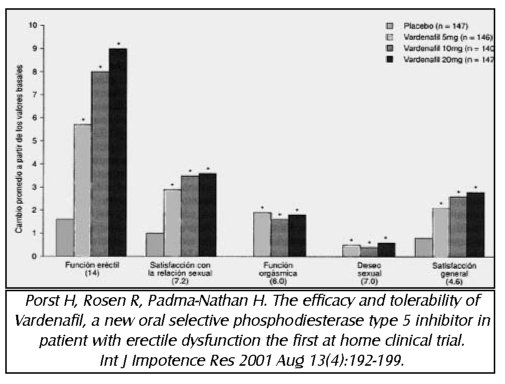
Las ingesta de alto consumo de grasas disminuirá un 20% las concentradones máximas logradas y retardará de 1 hora a 2 horas el tiempo que toma tener el máximo nivel sérico.
Brock, Taylor y Seger en el año 2002 publicaron en el European Urology un excelente estudio de la eficacia y tolerabilidad del vardenafil en hombres sometidos a drugía radical prostática en un estudio randomizado y con placebo sobre 440 pacientes con disfundón eréctil persistente luego de 6 meses o mas de cirugía radical retropubica por cáncer con preservación de haces neurovasculares, se les dio 10 y 20 mgs por 4 meses. Con ambas dosis mejoraran los sdores de sexualidad y las erecdones mejoraron un 65% con 20 mgs de Vardenafil y 59% con Vardenafil 10 mgs y 12.5% tomando placebo. Mientras mas preservados estén ambos haces neurovasculares mejor respuesta tendrán al Vardenafil. Situación ésta que podemos extrapolar a cualquiera de los inhibidores de la 5-fosfodiesterasa. Brock refiere un 71% sometidos a cirugía radical prostática con preservadón de los haces neurovasculares han mejorado sus erecciones con la dosis de 20 mgs de Vardenafil-Levitra®.
Brock (2003) publica un excelente artículo sobre la seguridad y eficacia del Vardenafil para el tratamiento de disfundón eréctil en hombres sometidos a cirugía radical prostática. El porcentaje de relaciones sexuales exitosas por padente recibiendo 20 mgs de Vardenafil fue del 74% en hombres con ligera a moderada disfunción eréctil y 28% en hombres con severa disfundón eréctil, comparado con 49% y 4% en grupos placebos respedivamente.
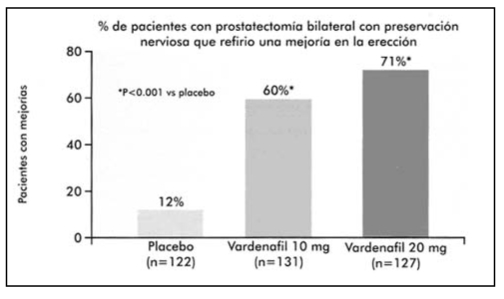
La dosis de 20 mgs mejoró los síntomas depresivos medidos por el Duke Perfil de Salud. Inclusive en el Centro para Estudios Epidemiológicos sobre Depresión (CES-D) el Vardenafil 20 mgs mejoró significativamente en reladón al placebo. Este aspedo del Vardenafil es bastante útil ya que sabemos que la calidad de vida de los pacientes afectados por disfunción eréctil está bastante deteriorada y el Vardenafil no sólo mejorará la disfunción erédil sino que al mejorar los síntomas depresivos, la calidad de vida del paciente afectado estaremos hadendo buena medicina.
Hellstrom y colaboradores en el año 2002 publicaron un excelente estudio realizado en USA y Canadá evaluando la eficacia y tolerabilidad del Vardenafil en una población de hombres con disfunción eréctil de etiología variable y de intensidades diferentes. Se realizó en 54 centros de los Estados Unidos de Norteamérica y Canadá. Con la dosis de 20 mgs 79% de pacientes con disfundón erédil leve tuviera una función eréctil normal, y un 39% con disfundón eréctil grave alcanzaron una función erédil normal.
Sotomayor (2001 y 2002) del Instituto Nadonal de Nutrición publicó sus investigaciones sobre el Vardenafil en dosis de 20 mgs durante 3 meses. Mejorando los puntajes de los Cuestionarios de Disfundón erédil en parientes mejicanos, así como el porcentaje de coitos realizados además de la satisfacción del paciente con el grado de dureza de su erección. Bien tolerado aun en dosis de 20 mgs.
No causa efectos adversos sobre los parámetros seminales ni causará alteraciones sobre los niveles séricos de FSH, LH, Testosterona y Hormonas sexuales unidas a globulina (S-HBG). Los efectos colaterales mas frecuentes causados por el Vardenafil son cefalea, calorones, dispepsia y rinitis, nauseas y mareos. Dichos efectos son dosis-dependientes y de intensidad leve-moderada.
Valiquette (2002) del Hospital Saint-Luc en Montreal realizó un estudio fase III doble ciego, donde demostró que el Vardenafil mantenía una eficacia duradera en 805 pacientes con disfunción eréctil con dosis de 5 mgs, 10 mgs, 20 mgs y placebo. De los pacientes que lograron erección satisfactoria y penetración exitosa en su primer intento 90% continuaron teniendo éxito en ocasiones siguientes.
Goldstein (2002) en la 62- Sesión Científica de la Asociación Americana de Diabetes (ADA) realizada en Junio del año 2002, afirmó que el Vardenafil es útil para la disfunción eréctil presentada en los pacientes diabéticos. La dosis fue de 10 ó 20 mgs una vez al día. Más del 70% de los pacientes reportaron mejoría de sus erecciones peneanas con la dosificación de 20 mgs, independiente del nivel de glicemia presentado. Es bien tolerado. Rinorrea (11%) y cefaleas (10%) fueron los efectos colaterales mas frecuentes.
Padma-Nathan (2002) y colaboradores investigaron y publicaron su trabajo sobre la eficacia y seguridad del Vardenafil en hombres con disfunción eréctil y terapia antihipertensiva publicado en el American Journal de Hipertensión. Sus conclusiones fueron que el Vardenafil fue bien tolerado y mejoraba la función eréctil en hombres con disfunción eréctil. No tenía prácticamente ninguna influencia significativa sobre la presión arterial.
Recientemente en Mayo 2004 el profesor Montorsi de la Universidad Vita Salute San Raffaele de Milán, presentó en el Séptimo Congreso de la Federación Europea de Sexología (EFS) en Brighton Inglaterra un trabajo denominado ONTIME (ONseT of Vardenafil In Men with Erectile Dysfunction), demostrándose que Vardenafil (Levitra®) tiene una respuesta superior (estadísticamente significativa) superior al placebo en 10 y 11 minutos en dosis de 10 mg y 20 mgs respectivamente. Se obtuvieron erecciones en 10 minutos en algunos pacientes y en la mayoría dentro de los primeros 25 minutos, siendo considerado el más rápido en su comienzo de acción de todos los inhibidores de la 5-fosfodiesterasa que existen en la adualidad. Fue un estudio en casa, doble dego, randomizado, con grupos paralelos, multicentricos que se hizo sobre 724 pacientes en 80 centros europeos y 8 norteamericanos. Los efectos colaterales más comunes fueron ligeros a moderados con cefaleas, rinitis, rinorrea y dispepsia. El estudio se diseñó con 4 semanas sin medicación y 4 semanas con Vardenafil de 10 mg, 20 mgs y placebo ornado bajo demanda. Las primeras 4 dosis fueron utilizadas pata determinar la rapidez en el comienzo de acción.
En otro estudio presentado en el mismo Congreso (EFS 2004) Eardley y colaboradores presentaron el estudio denominado MALES (Men's Attitudes to Life Events and Sexuality), considerando por los pacientes que el rápido comienzo de la erección era mas importante que la duración de la acción, la cual era considerada menos importante para los hombres de edad. Este estudio está considerado el survey mas extenso sobre sexualidad masculina, tomando entrevistas de 2912 hombres de 8 países (Reino Unido, Estados Unidos, Alemania, Francia, Italia, España, Méjico y Brasil), entre 20 y 75 años.
No debemos dar tratamiento para la disfunción eréctil a ningún paciente con enfermedad cardiovascular invalidante donde se le prohíban las relaciones sexuales. Tampoco cuando se administran nitratos por cardiopatía isquémica. No debemos dar Levitra en pacientes que tomen inhibidores de CYP 3A4 (indinavir, itraconazol, ketokonazol, ritonavir) ya que se alcanzarían concentraciones plasmáticas muy elevadas de Levitra. No se recomienda el uso de Levitra con bloqueadores alfa. Debe utilizarse con precaución en pacientes con deformidades anatómicas peneanas, o en patologías que predispongan la aparición de priapismo como la drepanocitosis, mieloma múltiple o estados de leucemia).
Keating (2004) y colaboradores de Auckland, Nueva Zelandia, refiere que el Vardenafil (Levitra®) es un inhibidor de la 5 fosfodiesterasa potente y selectivo, que mejora la función eréctil en hombres con ligera a severa disfundón eréctil, de variadas etiologías en su 2 estudios de 12 y 26 semanas de duración randomizados, doble ciego, multicentrico. Los hombres redbiendo Vardenafil de 10 y 20 mgs tuvieron mejorías mayores en el IIEF que en el grupo placebo. Penetradón y mantenimiento de la erección (basado en los Cuestionarios IIEF y SEP) fueron significativamente mayores con Vardenafil de 20 mgs comparado con el grupo Placebo. La satisfacdón de la reladón sexual así como de la función orgásmica fue significativamente mayor con vardenafil de 10 y 20 mgs que con placebo. Igualmente la propordón de pacientes con respuesta positiva al GAQ fue también mayor con vardenafil de 5 a 20 mgs, comparado con placebo. Mejoró la función eréctil en parientes con diabetes o siguiendo a cirugía radical prostática con preservación de uno o de ambos haces neurovasculares. Fue bien tolerado y los efedos colaterales fueron transitorios y fueron los usuales de los inhibidores de la 5-fosfodiesterasa (rinitis, cefaleas, rinorrea y sinusitis). Finalmente recomienda que sea considerado un fármaco de primera línea en casos de disfundón eréctil, sea cual fuere su etiología.
El intervalo QT en eledrocardiografía representa la duradón de la despolarización-repolarización ven-tricular. Cuando se presenta una prolongación significativa del intervalo Q-T se creará un estado elec-trofisiológico que podría aumentar las arritmias cardíacas. Los tres inhibidores de la 5-fosfodiesterasa tienen afortunadamente poco o ningún efecto sobre la prolongación del intervalo Q-T.
Morganroth (2004) publicó un excelente y novedoso trabajo acerca de la evaluadón del Vardenafil y del Sildenafil sobre la repolarización cardiaca. Específicamente sobre la duración del QT y del QT corregido (QTc) utilizando un modelo que minimizaba el error experimental para obtener así los resultados más precisos observados sobre al tiempo QT. La conclusión fue que ambos fármacos inhibidores de la 5-fosfodiesterasa no producen aumento del QT absoluto y solo produce mínimo aumento del intervalo QTc con una ligera curva dosis-respuesta, cuando se aumentan las dosis de Vardenafil de 10 a 80 mgs produciéndose como average un incremento de la duración en 2 mm. Los autores recomiendan que los cambios sobre el QTc deban ser conocidos cuando se prescriben fármacos como los inhibidores de la 5-fosfodiesterasa, y además recomiendan no dar éstos fármacos cuando se están ingiriendo ciertos antiarrítmicos. Hatzichristou (2004) refiere en su trabajo sobre hombres europeos con disfunción eréctil (323 pacientes) que la dosificación flexible de Vardenafil (Levitra®) es muy bien tolerada produciendo mejoría clínica significativa, obtenida con la respuesta a la pregunta 3 del SEP(sexual encounter profile) con un 58% a 74% de mejoría comparado con 22% a 34% del grupo placebo. Esto le da al médico margen de acción al poder variar la dosis de lOmgs a 5 mgs o inclusive aumentar a 20 mgs sin aumentar significativamente los efectos indeseables de la medicación y obteniendo buenos resultados clínicos.
Otro inhibidor de la 5-fosfodiesterasa, su estructura química es diferente a la del Sildenafil. El Tadalafil (Cialis®) tiene 17 horas de vida media. Su efedo lo podría comenzar a mostrar a los 17 minutos de tomada la primera dosis y el paciente podría tener mas de 2 reladones sexuales en 24 horas, debido a que su vida media es de 17 horas.
Montorsi y colaboradores (Sep J Urol, 2004) publica un excelente estudio sobre el tratamiento con Tadalafil en pacientes con disfundón eréctil siguiendo a drugía radical prostática con dosis de 20 mgs. Definieron la llamada tumescenda postoperatoria como 50% o más de respuesta "si" en la primera pregunta del SEP (sexual encounter profile) que dice: habilidad de alcanzar al menos algo de erección. Los resultados que se obtuvieron dieron un 54% de porcentaje de penetración exitosa y un 41% de porcentaje de reladones sexuales exitosas. Para el grupo de tumescencia postoperatoria estos valores fueron respectivamente 69% y 52%. Todos los pacientes que tomaron Tadalafil reportaron una mayor satisfacción en el "Erectile Dysfunction Inventory of Treatment Satisfadion que el grupo placebo. Los efedos colaterales fueron cefalea (21%), dispepsia (13%) y mialgia (7%).
Conduyeron que el Tadalfil 20 mgs fue eficaz y bien tolerado en disfundón eréctil siguiendo a drugía radical prostática con preservadón neurológica.
Kuan-Brook (2002) del St Joseph's Health Center de Ontario, Canadá refieren que con el Sildenafil fueron significativos los parientes que no obtuvieron mejoría clínica por lo cual el desarrollo de nuevos inhibidores de la 5-fosfodiesterasa con mayor selectividad, mayor duración de acción, potencia mayor y mayor facilidad de utilización vienen a llenar una necesidad. Con dosis de 20 mgs el tiempo de respuesta se extiende a 36 horas en el 60% de los pacientes cualquiera sea su etiología. Porcentaje de retiro del tratamiento fue del 1.7% de los pacientes.
Según Hellstrom (2002) no afeda los parámetros seminales, ni tampoco afecta las concentraciones séricas de hormonas testiculares o hipofisiarias como la testosterona, LH, FSH. El Tadalafil mejora sustancialmente los scores internacionales de función eréctil (IIEF).
Tiene un comienzo de acción sobre la erección peneana mas rápida que con el Sildenafil. Dosis de 10-20 mgs diario mejora en más de un 90% la disfunción eréctil leve a moderada. Sus efedos colaterales son cefaleas, dolor lumbar bajo, mialgias, dispepsia, nasofaringitis. El porcentaje de descontinuadón del tratamiento debido a los efedos indeseables es de aproximadamente un 5 a 7% (Montorsi, 2004). Su absorción no se verá limitada por la ingesta de grasa animal. Igualmente la farmacocinética del Tadalafil no se verá limitada por la ingesta alcohólica o por alimentos, éste detalle no debe pasar desapercibido, ya que una de las orientadones en la creación de nuevos fármacos para la disfunción eréctil es tratar de que no se "programe tanto al paciente" para tener una relación, es decir con exigencias de no tomar, no ingerir grasas, no comer, ya que todas éstos requisitos terminan por restarle "naturalidad" a la erección y al coito en sí, lo cual podría ser contraproducente en algunos pacientes. Estos se presentarán en base a la dosis administrada y disminuirán en la medida que se administren nuevas dosis. No ha sido asociado con disturbios en la visión de color y pocos pacientes han descontinuado el tratamiento por los efedos colaterales.
Saenz de Tejada (2002) publica un trabajo sobre los efectos del Tadalafil sobre la disfunción erédil en hombres con diabetes mejorando significativamente la función erédil siendo bien tolerado, importante en una población de alto riesgo para presentar disfunción erédil.
Porst (2002) presenta un estudio realizado sobre 36 centros en Europa y Norteamérica donde 348 hombres con disfundón erédil se le daba 20 mgs de Tadalafil, resultando en un aumento significativo de las relaciones sexuales y de la calidad de las erecciones pudiendo obtenerse con una sola dosis de 20 mgs hasta 36 horas de capacidad erectiva fadlitada, dándole mayor espontaneidad a las relaciones intimas.
Harin Padma (2003), refiere que el Tadalafil proporciona una rápida respuesta erédil y una duradón de su efedo por 24 horas permitiéndole a la pareja tener relaciones intimas de manera natural. Patterson revela que el Tadalafil es rápidamente absorbido, se elimina predominantemente por el hígado y en menos de 30 minutos comienza su inhibidón sobre las fosfodiesterasa-5 lográndose el efedo erédil deseado, manteniendo su efedo por arriba de 17.5 horas.
Kloner (2004) advierte que al igual que todos los inhibidores de la 5-fosfodiesterasa, no debe ser utilizarlo cuando se están tomando nitratos. Hutter (2002) menciona que el Tadalafil no tiene efectos clínicos relevantes sobre la presión sistólica o diastólica. Los efectos adversos cardiovasculares (infarto de miocardio, muerte súbita cardiaca) relacionados con el Tadalafil son mínimos.
Kloner (J Urol Nov 2004) refiere que los parientes que presentan disfunción eréctil tienen otras patologías como enfermedad cardiovascular, diabetes mellitas o hiperplasia prostática benigna sintomática, lo cual hace que se tenga que tener siempre presente las interacciones medicamentosas. A tal efedo concluye que el tadalafil aumenta los efectos hipotensivos de la doxazosina, en casos de parientes que necesitan terapia para sus síntomas urinarios obstrudivos en casos de crecimiento prostático, pero tiene muy pocos efectos en reladón a la Tamsulozina. Por lo tanto se recomienda que pacientes que tengan que tomar relajantes de la musculatura lisa prostática por hipertonía estromal y tengan concomitante-mente disfundón eréctil con terapia con tadalafil, tomen Tamsulozina 0.4 mgs diarios al acostarse o cuando tengan la mayor sintomatología.
Una de las consideraciones que se están tomando en cuenta en parientes sometidos a cirugía radical prostática, es que cuando los pacientes no quieran someterse a terapias intracavernosas inmediatamente a la extracción de la sonda uretrovesical, uno de los objetivos es la terapia oral con inhibidores de la 5-fosfodiesterasa y de ser posible se deberá dar 3 a 4 veces por semana, y en el caso del Tadalafil con sus 17 horas de vida media luce una alternativa viable y muy lógica.
El Tadalafil con su larga vida media podría ser considerado en terapias a largo plazo en pacientes sometidos a cirugía radica prostático con prejuicios en la toma diaria de fármacos y sobre todo en pacientes con miedo al desempeño sexual. Su larga vida media podría hacer "más natural" la aparición de tumescencia peneana y con ello, darle más confianza a la hora de tener relaciones, ya que dos dosis semanales podrían ser suficientes unido a otras alternativas coadyuvantes.
Fármaco revolucionario en el mundo de la medicina, cuyo nombre comercial de inicio fue Viagra®). Está considerado la primera línea de los tratamientos para disfunción eréctil, de cualquier etiología (psicogénica, neurogenica, vascular o mixta) y acompañada de otras condiciones medicas. A pesar de que en teoría no debería tener ingerencia sobre la "performance" sexual en la practica diaria vemos que también en éste aspecto mejoran parámetros del acto sexual como tiempo preorgasmo, control sobre la eyaculadón además de los parámetros sobre la erección como la calidad de turgencia, tiempo de laten-cia, periodo refractario entre otros.
Su eficada dependerá de si la drugía radical se ha completado o no con la preservación de los haces neurovasculares, ya que actúa como un fadlitador de las erecdones y así tenemos que cuando se preservan los dos haces podría haber, en el mejor de los escenarios hasta un 80% de potencia sexual postoperatoria, no así cuando se deja un solo haz, observado un descenso de la potencia sexual a un 20-0% en la mejor de las series consultadas. Sabemos ya que cuando no hay preservación de los haces neurovasculares no habrá respuesta al Sildenafil (Seftel, 2003; Zagaja,
2000).
Según Levine (2004) Director del Programa de Fundón Sexual masculina de la Universidad Rush de Chicago en un estudio de investigadón presentado en el Meeting anual de la Asodación Americana de Urología, hombres que tomaron dosis de Sildenafil en las noches después de 4 semanas de haberse sometido a drugía radical prostática con preservación de los haces neurovasculares, son mas propensos a tener un retorno precoz de sus erecciones nodurnas espontáneas, un signo de función eréctil normalizada. Este estudio se hizo en 54 hombres redbiendo 50 o 100 mgs de sildenafil o placebo una vez por día, en las noches al acostarse por 9 meses comenzando a las 4 semanas de haberse efectuado la cirugía radical. Se hicieron pruebas de tumescenda nodurna peneana y rigidez (NPTR test) (Nocturnal Penile Tumescence and Rigidity) en dos noches consecutivas en la semana 4, 12,24, 36 y 48 post-drugía. La fundón eréctil de dichos parientes fue constatada 8 semanas después de la descontinuación del tratamiento (semana 48) utilizando el IIEF con la pregunta: ¿En las pasadas 4 semanas, tuvo Ud. Erecciones lo suficientemente buenas para tener actividad sexual satisfactoria? Se consideró una respuesta positiva al tratamiento la presencia de función erédil espontánea sin la utilización del medicamento. El 28.6% de los 35 hombres del Sildenafil y 5.3% de los 19 hombres con placebo tenían respuesta positiva en los test NPTR. Rehabilitadón duradera de la función erédil es posible siguiendo a la cirugía radical donde sabemos que dicha función podría estar comprometida en más del 90% de los casos de parientes previamente potentes, por eso es que el Refiere que aun no se han definido momento optimo y dosis óptimas del Sildenafil para la rehabilitación sexual, las respuestas se han visto desde la semana 16 después de la cirugía, sugiriéndole al medico tratante que el inicio precoz de tratamiento es lo mas apropiado.
Gresser y Gleiter (2002) publican cifras de 43% de éxito terapéutico del Sildenafil en pacientes sometidos a cirugía radical prostática, 85% de éxito en pacientes con enfermedades neurológicas.
La biodisponibilidad del Sildenafil es de aprox. 41%, después de una dosis de 100 mgs la concentración plasmática total será de 440 ng/ml, para el Tadalafil será de 378 ng/ml y para el Vardenafil será de 19 ng/ml (Sachse 2000, Rhode 2001). La vida media del Sildenafil y Vardenafil son de 3 a 4 horas y la del tadalafil aprox 18 horas.
Feng (2000) y colaboradores del Departamento de Urología del Centro Medico Permanente Kaiser de los Ángeles California USA, trabajaron con el Sildenafil en disfunción eréctil postcirugía radical por cáncer concluyendo que es igualmente efectivo después de cirugía con preservación bilateral o unilateral de haces neurovasculares confirmado por las parejas de los pacientes. Cuando no se hace cirugía con preservación de haces no responderán al tratamiento con Sildenafil. En pacientes no sometidos a cirugía radical prostática habrá un 65% de éxito con la primera o con la segunda dosis, lo cual se ubica posteriormente en un 86% de éxito cuando se pasa de ocho tomas. Cuando no da los resultados previstos (pacientes que no responden al Sildenafil) es por una dosificación incorrecta, o por falta de un numero de ingesta que haga alcanzar una eficacia mas sostenida, o a una particular resistencia por parte del paciente, y/o a factores agregados que no corrige el Sildenafil con por ejemplo un status ansioso concomitante leve, moderado o severo. Carsson (2002), McCullough (2001) tuvieron porcentaje de respuesta baja al sildenafil en pacientes sometidos a cirugía prostática, pero esto cambiaría en los años siguientes.
El tema de impartir instrucciones inadecuadas al paciente ocasionando supuestos fracasos del Sildenafil es tratado por Hatzichristou y colaboradores (2005) en su trabajo sobre 100 pacientes inicialmente no respondedores al Sildenafil. Las limitantes para desarrollar su máxima eficacia la representaron no haber tomado la dosis máxima correcta, haber ingerido el producto con el estomago lleno, haber iniciado las relaciones intimas inmediatamente después de haber ingerido la tableta y por ultimo no haber realizado estimulación sexual para la adquisición de una erección. Esto nos hace reflexionar una vez más que se debe seguir muy de cerca al paciente que se le da un erectógeno, ya que debemos regular dosis y estar pendientes de la manera como se ingiere, para con ello lograr optimizar sus efectos farmacológicos. Esto es válido para cualquiera de las alternativas farmacológicas de la disfunción eréctil en relación a los inhibidores de la 5-fosfodiesterasa.
Carsson (2004) refiere en el curso dictado en el AUA 2004, que el porcentaje de respuesta cuando hay cirugía radical preservando ambos haces neurovasculares es del 33-80%, del 0-80% cuando sólo se preserva un haz y del 0 al 20% cuando no se preserva ningún haz neurovascular en la cirugía radical, siendo éstos datos contrarios a los suministrados por Feng (2000).
Hong (1999) refería que comparando la mejoría de respuesta al sildenafil en pacientes sometidos a cirugía radical prostática se notaba un incremento del 26% al 80% cuando se comparaban pacientes con 6 meses se operados con aquellos que tenían 18 a 24 meses de operado, lo cual nos hace concluir que no debemos esperar respuestas rápidas pero si debemos dar constantemente el tratamiento, para lograr desde turgencia peneana a un afarnca rigidez, advirtiéndole al paciente de éstos resultados para que no haya frustración y abandono del tratamiento.
Padma-Nathan 2003 en un estudio innovador, recomienda Sildenafil nocturno para profilaxis de la disfunción eréctil consecutiva a cirugía radical prostática por cáncer en pacientes que previamente tenían función eréctil normal definida como score igual o mayor de 8 en las preguntas 3 y 4 del IIEF (Internacional Index erectile function), y Test de tumescencia nocturna peneana normal, es dedr, 10 minutos continuos de rigidez de la base peneana de igual o más del 55%. La dosis de 50 0 100 mgs de sildenafil comenzaba al mes de operado durante 9 meses (36 semanas). De los 76 pacientes estudiados el 27% tuvo retorno de la fundón eréctil en su periodo postoperatorio cuando tomaron sildenafil comparado con el 4% del grupo que tomó placebo. Esto sucede por mejoría en la oxigenadón durante las erecdones nodurnas peneanas y por regeneración neuronal postoperatoria.
OTROS FACTORES ASOCIADOS A LA RESPUESTA AL SILDENAFIL POSTERIOR A CIRUGÍA RADICAL PROSTÁTICA SON LA FUNCIÓN ERÉCTIL PREVIA AL TRATAMIENTO QUIRÚRGICO, LA EDAD DEL PACIENTE (MIENTRAS MAS AVANZADA PEORES RESULTADOS), TIEMPO DE RECUPERACIÓN DESPUÉS DE LA CIRUGÍA, ENFERMEDAD CARDIOVASCULAR CRÓNICA (HTA, DIABETES, HIPERLIPIDEMIA), DEPRESIÓN, MEDICACIONES, ESTILO DE VIDA (ALCOHOL, DROGAS, CIGARRILLOS).
Los efedos colaterales reportados en más del 50% de los parientes son congestión nasal, cefaleas, rubor fadal, dispepsia, visión anormal transitoria, efedos adversos de tipo cardiovascular (hipertensión, taquicardia, pal-pitadón y angina de pecho) se reportan en menos del 1% de los parientes. El tratamiento a largo plazo no disminuirá la eficada ni la toleranda del Sildenafil en parientes con disfundón eréctil (Steers, 2001).
Raina (2004) revela que aquellos pacientes que por haber sido operados de drugía radical prostática utilizan terapia intracavernosa, podrían pasarse a terapia oral con Sildenafil siendo exitosa en más del 75% de los casos, y en lo que no respondieron bien al Sildenafil, en unión con la terapia de inyección intracavernosa, dio buenos resultados.
Wespes (2002) de Bélgica revela que los pacientes que no responden a la Sildenafil-Viagra® se debe a varios factores como desorden vascular de la célula del músculo liso de los sinusoides cavernosos, incremento de la ansiedad, disminución de la síntesis de oxido nítrico, no siendo los niveles de testosterona un factor a considerar, pero básicamente refiere que la explicación de la no-respuesta a la Sildenafil-Viagra® es histológica. Roumeguere y Wespes (2003) asocian disfundón eréctil con hiperlipidemia y riesgo de enfermedad coronaria.
Harin Padma-Natham (2003) y colaboradores de la clínica de Hombres de Bebería Hills en California condujeron un estudio doble ciego con 76 hombres con función erectiva normal en el preoperatorio (score de 8 ó mas en las preguntas 3 y 4 del IIEF y prueba de tumecescenda nodurna peneana normal (10 minutos o mas continuos de 55% o mas de rigidez en la base). Se sometían a cirugía radical y se comenzaba a darle 50 mgs nocturnos diarios, o 100 mgs o placebo por un periodo de 9 meses comenzando 1 mes después de la cirugía. 14 pacientes de 51 (27%) después de 48 semanas de la drugía con preservación bilateral de haces recibiendo sildenafil tuvieron retorno de la fundón erédil espontánea comparada con 1 parientes de 25 (4%) del grupo placebo. Los efectos colaterales fueron fatiga y dolor de cabeza con dosificación de 50 mgs. El sildenafil mejora la oxigenación al momento de las erecciones nodurnas y mejora la regeneradón neuronal. El objetivo era precisamente ese, lograr erecciones nocturnas peneanas, no erecciones para utilizarlas en coitos, ya que según el autor el Sildenafil no logra buenas erecciones hasta 9 a 18 meses después de la cirugía radical.
El Sildenafil causará una marcada elevación de GMPc (monofosfato cíclico de Guanosina) en el glande, en los cuerpos cavernosos, en el cuerpo espon-gioso ocasionando relajación muscular lisa de las sinusoides cavernosas y con ello una excelente erecdón.
Los parientes con diabetes, fumadores, o con ingesta de medicamentos antihipertensivos serán mas propensos a fallar con la terapia con Sildenafil.
DeBusk (2000) publica las recomendaciones del Princeton Consensus Panel donde se recomienda que los pacientes no deben utilizar Sildenafil, así como otros inhibidores de la 5-fosfodiesterasa cuando tienen alto riesgo cardiovascular como son pacientes portadores de angina de pecho inestable o refradaria, hipertensión no controlada, falla cardiaca congestiva grados 3 o 4, infarto de miocardio en las ultimas 2 semanas, con arritmias de alto riesgo, con cardiomiopatia obstrudiva o con enfermedad valvular moderada a severa. La única contraindicación absoluta es la ingesta de nitratos por enfermedad anginosa. Se debe utilizar con mucha precaución en pacientes con enfermedades que puedan desembocar en priapismo como anemia de células falciformes, leucemia o mieloma múltiple. Herrmann demuestra que no hay ningún efecto indeseable con siuldenafil oral en pacientes con severa enfermedad coronaria, sin embargo como del parecer que toda indicación de inhibidores de la fosfodiesteresa-5 deberá ser confirmada por el cardiólogo del paciente.
No hay duda que la eficacia del Sildenafil se incrementa al aumentar las dosis y la duración del tratamiento, así como al hecho de haber tratado o estimulado la disfundón erédil antes de la cirugía, y a la edad del paciente y al tiempo de recuperación después de la cirugía (Carsson 2002). El Sildenafil no debe tomarse con estomago lleno o habiendo consumido cantidades importantes de grasa ya que se reduce considerablemente su absorción y con ello su eficacia.
En los momentos aduales solo en los Estados Unidos de Norteamérica se ha prescrito Sildenafil a 6 millones de hombres, con un porcentaje de fallo de un 30% que son aprox 1.8 millones de hombres que estarían esperando la salida al mercado mundial de un nuevo fármaco que logre suplir lo que no han podido lograr con el Sildenafil (McCullough-Annual meeting AUA Orlando, 2002).
Padma-Nathan (2002) demostró que el Sildenafil no produce efectos adversos cuando se administra conjuntamente con tiazidas, diuréticos perdedores de potasio como el amiloride, espironolactona, y tri-amterene, inhibidores de la enzima convertidota de angiotensina (ACE), bloqueadores de los canales de caldo, y beta antagonistas.
Se deberá tener mucha precaución cuando el paciente presente alergias, o es mayor de 65 años
recomendándose comenzar con dosis de 25 mgs, incrementándola con anuencia del urólogo y del cardiólogo del caso. No debería utilizarse con dme-tidina, eritromicina, itraconazol, ketoconzol, mibefradil, ritonavir, saquinavir, nitratos. Ciertas condiciones medicas podrían afectar la utilización del Sildenafil como son parientes con arritmias, con enfermedad coronaria, con ataques cardiacos, con hipertensión arterial o hipotensión arterial, antecedentes de accidentes cerebrales vasculares en los 6 meses previos, pene con deformaciones tipo curvatura congénita o adquirida, problemas de san-gramiento, retinitis pigmentosa, leucemia, mieloma múltiple, tumores de medula ósea, polidtemia, anemia de células falciformes, y trombocitopenia. Historia de Priapismo, problemas renales, problemas hepáticos.
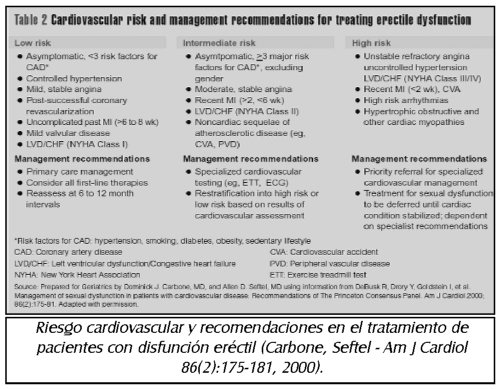
Según lineamientos de Princeton (De Busk R. Am. J Cardiol 86:176-81,2000) hay factores de riesgo para la administración de tratamiento de pacientes cardiovasculares con disfunción eréctil como: hipertensión, diabetes mellitus, edad avanzada, habito tabaquito, obesidad, vida sedentaria y dislipidemia. Se dividen en bajo riesgo, riesgo intermedio o alto riesgo. Sólo el grupo de bajo riesgo puede recibir de manera segura tratamiento para su disfunción eréctil. Los de riesgo intermedio y alto deberán realizarse pruebas que determinen la gravedad de las lesiones cardiacas antes que se trate de reestablecer la función sexual. Se consideran de bajo riesgo cuando: el paciente está asintomático y tiene menos de factor mayores de riesgo para enfermedad cardiovascular, o tenga hipertensión controlada, o tenga angina estable leve o status posterior de revascularizacion coronaria exitosa, o infarto de miocardio no complicado en el pasado (más de 6 a 8 semanas), o enfermedad valvular leve. Serán de riesgo intermedio cuando hay más de 3 factores de riesgo para enfermedad cardiovascular, cuando hay angina estable moderada, infarto de miocardio reciente (mas de 2 semanas pero menos de 6 semanas) y no tener secuelas no cardiacas de enfermedad arterioscleróticas como accidente cerebrovascular, enfermedad vascular periférica entre otras). Y se consideran grupos de alto riesgo aquellos con angina inestable o refractaria, hipertensión no controlada, infarto de miocardio reciente (menos de 2 semanas) o tener reciente accidente cerebrovascular, tener arritmias de alto riesgo, o tener miocardiopatia hipertrófica obstructiva o tener enfermedad vascular moderada o severa (Carsson, 2004).

También tendremos efectos aditivos en la disminución de la tensión arterial con la administración de Sildenafil (25 mgs) con el Doxazosin (4 mgs) fármaco alfa- 1 bloquearte adrenergico utilizado para el tratamiento de los síntomas urinarios bajos de origen prostático relajando la musculatura lisa prostática. A pesar de que no han aparecido trabajos sobre los otros alfa-1 adrenolíticos en conjunto con el Sildenafil, podríamos extrapolar que debemos tener sumo cuidado en la administración de dicha combinación y de ser posible no someter al paciente a la posible interacción de ambos medicamentos (Viagra Package insert. Pfizer Pharmaceuticals, 2003).
B) APOMORFINA
Es un D1/D2 agonista dopaminico que actúa sobre áreas del sistema nervioso central, sirviendo como mediador de la erección peneana. Produce su efecto al estimular los receptores dopaminergicos centrales (predominantemente D2) en los núcleos paraventriculares del hipotálamo (Hatzichristou 2001). Produce erecciones sobre todo en hombres con
problemas psicogénicos y en quienes le resulte difícil mantener la erección. El Dr. Fernando Ugarte y Romano, urólogo y sexólogo mejicano refería en un cursillo de Sexualidad en Venezuela que cuando se tiene un paciente con "angustia de desempeño" en su área sexual, la apomorfina podría resultar un valioso argumento terapéutico. La dosificación terapéutica recomendada es de 3 mgs sublingual. Puede producir mareos, nauseas. Actualmente se ha comprobado que dosis de 6 mgs podría comprometer al paciente, y se han visto casos de sincope central, por lo cual la FDA está en proceso de aceptación del producto para uso masivo, el cual ya se ha logrado en Europa. (Heaton, 2000; Dula, 2000; Heaton, 1995, 2000; Segraves, 1991).
C) POLIPEPTIDO VASOACTIVO INTESTINAL (VIP)
Péptido vasoactivo intestinal, es un relajante potente del músculo liso, aislado originalmente del intestino. Cuando se inyecta solo no produce erección pero cuando se une con la Fentolamina (Regitina®) entre 67% y 80% de los pacientes lograrán erecciones satisfactorias para realizar una relación sexual. Esta combinación está disponible en Europa pero no en los Estados Unidos de Norteamérica. Se está comenzando a probar en los Estados Unidos de Norteamérica. Sus efectos colaterales son sudoradón facial (53%), sudoradón del tórax (9%), rinorrea, sudoración, dolor en el sitio de inyección (11%). (Dinsmore, 1999, 1998; Sandhu, 1999; Del Popolo, 1993).
A continuadón mendonaremos antagonistas de los receptores adrenergicos que se utilizan para disfunción eréctil como son la Yohimbina, la Fentolamina, la Apomorfina y el Trazodone.
D) FENTOLAMINA
Fentolamina oral (Vasomax®), es un antagonista alfa- adrenergico y su eficada es de aprox. un 10% sobre placebo. Ha habido numerosos trabajos que refieren la acción de la fentolamina sobre parientes con disfunción eréctil. Zorgniotti (1994) publica trabajos con hombres con disfundón eréctil administrándosele 50 mgs de fentolamina y a oto grupo 10 mgs de fenoxibenzamina. El 42% del grupo que había tomado fentolamina tuvieron erecdones peneanas en contraste con solo el 9% del grupo que tomó fenoxibenzamina (un agente antagonista alfa-adrenergico de larga duradón). Demostró los efedos benefidosos de la fentolamina comparándola con placebo en dosis de 20 mgs vía oral con iguales resultados 32% con efedos positivos y 13% con placebo. Gwinup (1988) también demostró los efectos benefidosos de la fentolamina sobre la erecdón peneana. Goldstein (2000) en dosis de 40 y 80 mgs respedivamente, 55% y 59% de los parientes fueron capaces de alcanzar una penetración vaginal con 51% y 53% alcanzando penetración vaginal en 75% de los intentos. La corrección o mejoría de la disfundón eréctil fue en 53% en hombres tomando dosis de 80 mgs y 40% en hombres tomando dosis de 40 mgs de Fentolamina. En 7.7% de hombres experimentaron rinitis en dosis de 40 mgs y menos del 3.1% experimentaron otros efectos colaterales. La fentolamina es segura y bien tolerada. Goldstein (1998) y el Vasomax Study Group, publicaron la eficada y seguridad de la fentolamina oral para el tratamiento de disfundón eréctil leve.
E) TRAZODONE
El Clorhidrato de Trazodone es un antidepresivo triciclico (antagonista serotonina) sin efectos antimuscarinicos, que en 1/10.000-20.000 podría ocasionar erección prolongada (priapismo), lo cual lo hace extremadamente raro. La fisiopatología de dicho evento lo explica en su trabajo de 1991 Saenz de Tejada. En dosis de 50 a 150 mgs se obtuvieron 64% de respuesta erédil positiva, unida también a la Yohimbina.
En ocasiones estaría indicada la Sertralina para aquellos casos que antes de la drugía ya tenían eyac-ulación precoz por lo cual se indican 50 mgs vía oral unido a fármacos como los inhibidores de la 5 fos-fodiesterasa. Sin embargo debemos tener precaución con los antidepresivos ya que disminuyen los periodos REM del sueño y con ello disminuirían las erecciones nocturnas peneanas lo que llevaría a hipoxia de la musculatura lisa cavernosa y esto condudría a fibrosis cavernosa con las consecuencias por toda conocida en el deterioro de la función sexual.
Fink (2003) podría ser de gran utilidad en hombres con disfunción eréctil en altas dosis y en parientes con disfundón de origen psicógeno. Dando una muestra de la variabilidad en los resultados tenemos a Costabile (1999) en su trabajo producido en el Walter Reed Army Medical Center de Washington, USA, donde revela que el trazodone no es mas efectivo que el placebo en pacientes con disfunción eréctil severa de origen psicógeno. (Meinhardt, 1997) refiere su utilidad en parientes con disfundón erédil psicogénica.
F) DELEQUAMINE
El clorhidrato de delequamine es al igual que la Yohimbina un antagonista alfa-2 adrenergico. No se ha demostrado se mas eficaz que el placebo en el tratamiento de la disfundón erédil orgánica (Traish-Goldstein, 2000).
Bancroft (1995) estudiaron los efedos de un nuevo antagonista alfa-2 adrenergico (RS 15385) sobre el sueño y sobre la tumescenda nocturna peneana, reduciendo el tiempo total de sueño en voluntarios jóvenes y en hombres disfuncionales. En altas dosis hubo un aumento de erecciones espontáneas en jóvenes disfundonales durante los periodos no-REM.
3. TERAPIA FARMACOLOGICA INTRAURETRAL
Supositorios intrauretrales (Alprostadil-Muse®) colocados con la ayuda de lubricante K-Y para facilitar su introducdón, con lo cual se absorben medicamentos dentro de los tejidos erectiles, desde el cuerpo esponjoso a los cuerpos cavernosos, obteniéndose la erección deseada. Utiliza prostaglandinas E-l (Alprostadil). Se deja como alternativa de segunda línea cuando han dado resultados pobres los inhibidores de la 5-fosfodiesterasa. Aproximadamente 43% de los pacientes utilizando Muse tendrán efedos positivo sobre la erección peneana.
La erecdón comienza a los 5-10 minutos y dura aproximadamente 30 a 60 minutos, pero tendrá una variabilidad de padente en paciente. Cuando se une a mecanismos constrictivos en la base del pene y con ello reducir el retorno venoso se mejorarán los porcentajes de erecciones satisfadorias a un 70%. Se comienza con 500 microgramos y de acuerdo a la respuesta erédil obtenida se podría aumentar a 1000 microgramos o bajar a 250 microgramos.
Williams (1998) del MUSE Study Group y colaboradores demostraron que de los 249 hombres estudiados en 159(64%) tenían una erecdón capaz de realizar una relación sexual cuando utilizaban Alprostadil transuretral. En casa 46 de 67 hombres (69%) reportaron relaciones al menos una vez con el fármaco intrauretral, comparado con 8 de 73 (11%) del grupo placebo. Demostraron los padentes con Alprostadil intrauretral un 34% de mejoría en sus relaciones con su pareja, un 5% mostraron mejoría en su sensación de bienestar, y un 71% mejoraron en la calidad de sus erecciones, comparado con un 11%, 8% y 1% respectivamente en el grupo placebo. Las parejas de pacientes colocándose Alprostadil demostraron un 35% de mejoría en sus relaciones de pareja comparado a un 12% en el grupo placebo. Dolor urogenital fue reportado en 14% de los pacientes.
Padma-Nathan (1997) publicó en el New England Journal of Medicine sus experiencias con 1511 hombres con disfundón erédil a quien se le administró Alprostadil intrauretral siendo bien tolerado y efedi-vo en pacientes con disfunción eréctil crónica. Padma-Nathan (2003) y colaboradores evaluaron la eficacia y seguridad de Alprostadil tópico en crema (Alprox-TD®) para el tratamiento de disfunción eréctil en ligera, moderada y severa.
Los efedos colaterales son molestias punzantes uretrales, rubicundez del pene, sangramientos leves uretrales. El hecho de no inflingirse inyecdones en el pene, pudiera hacerla una modalidad mas utilizable, sin embargo la variabilidad personal en su absorción con la correspondiente correlación con su eficacia la hace al final poco atractiva.
4. AGENTES TÓPICOS: GEL O CREMA DE ALPROSTADIL (Topigland/Alprox®-Nexmed®)
Las prostaglandinas tópicas El son efectivas en alrededor del 40% de los pacientes siendo utilizadas al 2% al 4% y al 4% con soluciones de nitroglicerina.
Alprostadil en crema (Alprox®) ha tenido buena efedividad y tolerancia (Padma-Nathan, 2003), se aplica en dosis de 0.05, o.l, 0.2 y 0.3 mgs.
Padma-Nathan (2003) en dos estudios multicen-tricos, controlados por placebo fase 2, con parientes con disfunción eréctil ligera, moderada y severa recibiendo alprostadil tópico. Fue bien tolerado y se considera un potencial agente para el tratamiento de la disfundón eréctil.
Steidle (2002) publicaron su experiencia con 303 pacientes concluyendo que cuando la crema de alprostadil en dosis de 50,100,200 y 300 microgramos dentro del meato uretral con un aplicador especial (100 mgs en peso, o.l cc en volumen) de se combina con un fadlitador de permeabilidad dérmico podría ser un agente útil para el tratamiento de la disfunción eréctil. Por supuesto falta la prueba en otras circunstancias como por ejemplo posterior a cirugía radical prostática por cáncer entre otras.
Cremas conteniendo nitroglicerina aplicadas sobre el pene tienen poco éxito en lograr erecciones obre todo en casos leves o moderados de disfunción eréctil.
Hay 2 agentes que están siendo evaluados como los geles de Nitroglicerina y soluciones de Minoxidil (Rogaine®) para pacientes con disfunción eréctil. Se aplicó pasta de nitroglicerina al 2% sobre el tronco peneano de pacientes con disfundón erédil, 18 de 26 pacientes estudiados demostraron aumento de la circunferenda peneana.
La soludón al 2% de Minoxidil aplicada al glande aumentando el diámetro peneano y la rigidez del mismo. Sin embargo no se logró una erección plena. Siendo catalogado como fadlitador pero no como productor de erecdón peneana.
Se están utilizando geles de Testosterona tópica (Fortigel ® al 2%, Androgel ® al 1%), en dosis de 5-7 ng/día 1 vez al día en las ingles. Se utiliza cuando la testosterona sérica en menor de 300 mg% o en hombres hipogonadotropicos. Restaura los niveles de testosterona sérica en un 92% de los casos.
Shabsigh (2004) y colaboradores expone un trabajo donde colocaban a los pacientes con hipogonadis-mo y disfundón eréctil en terapia de reemplazo con gel de Testosterona al 1% lo cual convertía a los pacientes que no tenían respuesta al Sildenafil en pacientes con respuesta efediva en dosis de 100 mgs. Se les administraba en dosis de 5 gramos mejorando no solo su capaddad erectiva sino su fundón orgás-mica. Será útil en hombres con bajo nivel sérico de testosterona que ha previamente fallado a la terapia con Sildenafil.
5. ADITAMENTOS DE VACIO PENEANO
La terapia con aparatos que logran vacío peneano es una modalidad no quirúrgica, y bastante segura que produdrá erecciones peneanas. Fue aceptado en la espedalidad desde 1980. El vacío logrado (presión negativa) causará un incremento de sangre hacia los cavernosos peneanos y al colocarse una banda de goma en la base del pene, ésta atrapará dicha sangre en los cuerpos cavernosos e impedirá su drenaje con lo cual se logrará la turgencia y rigidez necesarias para llevar a cabo la penetradón y con ello una relación sexual satisfactoria. Los efedos colaterales son verdaderamente raros (lesiones de fricción en la piel peneana). Produdrá porcentajes de satisfacción entre un 60-80%. En nuestras comunidades latinoamericanas los aditamentos de vacío para lograr erecdones peneanas no ha sido bien acogido, ni es modalidad aceptada de manera natural por ninguno de los dos miembros de la pareja.
Derouet (1999) publica en Andrología un estudio retrospedivo de los resultados del uso de aditamentos de vacío externo para el tratamiento de la disfunción eréctil y sus repercusiones médicas y psicológicas, en 190 parientes utilizando un cuestionario y examen clínico. Un 57.8% respondió el cuestionario, un 20% rechazó el aditamento, un 30.9% lo rechazó luego de haberlo utilizado por 4 meses, otro grupo (7.3%) rechazó el mismo luego de 10.5 meses, un 41.8% lo usaron por largo tiempo, siendo principalmente pacientes que no respondieron a terapia intravenosa. En el grupo que lo uso por largo tiempo 98% de os pacientes estuvieron satisfechos con su uso y 85% de sus parejas también. Las complicaciones fueron hematoma en un 9.8%, daños de la piel un 2.2%, y 69.8% nunca tuvieron problemas. Un 74% de los pacientes que usaron el aditamento de vacío externo tuvieron orgasmos regulares, siendo entonces un procedimiento útil, seguro, y efectivo, con una limitada aceptación primaria y un bajo porcentaje de retiro del mismo en seguimientos a largo plazo.
Otros investigadores que han conseguido ayuda con los aditamentos de vacío peneano son: Marmar (1997), Bosshardt (1995), Katz (1990) y Batad (1995), Sidi (1990). Se recomienda también utilizar precozmente los aditamentos de vado peneano sin la banda de goma constrictora desde un punto de vista fisiológico para forzar pasivamente la oxigenación de los tejidos, basado en su efedo de estiramiento, que se contrapone con el efedo nodvo de la fibrosis cavernosa que causa acortamiento peneano. Además Colombo (2000) sugiere el uso de aditamentos de vado peneano 1 mes después de la drugía tres veces por semana, sin tomar en cuenta las hipótesis que culpan a los aditamentos de vado como originadores de fibrosis.
Raina (2005) describe la experiencia con la combinación de aditamentos de vacío peneano conjuntamente con inhibidores de la 5-fosfodiesterasa, en éste caso especifico, con el Sildenafil, lográndose en 31 pacientes un 77% de mejoría de la rigidez peneana y de la satisfacción sexual a través del cuestionario de función eréctil (IIEF), pudiendo considerarse otra alternativa cuando por si sólo los aditamentos de vacío no han logrado una buena respuesta clínica.
6. PRÓTESIS PENEANAS SEMIRRIGIDAS O INFLABLES
Desde 1970 han sido popularizadas en el mundo entero. Es un procedimiento que se basa en la colocación de dos cilindros (uno dentro de cada cuerpo cavernoso), colocado de manera ambulatoria, con extrema facilidad y cuidándose el cirujano de hacerlo de la manera mas aséptica posible. Tendrán diferentes medidas de acuerdo a la longitud de los cavernosos de cada paciente.
Se utilizan tres tipos de prótesis, la semirigida o prótesis maleable, las prótesis inflables, las prótesis que poseen dentro de su estructura los mecanismos inflables sin recurrir a conexiones extras. Podrían ser colocadas durante el propio acto quirúrgico de la cirugía radical prostática si el paciente demostrara disfundón erédil antes de la cirugía que no haya dado respuestas (siempre en el pre-operatorio) con terapias como inhibidores de la 5-fosfodiesterasa, aditamentos de vado, o terapias intracavemosas, intrauretrales o tópicas. De no ser así, no deberían colocarse antes de los 2 años de evolución postoperatoria para dar oportunidad a que las otras medidas terapéuticas puedan dar resultado.
7. PSICOTERAPIA, TERAPIA CONDUCTUAL, TERAPIA SEXUAL
Se recomiendan sea cual fuere la etiología e intensidad de la disfunción erédil, aplicando técnicas que ayuden a disminuir la ansiedad durante la relación intima que se intente. La pareja femenina es indispensable, ya que aumentaría gradualmente el desarrollo de intimidad y estimuladón
Desde el momento que el padente y su entorno familiar comprenden la gravedad de la situadón en reladón a la pesquisa, diagnostico y tratamiento del cáncer prostático comienza a ocasionar en el padente afectado un severo disturbio emocional caraderizado por stress, angustia, depresión, minusvalía y debilidad ante la inevitable realidad de su enfermedad, que desde antes de someterse a cirugía radical prostática ya comienza muchas veces a tener repercusiones de dichos procesos psicológicos sobre la esfera erediva peneana y sobre la libido. A poste-riori de la cirugía radical, existirán una serie de expedativas por parte del paciente en reladón a su capacidad de continenda urinaria y a su capacidad de erección peneana. En reladón a ésta última habrá una dinámica sexual disfuncional (McCullough,
2001) que se desarrollará en ambos integrantes de la pareja, sobre todo si además el padente presentara perdidas involuntarias de orina. La pareja femenina tendrá también emodones encontradas ya que no sabrá como comportarse en el periodo postoperatorio (sentimiento de protección a su esposo, lo que la apartará del requerimiento sexual y podría esto ser considerado por él como un rechazo y ocasionarle sentimientos de perdida de la autoestima y aumento de su depresión (McCullough, 2001).
Por todo lo que se ha mencionado consideramos importante, desde el momento que estemos en vías de dar con el diagnostico, es dedr, desde que el padente exhibe una elevación del antigeno prostático, pasando por el momento del diagnostico a través de ecosonografía prostática endorredal con la prádi-ca de biopsias prostáticas dirigidas o aleatorias, hasta llegar al momento de la cirugía radical prostática y de su periodo postoperatorio hasta los 2 primeros años de evoludón, darle al padente un apoyo psicológico completo no sólo a través de nuestras charlas, sino también a través de un psicólogo o psiquiatra dedicado a éstas actividades, así como con apoyo de asociadones de pacientes, o grupos de charlas de parientes que han pasado por las mismas circunstancias. Todo esto será de gran importancia para que el paciente recupere su actitud adecuada ante su realidad, tenga mayores reservas emocionales para recuperar en lo posible su adividad sexual y su continencia urinaria y ayude a que todas las otras medidas no quirúrgicas, que se adoptarán en los primeros 2 años de operado, den los mejores resultados posibles.
Guay (2003) de la Asociación Americana de Endocrinólogos clínicos, enfoca con sus colaboradores la disfundón eréctil como un problema de pareja y lo expone en su "Medical Guidelines for Clinical Practice for the evaluation and treatment of male sexual dysfundion: A couple's problem 2003 Update". El propósito es presentar un modelo de dedsión para la evaluadón, tratamiento y seguimiento de parejas con disfunción sexual. Refieren que cuando se enfoca la disfunción eréctil como exdusi-vamente del hombre, se está viendo el problema de manera incompleta, ya que la esposa la sufre con él. En el ddo de respuesta sexual masculinas presentan problemas como disminudón de la libido o eyacu-lación precoz que disminuirán también la gratifi-cadón de la pareja afectada. Problema de la pareja en sí, así como deterioro de la relación de pareja propiamente hablando, en los aspectos generales e íntimos, afectarán sin duda los resultados finales sobre el hombre estudiado. Guay menciona que la disfunción erédil deberá ser vista apropiadamente como una enfermedad crónica con componentes médicos, psicológicos y conduduales que no deberá ser tratada de una manera simple. Ambos integrantes de la pareja deberán ser partidpantes activos y comprometidos en el logro de la mejoría de la función sexual del hombre y en consecuenda de la felicidad final de la pareja.
Schover (1999) del M.D Anderson de Houston-Texas publicó en la revista Urology que tipos de consejos se le debían dar al paciente y su entorno familiar acerca de los cambios que posiblemente iba a tener en su fundón sexual. Era importante conocer la rutina de su calidad de vida con cuestionarios que nos den detalles de la misma como el CARES (Ganz 1992) (cáncer Rehabiltation and Evaluation System), que induye aspectos de su función sexual y de su grado de gratificadón al respecto, que podría llevarse a las relaciones maritales. Tenemos también el FACT (Fundional Assessment of cáncer Therapy) que tiene la ventaja de que es corto y disponible en una versión general y en versiones sitios-específicos que nos proveen informadón de síntomas de la esfera sexual mas detalladamente (Celia, 1996). Reanimar al paciente a que reasuma su adividad sexual durante y después de su tratamiento es otra misión del urólogo o del grupo médico que atiende al paciente. Minimizar los miedos inherentes a su actuación sexual. Manifestarle la necesidad de hablar abiertamente de asuntos sexuales con la pareja.
PAPEL DEL CONYUGE EN LA REHABILITACIÓN EXITOSA DE LA SEXUALIDAD DEL HOMBRE OPERADO
Es muy importante que tengamos presente que siempre que hablemos con el paciente para crear un clima propido para su pronta récupération eréctil en el periodo posterior a la drugía radical prostática, y que esté presente la pareja del padente, ya que será un fador muy importante dentro de la récupération de la actividad erédil con entusiasmo, afecto, proactiva en lo referente a terapias intimas, estimulo precoz, alternativas sexuales que fortifiquen la autoestima del padente y sobre todo que ayude a crear un clima propicio, seguro y sereno que le dé al hombre una gran seguridad para su verdadera y pronta recuperación. Hemos visto con frecuencia que haciendo el mismo tipo de cirugía radical, dando el mismo tipo de terapia precoz para la recuperación de la actividad eréctil, la actitud de la mujer es la que ha significado el obtener o no resultados positivos en su pareja operado, a corto, mediano y largo plazo.
Montorsi (2004) menciona en su trabajo sobre la respuesta de la mujer al tratamiento de la disfunción eréctil de su pareja, en el caso particular con sildenafil, que es importante tomarla en cuenta ya que nos confirmará los resultados en él obtenidos y pudiera ser de gran ayuda para lo que se quiere obtener. Seftel analizando el artículo refiere que siempre que sea posible habrá que incluir a la mujer en el seguimiento de los logros obtenidos en referencia a la disfundón sexual del hombre.
Las aditudes de la mujer en cuanto a su pareja operada de cirugía radical prostática es bastante compleja y de gran trascendencia en la recuperabili-dad de la fundón erediva del hombre operado. En muchas ocasiones se tiene una pareja "cansada de tener reladones íntimas" que ve la drugía como un argumento para finalizar dicha actividad. Otras mujeres ven en las relaciones una actividad "peligrosa" para la salud de su pareja y que puede llevarlo a complicaciones no deseadas. Algunas atraviesan por periodos depresivos concomitantes con su etapa menopáusica y por supuesto las relaciones sexuales no entran dentro de sus prioridades. Otras mujeres tienen sentimientos de "lastima" y "compadecimiento" de su esposo operado, siendo esto "nefastos" para todo tipo de hombres, operados o no operados de cirugía radical. Se convierte en una aditud que lleva al hombre a un sentimiento de frustración que involucra un mal desempeño sexual.
En definitiva son variadas las respuestas que la mujer puede tener y algunas de ellas podrían ocasionar un efedo negativo "castrante" sobre la sexualidad del paciente operado. Por lo cual creemos trascendente la actitud y aptitud de la mujer en la recuperabilidad de la función sexual postcirugía radical prostática.
8. EJERCICIOS DE KEGEL (Fisioterapia del Piso Pélvico Muscular) con o sin electroestimuladón, con o sin Biofeedback
Los Ejerdcios de Kegel incrementarán el tono y la fortaleza de la musculatura pubococdgea. Debido a que estos músculos están involucrados en el orgasmo y la eyaculación cuando se realizan los Ejercidos de Kegel rutinariamente por un tiempo prolongado ayudará a corregir problemas urinarios de inconti-nenda urinaria o de hiperadividad vesical y problemas reladonados con la esfera sexual que usualmente van dirigidos a problemas de eyaculación precoz. Para éste tipo de patología sin duda alguna deberán ser considerados como tratamiento de primera línea.
Sin embargo la rehabilitación del piso pélvico muscular luego de una drugía radical prostática es parte del proceso de rehabilitadón del padente en general. Recordemos que sin duda alguna la drugía radical de próstata alterará la dinámica muscular del área pélvica y por lo tanto su re-fortalecimiento ayudará significativamente en el restabledmiento de la fundón de continenda urinaria, de la función defecatoria y por supuesto en la rehabilitación de la función sexual, ya que de base la fisiología de la erecdón es un proceso neurohormonal complejo con la ayuda de toda la musculatura pélvica entre la cual destaca la pubococcigea y así como ya es rutina rehabilitar dicha musculatura en casos de síndromes de prostatitis crónica, no se debe tener rechazo por utilizarla en casos de disfunción eréctil posterior a cirugía radical prostática. Cierto es que ha sido un tema muy controversial en la cual numerosos investigadores se han mostrado reticentes en aceptar ésta forma de rehabilitadón, pero sin embargo su seguridad, su facilidad de aplicadón y sobre todo su inocuidad hace que pueda ser implementado al momento de retirar la sonda uretrovesical posterior al tratamiento. En todas las consultas urológicas se mandan los ejerdcios de Kegel para que el padente tenga más con-tinenda urinaria luego de la prostatedomia radical, pero se debe tener en mente que podría también estar rehabilitando la fundón sexual usualmente deteriorada.
En Medscape Urology 5(1), 2003, podemos leer el comentario del Dr. Sharlip de la Universidad de
California a la pregunta de si son útiles los ejerddos de Kegel en disfunción erédil causados por fuga venosa, respondiendo que no tienen eficada en casos de disfunción eréctil causados por enfermedad oclusiva corporovenosa. Refiere que no hay evidendas que los Ejercidos de Kegel produzcan cambios fisiológicos duraderos que podrían secundariamente mejorar la función eréctil. La fuga venosa es casi siempre manifestación de otra causa subyacente como insuficiencia arterial cavernosa o fibrosis cavernosa. Manifiesta que mejor es intentar con inhibidores de la 5-fosfodiesterasa o terapia intracavernosa, o intrauretral con Alprostadil o aditamentos de vacío.
Deberán realizarse diariamente para obtener mejores y más duraderos resultados. Los resultados de la ejercitación diaria (varias veces al día) se podrán notar en un lapso de aprox 2 a 3 semanas. Es importante reconocer los músculos pubococcigeos los cuales los podremos reconocer al detener el chorro urinario en plena micdón, lo cual hará que hagamos condencia del grupo muscular involucrado y de allí en adelante podremos ejerdtarlo sin estar orinando. Los ejercidos los podremos realizar varias veces al día en las circunstancias mas variadas. Los ejercidos de Kegel lograr erecdones mas fuertes, orgasmos mas intensos, un incremento en la capacidad eyacu-latoria y un riesgo disminuidos de disfunción erédil.
El ejerdcio se hará contrayendo la musculatura pubococdgea por 10 segundos, posteriormente relajar también por 10 segundos y volver a empezar. Hacerlo por periodos de 5 a 15 minutos varias veces al día. Comenzar los ejercidos antes de la cirugía radical prostática.
Los ejerdcios de Kegel conocidos desde la década de los años 40, son aplicados a personas, sean varones o hembras, que presenten perdidas involuntarias de orina con o sin debilidad del piso pélvico muscular, o en situadones donde haya disfuncionalidad de dicho piso pélvico, o en pacientes que deban reeducar su musculatura del piso pelviano, o en parientes con hiperactividad vesical o en pacientes femeninas con incontinencia urinaria posparto.
Pero también es un aliado útil para hombres con disfundón eréctil. La técnica consiste en contraer y relajar periódicamente los músculos involucrados en el control de la micción, en sesiones de 10 a 15 minutos 2 a 4 veces por día durante 16 a 20 semanas.
Si queremos llevar la Fisioterapia del piso pélvico a un ritmo mas rápido podríamos aplicar electroes-timuladón del piso pélvico con unidades ambulatorias o con unidades de consultorio con eledrodos anales, por periodos de 10 minutos dos veces por día por 16 a 20 semanas. Dorey menciona también la utilidad de los ejercidos de Kegel para fortalecer el piso pélvico muscular en pacientes con disfundón eréctil. Menciona que debe ser considerado un tratamiento de primera línea.
9. MEDICINA ALTERNATIVA O COMPLEMENTARIA
Mediana alternativa representada por fármacos a base de hierbas como la Gingko biloba, Tribulus te-rrestris, combinación de agentes herbarios (Tentex forte®), Yohimbina, L-Arginina, que tendrán eficacia alrededor del 10 al 30%, con un promedio de efectividad de un 25%, tanto por sus efectos reales como por su efedo placebo, sobre el paciente operado de cirugía radical prostática.
Moyad (2002,2004) en el Contemporary Urology Aug 2003, donde en conjunto con otros excelentes médicos como Lúe, Goldstein, Mulhall entre otros recomiendan conocer bien los efedos de algunos fito-farmacos representantes de la mediana alternativa hacia la disfundón erédil, ya que algunos dan efectos benefidosos pero otros son de dudosa utilidad y algunos son inclusive peligrosos.
Debemos estar pendientes de que el padente no esté tomando medicamentos alternativos con fitoes-trogenos ya que Srilatha reveló los efectos negativos que pueden causar los tratamientos con estrógenos y fitoestrogenos en predisponer la disfundón erédil por cambios fisiopatologicos en los receptores que median en la fundón eréctil (ER-alfa y ER-beta).
TODO LO QUE DE ALGUNA MANERA, MEJORE EL ENTUSIASMO, VITALIDAD Y LAS GANAS DE TENER RELACIONES ÍNTIMAS EN EL PACIENTE OPERADO, DEBERÁ SER UTILIZADO POR EL URÓLOGO O GRUPO TRATANTE. NO DEBEMOS CERRARNOS A NINGÚN ARGUMENTO TERAPÉUTICO SE A FARMACOLÓGICAMENTE VÁLIDO O DENTRO DE LA DENOMINADA MEDICINA ALTERNATIVA O COMPLEMENTARIA. NUESTRA FLEXIBILIDAD EN EL ENFOQUE TERAPÉUTICO DISMINUIRÁ EL GRADO DE FRUSTACIÓN DE NUESTROS PACIENTES. NO DEBEMOS DESCARTAR EL "EFECTO PLACEBO" DE LOS MEDICAMENTOS FITOTERAPÉUTICOS EN LA OBTENCIÓN DE ERECCIONES PENEANAS.
Aminoácido esendal y precursor del oxido nítrico que sabemos es el inductor de la relajadón del músculo liso de los cuerpos cavernosos para obtener una erecdón peneana. Goldstein menciona un estudio donde se compara la administradón de L-Arginina y placebo en pacientes con disfunción erédil, lográndose en el grupo que se le administró L-Arginina restaurar la función eréctil en 6 de 15 pacientes, siendo parientes jóvenes y con una mejor función arterial.
Moyad (2002,2004), confirma en un estudio comparativo que la L-Arginina (2.800 mg/día) versus grupo placebo por 2 semanas mejoraba las erecciones en 40% de los hombres. Los que respondieron a la terapia presentaban una mejor función vascular que los no-respondedores.
Klotz (1999) en otro estudio con dosis de 1.500 mg/día no se pudo demostrar mejoría en la función erectiva comparándola con placebo en disfunción eréctiles mixtas.
En un tercer estudio Chen (1999) selecciona 50 pacientes que recibieron L-Arginina 5 gramos día o placebo por 6 semanas para disfunción erédil orgánica (diabéticos o etiología arteriogenica), 31% de los hombres reportaron beneficio versus 12% del grupo placebo.
La L-Arginina mejora ciertos tipos de disfunción eréctil por su efedo sobre la función endotelial vascular (Melman, 1997) (Zorgniotti, 1994).
La podremos encontrar en forma natural en legumbres, granos completos, nueces.
Proveniente de la corteza de un árbol que se consigue en Africa y en India. Es un antagonista alfa-2 adrenergico con efectos centrales y periféricos. Considerado por mucho tiempo como un afrodisíaco su efedo sobre pacientes con disfunción eréctil. Ha sido comprobada la presencia de receptores adrenergicos alfa-2 sobre nervios no adrenergicos que produdrá un aumento en el flujo sanguíneo dentro de los tejidos erectivos. La administración de yohimbina producirá un incremento en los niveles centrales de norepinefrina, al bloquear los receptores alfa-2 adrenergicos. Tendrá solamente un efecto marginal sobre pacientes con disfundón eréctil orgánica.
Goldstein (1996) refiere que hubo un 43% de mejoría en las erecdones peneanas. Actúa sobre el sistema nervioso e incrementando la libido masculina. Por numerosos médicos es considerado homeopático. Es segura y solamente puede tener algunos efectos colaterales como ligero mareo, nerviosismo, irritabilidad, cefaleas y nausea. Se sabe que podría dar resultados luego de 2 meses de tratamiento en aprox. 10-20% de los casos. Para casos de disfunción eréctil posterior a cirugía radical prostática por cáncer, la Yohimbina prácticamente no tiene efectos positivos. Ocasiona efectos colaterales como palpitación, temblor fino, elevación de la presión sanguínea, ansiedad.
Guay (2002) del Centro de Disfunción Sexual de la Lahey Clinic en Peabody, Massachussets, ha tenido efectos cuestionables sobre la disfunción eréctil orgánica. Se midió la tumescenda nodurna peneana con monitopr de RigiScan, perfil hormonal, respuestas al Cuestionario Florida Sexual Health y respuestas clínicas después de dos dosis de Yohimbina en 18 hombres no fumadores con disfunción eréctil. Nueve de ellos (50%) tuvieron resultados exitosos completando su relación sexual en más del 75% de sus intentos. Ellos tenían menor severidad de su disfunción erédil manifestados por el test del RigiScan y por los altos scores del Test de Salud Sexual de Florida y mayores niveles de testosterona sérica. Conduye refiriendo que la Yohimbina es una terapia efectiva para tratar la disfundón erédil orgánica. Conclusión controversial en base al resultado de otros investigadores como Ernst (1998), Rowland (1997), Vogt (1997), Kunelius (1997), Montorsi (1994).
c. GINSENG ROJO COREANO (Panax ginseng)
Utilizado inicialmente como tratamiento para los síndromes climatéricos, puede mejorar las anomalías vasculares endoteliales en pacientes hipertensos al aumentar las concentradones de oxido nítrico (Sung 2000). Tiene además efedos inhibitorios sobre la retoma de ácido gamma-aminobutirico, glutamato, dioamia y otros neurotransmisores,
Choi (1998) en su trabajo de investigación obtuvo sobre el músculo liso de los cuerpos cavernosos del conejo una relajación dosis-dependiente al aumentar la secreción de oxido nítrico y aumentar el caldo intracelular. El mismo Choi demostraría que el ginseng rojo coreano no cambia la frecuencia coital, ni los patrones de eyaculadón precoz ni las erecciones matutinas, pero si favorece la rigidez peneana, la libido y la satisfacdón del padente. Alrededor del 60% de los parientes tuvieron un beneficio terapéutico comparado con 30% del grupo placebo, que merece éste último el comentario de que el efedo placebo también condiciona al paciente a tener mejores actuaciones en su esfera sexual. Además el Ginseng rojo coreano reducirá la fatiga, insomnio y depresión. Se da en dosis de 900 mgs tres veces al día.
d. GINKGO BILOBA
Al mejorar la perfusión vascular es utilizada en patologías como Demencia con insuficiencia crónica cerebrovascular. Sikora (1989,1998) realiza un estudio sobre 60 pacientes que no respondían a las inyecciones intracavemosas de papaverina y le daba Ginkgo biloba 60 mgs día por 12 a 18 meses. Se demostró mejoría de la perfusión sanguínea con ecosonografia+doppler luego de 6 a8 semanas y luego de 6 meses el 50% de los parientes habían read-quirido su función erédil. En los que no se obtuvieron buenos resultados la papaverina intracavernosa había readquirido su eficacia dínica. Mejora la función sexual en todas sus fases.
En 1989 Sikora mendona la utilidad de la Ginkgo biloba en el tratamiento de la disfunción erédil, obteniéndose resultados alentadores.
e. TRIBULUS TERRESTRIS
Planta que contiene compuestos con actividades tipo esteroidea o saponina-esteroidea. Tiene un compuesto denominado protodioscin que en dertas circunstancias se transforma en DHEA, el cual mejora la función eréctil (Acrasoy, 1998, Adaikan, 2000). Aumenta los niveles de androstenediona o estradiol cuando se combina con otros productos tipo DHEA. Se da en dosis de 2 cápsulas dos a tres veces por día.
f. DAMIANA (turntera difusa)
En combinación con otros productos naturales ha demostrado resultados promisorios.
g. COMBINACION DE HIERBAS PRO-ERECTIVAS PENEANAS (Tentex Forte®)
Podría mejorar la erección e incrementar el deseo sexual, siendo un producto no hormonal. Está contraindicado en hipertensión arterial, arteriosclerosis avanzada, enfermedades renales y fallas cardíacas. Se dosifica 2 grageas cada 12 horas por periodos de 1 a 2 meses alternado con periodos de descanso.
10. OTRAS ALTERNATIVAS
Acupuntura y la Hipnosis. La acupuntura utilizada en China por más de 2.500 años. Se está probando su utilidad en disfunciones erectiles psicógenas, resultando según los pacientes en "buenos resultados" (Moyad, 2002).
11. CONSERVAR UNA SALUD INTEGRAL
Se recomienda a los pacientes afectados de disfunción eréctil que adopte los mismos hábitos de vida de un paciente en riesgo de enfermedad coronaria, lo que significa dieta rica en frutas, vegetales, granos (fibra), dieta baja en grasas animales y baja en sodio. Moderación en los hábitos alcohólicos y abandonar el habito tabaquico, y con un programa de ejercicios físicos varias veces por semana. No hay duda que el ejercicio regular ayudará a evitar la disfunción eréctil. Moyad-Goldstein (2004), Goldstein (2000) de la Escuela de Medicina de la Universidad de Boston en un estudio de investigación publicado en Urology, sobre 600 hombres enfocados en su estilo de vida (hábitos tabaquicos, ingesta alcohólica, inactividad y obesidad) demostró que hombres que gastaban al menos 200 calorías al día a través de ejercicios, tenían menos probabilidad de volverse impotentes.
12. ELIMINAR MEDICACIONES QUE PUEDAN PRODUCIR DISFUNCIÓN ERÉCTIL
Medicamentos antidepresivos y psicoactivos como amitriptilina, buspirona clordiazepoxido, clorazepato, desipramina, diazepam, doxepin, fluoxetine, imipramina, lorazepam, meprobamato, nor-triptilina, oxazepam, fenelzine, fenintoina, tranil-cipromina. Medicaciones antihistaminicas como el dimenhidrinato, difenhidramina, hidroxizina, meclizine, prometazina, betanidina, clorotiazida, clortalidona. Medicaciones antihipertensivas clonidina, enalapril, metildopa, fenoxibenzamina, espironolactona, reserpina, propranolol, prazosin, triamterene, guanabenz, guanetidina, guanfacina, hidralazina, hidroclorotia-zida, labetalol, metoprolol, minoxidil. Medicaciones antiparkinsonianas como el benztropina, biperiden, bromocriptina, levodopa, prociclidina, trihexifenidil. Medicaciones quimioterapicas como el busulfan y la ciclofosfamida. Medicaciones relajantes musculares como la ciclobenzaprina, y la orfenadrina. Medicaciones tranquilizantes como la clorpromazina, fentanil, flufenazina, haloperidol, mesoridazina, pro-clorperazina, promazina, tioridazina, triotixene, tri-fluoperazina. Medicaciones variadas como ácido aminocaproico, atropina, cimetidina, clofibrato, ciproterona, digoxina, disopiramida,estrogenos, furazolidona, indometacina, licoricia, metocloprami-da, fenoxibenzamina, ranitidina, espironolactona, verapamil. Sustancias cuyo abuso producirá disfunción eréctil bebidas alcohólicas, anfetaminas, barbi-tuicos, cocaína, marihuana, metadona, narcóticos, nicotina, opiáceos.
13. REEMPLAZO HORMONAL
Siempre que se demuestren deficiencias en los niveles de testosterona sérica deberían administrarse suplementos de testosterona, por parte del internista-andrólogo del caso.
14. INJERTO DE NERVIO CAVERNOSO DURANTE PROSTATECTOMÍA RADICAL
Anastasiadi (2003) y colaboradores del Departamento de Urología del Colegio de Médico y Cirujanos de la Universidad de Columbia en Nueva York refieren su experiencia a través de 12 casos de injerto nervioso durante 10 prostatectomias radicales y 2 dstoprostatectomia radicales también, las cuales necesitaron de amplia resecdón local y del sacrificio de uno o ambos haces neurovasculares para poder lograr un margen quirúrgico negativo, lo cual de manera inequívoca va a dar como resultado disfunción eréctil. Se hizo injerto de nervio sural con técnicas microquirurgicas utilizando en el postoperatorio
o Sildenafil o alprostadil hasta el retorno de función eréctil espontánea, documentada por score de mas de 20 puntos en la función eréctil (EF), en el índice Internacional de Función erédil (IIEF). Es un procedimiento posible y seguro, con mínima morbilidad, Sin embargo debido a que se tiene que realizar en parientes con estadios avanzados de la enfermedad, usualmente necesitan de tratamientos adidonales que podrían comprometer aun mas la fundón eréctil del padente (terapia de bloqueo antiandrogenico, radioterapia).
Igualmente Chang (2003) de la Universidad de Texas tuvo experiencia con 30 pacientes demostrándose en el 60% (18 pacientes) objetivas y subjetivas evidencias de actividad eréctil espontánea. Concluyendo que los inhertos con nervio sural autologo después de cirugía radical prostática sin preservación de haces neurovasculares es efectiva para mantener la actividad eréctil espontánea y a su vez permitir que se optimice el control local de la enfermedad tumoral.
15. FARMACOTERAPIA BAJO INVESTIGACIÓN
En un excelente trabajo aparecido en Diciembre 2002, Nehra (2003) y Nehra-Kulaksizoglu (2002) del Departamento de Urología de la clínica Mayo en Rochester, Minnesota, mencionan que la terapia combinada será el futuro de la terapéutica de la disfunción eréctil, debido a que la erección peneana depende de numerosos factores como estímulos visuales, olfativos, imaginativos, y táctiles iniciados en el cerebro y en la periferia y que las respuestas a estos estímulos son mediadas por vías eferentes autonómicas en la medula sacra y llevados a su destino por nervios peneanos y cavernosos.
Refieren que los inhibidores de la 5-fosfodiesterasa no funcionan bien cuando los haces neurovasculares son lesionados, porque el oxido nítrico que se secreta de las terminaciones de los nervios cavernosos necesaria para la inhibición de la 5-fosfodiesterasa no puede ser introducida dentro de los cuerpos cavernosos para comenzar la formación de cGMP (guanosina monofosfato cíclico) por la guanilato dclasa. (GC)
Sin embargo si el cGMP puede ser producido intracavernosamente por fármacos que estimulen la guanilato ciclasa (GC) sin necesitar la presenda de las terminaciones nerviosas que produzcan óxido nítrico (NO), entonces la relajadón de la musculatura lisa cavernosa y por ende la erecdón podría ocurrir.
Kalsi y colaboradores (2002) indican que el BAY-41-2272, un adivador soluble de la dclasa guanilato podría causar relajadón de la musculatura lisa de los cuerpos cavernosos en el conejo, lo cual abre un campo interesante ya que los adivadores de la guanilato cidasa (GC) no solo podrían inducir tumescenda en los cuerpos cavernosos carentes de oxido nítrico pero también ser efectivo en la mayoría de casos con disfundón eréctil.
La empresa Guilford Pharmaceuticals reportó resultados satisfadorios con la Neuroinmunofilina GPI 1485, Marshall (2004) del Departamento de Neurología del Instituto de Ciendas neurológicas en Glasgow, la cual está bajo intensas investigadones y desarrollo por su potendal efecto sobre el tratamiento de la disfunción eréctil siguiendo a cirugía radical prostática con daño neurológico, así como para la Enfermedad de Parkinson. En agosto 2002 los trabajos Fase II investigando la GPI-1485 comenzaron en la búsqueda de su utilidad en la enfermedad de Parkinson y en Noviembre 2003 las investigaciones Fase II comenzaron en pacientes con disfunción eréctil posterior a drugía radical, donde ha demostrado poseer un sustancial efecto neuroprotedor y neurore-generativo. Se administran oralmente regenerando y protegiendo los nervios periféricos y centrales.
MODELO DE DECISIÓN DE DISFUNCIÓN ERÉCTIL POSTERIOR A CIRUGÍA RADICAL PROSTÁTICA POR CÁNCER
Criterio de Lue (UCSF-U.S.A) modificado por Potenziani (2002)
Comenzar inmediatamente en el periodo postoperatorio inmediato, al momento de la extracdón de la sonda en el periodo postoperatorio inmediato (a los 14 días de operado). Es importante aplicar los índices Internationales de Fundón eréctil (IIEF) para evaluar la eficacia de cada paso o etapa aplicada en éstos pacientes (ver índice al final)
Fundamental
1. COMENZAR CON TERAPIAS INTRACAVER-NOSAS CON ALPROSTADIL, TRIMIX. CON O SIN EL AÑADIDO DE TERAPIA ORAL CON INHIBIDORES DE LA 5-FOSFODIESTERASA.
1 ampolla intracavernosa 2 a 3 veces por semana intracavernosa, adarándole al paciente que lo que deseamos lograr no es sólo una erección sino un tumescenda en grados variables que nos reoxigenen adecuadamente las trabeculas de musculatura lisa del tejido cavernoso y con ello nos ayuden a que la recuperación erediva sea lo mas pronto posible.
En nuestros parientes unimos dos inyecdones a la semana de Alprostadil con 3 a 7 días a la semana de ingestión de medicamentos inhibidores de la 5-fosfodiesterasa en dosis de 50mgs de Sildenafil ó 10 mgs de Vardenafil ó 10 mgs de Tadalafil. Y si no lo asociamos con terapia intracavernosa 2 a 3 veces por semana, se dan dosis máximas de inhibidores de la 5-fosfodiesteresa, es decir 100 mgs de sildenafil, o 20 mgs de vardenafil o 20 mgs de tadalafil.
Debemos aclarar que si la respuesta al Alprostadil intracavernoso es intensa (es decir positiva), se deberá dejar a 1 vez a la semana o pasar a terapia oral 3 a 4 veces por semana con inhibidores de la fosfodi-esterasa.
EN LO PAÍSES LATINOAMERICANOS, ASÍ COMO EN MENOR GRADO EN LOS PAÍSES ANGLOSAJONES, LAS TERAPIAS DE INYECCIÓN INTRACAVERNOSA NO SON USUALMENTE BIEN RECIBIDAS NI POR EL PACIENTE NI POR SU PAREJA, SIN EMBARGO NO DEJAN DE SER "IDEALES" PARA LA ESTIMULACIÓN DIRECTA DE LOS EFECTOS RELAJANTES EN LA MUSCULATURA LISA DEL TEJIDO CAVERNOSO, POR LO CUAL HABRÍA QUE INSISTIR AL MENOS DURANTE LOS PRIMEROS TRES MESES DEL POSTOPERATORIO INMEDIATO, PARA QUE DESPUÉS PASEMOS A TRATAMIENTOS VÍA ORAL CON TODA UNA SERIE DE FÁRMACOS QUE NOS AYUDARÁN EN RECUPERAR LA SALUD SEXUAL DE LOS PACIENTES OPERADOS, SIEMPRE Y CUANDO HAYAN SIDO PRESERVADOS LOS HACES NEUROVASCULARES DE LA ERECCIÓN.
2. INHIBIDORES DE LA 5-FOSFODIESTERA (Vardenafil, Tadalafil, Sildenafil).
3. ELIMINACION DE FARMACOS NOCIVOS PARA LA ERECCION.
Medicamentos antíhístamínícos
Dimenhidrinato.
Difenhidr amina.
Hidroxizina.
Meclizina.
Prometazina.
Medicamentos antidepresivos y psicoactivos
Lorazepam.
Clordiazepoxido.
Buspirona.
Clorazepato.
Fenintoina
Tranidpromina.
Fenelzina.
Amitriptilina.
Desipramina.
Diazepam.
Doxepin.
Fluoxetine.
Imipramina.
Meprobamato.
Nortriptilina.
Oxazepam.
Medicamentos antihipertensivos y diuréticos Guanabenz.
Guanetidina.
Hidrodorotiazida.
Alfa-Metildopa.
Metroprolol.
Minoxidil.
Fenoxibenz amina.
Fentolamina.
Clorotiazida.
Clortalidona.
Clonidina.
Betanidine.
Enalapril.
Hidralazina.
Prazosin.
Propranolol.
Reserpina.
Espironoladona.
Triamterene.
Medicamentos quimioterapéuticas Ciclofosfamida.
Busulfan.
Medicamentos relajantes musculares Cidobenzaprina.
Orfenadrina.
Medicamentos tranquilizantes Tioridazina.
Clorpromazina.
Promazina.
Fentanil.
Trifluoperazina.
Flufenazina.
Haloperidol.
Mesoridazina.
Prodorperazina.
Tiotixene.
Medicamentos variados
Barbitúricos.
áddo aminocaproico.
Cimetidina.
Acetato de Ciproterona. Digoxina.
Estrógenos.
Narcóticos.
Furazolidona.
Indometadna.
Licoricia.
Metodopramida.
Ranitidina.
Espironolactona.
Verapamil.
Clofibrato.
Anfetaminas.
Metadona.
Atropina.
Opiáceos.
Disopiramida.
Sustancias Nocivas para la erección
Nicotina (tabaco).
Bebidas alcohólicas.
Marihuana.
Cocaína.
4) MANTENER RECOMENDACIONES EN HÁBITOS, ALIMENTACIÓN Y EJERCICIOS
5) MEDICINA ALTERNATIVA (Fármacos Fitotera-picos únicos o en mezclas para estimuladón del deseo sexual, por ejemplo Gingko biloba, Ginseng rojo coreano, tribulus terrestris, Tentex forte, entre otros)
6) PSICOTERAPIA DE APOYO + TERAPIA SEXUAL al paciente + PAPEL DEL CÓNYUGE EN LA REHABILITACIÓN EXITOSA DEL PACIENTE OPERADO
7) EJERCICIOS DE KEGEL (Fisioterapia del piso pélvico muscular) CON O SIN ELECTROESTIMULACIÓN CON O SIN BIOFEEDBACK
8) REEMPLAZO HORMONAL SI FUERA NECESARIO
9) TRATAMIENTO INTRAURETRAL CON PROS-TAGLANDINAS E-l (Muse®)
10) ADITAMENTOS DE ERECCIÓN PENEANA POR VACÍO
11) COLOCACIÓN DE PRÓTESIS PENEANA
12) CIRUGÍA VASCULAR
Abosall, S et al. Role of penile vascular injury in erectile dysfunction after radical prostatectomy. British Journal of Urology. 73: 75-82, 1994.
Aboseif S, Shinohara K, Breza J et al. Role of penile vascular injury in erectile dysfunction after radical prostatectomy. Br J Urol 73: 75-82, 1994.
Acrasoy HB, Erenmemisoglu A, Tekol Y. Effect of Tribulus terrestris. L Saponin mixture on some smooth muscle preparations: a preliminary study. Boll Chim Farm 137(11): 473-475, 1998.
Acuña Cañas Alonso. Guias de Practica clínica (GPC) Sociedad Colombiana de Urología disfunción eréctil. Urología Panamericana 13(1): 26-29. Enero-Marzo
2001.
Adaikan PG, Gauthaman K, Prasad RN, Ng SC. Proerectile pharmacological effects of Tríbulus terrestris extract on the rabbit corpus cavernosum. Ann Acad Med Singapore 29(1): 22-26, 2000.
Althof SE. Quality of Life and Erectile Dysfuntion. Urology 59(6): 803-810, 2002.
Althof SE. EDITS: development of questionnaires for evaluating satisfaction with treatments for erectile dysfunction. Urology 53: 793-799, 1999.
Althof SE. When an erection alone is not enough: biopsychosocial obstacles to lovemaking. Int J Impot Res 14 (Suppl 1): S99-S104, Feb 2002.
Anastasiadis AG, Benson MC, Rosenwasser MP, Salomon L, El-Rashidy H, Ghafar MA, McKiernan JM, Burchardt M, Shabsigh R. Cavernous nerve graft reconstruction during radical prostatectomy or radical cystectomy: safe and technically feasible. Prostate Cancer and Prostatic Diseases 6: 56-60, 2003.
Andersson KE.Erectile physiological and pathophysiological pathways involved in erectile dysfunction. J Urol. 170(2 Pt 2): S6-13, Aug 2003, discussion S13-4.
ARHP (Association of Reproductive Health Professionals. Sexual Activity Survey. Washington, D.C. April 1999) (http://www.arhp.org).
Aytac IA, McKinlay JB, Krane RI. The likely worldwide increase of erectile dysfunction between 1995 and 2025 and some possible policy consequences. BJU Int. 84:50-56, 1999.
Ball RA, Lipton SA, Dreyer EB. Entubularization repair of severed cavernous nerves in the rat resulting in return of erectile function. J Urol 148: 211-215, 1992.
Bahnson RR, Catalona WJ. Complications of radical retropubic prostatectomy Ch 29: 386-394 in Complications of Urologic Surgery. Prevention and Management Smith RB, Ehrlich RM . WB Saunders Co, 1990.
Bancroft J, Munoz M, Beard M, Shapiro C. The effects of a new alpha-2 adrenoceptor antagonist on sleep and nocturnal penile tumescence in normal male volunteers and men with erectile dysfunction. Psychosom Med. 57(4): 345-356, Jul-Aug 1995.
Baniel J, Israilov S, Segenreich E, Livne PM. Comparative evaluation of treatments for erectile dysfunction in patients with prostate cancer after radical retropubic prostatectomy. BJU Int. 88(1): 58-62, Jul 2001.
Barclay L. Medscape Medical News Vardenafil Improves Erectile Function After Prostatectomy 10th World Congress of the ISSIR. Sept 2002.
Bataci S. Treating erectile dysfunction with a vacuum tumescence device: a retrospective analysis of acceptance and satisfaction. British Journal of Urology. 76: 757, 1995.
Battiston B et al. Nerve repair by means of vein filled with muscle grafts I. Clin result. Microsur 20: 32-36,
2000.
Berman JR. Sexual dysfunction helping the couple recommence a sexual relationship alter pregnancy, illness or surgery. Instructional course AUA Annual meeting San Francisco, 2004.
Bochinski DJ, Lue TF. The evolution in treatments for erectile dysfunction. Family Urol 9(1): 16-19, Spring 2004.
Bodie J, Lewis J, Schow D, Manoj Monga. Laboratory evaluations of erectile dysfunction: an evidence based approach. J Urol March 2262-2264, 2003.
Bosshardt BJ. Objective measurement of the effectiveness, therapeutic success and dynamic mechanisms of the vacuum erection device. British Journal of Urology. 75:786, 1995.
Braun M, Sommer F, Lehmacher W, Raible A, Bondarenko B, Engelmann U. Erectile dysfunction. Are interdisciplinary diagnosis and therapy necessary? Dtsch Med Wochenschr. 23;129(4): 131-136, Jan 2004.
Braun M, Wassmer G, Klotz T, Reinferath B, Mathers M, Engleman V. Epidemiology of erectile dysfunction: results of the "Colgne Male Survey" International Journal of Impotente Research 12: 305-311, 2000.
Braun MH, Sommer F, Haupt G, Mathers MJ, Reifenrath B, Engelmann UH. Lower urinary tract symptoms and erectile dysfunction: co-morbidity or typical "Aging Male" symptoms? Results of the "Cologne Male Survey" Eur Urol. 44(5): 588-594, Nov 2003.
Breza J. Detailed anatomy of penile neurovascular structures: surgical significance. J Urol, 141: 437-443,1989.
Brock G, Nehra A, Lipshultz L, et al. Influence of Vardenafil on erectile dysfunction and depressive symptoms post radical prostatectomy. To be presented at the 10th World Congress of the International Society for Sexual and Impotence Research, September 24, 2002, Montreal, Quebec, Canada.
Brock G, Nehra A, Lipshultz L, Gleave M, Seger M, Padma-Nathan H, for the Vardenafil Study Group . Influence of Vardenafil on Erectile Dysfunction and Depressive Symptoms Post Radical Prostatectomy. Int. J. Imp. Res. 14 Suppl 3: S97, 2002.
Brock G, Taylor T, Seger M. Efficacy and tolerability of Vardenafil in men with erectile dysfunction following radical prostatectomy (abstract # 598) European Urology Supplements 1(1):152, 2002.
Brock G, Nehra A, Lipshultz LI, Karlin GS, Gleave M, Seger M, Padma-Nathan H. Safety and efficacy of vardenafil for the treatment of men with erectile dysfunction after radical retropubic prostatectomy. J Uroll70 (4 Pt 1): 1278-1283, Oct 2003.
Brock G, Nehra A, Lipshultz LI, Karlin GS, Gleave M, Seger M, Padma-Nathan H. Safety and efficacy of Vardenafil for the Treatment of men with erectile dysfunction after radical retropubic prostatectomy. Journal Urology 170(4) parte 1/2:1278-1283, Oct 2003.
Brock G, Terry T, Monica S, Vardenafil PROSPECT Group Canada. Efficacy and tolerability of Vardenafil in men with erectile dysfunction following radical prostatectomy. Eur Urol suppl 42: 1, 2002.
Burgers JK, Nelson RJ, Quinlan DM, Walsh PC. Nerve growth factor, nerve grafts and amniotic membrane grafts restore erectile function in rats. J Urol 146: 463-468, 1991.
Burnett AL. Rationale for cavernous nerve retorative therapy to preserve erectile function after radical prostatectomy. Urology 61(3): 491-497, March 2003.
Burnett AL.Strategies to promote recovery of cavernous nerve function after radical prostatectomy. World J Urol. 20(6): 337-342, May 2003.
Cappelleri JC. A diagnostic evaluation of the Erectile Function domain of the International Index of Erectile Function (IIEF). Urology 54: 346-351, 1999.
Carroll JL, Ellis D, Bagley DH. Impotence in the elderly. Evaluation of erectile failure in men older than seventy years of age. Jefferson Sexual Function Center. Urology. 39(3): 226-230, Mar 1992.
Carroll JL, Ellis DJ, Bagley DH. Age-related changes in hormones in impotent men. Jefferson Sexual Function Center. Urology. 36(1): 42-46, Jul 1990.
Carroll JL, Bagley DH. Evaluation of sexual satisfaction in partners of men experiencing erectile failure. J Sex Marital Ther. 16(2): 70-78, 1990.
Carroll JL, Baltish MH, Bagley DH. The use of PotenTest in the multidisciplinary evaluation of impotence: is it a reliable measure? Jefferson Sexual Function Center. J Sex Marital Ther. 16(3): 181-187, 1990.
Carsson CC. Broderick GA, Goldstein I, Heaton JP, Rosen RC, Shabsigh R. A focus on the management of Erectile Dysfunction: Problems and Solutions A Supplement to Contemporary Urology 4-23, Jul 2000.
Carsson CC, Burnett AL, Levine LA. The efficacy of sildenafil citrate (Viagra) in clcinical populations: An update. Urology 60(supplm 2B): 12-27, 2002
Carsson CC. Managing Erectile Dysfunction: Problems and Solutions A Supplement to Contemporary Urology 4-19, Jun 2002.
Carsson CC, Burnett AL, Levine LA, Nehra A. The efficacy of Sildenafil citrate (Viagra) in clinical populations: An update Urology 60 (2B) 12-27, Aug 2002
Carsson CC. ED: What to do when pharmacotherapy fails Symposium Contem Urology 15(5): 28-46, May 2003.
Carsson CC, Murria AM, Rajfer J. New advances in erectile dysfunction therapy. Evening seminars AUA Annual Meeting San Francisco 2004.
Catalona WJ. Patient selection for results of and impact on tumor resection of potency-sparing radical prostatectomy. Urologic Clinics of North America 17(4): 819-826, Nov 1990.
Catalona, WJ et al. Nerve-sparing radical prostatectomy: evaluation of results after 250 patients. Journal of Urology. 143: 538, 1990.
Catalona WJ, Bigg SW. Nerve-sparing radical prostatectomy: evaluation of results after 250 patients. J Urol: 143: 538, 1990.
Catalona WJ, Carvalhal GF, Mager DE. Potency, continence and complication rates in 1870 consecutive radical retropubic prostatectomy J Urol 162(2): 433-438, 1999.
Carbone DJ, Seftel AD. Erectile Dysfunction: Diagnosis and treatment in older man. Geriat 57: 18-24, Sep
2002.
Carrier, S. Regeneration Of Nitric Oxide Synthase-Containing Nerves After Cavernous Nerve Neurotomy In The Rat. Journal of Urology. 153: 1722-1727, 1995.
Celia DF: Quality of life outcomes: Measurement and validation. Oncology 10(ll;suppl): 233-246, 1996.
Chaikin DC, Broderick GA, Malloy TR. Erectile dysfunction following minimally invasive treatments for prostate cancer. Urology 148: 100-4, 1996.
Chang DW, Wood CG, Kroll SS, Youssef AA, Babaian RJ. Cavernous nerve reconstruction to preserve erectile function following non-nerve-sparing radical retropubic prostatectomy: a prospective study. Plast Reconstr Surg. 111(3): 1174-1181, March 2003.
Chen J, Wollman Y, Chernichovsky T. Effect of oral administration of high-dose nitric oxide donor L-arginine in men with organic erectile disfuncion: results of a double-blind, randomized, placebo-con-trolled study. BJU Int 83(3): 269-273, 1999.
Chen X, Lee TJ. Ginsenosides-induced nitric oxide-mediated relaxation of the rabbit corpus caver-nosum. Br J Pharmacol 115(1): 15-18, 1995.
Choi YD, Xin ZC, Choi HK. Effect of Korean red ginseng on the rabbit corpus cavernosal smooth muscle. Int J Impot Res 10(1): 37-43, 1998.
Choi HK, Seong DH, Rha KH. Clinical efficacy of Korean red ginseng for erectile dusfunction. Int J Impot Res 7(3): 181-186, 1995.
Chuang AT, Strauss JD, Murphy RA, Steers WD. Sildenafil, a type-5 CGMP phosphodies-terase inhibitor, specifically amplifies endogenous cGMP-dependent relaxation in rabbit corpus cavemosum smooth muscle in vitro. J Urol. 160(1): 257-261, Jul 1998.
Chun WS, Sohn JH, Park YY. Is obesity and underlying factor in erectile dysfunction? Eur Urol 36(1): 68-70, 1999.
Christ GJ, Maayani S, Valcic M. Pharmacological studies of human erectile tissue characteristics of spontaneous contraction and alterations in alpha-adreno-ceptor responsiveness with age and disease in isolated tissues. Br J Pharmacol 101: 375, 1990.
Corty EW: The reliability and validity of a sexual functioning questionnaire. J Sex Mar Ther 22: 27-34,1996.
Costabile RA, Spevak M, Fishman IJ. Efficacy and safety of transurethral alprostadil in patients with erectile dysfunction following radical prostatectomy. J Urol 160, 1325-1328, 1998.
Costabile RA, Spevak M. Oral trazodone is not effective therapy for erectile dysfunction: a double-blind, placebo controlled trial. J Urol. 161(6): 1819-1822, Julio 1999.
Cui D, Hu L, Li S, Zheng X.Restoration of erectile function by reconstructing cavernous nerves with sural nerve grafts. Zhonghua Nan Ke Xue. 10(5): 330-333, May 2004.
Daniel J, Israilov S, Segenreich E, Livne PM. Comparative evaluation of treatments for erectile dysfunction in patients with prostate cancer after radical retropubic prostatectomy. BJU Int 88(1): 58-62, Jul 2001.
Davidson PJ, van den Ouden D, Schroeder FH. Radical prostatectomy: prospective assessment of mortality and morbidity. Eur Urol 29: 168-173, 1996.
DeBusk R, Drory Y, Goldstein I, et al. Management of sexual dysfunction in patients with cardiovascular disease: recommendations of The Princeton Consensus Panel. Am J Cardiol. 2000; 86: 175-181.
De Kernion JB, Naitoh J. Radical Prostatectomy for localized prostate cancer: Indications technique and results in prostate cancer treatment. Stage by stage. PG Course # 9750 AUA Annual Meeting 1997 New Orleans.
Del Popolo G, Natali A, Lombardi G et al. The treatment of erectile failure in spinal cord injury: Intraca-vemosal VIP alone and in combination with PGE1. Preliminary results. ACTA-UROL-ITAL Acta-Urologica-Italica. 7(SUPPL. 2): 187-188, 1993
Derby CA, Mohr BA, Goldstein I. Modifiable risk factors and erectile dysfcuntion: can lifestile changes modify risk? Urology 56(2): 302-306, 2000.
Derogatis LR. The DSFI: a multidimensional measure of sexual functioning. J Sex Marital Ther 5: 244-281, 1979.
Derogatis LR. The Derogatis Interview for Sexual Functioning (DISF/DISF-R): an introductory report. J Sex Marital Ther 23: 291-296, 1997.
Derouet H, Caspari D, Rohde V, Rommel G, Ziegler M.Treatment of erectile dysfunction with external vacuum devices. Andrologia. 31 Suppl 1: 89-94, 1999.
Dinsmore WW, Gingell C, Hackett G. Treating men with predominantly nonpsychogenic erectile dysfunction with intracavernosal vasoactive intestinal polypeptide and phentolamine mesylate in a novel autoinjector system: a multicentre double-blind placebo-controlled study. BJU Int 83(3): 274-279, 1999.
Dinsmore WW, Alderdice DK. Vasoactive intestinal polypeptide and phentolamine mesylate administered by autoinjector in the treatment of patients with erectile dysfunction resistant to other intraca-vernosal agents. Br J Urol 81(3): 437-440, 1998.
Donatucci CF, Lue TF. Erectile dysfunction in men under 40: etiology and treatment of choice. Int J Impotence Res 5: 97-103, 1993.
Donatucci CF. Male sexual dysfunction: the new millennium.Curr Opin Urol. 10(4): 313-317, Jul 2000 Review.
Donatucci C, Eardley I, McVary KT, Thibonnier M, Vardenafil European Group and National Group. Vardenafil improves erectile function regardless of etiology or baseline severity in men with erectile dysfunction. AUA Annual Meeting 2002, Orlando Florida, Abstract # 715. Sexual Function/ Dysfunction/ Andrology Medical and non surgical therapy (I) (Podium Session) F3/F4 Monday 27, May 2002.
Dorey G (2001) Conservative treatment of male urinary incontinence and erectile dysfunction. Ed. Dorey Whurr G Publishers Ltd 19 B Comptom Terrace, London.
Dula E, Keating W, Siami PF, Edmonds A, O'Neil J, Buttler S. Efficacy and safety of fixed-dose and dose-optimization regimens of sublingual apomorphine versus placebo in men with erectile dysfunction. Urology 56: 130-135, 2000 Rec #: 6915.
Eardley I, Rosen R, Fisher W, Niederberger C, Sand M.Rapid Onset vs. Long Duration of Action: Effect of Age and Comorbidity on Attribute Ranking in The Men's Attitudes to Life Events and Sexuality (MALES) Study. 7th Congress of the European Federation of Sexology (EFS) May 2004.
Eastham JA, Scardino PT. Radical Prostatectomy for clinical stage T1 and T2 prostate cancer. Ch 43: 741-758 in Comprenhensive textbook of genitourinary oncology Vogelzang N, Scardino P, Shipley W, Coffey DS. W & W 1996.
Eid JF, Nehra A, Andersson KE, Heaton J, Lewis RW, Morales A, Moreland RB, Mulcahy JJ, Porst H, Pryor JL, Sharlip ID, Wagner G, Wyllie M. First international conference on the management of erectile dysfunction. Overview consensus statement. Int J Impot Res 12 Suppl 4:S2-5, 2000.
Ernst E, Pittler MH. Yohimbine for erectile dysfunction: a systematic review and meta-analysis of randomized clinical trials. The Journal of Urology 159: 433-436, 1998.
Feldman HA, Goldstein I, McKinlay JB, Hatzichristou DG, Krane RJ. Construction of a surrogate variable for impotence in the Massachusetts Male Aging Study. J Clin Epidemiol 47: 457-467, 1994.
Feldman HA, Goldstein I, McKinlay JB, Hatzichristou DG, Krane RJ. Impotence and its medical and psychosocial correlates in men aged 40-70: results of the Massachusetts Male Aging Study. J Urol 151: 54-61,
1994.
Feldman HA, Johannes CB, Derby CA, Kleinman KP, Mohr BA, Araujo AB, McKinlay JB. Erectile dysfunction and coronary risk factors: prospective results from the Massachusetts Male Aging Study. Prev Med. 30: 328-338, 2000.
Feng MI, Huang S, Kaptein J, Kaswick J, Aboseif S. Effect of sildenafil citrate on post-radical prostatectomy erectile dysfunction. J Urol. 164(6): 1935-1938, Dec 2000.
Fink HA, MacDonald R, Rutks IR, Wilt TJ.Trazodone for erectile dysfunction: a systematic review and meta-analysis. BJU Int. 92(4): 441-446, Sep 2003.
Fowler FJ, Barry MJ, Lu-Yao G, et al. Patient-reported complications and follow-up treatment after radical prostatectomy. The National medicare Experience: 1988-1990 Urology 42: 622-629, 1993.
Frank E, Anderson C, Rubenstein D. Frequency of sexual dysfunction in "normal" couples. New England Journal of Medicine, 299, 111-115, 1978.
Ganz PA, Schag CF, Lee JJ, et al: The CARES: A generic measure of health-related quality of life for patients with cancer. Qual Life Res 1: 19-29, 1992.
Geary ES, Dendinger TE, Freiha FS, Stamey TA. Nerve sparing radical prostatectomy: a diferent view J Urol 154: 145-149, 1995.
Godschalk MF, Sison A, Mulligan T. Management of erectile dysfunction by the geriatrician. J Am Geriatr Soc. 45(10): 1240-1246, Oct 1997.
Goldstein I, Lue TF, Padma-Nathan H, Rosen RC, Steers WD, Wicker PA. Oral Sildenafil in the treatment of erectile dysfunction. Sildenafil Study Group. New England Journal of Medicine 338 (20): 1397-1404, May 14, 1998.
Goldstein I. Oral phentolamine: an alpha-1, alpha-2 adrenergic antagonist for the treatment of erectile dysfunction. Int J Impot Res. 12 Suppl 1: S75-80, Mar 2000 Review.
Goldstein I. Pharmacotherapy for erectile dysfunction, in Pharmacotherapy for erectile dysfunction PG Course 9676 AUA 91 st Annual Meeting Orlando 1996.
Goldstein I. Long-term efficacy and safety of Vardenafil in diabetic men with erectile dysfunction. Presented at the American Diabetes Association 62nd Scientific Sessions Conference, 15 June 2002, San Francisco, California, US.
Goldstein I.The mutually reinforcing triad of depressive symptoms, cardiovascular disease, and erectile dysfunction. Am J Cardiol. 20; 86(2A): 41F-45F, Jul 2000. Review.
Goldstein I, Vasomax Study Group. Efficacy and safety of oral phentolamine (Vasomax) for the treatment of minimal erectile dysfunction. J Urol 159: Suppl: 240-240, 1998.
Gresser U, Gleiter CH. Erectile dysfunction: Comparison of efficacy and side effects of the PDE-5
inhibitors Sildenafil, Vardenafil and Tadalafil. Review of the Literature. Eur J Med Res 7: 435-446,
2002.
Guay D, Spark R, Bansal S, Cunningham G, Goodman N, Nankin H, Petak S, Perez J. American Association for Clinical Endocrinologist. Medical Guidelines for Clinical Practice for the Evaluation and Treatment of male sexual dysfunction: A couple's problem 2003 Update. Endocrine Practice 9(1) Jan/Feb 2003.
Guay A, Spark R, Jacobson J, Murray F, Geisser M.Yohimbine treatment of organic erectile dysfunction in a dose-escalation trial. Int J Impot Res. 14(1): 25-31, Feb 2002.
Gwinup G. Oral phentolamine in nonspecific erectile insufficiency. Ann Intern Med 109: 162-163, 1988.
Hampell, O. Cavernous nerve grafting restores partial erections after radical retropubic prostatectomy. Journal of Urology. 143: 538, 1990.
Hatzichristou D, Montorsi F, Porst H, Buvat J, Taylor T and Bändel T. A flexible dose regimen of vardenafil for erectile dysfunction: a placebo-controlled trial. Presented at the XVIII Congress of the European Association of Urology, 15 March 2003, Madrid, Spain.
Hatzichristou D, Pescatori E: Current treatments and emerging therapeutic approaches in male Erectile Dysfunction. BJU 88 (Suppl.3): 11-17, 2001.
Hatzichristou D, Montorsi F, Buvant J, Laferriere N, Bändel T, Porst H and for the European Vardenafil study group. The efficacy and safety of flexible-dose vardenafil (Levitra®) in a broad population of european men. Eur Urol 45: 634-641, 2004.
Hatzichristou D et al. Sildenafil failures may be due to inadequate patient instructions and follow-up: A study on 100 non-responders. European Urology 47: 518-523,2005.
Heaton J. Apomorphine: an update of clinical trial results. Int J Impotence Res 12 Suppl 4: S67-S73, 2000.
Heaton J, Morales A, Adams M, Johnston B, el Rashidy R. Recovery of erectile function by the oral administration of apomorphine. Urology 45(2): 200-206, 1995.
Hellstrom W, Overstreet J, Yu A, Saikali K, Sheen W, Beasley C, Watkins V. Tadalafil has no clinically
relevenat effect on semen characteristics. Presented at the 10th World Congress of International Society for Sexual and Impotence Research (ISSIR) 2002 Montreal Canada.
Hellstrom W, Gittelman M, Karlin G, Segerson T, Thibonnier M, Taylor T, Padma-Nathan H, on Behalf of the Vardenafil Study Group. Sustained efficacy and tolerabillity of Vardenafil, a highly potent selective phosphodiesterase type 5 inhibitor, in men with erectile dysfunction results of a randomized, doubleblind, 26 week placebo-controlled pivotal trial. Urology 61 (4A) 8-14, Suppl April 2003.
Hellstrom WJG, Gittelman M, Karlin G, Segerson T, Thibonnier M, Taylor T, Padma-Nathan H. Vardenafil en el tratamiento de la disfundón erectil: Eficacia y seguridad en un ensayo aleatorizado, doble ciego, controlado con placebo J Androl 23(6) 763-772, Nov-Dec 2002.
Herrmann HC, Chang G, Klugherz BD, Mahoney PD. Hemodynamic effects of Sildenafil in men with severe coronary artery disease. New Eng J Med: 342(22) 1622-1626, Jun 2000.
Hollenbeck BK, Dunn RL, Wei JT, Montie JE, Sanda MG. Determinants of long-term sexual helath outcome after radical prostatectomy measured by a validated instrument. J Urol 169(4): 1453-1457, April 2003.
Holmes S, Kirby R, Carson C. Disfunción erectil masculina. Fast Facts. Health Press J&C Edic Medicas SL, 1997.
Hong E, Lepor H, McCullough A. Dependent patient satisfaction with sildenafil for erectile dysfunction (ED) after nerve-sparing radical retropubic prostatectomy (RRP). Int J Impot Res. Suppl 11 (Suppl 1): S15-S22, 1999.
Hong B, Ji Y, Hong J. A double blind crossover study evaluating the efficacy of Korean red ginseng in patients with erectile dysfunction: a preliminary report. J Urol 168(5): 2070-2073, 2002.
Hollenbeck B, Dunn R, Wei J, Montie J, Sanda M.Determinants of long-term sexual health outcome after radical prostatectomy measured by a validated instrument. J Urol. 169(4): 1453-1457, April 2003.
Hutter AM, Kloner RA, Watkins VS, Costigan T, Bedding A, Mitchell MI, Emmick JT. Blood Oressure and cardiovascular effects of tadalafil a new PDE5 inhibitor. Presented at the American Society of Hypertension (ASH) New York City, New York USA, 2002.
Impotence. National Institutes of Health Consensus Statement. JAMA 123: 23-273, 1993.
Jung G, Spencer E, Lue T. Growth hormone enhances regeneration of nitric oxide synthase-containing penile nerves after cavernous nerve neurotomy in rats. J Urol 160: 1899-1904, 1998.
Kadmon D. Unilateral interposition sural nerve grafting following ipsilateral neurovascular bundle resection at radical prostatectomy (RP) decreases the time to potency recovery. J Urol (5) Suppl 149: 165, 2001.
Kalsi J, Rees J, Hobbs A, et al. BAY-41-2272, a novel NO-independent soluble guany-late cyclase activator, relaxes human and rabbit corpus cavemosum. Int J Impot Res. 14(suppl 3): S2, 2002.
Kao T, Cruess D, Gamer D . Multicenter patient self-reporting questionnaire on impotence, incontinence and stricture after radical prostatectomy. J Urol 163: 858-864, 2000.
Katz P. The effect of vacuum devices on penile hemodynamics. Journal of Urology. 143: 55, 1990.
Keating G, Scott LJ. Spotlight on vardenafil in erectile dysfunction. Drugs Aging. 21(2): 135-140, 2004.
Kim E, Scardino P, Hampel O, Mills N, Wheeler T, Nath R. Interposition of sural nerve restores function of cavernous nerves resected during radical prostatectomy. J Urol. 161(1): 188-192, Jan 1999.
Kim E. Nerve grafting restores erectile function after prostatectomy. Urology 57 (2), March 2001.
Kim E. Bilateral nerve graft during radical retropubic prostatectomy: 1-year follow up. J Urol 165:1950-56,2001.
Kim J, Bennett N, Katsumi S, Yoshimura N, Wolfe D, Goins W, Nelson J, De Groat W, Glorioso J, Chancellor M. Neurotrophic factor gene therapy: Potential cure for post radical prostatectomy erectile dysfunction. Abstract # 1179 J Urol 169(4) Program Abstracts AUA 2003 Chicago Illinois. USA.
Kim E. Strategies for preventing erectile dysfunction induced by radical prostatectomy. Contemporary Urology 14(11): 12-23 November 2002.
Kim E. Interposition sural nerve grafting during radical retropubic prostatectomy. Urology 57: 211-216, 2001.
Kim E. Interposition of sural nerve restores function of cavernous nerves resected during radical prostatectomy. J Urol 161: 188-192, 1999.
Kim ED, Nath R, Slawin KM, Kadmon D, Miles BJ, Scardino PT. Bilateral nerve grafting during radical retropubic prostatectomy: extended follow-up. Urology, 58(6): 983-7, Dec 2001.
Kinsey AC et al. Sexual Behaviour in the human male. W.B Saunders Philad 1948 Bloomington: Indiana U. Press.
Kinsey AC et al. Sexual Behaviour in the human female. W.B Saunders Philad 1953 Bloomington: Ind U. Press.
Kirby R, Carson C, Goldstein I. Erectile Dysfunction. A Clinical Guide.Isis Medical Media.Case 11: Prostate Cancer 99-100, 1999.
Kloner RA, Emmick J, Bedding A, Humen D. Pharmacodynamic interactions between tadalafil and nitrates. Presented at the American College of Cardiology (ACC) 2002 Atlanta, Georgia USA.
Kloner RA. A Symposium: Erectile Dysfunction and cardiovascular risk factors. The American Journal of Cardiology 92(9A) 1M-65M Nov 6, 2003.
Kloner RA. Erectile disfunction in the cardiac patient. AUA News 9(3): 7, April/May 2004.
Kloner RA, Jackson G, Emmick JT, Mitchell MI, Bedding A, Warner MR, Pereira A. Interaction between the phosphodiesterase 5 inhibitor tadalafil and 2 alpha-blockers, doxazosin and tamsulosin in healthy nor-motensive men. J Urol 172 (5) part 1 of 2: 1935-1940, Nov 2004.
Kloner RA, Mullin SH, Shook T, Mathews R, Mayeda G, Burstein S, Peled H, Pollick C, Choudhary R, Rosen R, Padma-Nathan H. Erectile dysfunction in the cardiac patient, how common and should we treat? J Urol 170: S46, 2003.
Klotz L. Neurostimulation during radical prostatectomy: improving nerve-sparing techniques. Sem Urol Oncol 18: 46-50, 2000.
Klotz T, Mathers MJ, Braun M. Effectiveness of oral L-arginine in the first line treatment of erectile dysfunction in a controlled crossover study. Urol Int 63(4): 220-223, 1999.
Kuan J, Brock G. .Selective phosphodiesterase type 5 inhibition using tadalafil for the treatment of erectile dysfunction. Expert Opin Investig Drugs. 11(11): 1605-1613, Nov 2002.
Kunelius P, Häkkinen J, Lukkarinen O. Is high-dose yohimbine hydrochloride effective in the treatment of mixed-type impotence? A prospective, randomized, controlled double-blind crossover study. Urol 49(3): 441-444, 1997.
Kury P, Stoll G, Muller HW. Molecular mechanisms of cellular interactions in peripheral nerve regeneration. Curr Opin Neurol 14: 635-639, 2001.
Laan E: Physiological measures of vaginal vasoconges-tion. Int J Impot Res 10(Suppl 2): S107-S110, 1998.
Langtry H, Markharm A. Sildenafil: A review of its use in erectile dysfunction. Drugs 57: 967-989, 1999.
Laumann EO, Paik A, Rosen RC. Sexual dysfunction in the United States: prevalence and predictors. JAMA. 281: 537-544, 1999.
Lee CT, Richie JP, Oesterling JE. Bilateral pelvic lym-phadenectomy and anatomical radical retropubic prostatectomy Ch 29:404-425 in Urologie Oncology Oesterling JE, Richie JP. WB Saunders Co 1997.
Levine SB. Erectile dysfunction why drug therapy isn't always enough. Clev Clin J Med 70(3): 241-246, 2003.
Levine L. Longitudinal Randomized Placebo-Controlled Study of the Return of Nocturnal Erections After Nerve-Sparing Radical Prostatectomy in Men Treated With Nightly Sildenafil Citrate." May 10th 2004 American Urological Association Annual Meeting. Abstract #875.
Levitra. Monografía del Prosducto. Bayer Health Care.
2003.
Lin CS, Xin ZC, Lin G, Lue T. Phosphodiesterases as therapeutic targets Urology 61(4): 685-691, April 2003.
Litwin MS. Life after radical prostatectomy: a longitudinal study. Journal of Urology. 166(2): 587-92, Aug 2001.
Litwin MS, Flanders SC, Pasta DJ, Stoddard ML, Lübeck DP, Henning JM.Sexual function and bother after radical prostatectomy or radiation for prostate cancer: multivariate quality-of-life analysis from CaPSURE. Cancer of the Prostate Strategic Urologic Research Endeavor. Urology.54(3): 503-508, Sep
1999.
Lowentritt BH, Scardino PT, Miles BJ. Sildenafil citrate after radical retropubic prostatectomy J Urol 162: 1614, 1999.
Lowentritt BH. Sildenafil citrate after radical retropubic prostatectomy. J Urol 162: 1614-1617, 1999.
Lue T, Brock GB, Levine L. Erectile Dysfunction, Priapism and Peyronie's Disease. Postgraduate course H0002. AUA Annual Meeting Anaheim 2001.
Lue T. Impotence: a patient's goal-directed approach to treatment. World J Urol 8: 67, 1990.
Lue TF. Erectile Impotence. Diagnostic methods. Prob Urol 5: 519-526, 1991.
Lue, TF . Intraoperative electrostimulation of the cavernous nerve: technique, results and limitations. Journal of Urology. 154: 1426-1428, 1995.
Lue TF, McCullough AR, Levine LA. Erectile Dysfunction, Priapism and Peyronie's Disease. Postgraduate Course # H0229. AUA Annual Meeting Orlando 2002.
Mace DR, Bannerman RHO, Burton J. The teaching of human sexuality in schools for health professionals, Geneva, World Health Organization 1974 (Public Health Report # 57).
Marmar JL. Vacuum constriction devices. In W.J.G. Hellstrom (ed), Male Infertility And Sexual Dysfunction. Springer Verlag, New York, pp 409,1997.
Marks LS, Duda C, Dorey FJ, Macairan ML, Santos PB. Treatment of erectile dysfunction with sildenafil. Urology 53(1): 19-24, Jan 1999.
Marshall V, Grosset D. GPI-1485(Guilford). Curr Opin Investig Drugs 5(1): 107-112, Jan 2004.
McCullough A. New Therapies for erectile dysfunction. In Erectile Dysfunction, Priapism and Peyronie's Disease. Ho229 PG. Lue TF, McCullough AR, Levine LA. American Urological Association 97th Annual Meeting 2002.
McCullough AR. Prevention and Management of erectile dysfunction following radical prostatectomy Urologic clinic of North America 28(3): 613-627, Aug
2001.
Magee TR, Gonzalez-Cadavid NF, Rajfer J. The status of gene therapy for erectile dysfunction. Contemporary Urology 14(10): 14-31, Oct 2002.
MacKinnon SE, Dellon AL. Nerve injury and regeneration. In: MacKinnon SE, and Dellon AL (eds) Surgery of the peripheral nerve Thieme Medical: New York: 16-34, 1988.
Masters W,Johnson V.Sex and the aging process.J Am Geriatr Soc 29(9): 385-390, Sep 1981.
McCullough AR. Prevention and management of erectile dysfunction following radical prostatectomy. Urol Clin North Am 28(3): 613-627, 2001.
McMahon CG, Samali R, Johnson H. Efficacy safety and patient acceptance of sildenafil citrate as treatment for erectile dysfunction Journal of Urol 164(4) 1192-1196, Oct 2000.
McKiernan JM. Cavernous nerve graft reconstruction following radical prostatectomy in 77 patients: feasibility, safety and early results. J Urol 165 (5) Suppl: 149, 2001.
Melman Arnold. Impotence The Urol Clinics of North America 22(4): 699-922, Nov 1995.
Melman A. An intermediate approach to impotence evaluation. Contemporary Urology 7(7): 14-21, Jul
1995.
Meleuman EJ, Mulders PF. Erectile function after radical prostatectomy: a review Eur Urol 43: 95, 2003.
Melman A. 1-Arginine and penile erection. J Urol 158(3 Pt 1): 686, 1997.
Meinhardt W, Schmitz PI, Kropman RF, de la Fuente RB, Lycklama a Nijeholt AA, Zwartendijk J. Trazodone, a double blind trial for treatment of erectile dysfunction. Int J Impot Res 9: 163-165, 1997.
Meyer JP, Gillatt DA, Lockyer R, Macdonagh R. The effect of erectile dysfunction on the quality of life of men after radical prostatectomy. BJU Int.92(9): 929-931, Dec 2003.
Mirone V, Imbimbo C, Palmieri A, Longo N, Fusco F. Erectile dysfunction after surgical treatment. Int J Impot Res. 13 Suppl 5: Sl-15, Dec 2001.
Mirone V, Imbimbo C, Palmieri A, Longo N, Fusco
F.Erectile dysfunction after surgical treatment. Int J Androl. 26(3): 137-140, Jun 2003. Review.
Montague DK, Lakin MM Impotence Ch 14:38-40 Urology Secrets; Resnick MI, Novick AC. Hanley & Belfus INC. 1995.
Montague DK. El Tratamiento de la Disfunción erectil orgánica. Guia para el paciente. American Urological Association. Erectile Dysfunction Clinical Guideline Panel.
Montorsi F, Briganti A, Salonia A, Rigatti P, Burnett AL.Current and future strategies for preventing and managing erectile dysfunction following radical prostatectomy. Eur Urol. 45(2): 123-133, Feb 2004.
Montorsi F, Nathan HP, McCullough A, Brock GB, Broderick G, Ahuja S, Whitaker S, Hoover A, Novack D, Murphy A, Varanese L.Tadalafil in the treatment of erectile dysfunction following bilateral nerve sparing radical retropubic prostatectomy: a randomized, double-blind, placebo controlled trial. J Urol. 172(3): 1036-1041, Sep 2004.
Montorsi F, Briganti A. The management of erectile dysfunction after radical prostatectomy www.levit-ra.bayer.com. Men's Health Newsletter 3/2003 http ://www.univie. ac. at/wcmh/mhn/mhnl5 .htm.
Montorsi F, Guazzoni G, Strambi LF, Da Pozzo LF, Bnava L, Barbieri L, Rigatti P, Pizzini G, Miani A. Recovery of spontaneous erectile function after nerve-sparing radical retropubic prostatectomy with and without early intracvernous injections of alprostadil: results of a prospective randomized trial. J Urol 158: 1408-1410, 1997.
Montorsi F, Maga T, Salonia A. Sildenafil taken at bedtime significantly increases nocturnal erectile activity. Results of a prospective Rigiscan study. J Urol 164: 148, 2000.
Montorsi F, Althof SE. Partner responses to sildenafil citrate (Viagra) treatment of erectile dysfunction. Urology 63(4): 762-767, 2004.
Montorsi F, Verheyden B, Meuleman E, Junemann KP, Moneada I, Valiquette L, Casabe A, Pacheco C,
Denne J, Knight J, Watkins VS. Long-term safety and tolerability in the treatment of erectile dysfunction. Eur Urol 45: 339-345, 2004.
Montorsi F, Strambi LF, Guazzoni G. Effect of yohim-bine-trazodone on psychogenic impotence: a randomized, double-blind, placebo-controlled study. Urology 44(5): 732-736,1994.
Montorsi F et al. Onset of Vardenafil in men with erectile dysfunction(ONTIME Study). 7th Congress of the European Federation of Sexology (EFS) May
2004.
Montorsi F, Briganti A. What's new in erectile dysfunction following radical prostatectomy. AUA News 10(2): 11-13, March 2005.
Moore TM, Strauss JL, Herman S, Donatucci CF. Erectile dysfunction in early, middle, and late adulthood: symptom patterns and psychosocial correlates. J Sex Marital Ther. 29(5): 381-399, Oct-Dec 2003.
Morales A, Heaton JWP Oral and topical therapy for impotence: the beginning of the quest. In Pharmacotherapy for erectile dysfunction PG Course 9676 AUA 91 st Annual Meeting Orlando
1996.
Morganroth J, Ilson BE, Shaddinger BC, Dabiri GA, Patel BR, Boyle DA, Sethuraman VS, Montague TH. Evaluation of Vardenafil and Sildenafil on cardiac repolarization. Am J Cardiol 93: 1378-1383, 2004.
Moyad MA, Barada JH, Lue TF, Mulhall JP, Goldstein I, Fawzy A for the Sexual Medicine Society (SMS) Nutraceutical Committee. Prevention and treatment of erectile dysfunction using lifestyle changes and dietary supplements: what works and what is worthless, part II. Urol Clin N Am 31(2): 249-257, y 259-273, May 2004.
Moyad MA. Dietary supplements and other alternative medicines for erectile dysfunction. What do I tell my patients? Urol Clin North Am. 29(1): 11-22, Feb 2002.
Moyad MA, Barada JH, Lue TF, Mulhall JP, Goldstein I, Fawzy A; Sexual Medicine Society Nutraceutical Committee.Prevention and treatment of erectile dysfunction using lifestyle changes and dietary supplements: what works and what is worthless, part II. Urol Clin North Am. 2004 May; 31(2): 259-73. Review.
Mulcahy JJ.Erectile function after radical prostatectomy. Semin Urol Oncol. 18(1): 71-75, Feb 2000.
Mulhall, JP. The Hemodynamics of Erectile Dysfunction Following Nerve-Sparing Radical Retropubic Prostatectomy. International Journal of Impotence Research, 8: 91-94, 1996.
Mulhall, JP. Erectile dysfunction following radical prostatectomy: hemodynamic profiles and their correlation with recovery of erectile function. Journal of Urology, 167(3): 1371-75, 2002.
Mydlo JH. The impact of obesity in urology. Urol Clin N Am 31(2): 275-287, March 2004.
National Institutes of Health, Consensus Development Conference Statement, December 7-9, 1992. Online data: http://odp.od.nih.gov/consensus/cons/091/091_state-menthtm.
Nehra A, Kulaksizoglu H. Combination therapy for erectile dysfunction: where we are and what's in the future. Curr Urol Rep. 3(6): 467-470, Dec 2002.
Nehra A, Steers WD. Proceedings of the Third International Conference on the management of erectile dysfunction: Linking pathophysiology and therapeutic response. Journal of Urology 170(2); part 2/2, August 2003.
O'Leary MP, Rhodes T, Girman CJ, Jacobson DJ, Roberts RO, Lieber MM, Jacobsen SJ. Distribution of the Brief Male Sexual Inventory in community men. Int J Impot Res.15(3): 185-191, Jun 2003.
Ormrod D, Easthope SE, Figgitt D. Vardenafil. Drugs & Aging 19 (3) 2002.
Padma-Nathan H, Sharlip ID, Shassigh R. The current state of care for erectile dysfunction. A supplement to Comtemporary Urology. A Multimodal approach to erectile Dysfunction. 4-20, Feb 2000.
Padma-Nathan H, Steidle C, Salem S, Tayse N, Yeager J, Harning R. The efficacy and safety of a topical alprostadil cream, Alprox-TD® for the treatment of erectile dysfunction: two phase 2 studies in mild-to-moderate and severe ED. Int J of Impot Res 15(1), 10-17, Feb 2003.
Padma-Nathan H, Porst H, Eardley I, Thibonnier M. Efficacy and Safety of Vardenafil, a Selective Phosphodiesterase 5 Inhibitor, In Men with Erectile
Dysfunction on Antihypert Therapy Am J. Hypertens 15, 48 A, 2002.
Padma Nathan H, Me Cullough AR, Giuliano F, Toler SM, Wohlhuter C, Shpilsky A. Postoperative nightly of sildenafil citrate significantly improves the return of normal spontaneous erectile function after bilateral nerve-sparing radical prostatectomy. Abstract # 1402. AUA Chicago Meeting. J Urol 169(4) April
2003. J Urol suppl 169: 375, abstract 1402, 2003.
Padma-Nathan H, Rosen RC, Shabsigh R, Saikali K, Watkins V, Pullman B. IC351 (Cialis) provides prompt response and extended period of responsiveness for the treatment of men with erectile dysfunction (ED) Presented at the 96th Annual meeting of the American Urological Association (AUA) 2001 Anaheim California USA.
Padma Nathan H, Hellstrom WJG, Kaiser FE, Labasky RF, Lue T, Nolten WE, Norwood PC, Peterson CA, Shabsigh R, Tam PY, Place VA, Gesundheit N for the Medicated Urethral System for erection (MUSE) Study Group. New Eng J Med. 336: 1-7 Jan 1997.
Padma-Nathan H. Efficacy and tolerability of tadalafil, a novel phosphodiesterase 5 inhibitor, in treatment of erectile dysfunction. Am J Cardiol.92(9A): 19M-25M, Nov 2003. Review.
Padma Nathan H, et al. Posoperative nightly administration of sildenafil citrate significantly improves the return of normal spontaneous erectile function alter bilateral nerve-sparing radical prostatectomy. Journal Urol suppl 169: 375, abstracts 1402, 2003.
Patterson B, Bedding A, Jewell H, l’ayne C, Mitchell M. Dose-Normalized phramacokinetics of tadalafil (IC351) administered as a single dose to healthy volunteers. Presented at the 4th Congress of the European Society for sexual and impotence Research (ESSIR) 2001 Roma Italia.
Perrotte P, Babaian RJ, Wood CG.Sural nerve graft during non-nerve-sparing radical retropubic prostatectomy restores erectile function in patients with locally advanced prostate cancer. Prost Cancer Prost Dis. 3(S1): S33, Dec 2000.
Podlasek C, Gonzalez C, Zelner D, Jiang H, McKenna K, McVary K.Analysis of NOS isoform changes in a post radical prostatectomy model of erectile dysfunction. Int J Impot Res. 13 Suppl 5: SI-15, Dec 2001.
Porst H, Rosen R, Padma-Nathan H. The efficacy and tolerability of Vardenafil, a new oral, selective phosphodiesterase type 5 inhibitor, in patients with erectile dysfunction: the first at home clinical trial. Int J Impot Res 13: 192-199, 2001.
Porst H, Rosen R, Padma-Nathan H, Goldstein I, Giuliano F And The International Vardenafil Study Group . Vardenafil, a New Highly Selective PDE5 Inhibitor, Improves Erectile Function Irrespective of the Baseline Severity and Etiology of ED or Age of Patient. Eur Urol 39 (Suppl 5), 2001.
Porst H, Rosen R, Padma-Nathan H, Varanese L, Anglin
G, Giuliano F. Tadalafil allows men with erectile dysfunction to have successful intercourse up to 36 hours postdose. Presented at the 10th World Congress of International Society for Sexual and Impotence Research (ISSIR) 2002 Montreal-Canada.
Porst H. The rationale for prostaglandin El in erectile failure: a survey of worldwide experience. J Urol 155(3): 802-815, 1996.
Porst H. Transurethral alprostadil administration with MUSE "Medicated Urethral System for Erection". Current overview and personal experiences. Urologe A 37(4): 410-416, 1998.
Porst H. Transurethral alprostadil with MUSE (medicated urethral system for erection) vs intracavernous alprostadil a comparative study in 103 patients with erectile dysfunction. Int J Impot Res 9(4): 187-192,
1997.
Porst H, Buvat J, Meuleman E, Michal V, Wagner G. Intracavernous Alprostadil Alfadexan effective and well tolerated treatment for erectile dysfunction. Results of a long-term European study. Int J Impot Res 10(4): 225-231, 1998.
Porst H, Van Ahlen H, Block Th et al. Intracavernous self-injection of prostaglandin E-l in the therapy of erectile dysfunction. VASA-J-VASC-DIS Vasa-Joumal-of-Vascular-Diseases. 18(Suppl. 28): 50-56, 1989.
Porst H. IC351 (Tadalafil, Cialis): update on clinical experience. Int J Impot Res. 14 Suppl 1: S57-64, Feb 2002.
Potempa A-J, Bernard I, Ulbrich E. Under flexible dosing, 'real world' conditions, vardenafil improved erectile function in a broad population of men. To be presented at the XVIII Congress of the European Association of Urology, 14 March 2003, Madrid, Spain.
Pryor J. Vardenafil: Update on clinical experience. Int J Impot Res 14 Suppl 1: S65-9, Feb 2002.
Quinlan DM, Epstein JI, Carter BS. Sexual function following radical prostatectomy: influence of preservation of neurovascular bundles J Urol 145(5): 998-1002, 1991.
Quinlan DM, Nelson RJ, Walsh PC. Cavernous nerve grafts restore erectile function in denervated rats. J Urol 145: 380-383, 1991.
Rabbani F, Patel MI, Scardino PT. Time course of recovery of potency after bilateral nerve sparing radical prostatectomy. Abstract #1178. J Urol 171(4): 310, May 2004.
Radical Prostatectomy often results in impotence and urinary incontinence http://www.pslgroup.com/dg/ 159786.htm.
Raina R, Lakin MM, Agarwal A, Ausmundson S, Montague DK, Zippe CD. Long term intracavernous therapy responders can potentially switch to sildenafil citrate after radical prostatectomy. Urology 63(3): 532-538, 2004.
Raina R, Lakin MM, Thukral M, Agarwal A, Ausmundson S, Montague DK, Klein E, Zippe CD.Long-term efficacy and compliance of intracor-poreal (IC) injection for erectile dysfunction following radical prostatectomy: SHIM (IIEF-5) analysis. Int J Impot Res. 15(5): 318-322, Oct 2003.
Raina R et al. Sildenafil citrate and vacuum constriction device combination enhances sexual satisfaction in erectile dysfunction alter radical prostatectomy. Urology 65: 360-364, 2005.
Reiner WG, Walsh PC. An anatomical approach to the surgical management of the dorsal vein and santori-ni's plexus during radical retropubic surgery. J Urol 121: 198-200, Feb 1979.
Resnick MI, Thompson IM. Surgery of the prostate. Churchill Livingstone, 1998.
Robinson J, Dufour M, Fung T. Erectile functioning of men treated for prostate carcinoma. Cancer 79, 538-544, 1997.
Rogers RS, Gholami S, Lue T. Erectile dysfunction after treatment: ch 26 339-360 in Prostate Cancer Carrol PR, Grossfeld GD. American Cancer Society Atlas of
Clinical Oncology Prostate Cancer. BC Decker Inc 2002.
Rhode G, Wensing G, Unger S et al. The pharmacokinetics of Vardenafil, a new selective PDE 5 inhibitor, is minimally affected by coadministration with Cimetidine or ranitidine. Pharmacotherapy 21 (10), 2001.
Rosen RC. The international index of erectile function (IIEF): a multidimensional scale for assessment of erectile dysfunction. Urology 49: 822-830, 1997.
Rosen RC. The Female Sexual Function Index (FSFI): a multidimensional self-report instrument for the assessment of female sexual function. J Sex Mar Ther 26: 191-208, 2000.
Rosen RC, Cappelleri JC, Gendrano N.The International Index of Erectile Function (IIEF): a state-of-the-science review. Int J Impot Res. 14(3): 226-244, Ago 2002.
Rosen RC.Brief Male Sexual Function Inventory for urology. Urology. 47(5): 782-783, May 1996.
Rosen RC. Development and evaluation of an abridged 5-item version of the International Index of Erectile Function (IIEF-5) as a diagnostic tool for erectile dysfunction. Inti J Impot Research 2001.
Rowland DL, Kalian K, Slob AK. Yohimbine, erectile capacity, and sexual response in men. Arch Sex Behav 26(1): 49-62, 1997.
Roumeguere T, Wespes E, Carpentier Y, Hoffmann P, Schulman CC.Erectile dysfunction is associated with a high prevalence of hyperlipidemia and coronary heart disease risk. Eur Urol.;44(3): 355-359, Sep 2003.
Sadeghi-Nejad H, Goldstein I. Male Erectile Dysfunction Ch 12:152-163, in Manual of Urology Siroky MB, Edelstein RA, Krane RJ. Lippincott, Williams & Wilkins Spiral manual 1999.
Saenz de Tejada IS, Cuevas AJ. The phosphodiesterase inhibitory selectivity and the in vitro and in vivo potency of the new PDE5 inhibitor vardenafil. Int J Impot Res 13: 282-290, 2001.
Saenz de Tejada I, Knight JR, Anglin G, Emmick JT. Efectos del Tadalafil sobre la disfunciön erectil en hombres con diabetes. Diabetes Care 25: 2159-2164,
2002.
Saenz de Tejada, I et al. Pathophysiology of prolonged penile erection associated with trazodone use. Journal of Urology, 165: 60-3, 1991
Sachse R, Rohde G. Safety, Tolerability and pharmacokinetics of multiple dose treatment with the new PDE5-inhibitor BAY 38-9456. Poster, presented at EAU, Brussels 2000.
Sandhu D, Curless E, Dean J. A double blind, placebo controlled study of intracavemosal vasoactive intestinal polypeptide and phentolamine mesylate in a novel auto-injector for the treatment of non-psy-chogenic erectile dysfunction. Int J Impot Res 11(2): 91-97, 1999.
Sarti A, Rubilotta E, Righetti R, DAmico A, Al Rabi, N, Cavalleri S, Ficarra V, Malossini G. Pharmacological therapy of erectile dysfunction after radical prostatectomy Cattedra e Scuola di Specializzazione in Urologia - Universita degli Studi - Verona 49° Convegno SUNI - Brescia, 21-23, settembre 2000.
Scardino PT, Kim ED. Rationale for and results of nerve grafting during radical prostatectomym. Urology 57: 1016-1019, 2001.
Shabsigh R, Kaufman JM, Steidle C, Padma-Nathan
H.Randomized study of testosterone gel as adjunctive therapy to sildenafil in hypogonadal men with erectile dysfunction who do not respond to sildenafil alone. J Urol. 172(2): 658-663, Aug 2004.
Schover LR, Fouladi RT, Wameke CL, Neese L, Klein EA, Zippe C, Kupelian PA. Defining sexual outcomes after treatment for localized prostate cancer. Cancer 95: 1773-1785, 2002.
Schover LR, Fouladi RT, Wameke CL, Neese L, Klein EA, Zippe C, Kupelian PA. Utilization of Medical Treatments for Erectile Dysfunction in Prostate Cancer Survivors. Cancer 95: 2397-2407, 2002.
Schwartz AN, Graham MM. Combined technetium radioisotope penile plethysmography and xenon washout: a technique for evaluating corpora caver-nosal inflow and outflow during early tumescence. J Nucl Med. 32(3): 404-410, Mar 1991. Erratum in: J Nucl Med 32(7): 1374, Jull991.
Schwartz AN, Lowe M, Harley JD, Berger RE. Preliminary report: penile vein occlusion therapy: selection criteria and methods used for the transcatheter treatment of impotence caused by venous-sinusoidal incompetence. J Urol. 148(3): 815-820, Sep 1992.
Schwartz EJ, Wong P, Graydon RJ. Sildenafil preserves intracorporeal smooth muscle after radical retropubic prostatectomy.J Urol. 171(2 Pt 1): 771-774, Feb
2004.
Schwartz K, Bunner S, Bearer R, Severson RK. Complications from treatment for prostate carcinoma among men in the Detroit area. Cancer. 1;95(1): 82-89, Jul 2002.
Schwartz I, McCarthy D. Sildenafil in the treatment of erectile dysfunction. N Engl J Med. 3;339(10): 699-700, Sep 1998 author reply 701-702.
Scott SG, O'Leary M. Management considerations of urinary incontinence and erectile dysfunction after local therapy for prostate cancer. Ch 26: 383-391 in Prostate Cancer. Principles 7 Practice. Kantoff PW, Carroll PR, D'Amico AV, Ross RK, Isaacs JT, Scher HI. Lipincott Williams & Wilkins 2002.
Scott WW.Origins of radical perineal and nerve-sparing retropubic prostatectomy. Prostate. 1997 Jul 1;32(2): 149-151, Jul 1997.
Seftel AD, Wilson SK, Knapp PM, Shin J, Wang WC, Ahuja S. The efficacy and safety of Tadalafil in United States and Puerto Rican men with erectile dysfunction.J Urol. 172(2): 652-657, Aug 2004.
Seftel AD, Sun P, Swindle R. The prevalence of hypertension, hyperlipidemia, diabetes mellitus and depression in men with erectile dysfunction. J Urol. 171(6) Pt 1 of 2: 2341-2345, Jun 2004.
Seftel AD. Phosphodiesterase type 5 inhibitor differentiation based on selectivity, pharmacokinetic, and efficacy profiles. Clin Cardiol. 27(4 Suppl 1): 14-19, Apr 2004.
Seftel AD, Mohammed MA, Althof SE. Erectile dysfunction: etiology, evaluation, and treatment options. Med Clin North Am. 88(2): 387-416, Mar 2004.
Seftel A. High dose Sildenafil citrate as a salvage therapy for severe erectile dysfunction.J Urol. 170(2) Pt 1 of 2: 684, Aug 2003.
Seftel A. Intracavemosal vascular endothelial growth factor (VEGF) injection and adeno-associated virus-mediated VEGF gene therapy and reverse venogenic erectile dysfunction in rats. J Urol. 170(2 Pt 1): 681, Aug 2003.
Seftel A. Effects of Tadalafil on erectile dysfunction in men with diabetes. J Urol. 170(2 Pt l):679-680, Aug
2003.
Seftel A. Sildenafil citrate for treatment of erectile dysfunction in men with type 1 diabetes. Results of a randomized controlled trial.J Urol. 170(2 Pt 1): 678, Aug 2003.
Seftel AD. Erectile dysfunction in the elderly: epidemiology, etiology and approaches to treatment. J Urol. 169(6): 1999-2007, Jun 2003.
Seftel A, Althof SE. Evaluation & Treat of patients with erectile dysfunction. 96 th Annual Meet AUA, 2001.
Seftel AD, Althof SE, Hirsch IH. Office evaluation of male sexual function. The Clinics Atlas of Office procedures. Office Urology 5(1): 11-26, March 2002.
Seftel AD, Wegryn JD, Nehra A. Management of complications of therapy: Erectile dysfunction Ch 46: 416-422 in Advanced therapy of Prostate Disease Resnick MI, Thompson IM. BC Decker Inc 2000.
Segraves RT, Bari M, Segraves K, Spirnak P. Effect of apomorphine on penile tumescence in men with psychogenic impotence. J Urol 145(6): 1174-1175, 1991.
Sexual Health News from Medical Association Meetings .Focus on Sexual Health medicine. Winter-Spring 2002. Sexual Health School. An advanced training program for primary care physicians.
Shabsigh R. Erectile Dysfunction Challenges and Solutions. June 1, 2001 AUA 96th Annual Meeting.
Sidi AA. Patient acceptance of and satisfaction with an external negative pressure device for impotence. Journal of Urology. 144: 1154, 1990.
Sikora R, Sohn MH, Deutz FJ. Ginkgo Biloba extract in the therapy of erectile disfunción. J Urol 141:188 A, 1989.
Sikora R, Sohn MH, Engelke B. Randomized placebo-controlled study on the effects of oral treatment with ginkgo biloba extract in patients with erectile disfunction (abstract 917). J Urol 159: 240a, 1998.
Sildenafil. Liderando los avances en el tratamiento de la Disfunción erectil XVII Congreso de la Asociación Europea de Urología Birmingham, Reino Unido Febero 2002.
Singh H, Karakiewicz P, Shariat SF, Canto El, Nath RK, Kattan MW, Slawin KM. Impact of unilateral interposition sural nerve grafting on recovery of urinary function after radical prostatectomy. Urology. 63(6): 1122-1127, Jun 2004.
Smith Jr JA. Early Detection and treatment of localized carcinoma of the prostate. The urologic clinics of north america. 17(4): 689-920, Nov 1990.
Sobin LH, Wittekind C (eds). TNM Classification of Malignant Tumors: International Union Against Cancer 5th edn Wiley-Liss: New York, 170-173, 1997.
Sociedad Latinoamericana para el Estudio de la Impotencia y Sexualidad. I Consenso Latinoamericano de Disfunción Erectil. Cap Americano de la International Society for sexual and Impotence Research (ISSIR) 28-31, Ago 2002.
Soderdahl DW, Thrasher JB, Hansberry KL. Intracavernosal drug-induced erection therapy versus external vacuum devices in the treatment of erectile dysfunction. Br J Urol 79, 952-957, 1997.
Spector IP, Carey MP. Incidence and prevalence of the sexual dysfunctions: A critical review of the empirical literature. Archives of Sexual Behavior, 19: 389-408, 1990.
Srilatha B, Adaikan PG. Estrogen and phytoestrogen predispose to erectile dysfnction: do ER-alpha and ER-beta in the cavernosum play a role? Urology 63(2): 382-386, 2004.
Stanford JL, Ziding F, Hamilton AS, et al. Urinary and sexual function after radical prostatectomy for clinically localized prostate cancer. JAMA 283: 354-360,2000.
Stefanovic KB, Corman JM. Sexual Function Following Radical Prostatectomy. Mayo 2002. http://www. vmmc.org/dbArticles/articlel72869.asp.
Stanford JL, Feng Z, Hamilton AS, Gilliland FD, Stephenson RA, Eley JW, Albertsen PC, Harlan LC, Potosky AL.Urinary and sexual function after radical prostatectomy for clinically localized prostate cancer: the Prostate Cancer Outcomes Study. JAMA. 283(3): 354-360, Jan 2000.
Steidle C, Padma-Nathan H, Salem S, Tayse N, Thwing D, Fendi J, Yeager J, Harning R. Topical alprostadil cream for the treatment of erectile dysfunction: a combined analysis of the phase II Program. Urol 60(6): 1077-1082, Dec 2002.
Sotomayor M, Rubio E, Tapia R, Telich M, Torres A, Gonzalez G. for the SPICE study group. Int. J. Imp. Res. 14 Suppl 3: S88, 2002.
Sotomayor MJ. Erectile Dysfunction: Breaking the Silence. 20th International Bayer Pharma Press Seminar, Nov 2, 2001, México city, México.
Southgate J. New rivals to Viagra expand the market. Scrip World Pharmaceutical News, 2002. Int J Androl. 2003 Jun; 26(3): 137-140, 2003.
Steers W,Guay AT,Leriche A, Gingell C, Hargreave TB, Wright PJ, Price DE, Feldman RA. Evaluación de la eficacia y seguridad de Viagra® (citrato de sildenafil) en hombres con disfuncion erectil durante el tratamiento a largo plazo. International Journal of Impotence Research 13, 261-267, 2001.
Sunderland S. Nerve grafting and related methods of nerve repair. In: Sunderland S (ed.) Nerve injuries and their repair: a critical appraisal Churchill Livingstone: Edinburg 467-497, 1991.
Sung J, Han KH, Zo JH. Effects of red ginseng upon vascular endotelial function in patients with essential hipertensión. Am J Chin Med 28(2):.205-216, 2000.
Schover LR. Counseling cancer patients about changes in sexual function. Oncology 13(11): 1585-1591, Nov 1999.
Schwartz EJ, Wong P, Graydon RJ. Sildenafil preserves intracorporeal smooth muscle after radical retropubic prostatectomy. J Urol 171(2) part 1 of 2: 771-774, Feb 2004.
Taylor JE: Self-report assessment of female sexual func-tion:psychometric evaluation of the Brief Index of Sexual Functioning for Women (BISF-W). Arch Sex Behav 23: 627-643, 1994.
Traish A, Kim N, Moreland R, Goldstein I. Role of alpha adrenergic receptors in erectile function. Int J Impot Res. 12 Suppl 1: S48-63, Mar 2000. Review.
Tsang D, Yeung HW, Tso WW, Peekl H. Ginseng saponins: influence on neurotransmitter uptake in rat brain synaptosomes. Planta Med 3: 221-224,1985.
Vale J. Male Erectile Dysfunctioning (MED) Following Radical Therapy for Urological Malignancy Urol Clin North Am. 28(3): 613-627, Aug 2001.
Vale J. Erectile dysfunction following radical therapy for prostate cancer. Rad Oncol 57(3): 301-305, Dec 2000.
Valiquette L. Vardenafil provides reliable efficacy over time in men with erectile dysfunction. Presented at the 10th Congress of the International Society for Sexual and Impotence Research, 24 Sept 2002, Montreal, Quebec, Canada.
Vogt HJ, Brandi P, Kockott G. Double-blind, placebo-controlled safety and efficacy trial with yohimbine hydrochloride in the treatment of nonorganic erectile dysfunction. Int J Impot Res 9(3): 155-161, 1997.
Wang AC, Wang YY, Chen MC. Single-Blind, randomized trial of pelvic floor muscle training, biofeed-back-assisted pelvic floor training, and electrical stimulation in the management of overactive baldder. Urol 63(1): 61-66, 2004.
Walsh PC, Mostwin JL. Radical prostatectomy and cystoprostatectomy with preservation of potency. Results using a new nerve sparing technique. Br J Urol 56: 694-697, 1984.
Walsh PC. Radical prostatectomy, preservation of sexual function, and cancer control: the controversy. Urologic Clinics of North America. 14: 663, 1987.
Walsh P. Patient reported urinary continence and sexual function after radical prostatect Urol 55: 58-61, 2000.
Walsh P, Donker P. Impotence following radical prostatectomy: insight into aetiology and prevention. J Urol 128: 492, 1982.
Walsh PC. Nerve grafts are rarely necessary and are unlikely to improve sexual function in men undergoing anatomic radical prostatectomy. Urology 57: 1020-1024,2001; www.levitra.bayer.com http://www. uni vie. ac. at/wcmh/mhn/mhnl5 .htm
Wei JT. Comprehensive comparison of health-related quality of life after contemporary therapies for localized prostate cancer. Journal of Clin Oncol. 20(2): 557-566, 2002.
Wespes E.Smooth muscle pathology and erectile dysfunction. Int J Impot Res. 14 Suppl 1: S17-21, Feb
2002.
Williams G, Abbou CC, Amar ET, Desvaux P, Flam TA, Lycklama a Nijeholt GA, Lynch SF, Morgan RJ, Muller SC, Porst H, Pryor JP, Ryan P, Witzsch UK, Hall MM, Place VA, Spivack AP, Todd LK, Gesundheit N. The effect of transurethral alprostadil on the quality of life of men with erectile dysfunction, and their partners. MUSE Study Group. Br J Urol. 82(6): 847-854, Dec 1998.
Zagaja GP, Mhoon DA, Aikens JE, Brendler CB. Sildenafil in the Treatment of erectile dysfunction after radical prostatectomy Urology 56(4): 631-634, Oct 2000.
Zelefsky MJ, Eid JF. Elucidating the etiology of erectile dysfunction after definitive therapy for prostatic cancer. Int J Radiat Oncol Biol Phys 40 (1), 129-133, Jan 1998.
Zippe CD, Jhaveri FM, Klein EA. Role of Viagra after radical prostatectomy. Urology 55(2): 241-245, Feb
2000.
Zippe CD, Raina R, Thukral M, Lakin MM, Klein EA, Agarwal A.Management of erectile dysfunction following radical prostatectomy. Curr Urol Rep. 2(6): 495-503, Dec 2001.
Zorgniotti AW, Lizza AF. Effect of large doses of nitric oxide precursor L-arginine on erectile dysfunction. Int J Impot Res 6(1): 33-35, 1994.
Zorgniotti AW: Experience with buccal phentolamine mesylate for impotence. Int J Impot Res 6: 37-41, 1994.
Zorgniotti AW, Lizza EF. Effect of large doses of the nitric oxide precursor, l-arginine, on erectile dysfunction. Int J Impot Res 6: 33-35, 1994.
Young J, Auerbach S, Porst H and the International Vardenafil Study Group . Vardenafil (A New Selective PDE5 Inhibitor) Significantly Improved all IIEF Domains in Patients with Erectile Dysfunction and Showed a Favorable Safety Profile: Results at 4 and Weeks of Treatment.J Urol 165 (5): 224, 2001.
Dr. Julio César Potenziani Bigelli
Individuo de Número (Sillón XXIV) de la Sociedad Venezolana de Historia de la Medicina
HISTORIA DE LA CIRCUNCISIÓN Y SU TRASCENDENCIA EN LAS DIFERENTES CULTURAS DE LA HUMANIDAD
Trabajo de incorporación como individuo de número (Sillón XXIV) Sociedad Venezolana de Historia de la Medicina
NUNCA SE PODRIA IMAGINAR COMO UNA CIRUGÍA TAN SIMPLE, HAYA TENIDO TAN DIVERSAS CAUSAS Y TAN COMPLEJA TRASCENDENCIA EN CADA UNA DE LAS CULTURAS QUE MODELARON LA HISTORIA DEL HOMBRE.
El presente trabajo sobre la "Historia de la circuncisión y su trascendencia en las diferentes culturas de la humanidad" ha sido realizado luego de una exhaustiva revisión de más de 150 fuentes extraídas de libros, monografías médicas y fuentes de Internet en sitios web de historia de la medicina y de historia de la cirugía.
Se ha tratado de mantener una germina cohesión en el texto ofreciendo no sólo información válida sino adecuadamente sustentada por estudiosos de la materia, para lograr finalmente ofrecer una visión lo más global, y a su vez detallada posible, de lo que ha sido la circuncisión en la historia del hombre.
No hemos querido profundizar en la técnica en sí, aun cuando mostramos los dibujos de las mismas, ni tampoco hemos querido mencionar la circuncisión femenina, también llamada mutilación femenina aun practicada en muchos lugares del mundo, sobre todo en el continente africano.
Esperamos que nuestro esfuerzo sirva no sólo de lectura amena, sino de información y fuente de consulta para los que "a posteriori" tenga a bien escribir sobre el tema.
La circuncisión del latín 'circumddere', (de 'cir-cum'= alrededor y 'caedere' = cortar circularmente una porción del prepucio y en su segunda acepción significa: cercenar, quitar o moderar alguna cosa. DRAE XIX ed. 1970).
Está ligada a la palabra griega 'peritome', que significa cortar, específicamente la remoción del prepucio o piel que recubre el glande y que ha sido realizada, según estimadones de numerosos autores (Barns 1936), (Denniston 1997), a un sexto de la pobladón masculina mundial, ocasionando constantemente disputas en torno a su origen y a su significado (Dunsmuir 1999).
En las sodedades ocddentales, prindpalmente los países anglo-sajones como Reino Unido, Canadá, Australia y Estados Unidos de Norteamérica la dr-cundsión se realiza por razones 'médicas' no religiosas. Pero aun en ésos países existe una enorme variadón, ya que vemos que la tasa de circuncisión en el Reino Unido es de 5-6% y en Estados Unidos de Norteamérica es del 60%. (Wallerstein 1980,1985) describe dos trabajos que serían trascendentales en el enfoque de las sociedades pediátricas en los Estados Unidos, uno fue "Circuncisión: Una falada de salud americana" y el otro "Circundsión: el único enigma medico norteamericano".
La circuncisión neonatal en Gran Bretaña dedinó de 30% en los años 1940 y descendió a niveles bajísimos en la adualidad (por debajo del 2%). Sin embargo se siguen haciendo alrededor de 30.000 procedimientos al año (Williams 1993). Es el quinto procedimiento quirúrgico mas utilizado en los Estados Unidos de Norteamérica. En 1992 en el mismo país se realizaron
1.200.000 drcundsiones y 62% de los recién nacidos fueron sometidos a dicha cirugía.
El porcentaje de drcundsión ha dedinado 11.4% en los últimos dos años según afras del Centro Nadonal de Estadísticas en Salud norteamericano, de 63.1% en el 2001 a 55.9% en el 2003. La mayor dedinadón fue en los estados del oeste americano, donde el 68.6% de los niños no les fue pradicada la drcundsión.
La palabra hebrea para no-drcunddado es 'orla' que significa 'obstrucción' 'impedir'. De lo que proviene la acotadón bíblica de "corazón no-circunci-dado' referido a obstrucdonismo.
En el diccionario de Mitología Universal (Noel 1991) la palabra 'Circuncisión' está definida como:
Ceremonia religiosa entre los judíos y los mahometanos que consiste en cortar el prepucio de los niños que deben profesar un u otra de éstas regiones. Era también una de las pruebas a que los sacerdotes egipcios sujetaban a los iniciados. Para los judíos un rito religioso instituido por Jahvé como signo visible de su alianza con Abraham, su descendencia (Gen 17).
En la actualidad se realizan al sexto día después del nacimiento del varón. Entre los cristianos solo se realiza en la Iglesia de Etiopia. Entre los musulmanes se efectúa entre los tres y los siete años. No está pres-cripta por el Coran. Se trata de un rito pre-islámico. En muchas tribus de Africa negra la circuncisión es muy importante como punto culminante de un conjunto de ritos que constituyen la denominada iniciación a la vida como varón joven. Más que una operación higiénica es una prueba de virilidad en la que el niño deja de ser tal y es admitido en la comunidad de adultos. Como vemos solamente el intento de definirla es complejo.
Su práctica se remonta al periodo neolítico y se cree que junto a la trepanación son dos de las más antiguas cirugías practicadas por el hombre (Hernández 2004), (Margulis 2003). Pueblos semíticos no judíos iniciaron su uso, posteriormente los Egipcios, hace mas de 60 siglos continuaron con su practica, que posteriormente fue seguida por hebreos, fenicios, sirios, cristianos, así como culturas africanas, mesoamericanas, andinas, oceánicas, pueblos anglosajones (Reino Unido, Gran Bretaña y Estados Unidos de Norteamérica) han dado su aporte a la fértil imaginación del hombre, en lo referente a la circuncisión, llevándonos desde las interpretaciones teogónicas hasta las más disímiles e increíbles teorías.
Su realización ha sido ligada a razones religiosas-étnicas, culturales, higiénicas, sociales, médicas de acuerdo a las diferentes culturas del hombre, desde los albores de nuestra civilización hasta nuestros días, y su significación, será no sólo interesante sino también útil para hacernos ver, el desarrollo de las ideas en el ámbito humano y social así como en el mundo médico (Durant 1954).
Se practicaba en sociedades secretas de Tarnul, Caldea, Madura y Tibet (Godfrey Higgins "Anacalypsis", London 1836), en pueblos de Mesopotamia, colchianos, etíopes, coptos, abisinios, tagalos (Filipinas), mahometanos en Sumatra, la costa este de Nueva Guinea, y los samoanos, los aztecas y los mayas en Centroamérica, indios de Suramérica, en Australia y gran parte de las islas de Oceania, practicaban la circuncisión por diferentes razones, lo que hace de ésta cirugía sin duda alguna la más antigua y la más utilizada en las diferentes culturas del hombre.
Cristóbal Colón consiguió nativos del "Nuevo Mundo" circuncidados.
En la familia real inglesa la realización de la circuncisión es considerada una marca de realeza, al igual que entre los aztecas donde también era considerada una marca de nobleza y superioridad. La circuncisión no se practica en las tradiciones hinduistas-budistas así como tampoco en la tradición confusionista.
La circuncisión masculina ha sido considerada como una violación de los derechos humanos por legisladores y organizaciones no gubernamentales e instituciones educativas. Y vemos por ejemplo que naciones como Alemania, da asilo político a los hombres turcos que se ven forzados a realizarse una circuncisión, siendo esto controversial e irónico a la luz de lo acontecido en el propio suelo alemán y países vecinos hace apenas 65 años con los campos de exterminio judío llevado a cabo por los nazis.
La organización NOCIRC ha estimado que 13.3 millones de varones cada año, son forzados a realizarse circuncisión sin indicación médica.
Fue prohibida por el emperador Adriano (76-138
d.c) dictándose pena de muerte a los que la practicaran y sin embargo los judíos la realizaban secretamente.
Hubo periodos donde el propio pueblo judío recibiendo influencias culturales foráneas, como sucedió durante el reinado de Antioco IV Epífanes (164 d.c) el cual helenizó los territorios por los conquistados, dejó de circuncidarse para no tener diferencias con los 'gentiles' y muchos trataron de 'revertir' la circuncisión ya realizada. Bajo Antioco IV sucedió la revuelta de los Macabeos el año 167 d.c.
En nuestro calendario gregoriano, llamado así por el Papa Gregorio XIII el cual ordenó el año de 1582 abolir el calendario Juliano, realizado por Julio Cesar de la Roma Imperial, el 1- de enero se conmemora la circuncisión de Jesús, realizada según las
normas hebreas al octavo día de nacido que fue el 25 de Diciembre.
La realización de la circuncisión es diferente de acuerdo a cada cultura o civilización que la practicó. Así vemos como los egipcios la realizaban en niños entre los 6 y 12 años. Entre los etíopes, hebreos, musulmanes y otros pueblos se realizaba a los pocos días de nacido. Los hebreos en particular a los 8 días. Otros la realizan en la pubertad. Otros en la adolescencia.
Cuando hablemos de la circuncisión practicada en los siglos XVIII y XIX veremos que había indicaciones médicas, ya que se le atribuían muchísimos efectos benéficos en el asma, las hernias, la epilepsia, la enuresis, la gota, y prevenir o curar el alcoholismo, así como prevenir la practica de la masturbación, donde hubo verdaderos tratados al respecto, incluyendo figuras de la talla de Juan Jacobo Rousseau, dándole normas a los padres para evitar dicha practica, entre otras cientos de indicaciones que justificaban su práctica.
Inclusive hubo y todavía en muchas sociedades médicas salen publicados trabajos donde se indica que en poblaciones que practican la circuncisión se ven menos casos de virus papiloma humano ligado a la génesis del cáncer de cuello uterino de sus parejas, e igualmente en poblaciones circuncidadas se ven cifras más bajas de incidencia y prevalecía en enfermedades como sífilis y herpes genital que las mostradas en poblaciones no circuncidadas.
Teodorico de Borgognoni, en 1267 sugiere la necesidad de la "remoción de la parte final del pene en el tratamiento de verrugas negras y de tubérculos", por lo que se considera como descriptor de la circuncisión para el tratamiento de patologías peneanas, aun cuando es improbable que los 'doctores' hicieran la cirugía hasta la mitad del siglo XIX. (Campbell 1960).
Se ven ejemplos de arqueología erótica con las figuras itifálicas en las regiones de Ecuador y Colombia. Las


culturas Tumaco, Tolita y Quimbaya habitaron las regiones norte de Ecuador y Sur de Colombia desde el siglo II a.c hasta el siglo X d.c. Detallando bien las figuras todas, tienen el glande al descubierto. ¿Significa que habían sido sometidos a circuncisión?
DEFINICIONES ÚTILES
La palabra 'Fimosis' deriva del griego donde se le daba la definición de 'defecto peneano genuino'.
La palabra 'acroposthion' es la porción de la piel prepucial que sobrepasa el glande.
La palabra 'Posthe' es la piel del tronco peneano.
Galeno hablaba del prepucio como "magníficamente útil como adorno" pero el termino Fimosis, tanto Heliodoro, Andromaco y el propio Galeno la definían como 'estrechez inflamatoria del ano o del parpado, pero nunca en referencia a la zona prepucial (Hodges 1999).
Kynodesme (del griego "correa de perro") y era en esencia el "protector de la moral publica"
Celso en el siglo I d.c refería que la Fimosis era "descripción diagnostica de los efectos sobre el prepucio causados por una condición patológica real". Actualmente se abre la interrogante si era causada posiblemente por causas bacterianas.
Antyllus en el siglo II d.c refería que la Fimosis era "tejido cicatricial inelástico sumado a granulaciones patológicas como la causa de un prepucio sintomático y no retraible", recomendándose una serie de incisiones en el tejido cicatricial para expandir el prepucio.
La palabra Cirugía en griego 'cheírourghía'= "trabajo manual" de 'cheir'= mano, y 'ergon'= trabajo, la podemos conseguir escrita en dos libros del Corpus Hippocraticum (Cosmacini-La vita nelle mani-2003).
Según Hipócrates la cirugía se convierte en una 'techné' =una técnica, donde se selecciona el momento más adecuado para realizarla 'kairós' = el momento oportuno, para realizar una 'eucheiría' =un buen trabajo y con ello garantizar la curación 'techne iatriké' = el arte de curar. (Cosmacini-La vita nelle mani-2003).
¿QUIÉNES REALIZABAN LA CIRCUNCISIÓN?
Hoffman (1995) especulaba si eran médicos o curanderos los que realizaban el procedimiento en el pueblo judío? La respuesta probablemente es compleja. En tiempos bíblicos era la madre que realizaba la ceremonia sobre el recién nacido. También podían practicarla hombres que tenían habilidades quirúrgicas y conocimiento religioso avanzado. Posteriormente el hacedor de la plegaria que era el Mohel circuncidaba al niño, lo bendecía y lo entregaba a los padres en una ceremonia que ha cambiado muy poco en el curso de los tiempos.
En la antigua sociedad egipcia el procedimiento era realizado por sacerdotes con sus uñas, a menudo impregnadas de oro.
Se mantuvo hasta el medioevo la responsabilidad de los hombres ligados a la religión la responsabilidad del procedimiento (Alien 1909).
Posteriormente serían los curanderos-barberos y posteriormente los cirujanos y urólogos cuando la evolución de la cirugía logró la especializadón y aceptación de la especialidad en el campo médico.
¿EXISTEN CAUSAS MÉDICAS PARA LA CIRCUNCISIÓN?
Se ha especulado mucho sobre la asociación que existe entre circuncisión y enfermedades infecciosas, bien sea de transmisión sexual o de otra etiología. Sin embargo, debemos dedr que los estudios de investigación al respecto comenzaron a finales del siglo XIX y en el siglo XX cuando la etiología de las enfermedades infecciosas comenzó a entenderse y a descubrirse, por lo cual sería difícil pensar que era una exclusiva razón profiláctica la que obligaba a su utilización.
Los jeroglíficos egipcios nos muestran pacientes sufriendo de hematuria microscópica con dolores intensos, así como fimosis y cálculos vesicales. El papiro de Kahun (1900 a.c) describe remedios contra la hematuria, producida por el schistosoma haematobium evidenciados por huevos y parásitos calcificados encontrados en riñones de momias egipcias. Igualmente se consiguieron antígenos circulantes en tejidos de momias. Esto podría dar motivos para especular que los egipcios relacionaron dicha enfermedad, verdadera endemia de su época, con la presencia del prepucio, lo cual pudo haber sido uno de los factores por los cuales se hada la circuncisión en tierras egipdas.
Para el año 2003 se denundaron 66 millones de niños infedados con schistosomiasis urinarias en 54 países (Nuttall 1997). Niños que se bañan en aguas contaminadas son mas propensos a la infecdón, y el prepu-do sirve como contenedor de aguas infedadas permitiendo la invasión de la cercaría y su penetradón en el organismo a través de la mucosa prepudal, un área inmunodefidente (Fleiss 1998). Curiosamente se sabe que tropas británicas con sede en Egipto usaban preservativos cuando nadaban en el Nilo. Bilharz describió la enfermedad en 1851 en trabajadores del Nilo.
Igualmente la O.M.S (Organizadón Mundial de la Salud) cita dos artículos que se refieren a la disminución del contagio de VIH a través de la drcundsión: (Circumcision reduces risk of HIV infection in men. Bull World Health Organ, 82(5): 394-395, May 2004) y (Circumcision reduces risk of HIV infection in men. Bull World Health Organ. 82(5): 394-395, May 2004 ).
La anatomía prepucial hace propenso la posibilidad de infectarse. Antes de una cierta edad se hace muy difícil el aseo de dicha zona permitiendo que de alguna manera pueda convertirse en asiento de infecciones difídles de erradicar con la limpieza. Se forman frecuentes adherencias prepuciales que impiden la retracdón y con ello una limpieza adecuada, ya que realizarla produce inmenso dolor.
Las secredones de las glándulas de Tysson y la infecdón de múltiples fuentes hacen de la limpieza prepucial algo verdaderamente importante. Igualmente observamos que después de las relaciones íntimas por fatiga o negligencia, el hombre al no lavarse inmediatamente, el saco prepucial podría albergar todo tipo de organismos patógenos trasmitidos por el aparato genital femeninos y otras áreas perineales y anales, dependiendo de las preferendas sexuales de la pareja. Con repetidas infecciones las balanitis a repetidón generaran tejidos fibrosos, no elásticos ni extensibles, que impiden la retracdón del mismo sobre el glande y al final se deberá realizar circuncisión o prepucectomía.
Los diabéticos no drcuncidados desarrollaran balanopostitis a repetidón que también terminará en cirugía prepucial. Hay bacterias como Proteus mirabilis y Serratia odoriferous tienen mayor adherenda prepudal, como la pseudomonas aeuru-ginosa y las cepas de Klebsiella resultando en más infecciones en los hombres no circuncidados. Por lo tanto la misma previene las infecdones del sistema urinario (I.T.U) (Marx 1989). Habrá también aso-ciadón entre infecciones de transmisión sexual (I.T.S) y el no tener drcundsión.
Richards (1996) refiere en su excelente articulo de la circuncisión masculina: medicina o ritual", que ésta ha sido realizada por muchas causas que van desde favorecer o desfavorecer el desempeño sexual hasta actos de sacrifidos a deidades y dioses en general, como signos tribales, como signos de prestigio social, como recordatorio de una determinada casta social, como sacrificio para la fertilidad, como test de resistencia, como reencarnación y como higiene.
Brigman (1985) sugiere que la histeria antimasturbatoria de mediados a finales del siglo XIX fue la causa de la repopularizadon de la circuncisión.
Refería Brigman (1985) que la drcundsión no está médicamente garantizada, es dolorosa, y con riesgos cosméticos permanentes así como riesgos de secuelas psicológicas.
Los psicólogos han mencionado la nodón de "dolor impreso" al codificar la nodón de violencia en su cerebro, hadendo que se produzca el despego maternal como un sentimiento de arrancarlo de la infanda. Son considerados según Milos (1992) como requisitos que facilitan la habilidad del niño en el resto de su vida. Argumentos compartidos y sustentados por Anna Freud en 1952 en su articulo "The role of bodily ilness in the mental life of children". (Canserver 1965) y Goldman en su brillante trabajo "Circundsión: El trauma oculto" (1997).
¿Por qué la drcundsión?, ¿Por qué el ritual, mito o curiosidad con el pene? ¿Por qué tantas culturas tan disímiles y distantes entre si, tienen en sus cosmogonías, costumbres sociales, rituales religiosos, rituales de fertilizadón de sus tierras, o simplemente por preceptos religiosos, la realización de la circuncisión? La respuesta es compleja.
A pesar de que nuestro enfoque de las causas posibles que sustentan la pradica de la circuncisión, tiene éste, la amplitud mental de los tiempos modernos, y es necesario pensar que para los habitantes de la mesopotamia milenaria, o de Egipto, o de las tribus o clanes judíos, o de cualquier otra época en la historia, "su época" era para ellos "su tiempo adual", y eso es importante a nuestro entender dejarlo bien establecido.
Por tal motivo nuestra explicadón del por qué será solamente "especulativa" guardando el debido respeto que toda época histórica se merece, cuando tratamos de darle explicación a una determinada acción o costumbre.
Desde antes del año 3.000 a.c se sabia de la práctica de la circuncisión, sin dejar de mencionar que en las cavernas de la prehistoria del sur de Francia (Paleolítico superior) se encontraron pinturas rupestres que datan de hace 9.000 a 20.0000 años que describen operadones de drcundsión.
Antropólogos, psicólogos, psiquiatras, historiadores, médicos, religiosos entre otros, han ofreddo numerosas explicadones para explicar su practica entre las que se cuentan mejorar o desmejorar el desempeño sexual, sacrificio o fertilidad a los dioses, prestigio sodal, status social, signos o huellas tribales, con fines ritualistas de diverso origen (Liebert 2002), signos o huellas étnicas-religiosas, test de resistencias, como concepto de reencarnación, para aliviar ciertas conductas anómalas sexuales y como parte de un objetivo global e individual de higiene (Richards 1996), (Acuña 1998), (Hodges 1999).
Dunsmuir y Gordon del Departamento de Urología del Hospital St George's de Londres (1999) referían al respedo: Sir Graham Elliot egiptólogo inglés sugería que la circuncisión es uno de los rasgos de las culturas "Helioliticas" de hace 15.000 años atrás. Otros piensan que se originó independientemente en muchas culturas diferentes.
Entre las momias egipcias (1.300 a.d) y pinturas que describen el procedimiento varios miles de años antes dan cuenta de lo extendido de su uso (Lewinson 1958),(Rogers 1856).
Desde nativos del Nuevo Mundo descubierto por Colón en el siglo XV pasando por pueblo africanos, cercano oriente, entre los musulmanes de la India, entre los aborígenes australianos.
Muchos historiadores creen que es un ritual que se hacia en sociedades antiguas como una forma de control social. Concebían que el causarle dolor y san-gramiento era una especie de recordatorio del poder de la Iglesia: "tenemos el control sobre tu distinción de ser un hombre, sobre tu placer y tu derecho a reproducirte". "Nosotros marcamos a tu hijo quien nos pertenece a nosotros y no a ti (Jolly 1899).
En algunas tribus africanas se realiza al nacer. En la sociedad judía al octavo día de nacido. Entre los mahometanos se hace en la temprana edad adulta como un rito de "paso" de la pubertad al matrimonio.
En el Egipto faraónico los guerreros enemigos capturados eran a menudo circuncidados antes de ser condenados a la esclavitud. La amputación de los dedos y la castración fueron procedimientos muy comunes, pero que sin duda restaban fuerza al esclavo lo que determinó que en un momento fuera abandonado como costumbre. Era en éste aspecto un acto degradante, humillante que además se seguía realizando en la descendencia del esclavo.
Los fenicios y luego los judíos que tuvieron largos periodos de esclavitud adoptaron y ritualizaron la circuncisión, convirtiéndola en un signo que representaba el convenio entre Dios y el hombre. ¿Podría ser considerado una señal de supervivencia? ¿Podría ser considerado como fuente de inspiración, voluntad y coraje para seguir adelante, hasta finalmente algún día ser libre?. Lo que no hay duda es que muchas tribus judías no practicaban la circuncisión antes del cautiverio egipcio, lo cual da mucho a qué pensar.
Identidad cultural (Lewinson 1958), ritual de fertilidad para obtener buenas cosechas, debido al hecho que algunas culturas la realizaban en determinados momentos del año y el pene tiene 'poderes que producen vida' (Rogers 1956), Barns (1936) refería que en Nicaragua la sangre de la operación era mezclada con maíz para ser tomada durante las ceremonias de los sembradíos.
Según Liebert (2002) en su trabajo "Circuncisión: un acto simbólico?", refiere que "el acto de herirse a uno mismo y derramar la propia sangre es un gesto universal y antiquísimo.
Castración y culto fálico son indisociables. El Rey simboliza el falo universal y su muerte es un acto de autocastración. La muerte masculina y la detumescencia del pene están íntimamente ligadas (Freud 1939).
Psicoanalíticamente las mutilaciones sexuales se consideran como fundamentalmente ambivalentes: desorganizado y diabólico cuando está impuesto por un sujeto encarado y organizado y benéfico cuando es intencional: la circuncisión libera al pene de su parte femenina y acentúa su carácter fálico, con lo cual se supera o vence una ansiedad fundamental". Como una fuente de vida y muerte en ciclos cósmicos es reflejado vía una ceremonia de sacrificio en la forma de rituales asemejando ecos de la castración primordial o primigenia y un compromiso entre deseo de muerte y la amenaza de aniquilación.
La Teogonia 'Generación de Dioses' de Hesiodo (poeta griego del siglo VII a.c., escribió dos obras importantes: "Los Trabajos y los Días", donde describe la vida de los campesinos de su tiempo y enseña cuando ha de hacerse cada trabajo del campo; y "Teogonia" donde habla de los dioses griegos, cuenta que la ruptura del abrazo o convenio impuesto por Urano "Rey de las Montañas, el Cielo y la Tierra". Deseando terminar con el acoplamiento interminable que previene las futuras generaciones, Gaia (madre tierra), exhorta a sus hijos a penalizar a su padre y Kronos el mas joven de los Titanes corta los genitales con su mano izquierda (desde entonces la siniestra) a su padre Urano con una hoz y los arrojó al mar cerca del Cabo Drépano. Del esperma derramado mezclándose con la espuma del mar nace Afrodita. Esto separa el délo de la tierra, dejando que la creación tome su rumbo. Esta mutiladón liberadora y sacrilega establece súbitamente el amplio reino de la violencia y marca el nadmiento del amor (Afrodita) (Julien 1997).
Esto asemeja al mito de Isis ('La que llora') la figura más conodda del Panteón egipdo representante del prindpio femenino, fuente de toda fecundidad y de toda transformadón y Osiris "Hijo del Cielo y de la Tierra" primer Dios que se manifestó en el mundo y reinó sobre los hombres, la mas antigua de todas las Teogonias donde se produce una batalla fratridda entre Seth y Osiris, ésta reina sobre Egipto junto a su hermana y esposa Isis. Seth captura a Osiris por envidia, y lo corta en 14 pedazos, los cuales disemina por el país. Isis parte en busca de su marido y lo encuentra excepto por su falo (perdida de la función creadora) que lo había devorado un cangrejo. Lo reconstruyó y lo momificó y le devolvió la vida, para luego criar a su hijo Horus quien a la postre se vengaría matando a Seth. Exalta el amor maternal y conyugal y la abnegación. (Julien 1997).
Kuss y Gregoir (1990) refieren que la hipótesis más probable es que el antiguo Egipto localizaba el alma en los genitales, querían ofrecer su piel a las divinidades como un signo de su alianza sumisión. El color rojo del horizonte (usual en Egipto al amanecer y al atardecer) se interpreta como reflejo de la sangre de la circuncisión de su Dios Ra.
Freud (1939) refería además "los mas profundos motivos del antisemitismo nacen de raíces y tiempos antiguos. Proviene del inconsciente de la gente y uno de las costumbres que ha aislado a los judíos entre ellos mismos es la circuncisión que siempre ha dado una insatisfactoria e inquietante impresión la cual indudablemente podría ser explicada por su semejanza con la castración terrorífica y entonces toque el fragmento de un pasado primitivo que uno quiere olvidar.
Freud(1920,1939,1952,1953) refería que San Pablo o Pablo de Tarso, el perpetuador del Judaismo también se convirtió en su destructor. Introdujo la idea del sentimiento de culpa de la humanidad y del concepto de redención. El abandonó la idea del pueblo escogido y abandonó su visible signo de la circuncisión, ya que la nueva religión podría difundirse universalmente.
Desde los siglos XVIII en adelante se comenzó a asociar enfermedades de transmisión sexual y fimo-sis, con lo cual la indicación de circuncisión obedecía a razones netamente médicas-orgánicas por la retracción "intratable" médicamente de dicho prepucio, haciendo necesaria la practica de la circuncisión. La gonorrea ocasionaba la fimosis gonorreica, la cual numerosas veces terminaba con la cirugía de la piel prepucial. (Abernathy 1828). Y ya francamente en el siglo XX se asocia la circuncisión con la profilaxis de infecciones de transmisión sexual, y cáncer (Ravich 1973).
TRASCENDENCIA DE LA CIRCUNCISIÓN EN LAS DIFERENTES CULTURAS
Se hada según Hutcheson (2004) como ritual de sacrifido, como signo de sumisión a una deidad, como ofredmiento de fertilidad, como marca de identificadón tribal, como paso de la pubertad-ado-lescenda a la adultez, como ritual de humiliation y marca al enemigo, siendo posteriormente realizadas como parte de una estrategia antimasturbatoria, como profilaxis para un sinnúmero de patologías muy disímiles entre si, como parte de una estrategia nacional de higiene, como profilaxis contra infecciones de transmisión sexual.
Se hada ya en el siglo XIX y XX para patologías como la fimosis, parafimosis y en los casos de balanitis y balanopostitis a repetición (Potenziani JC, Informe Médico, 2005).
La fimosis definida como "estrechez rara, inflamatoria o cicatricial del orificio prepucial consecuencia de condiciones patológicas reales mas que una enfermedad en si misma" según criterios de Hodges (1999), ha sido la indicación principal no religiosa de la circuncisión.
En la antigüedad, se dejaba para rituales de tipo religioso y para reforzar y hacer evidentes privilegios de clase sodal o de realeza, ya que no creemos que podían esgrimirse conceptos de higiene cuando en realidad no se conoda el concepto.
La palabra "higiene" viene del término griego 'Hygieie', o 'Higia', nombre que se le daba entre los griegos a la Diosa de la Salud y fue retomada por la medicina hipocrática, secularizándola y otorgándole el sentido de un conjunto de normas que deberían ser seguidas para mantener la salud y prevenir las enfermedades (Quevedo 2004), (Andrade 2003).
Esto podría derrumbar las hipótesis que explicaban que la circuncisión que se realizaba, antes de la época griego-romana, seguía preceptos higiénicos, en un momento en la cual la humanidad sufría las con-secuendas de la falta de higiene, según los preceptos aduales y de no tener conocimientos de control de enfermedades, ni de disposidón y control de excretas, ni de tratamiento del agua para convertirla en potable, ni de la conservación de los alimentos para impedir su descomposición. En fin creemos que el concepto de higiene como tal se conoce hoy en día, no era un fador de realizadón de la drcundsión.
Posteriormente las explicaciones para su realizadón, van desde consideradones estéticas, a con-sideradones patológicas, sobre todo en los 200 años trascurridos desde mediados del siglo XVIII hasta mediados del siglo XX, donde se escribieron centenares de trabajos médicos dando fe cierta de que la fimosis era 'indudablemente' la causa de enfermedades como cáncer del sistema genitourinario en el hombre y en la mujer, enfermedades venéreas, malnutrición, cuadros de epilepsia, hidrocefalias, demencia, idiocia, hábitos de masturbación, enfermedades cardiacas, homosexualidad, sorderas, infecciones urinarias, criminalidad y muerte, para solo mencionar algunas (Hodges 1999).
Desde mediados del siglo XX, y sobre todo en sus últimos 25 años y comienzos del siglo XXI la circuncisión resulta importante en el combate contra las infecciones de transmisión sexual (I.T.S), (Fakjian 1990),(Fink 1989),(Fleiss 1995), (Tyndall 1996).
Inclusive durante un tiempo se habló de la necesidad de cirugía de circuncisión en neonatos con infecciones urinarias a repetición, pero ésta indicación ha disminuido, quedándose sólo para aquellos casos que sin duda alguna la fimosis es el factor obstructivo a la libre salida de orina, causando altos niveles de orina residual con la consiguiente infección urinaria (Ginsburg 1982), (Roberts 1986).
CIRCUNCISIÓN EN EL FÉRTIL CRECI ENTE-MESO POTAMIA
Evidencias descubiertas por Hauptmann y Schmidt de la Academia Heildelberg de Humanidades y Ciencias de Alemania en conjunto con el Museo Arqueológico Sanhurfa de Turquía comenzaron a estudiar un asentamiento mesopotámico sobre un tributario del río Eufrates en el reservorio de Atartuk y otro sitio denominado Gobekli Tepe, en la llanura de Harran, sitios activos entre los años 8.500 y 9.500 a.c, consiguiéndose figuras itifálicas andrológicas-ginecológicas de tres metros de altura en forma de T y realizadas en piedra caliza, semejando en ocasiones penes circuncidados, lo que vendría a reforzar la teoría de Smith, egiptólogo ingles, que refería que la circuncisión era uno de los signos de las culturas helioliticas diseminadas por el mundo 15.000 años atrás. Igualmente se describen en la cultura magdaleniana (15.000 a 9.000 años a.c) modelos de falo en hueso. Posteriormente en el periodo neolítico las figuras itifálicas (con el pene erecto), eran sumamente comunes, dando a entender que los símbolos de la sexualidad eran parte de cultos religiosos.
Sabemos de momias egipcias circuncidadas, así como de jeroglíficos que nos muestran a sacerdotes de alto rango y miembros de la nobleza egipcia circuncidados. En el museo del Cairo aparece una pintura de un faraón circuncidado del año 3.000 a.c pero según Wallerstein (1983) podríamos hablar que la circuncisión se está efectuando en tierras egipcias desde el año 4.000 a.c.
Un relieve egipcio (realizado durante la VI dinastía) hace ver la realización de una circuncisión en un joven. Se sabe que durante la sexta dinastía correspondiente al denominado Imperio antiguo, que va del 2.700 al 2.185 a.c y que fue constituido por 4 dinastías de las 31 que están descritas (Manetón-Crónica de Reyes), se lee en el "Libro de la Muerte" un mito egipcio que describe que el Dios Solar Ra se circumdsa a si mismo, cortándose su órgano viril y con la ayuda de los Dioses Hu y Sia se origina el Universo y la existencia humana a partir de la sangre que sale de su miembro viril mutilado o drcundda-do. Esta sería una de las explicaciones de la práctica de la circuncisión en el pueblo egipcio.
El egiptólogo Budge EA (1895) en su libro "Los Dioses de los Egipdos" menciona que en los inidos de la civilizadón egipcia, existía un Dios de la Circuncisión cuya misión o trabajo era mantener la fertilidad en los bancos del Nilo.
Herodoto, historiador griego del siglo V a.c escribía que los egipdos pradicaban la drcundsión con el objetivo de estar aseados y limpios, considerando que era preferible "estar" limpios que "parecerlo".
En un grabado de la tumba de Ankhmahor que era capataz-Visir del Rey Teti (6a. dinastía alrededor del año 2345 a.c) en la ciudad de Sakkara (Egipto), se ven los pasos de la circuncisión y las actitudes del cirujano (que era el sacerdote), su ayudante y el padente. Se sabe que era un procedimiento que se realiza en la pubertad-adolescenda. La práctica de la circuncisión era prádica común en Africa, Egipto para posteriormente extenderse al pueblo hebreo, al pueblo árabe y otros pueblos del medio oriente. El bisturí en el Imperio antiguo eran hojas de obsidiana o pedernal (piedra de chispa) y en los Imperios nuevos (1567-1085 a.c) el bisturí era de metal. Se colocaba miel con aceite para mejorar la cicatrizadón y evitar las infecdones de la herida.
Además de los motivos religiosos que obligaban a los egipdos a realizar el procedimiento tenían también motivos higiénicos, motivos de pureza, así como se consideraba un requisito para contraer matrimonio y como un tratamiento para la denominada gangrena del prepucio. Tenemos testimonio de que los instrumentos quirúrgicos mas sofisticados eran originarios de Egipto y por eso es que griegos y romanos consideran a Egipto como la cuna de la mediana (Hernández 2004).
El antiguo Egipto pradicaba la circuncisión originalmente constituido como un signo de dase social. El poder político y religioso estaba en las manos del sacerdote quien rapaba su cabeza y se circuncidaba.
Kuss y Gregoir (1990) refieren que la hipótesis más probable es que el antiguo Egipto localizaba el alma en los genitales, querían ofrecer su piel a las divinidades como un signo de su alianza sumisión. Y además existía la intendón de purificarse con el acto. El color rojo del horizonte (usual en Egipto en el amanecer y atardecer) se interpretaba como reflejo de la sangre de la drcundsión del Dios Ra.
El dibujo que se tiene de la circuncisión es de Saqqarah representando un bajo relieve donde se efectúa una drcundsión (Mastaba de Ankh-má-Hor 2.200 BC), el operador se llama "Padre drcundsor". Se la llamaba Tahara (purificadón). Mientras que en otros países árabes el ritual conservaba el nombre de Khitan.
La edad en la que los egipcios pradicaban su circuncisión refleja la importanda del ritual y de la operación. Filón de Alejandría (filósofo judío), así como los escritores griegos y San Ambrosio sitúan la edad entre 13 y 14 años, y en los periodos avanzados de la dvilización la operadón era para todos los varones egipcios no solo para la clase sacerdotal.
En el dicdonario filosófico de Voltaire (1764) "Clemente de Alejandría reporta que Pitágoras viajando a Egipto fue obligado a drcunddarse para ser admitido en los misterios, por lo tanto era absolutamente esendal para pertenecer a los sacerdotes egipcios, al igual que para ser admitido a la Biblioteca de Alejandría y con ello acceder a los conocimientos de la época. Los sacerdotes orientales se hacían determinadas marcas corporales para congraciarse con sus Dioses. Los sacerdotes de Baco se grababan hojas de laurel. Luciano nos dice que los devotos de la Diosa Isis se grababan dertos caracteres sobre sus muñecas y cuello. Los sacerdotes de Cibeles se convertían en eunucos. Muchos de los egipdos que reverenciaban el instrumento de procreación ofertaban a los Dioses Isis y Osiris creadores de la vida sobre la tierra una pequeña parte del miembro que perpetuaba la espede humana.
Ghalioungui (1969,1983) en "La Medicina de los Faraones" refería como una de las explicadones propuestas para la pradica de la drcundsión era que querían eliminar la ambigüedad sexual de los adolescentes al resecar el prepudo, los labios menores y el clitoris. No nos olvidemos de la condición de ambigüedad sexual de los Dioses Creadores."
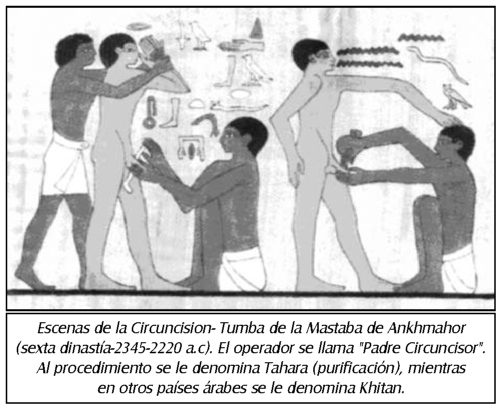
Dentro de la cultura egipcia el incesto estaba permitido y la circuncisión, prádica adoptada posteriormente por los judíos, tenía un caráder ritual en la ceremonia de iniciadón de la adolescenda (Vera Gamboa 1998).
Es probable que en el antiguo Egipto el enorme volumen de casos de hematuria y síntomas urinarios bajos irritativos, por la infecdón proveniente de las aguas del Nilo, por el Schistosoma haematobium (Allen 1909), pudo ser la explication de que se adoptara la costumbre de la circuncisión, al darse cuenta de que el prepucio se convertía en asiento de infecciones y posible causa de la antes mencionada hematuria.
Posteriormente los judíos allí cautivos, adoptarían la costumbre y la llevaron con ellos al salir de Egipto,
pasando de un precaución sanitaria, sacerdotal, social y teogonica, a un rito religioso (convenio con Dios) (Weiss 1997), (Cline 1997), (Cooley 1996).
ARNOLD (1886) REFERÍA "NUNCA SE DEBERÍA OLVIDAR QUE ENTRE LOS PUEBLOS PRIMITIVOS CUALQUIER LEY O USANZA TRADICIONAL TENDÍA, CON EL PASAR DEL TIEMPO, A ASUMIR UN CARÁCTER RELIGIOSO".
CIRCUNCISIÓN EN EL PUEBLO JUDÍO
El filosofo judío Baruj Spinoza (1622-1677) refería "respecto a la circuncisión, me parece de tan gran importancia, que a mi juicio, puede ser por sí solo el principio permanente de conservación del pueblo judío".
Paradójico e interesante, ya que estas palabras provenían de un filósofo alejado de los dogmas ortodoxos judíos, como dice Perednik (2003), casi un apóstata.
Hoffman (1995) menciona la importancia de la circuncisión para el pueblo judío en su excelente trabajo "La circuncisión como un símbolo en la psique judía".
No hay duda que la circuncisión como símbolo de compromiso, de renovación de pacto ancestral, representa un distintivo judío. Un símbolo que nos ha separado de los cristianos desde que Saúl, posteriormente Pablo de Tarso decidiera eliminar la circuncisión como requisito de ingreso a la iglesia primitiva cristiana, basado en que Abraham fue traído a la fe de Dios antes de su circuncisión.
El libro de los Reyes nos insinúa que ya bajo el reinado de Izbel (s.XI a.c), los judíos habían abandonado la tradición de la circuncisión. En el siglo II a.c, durante la época helenística (Antíoco Epifanes), se volvieron a reblandecer las costumbres judías en cuanto a la circuncisión, no sólo al no hacérsela, sino inclusive realizando cirugía de restauración del prepucio para eliminar cualquier rastro de la misma.
Las prohibiciones formales como la de Antíoco (s.II a.c), la de Adriano (s.II d.c), la de Justiniano (s. VI e.c.) no lograron tampoco eliminar la costumbre ancestral. (Perednik 2003), la tradición sin embargo estaba demasiado arraigada en el pueblo judío, como para ser erradicada.
La circuncisión no nace con Abraham y el pueblo judío. Sabemos de su práctica desde antiguas civilizaciones mesopotámicas, específicamente los semitas de la región occidental del fértil creciente influenciados por la cultura egipcia. Posteriormente tratando de mantener una identidad particular para diferenciarse de los babilonios, ella adquiere importancia y trascendencia.
Inclusive entre los propios judíos previos al exilio no representaba una práctica importante. A pesar de que se realizaba e inclusive se menospreciaba a los judíos que no se circuncidaban, como los filisteos, la significación de la misma, como es conocida hoy en día la adquiere, según muchos investigadores durante el éxodo a la "Tierra Prometida", posterior al cautiverio egipcio que duró 205 años.
Adoptaron la circuncisión en Egipto. Una de las especulaciones que esgrimen numerosos historiadores es que la arena del desierto causaba irritación y posteriormente infección en la zona prepucial de los niños, que actuaba como saco reservo-rio para dichas infecciones. Por lo tanto para evitar esto, los egipcios sometían a sus esclavos a la circuncisión para proteger la salud de sus esclavos y con ello mantenerles su habilidad para el trabajo evitando enfermedades debilitantes como hematuria, disuria y complicaciones genitourinarias que a menuda causaban la perdida de un esclavo e inclusive su muerte.
Herodoto en el siglo V a.c reporta que "Los colchidianos, egipcios y etíopes son los únicos pueblos que han siempre practicado la circuncisión. Los fenicios y los sirios palestinos reconocen que ellos adoptaron sus hábitos de los egipcios. Los sirios viviendo en el valle de Thermodon puntualizaron que recientemente habían olvidado o borrado la costumbre de los colchidianos. Estos son los únicos pueblos que practican esto y se nota que observan las mismas reglas que los egipcios.
Voltaire (1764-Dicdonario Filosófico) menciona a Herodoto y opina que "Está daro que muchos pueblos adoptaron la pradica egipcia de la drcundsión, pero ninguna nación ha jamás clamado haber adoptado la circuncisión de los judíos. Los judíos admiten que ellos vivieron en Egipto por 205 años, y ellos están orgullosos del hecho de que ellos no practicaban la circuncisión en este periodo.
Por lo tanto esta claro que los egipcios no aprendieron la circuncisión de los judíos durante estos 205 años. ¿Podría un maestro adoptar la marca principal de la religión de sus esclavos fugitivos, y considerados también como ladrones? No entra dentro de la naturaleza humana.
El libro de Josué dice que los judíos fueron circuncidados en el desierto, sin embargo se consiguen estudios que reflejan que no hubo circuncisiones durante la travesía e inmediatamente antes de entrar a la Tierra prometida circuncidaron a sus varones.

Freud (1939) en su libro titulado "El hombre Moisés y la religión monoteísta", postula que Moisés era un egipcio de alto rango muy cercano al faraón Akenaton y un adepto de la religión monoteísta que deseaba imponer, Aton el Dios Sol, con el faraón como su representante sobre la tierra. "Si Moisés fue un egipcio y si el pasó su propia religión a los judíos debió haber sido la religión de Aton. No solo dio una nueva religión a los judíos sino que introdujo la circuncisión en ellos.
Este hecho que menciona Freud, es de capital importancia para nuestro problema y no ha recibido la atención que merece. Los relatos bíblicos son contradictorios en numerosos aspectos, consecuentemente hay solo una respuesta al origen de la circuncisión de los judíos... y es que proviene de los egipcios.
La circuncisión judía llamada "Berith Milah" es una de las mayores prácticas rituales del judaismo, de origen bíblico y fundado en la circuncisión ritual de Abraham (Romberg 1982), (Snowman 1971). Berith (alianza), es parte de una cadena etimológica que proviene de Bharatar (Persia), Phreter (Griego), Frater (latín), Brother (inglés) y Bruder (alemán) y en árabe el término es "Khitan".
El día que Abraham fue circuncidado, a los 99 años junto a su hijo Ismael y a 318 hombres de su clan, ese día se volvió importante para el pueblo judío y se denomina "Iom Kipur" o día del Perdón. "Es el único medio para llegar a la perfección espiritual y material, condición indispensable para poder estudiar y comprender la Torá. Es por ende la señal que identifica el pacto o convenio que realizó Dios con Abraham y su descendencia de ser el 'Pueblo Elegido'.
El rofé o médico hebreo, es considerado un cirujano debido a la práctica de la circuncisión. Practica que está descrita en el Génesis (17,11-12), donde Dios revela a Abraham "Circuncidarán la carne de vuestro prepucio" y ésta será la señal del pacto entre ustedes y Yo, y en el curso de todas vuestras generaciones, ustedes realizarán la circuncisión en cada varón a la edad de 8 días. Tenía pues el objetivo de consagrar al Señor, desde el nacimiento, la vida de cada hombre y recordarle cada día éste pacto. Se dice que tenía como objetivo secundario, recordarle a cada hombre que la existencia consagrada a Dios debía realizarse día a día afirmando la supremacía del espíritu sobre los instintos y placeres de los sentidos (Cosmacini 2003).
Moisés circuncidó a los varones de 8 días de nacido cuando salieron en el éxodo de Egipto hada la Tierra prometida y al final del viaje, 40 años después su hermano Josué hizo circuncidar a todos los que habían nacido durante los 40 años del viaje por el desierto enterrando sus prepucios en las arenas del desierto.
Codificada en el Talmud en el 2do siglo d.c modificada por Maimonides en el siglo XII d.c y por
Jospeh Karo en el siglo XVI es un imperativo para todos los redén naddos varones y debe ser hecha al 8 día después de nacer excepto si hay contraindicaciones medicas. Es hecha en casa, por un Mohel u otro varón calificado. Si es hecho en la sinagoga el padrino mantiene al niño sentado sobre la silla del profeta Elias llamado "el ángel de la alianza". Es un acto eminentemente religioso que comprende dos bendiciones y el nombre del niño es dado es la misma ocasión.
Freud refería "Originalmente lo sagrado no es nada mas que la continuadón del padre primitivo". "Saher" no solo significa sagrado o consagrado sino que también significa diabólico y abominable. La dr-cuncisión es el substituto simbólico para la castración inidalmente infligida por el Padre primitivo sobre sus hijos en la plenitud de su poder y por adoptar este símbolo uno demuestra que uno estaría gustoso a someterse uno mismo al deseo paterno aun si requiere el más doloroso sacrifido. Refería que los más profundos motivos del antisemitismo nacen de raíces y tiempos antiguos. Proviene del inconsdente de la gente y uno de las costumbres que ha aislado a los judíos es la drcundsión que siempre ha dado una impresión insatisfadoria e inquietante la cual indudablemente podría ser explicada por su semejanza con la castración reminiscencias de un pasado primitivo que la gente quiere olvidar.
Un primer intento para prohibir la prádica de la circuncisión fue en el mediterráneo muchos cientos de años antes del nadmiento de Jesús bajo el reinado de Antioco Epífanes en el siglo II a.c en Judea. Tres siglos después bajo Adriano se quiso hacer lo mismo, dando origen a una revuelta judía (Bar Kokhebha) en el 132 d.c.
Antonio el Piadoso entre los años 86-161 a.c prohibió a los judíos circuncidarse y los castigaba con la muerte. En el siglo XIX la circuncisión no solo fue tolerada sino fuertemente aconsejada por razones medicas e higiénicas y para combatir la masturbación y aun mas la enuresis, entre anglosajones protestantes particularmente en los Estados Unidos de Norteamérica (WASP).
El pueblo judío cumple lo ordenado por Dios. A cambio del derecho divino de la tierra prometida, Canáan, Abraham en su propio nombre y en el de sus descendientes se compromete aceptar a Dios como la deidad del pueblo judío. En Génesis 17.7 "Yo establezco contigo y con tu descendencia después de ti por sus generadones, mi pacto eterno de ser tu Dios y el de tú descendenda después de tí. Y como firma del pacto Abraham acepta el rito de la drcun-cisión en hebreo Herith que significa pacto. En Génesis 17.10. " Este es mi pacto que guardareis... circuncidad todo varón".
De manera curiosa Abraham era un semita oriental y se dice que fue drcunddado a muy avanzada edad, más precisamente a los 99 años. En el libro del Génesis 17.24 leemos: "Era Abraham de noventa y nueve años cuando se circuncidó...".
Se podría interpretar que la drcundsión tenía que ver con la fecundidad personal y con la fertilidad de los campos y por ende con la prosperidad del pueblo que la pradicara. En el génesis Cap XVII,13 se indica que "el pacto señalado en vuestra carne es para denotar la alianza eternal que hago con vosotros". En el génesis XVII,2 antes de ordenar la circuncisión dice: "Te multiplicaré más y más en gran manera y procede entonces a enunciar el pacto".
Para los investigadores e Historiadores que aducen que el pueblo judío fue el primero en practicar la circuncisión referirán que Abraham vivió en el siglo XVIII a.c precediendo cuatro siglos a Akhenatón de Egipto (Amenofis IV) esposo de Nefertiti (Messadié 2001), fundador supuesto del monoteísmo, siendo Abraham el fundador por su parte del monoteísmo judío con sus costumbres de circuncisión.
En el Talmud de Babilonia había una regla que prohibía la circuncisión si se hubiera presentado antes en la familia dos hijos que hubieran sangrado durante el ritual, lo que hace suponer que tenían der-to criterio en lo que a trastornos hemorrágicos se refiere (Sanabria 1986,1999). En el libro del Levítico se describe una enfermedad que se relacionaba con la practica sexual, lo que se cree era la gonorrea y Moisés señala su alta contagiosidad y su manera de prevenirla evitando el contado sexual en los momentos iniciales de los síntomas. Induso hay hipótesis que tenía lugar en el momento histórico donde los israelitas luchaban con los madianitas.
CIRCUNCISIÓN EN EL PUEBLO ÁRABE
En Arabia la circundsión precedió al Islam. Uno del requerimiento de naturaleza religiosa (Fitra) era la circuncisión. Es mencionado en la poesía preisla-mica y en el Hadith, la palabra del profeta Mahoma.
Se sabe que hay un tiempo recomendado para la circuncisión, hay un tiempo obligatorio y hay un tiempo permisible. Como tiempo recomendable es al séptimo día de nacido, el día de aq. Hay un tiempo permisible que es permitido realizar la circuncisión antes del 7 día o después hasta antes de la pubertad. Hay un tiempo que es el periodo obligatorio cuando la pubertad llega ya que es cuando las acciones de culto y reverencia, purificaciones y plegarias se hacen obligatoria y solo se pueden hacer correctamente si el individuo está circuncidado.
En el Islam la circuncisión masculina no es ordenada por el Coran. Es parte del Sunnah (roles de conducta establecidos por el profeta). En Turquía la operación se le denomina Sunnah y al drcuncisor Sunnatji.
Bouhdiba un escritor árabe dijo que la circuncisión era mas una practica musulmana que islámica. Por lo tanto es una costumbre árabe, causa de festividades equivalente a una boda. Es un momento privilegiado, momento de reunión familiar, reunión vecinal o de amigos. Según Andrade (2003) todo musulmán debe estar drcunddado antes de contraer matrimonio.
Según el historiador judío Josefo (37-100d.c), autor de "La guerra de los judíos" y "Antigüedades judaicas" (Ant.,I,xii,2) la edad en la cual los árabes eran circuncidados era a los trece años en imitación de Ismael (Gen xvii,25). Hoy en día los mahometanos se circuncidan entre los 7 y los 12 años.
Los musulmanes son al mayor grupo religioso en el mundo que realiza circuncisión masculina y femenina. Ellos los consideran al Corán como el último mensaje que Dios envió a la Humanidad a través del profeta Mahoma a quien le fue revelado entre los años 610 y 632 d.c la fecha de la muerte del profeta. El Corán aceptado por todos los musulmanes fue recogido 15 a 20 años después de la muerte de Mahoma en los tiempos del Califa Utman, quien ordenó que todas las previas colecciones fueran quemadas.
Muy curiosamente en el Corán no hay referendas ni a la drcundsión masculina ni femenina. La palabra circuncisión no existe en el Coran, ni siquiera se menciona la circuncisión de Abraham. La única referencia explícita está en dos versos 2:88 y 4:155 en los cuales se utiliza la palabra no-drcunddado de manera metafórica, no literal, asociado con corazones, como cubierta. De acuerdo a Al-Jahiz (siglo IX d.c) la drcundsión masculina y femenina ha sido practicada por los árabes desde los tiempos de Abraham y Hagar hasta nuestros días (Abu-Sahlieh
1994).
Consideraban el prepudo impuro y desataron contra los no-drcundsos en sus poemas e invectivas. En la poesía de Al-Qays (siglo VI d.c) llamó al emperador bizantino "aghlaf" que significa no-circunciso. Al-Marsafi refuerza la idea de que los árabes son denominados "La nación de la circuncisión".
Pero podría ser impredsa la afirmación que los árabes practicaban la circuncisión por muchas razones: en primer lugar en los tiempos de Mahoma los árabes pradicaban tres religiones, la judía, la cristiana y la pagana, por lo tanto los judíos pradicaban la drcundsión, pero los cristianos no y los paganos supuestamente practicaba la drcundsión pero la Biblia los denominaba los no-drcundsos.
Inclusive no se sabe a cienda cierta si Mahoma fue circuncidado, según escritos y colecciones de Hadiths como los de Ahmad Ibn-Hanbal (siglo IX d.c), deda "Uthman Ibn-al-As fue invitado a la drcundsión, pero el se rehusó. Cuando le preguntaron la razón el dijo: en los tiempos de Mahoma no practicaban la drcundsión y no estábamos invitados para eso.
Se concluye diciendo que las personas eran libres de drcunddarse, según sus deseos, no era obligatoria en los tiempos de Mahoma e indusive algunos siglos después. (Quereshi 2004).
Los musulmanes le dan una gran importancia a la Sunnah o tradidones de Mahoma, el cual es considerado la segunda fuente de ley islámica. El autor de la Sunnah es Mahoma. El autor del Corán es Dios. Los sunnitas y los shiitas tienen sus propias colecciones que contradicen y se oponen a las colecciones de los rivales religiosos.
Hay cuatro versiones contradictorias respedo a la circuncisión de Mahoma. Mahoma refería: "Por motivo de mi honorable posidón en Dios, Yo nací drcunddado y nadie vio mi pudor (pudendum).
Ibn-Abbas decía que el mensajero de Dios había nacido circuncidado y con el cordón umbilical cortado. La segunda versión es que Mahoma había sido circuncidado por el ángel que abrió su tórax y purificó su interior. La tercera versión es que el abuelo de Mahoma Abd-al-Muttalib circuncidó a Mahoma cuando la tenia 7 días de nacido, hizo una fiesta y le puso nombre. La cuarta versión es que Mahoma nació incompletamente circuncidado y su abuelo cortó el resto de su prepucio.
La orina del no-circuncidado es impura según la tradición shiita. Según el Hadith de Mahoma dice "la tierra se vuelve profanada 40 días por la orina de una persona no circuncidada", "La tierra se queja vehementemente a Dios por la orina de los no-circuncida-do", "Circuncisa tus hijos cuando ellos tienen 7 días de nacido y es mejor para ellos y la progenie crece mas rápido".
CIRCUNCISIÓN EN LA GRECIA CLÁSICA
Era inconcebible en la Grecia Clásica la práctica de la circuncisión.
La estética prepucial ideal en la antigua Grecia y posteriormente en Roma tenía que cumplir con el requisito de ser lo suficientemente largo "que podía comprender por arriba de las tres cuartas partes de la longitud total del pene" y cubrir totalmente el glande, para no incurrir en el denominado lipodermos, y las personas que lo tenían se les llamaba leipodermos (Hodges 2001).

Para el pueblo griego y posteriormente también en la Roma clásica era un acto bochornoso, chocante descubrirse el glande. No había peor problema para un atleta que aparecer desnudo en la arena y exhibir un glande al descubierto bien sea porque había sido circuncidado o porque había nacido así, con poca piel que lo recubriera.
Entre los griegos, el prepucio estaba dividido en dos estructuras diferentes: el posthe y el akro-posthión. El posthe era la parte del prepucio que recubría pene y glande y el akroposthión era la parte final que sobresalía del glande.
En la antigua Grecia, era descortés, incivil, grosero demostrar el glande, es decir tener el glande sin recubrir por el prepucio.
Era normal en los Juegos Olímpicos griegos, que los atletas hicieran sus rutinas deportivas completamente desnudas, como vemos en las gráficas a continuación.

Durante juegos u otras ocasiones deportivas, los atletas (komasts) ataban lazos o tiras de cuero alrededor del prepucio, y colocándolo hacia arriba se lo amarraban a la cintura para prevenir que el glande protuyera; éste aditamento recibía el nombre de Kynodesme (del griego "correa de perro") y era en esencia el "protector de la moral publica".
En ésa época tenían un adjetivo para alguien que estaba circuncidado, o calvo o fuera un anciano desaseado, ésa palabra era psolos (Aristófanes
1995). Otros referían que simplemente dicha palabra significaba "tener una erección", ya que al tenerla, el glande podía sobresalir del prepucio que
lo recubría.
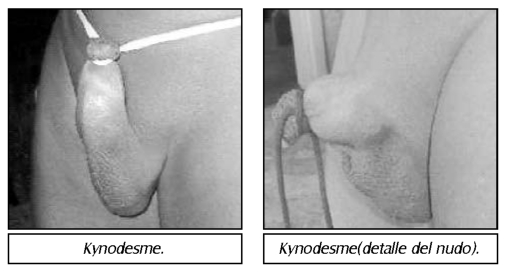
El hombre que tenía un prepucio deficiente o inadecuado, bien sea congénito o secundario, se definía como Lipodermos en griego "piel faltante". La persona que poseía el Lipodermos se le llamaba Leipodermos. Era tratada con Fitoterapia, tracción o cirugía. Dioscorides y Galeno, recomendaban para el Lipodermos congénito una planta rubefaciente llamada Thapsia garganica, la cual aumentaba el volumen (por inflamación) de los tejidos donde era aplicada y era muy útil en la zona prepucial.
En vasijas de cerámica donde se representaba Hércules destronando a Busiris mitológico sacerdote-rey de Egipto y se puede ver el sacerdote egipcio gordo, feo, con su pene circuncidado y su glande prominente exteriorizado, contrastando con la figura de Hércules con su pene cuyo prepucio es largo y tapa su glande.
Escritores griegos como Strabo (64 a.c y Diodorus Siculus (1 siglo .a.c) escandalizaban a sus lectores describiéndoles la practica de la circuncisión realizada por tribus primitivas de los territorios del Mar Rojo como los hebreos y los egipcios, refiriéndoles que algunos amputaban solo el prepucio y otros inclusive el glande y otros amputaban el pene completamente (Hodges 2001).
CIRCUNCISIÓN EN LA ROMA IMPERIAL
Al igual que en Grecia, los romanos compartían el rechazo por la circuncisión la cual consideraban una irreverencia barbarita, exceso y depravación (Hodges 2001).
Inclusive podemos ver abajo en una gráfica un sátiro con el detalle del glande recubierto con prepucio como demostración de arte etrusco, pueblo del centro-sur italiano, precursores del pueblo romano.
Galeno describió un aditamento o peso, tubo de cobre en forma de túnel, que funcionaba como antilipodermos, era conocido como "Pondus Judaeus" o "Judeum Pondum", por su relación principalmente con el pueblo hebreo.

Para los hombres que tenían glande al descubierto bien sea por prepucio ausente o subdesarrollado, o inclusive aquellos que se circuncidaban y se arrepentían Celso (siglo I d.c) realizaba la des-circuncisión realizando una incisión superficial de piel en la base del pene, por arriba de la vascularización del mismo y sin tocar la uretra, entonces la piel del tronco peneano es deslizada distalmente hasta cubrir el glande, posteriormente se anuda dicha piel, para que
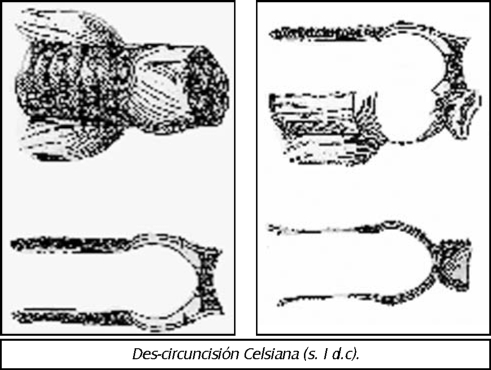
no se retraiga próximamente y se debe hacer muy suavemente para no obstruir el flujo urinario. La zona denudada del tronco peneano granulaba lentamente. Los resultados de ésta cirugía tanto funcionales como cosméticos parecen dudosos. La modificación de dicha técnica vino siglos después.
Antyllus, medico griego del siglo II d.c, definía el termino Fimosis como "tejido cicatricial inelástico" y deda que las granuladones patológicas de la zona eran la causa del prepudo no retraible y sintomático. Proponía una serie de indsiones como la cura para poder expandir y permitir que el prepucio funcionara adecuadamente.
Oribasius de Pergamo (325-403 d.c) era el mas eminente medico bizantino de la época y fue el médico personal del Emperador Julián El Apostata Sardiano acompañándolo en sus guerras contra Persia. Estudió mediana en la famosa escuela de Alejandría. Describió el tratamiento conservador de la restauración prepucial (procedimiento por medio del cual restauraba una parte de la piel prepudal), al igual que un siglo antes había ideado Celso en Roma, sobre todo en el pueblo judío. Desaibió una técnica llamada Krikosis del griego Krikos (anillo).
CIRCUNCISIÓN EN EL PUEBLO CRISTIANO
El aistiano no debería olvidar que el día primero de enero, cuando comienza el año en el almanaque gregoriano-cristiano, se conmemora el día de la circuncisión de Cristo
Es el tema de la circuncisión uno de los puntos cardinales de la "diferendación" del aistiano con el pueblo judío y los musulmanes. Tanto es así que en la Biblia se hacen numerosas citas para definir y adarar este punto.
El aistiano "No necesita del convenio para estar en Dios, con Dios o para tener la protecdón de Dios". Es la fe la que hace adivar los acontedmientos místi-cos-religiosos de la reveladón de Dios a cada cristiano. Fe y amor al prójimo deberán ser las bases del cristianismo. La idea fundada en el amor al prójimo, en la humildad y en un conjunto de valores de bondad y benevolencia, no advertidos en los sistemas religiosos hasta ésa fecha, atraerá paulatinamente la atención de los sedores cultos y pudientes, cansados de la banalidad de sus aeencias politeístas.
En su sendllo pero a la vez complejo mensaje, el cristianismo se apoyaba en una idea de revelación divina, que prometía la salvadón a través de un mediador, el Mesías, Jesús, que prometía instaurar una nueva vida, plena de amor y virtud. La salvación del fiel, dependía de su unión al Cristo salvador, unión que debía efeduarse a través de dos ritos: el bautismo, símbolo del renacer en Cristo, y la eucaristía, el ágape de comunión en la mesa del Mesías.
Excepto los coptos, los cristianos han reemplazado la costumbre judía de la circuncisión con el bautismo. La "circuncisión espiritual" tomó lugar sobre la circuncisión física a tal grado que en la Epístola a los Filipensis San Pablo discute la cierta y la falsa drcundsión. En "El verdadero camino de la salvadón cristiana" refiere "Pues los verdaderos dr-cundsos somos nosotros, los que damos culto según el espíritu de Dios y nos gloriamos en Cristo Jesús sin poner nuestra confianza en la carne, aunque yo tengo motivos para confiar también en la carne. Si algún otro cree poder confiar en la carne, mas yo. (3,3-4).
Por lo tanto la circuncisión cristiana es puramente espiritual una verdadera o simbólica desconexión de los pensamientos diabólicos, deseos impuros, falsas creencias y otras idolatrías y herejías en todas sus formas.
El Concilio de Jerusalén del año 48 fue el primer Condlio de la Iglesia Cristiana-Católica y fue convocado por un grave problema surgido de la conversión de gentiles al aistianismo. No olvidemos que los primeros aistianos fueron "judíos conversos", originarios de Palestina. El siguiente paso estuvo en la conversión de "judíos helenizados" o judíos que vivían en zonas helenizadas cuya cultura era diferente de la de los hebreos (ya vimos como surge un problema entre ambas comunidades judías resuelto al integrarlos en la asamblea de discípulos).
Pero el tercer paso fue incorporar cristianos provenientes del mundo pagano, es dedr: gentiles, no judíos. Los aistianos gentiles fueron en principio una minoría. Es muy importante destacar que en aquellos momentos los aistianos se sentían como la continuación del judaismo, parte integrante del Pueblo de Israel y judíos de pura cepa, pero los conversos gentiles no se sentían judíos y sentían rechazo ante las costumbres hebreas que imponían la drcun-cisión a los varones. En su Epístola a los Gálatas, en el capítulo 2, Pablo describe un enfrentamiento entre él y Pedro (llamado aquí Cefas) en Antioquia:
11 Mas, cuando vino Cefas a Antioquia, me enfrenté con él cara a cara, porque era digno de reprensión.
12 Pues antes que llegaran algunos del grupo de Santiago, comía en compañía de los gentiles; pero una vez que aquéllos llegaron, se le vio recatarse y separarse por temor de los circuncisos.
13 Y los demás judíos le imitaron en su simulación, hasta el punto de que el mismo Bernabé se vio arrastrado por la simulación de ellos.
14 Pero en cuanto vi que no procedían con rectitud, según la verdad del Evangelio, dije a Cefas en presencia de todos: "Si tú, siendo judío, vives como gentil y no como judío, ¿cómo fuerzas a los gentiles a judaizar?"
15 Nosotros somos judíos de nacimiento y no gentiles pecadores; a pesar de todo,
16 Conscientes de que el hombre no se justifica por las obras de la ley sino sólo por la fe en Jesucristo, también nosotros hemos creído en Cristo Jesús a fin de conseguir la justificación por la fe en Cristo, y no por las obras de la ley, pues por las obras de la ley nadie será justificado.
17 Ahora bien, si buscando nuestra justificación en Cristo, resulta que también nosotros somos pecadores, ¿estará Cristo al servicio del pecado? ¡De ningún modo!
18 Pues si vuelvo a edificar lo que una vez destruí, a mí mismo me declaro trasgresor.
19 En efecto, yo por la ley he muerto a la ley, a fin de vivir para Dios: con Cristo estoy crucificado:
20 Y no vivo yo, sino que es Cristo quien vive en mí; la vida que vivo al presente en la carne, la vivo en la fe del Hijo de Dios que me amó y se entregó a sí mismo por mí.
21 No tengo por inútil la gracia de Dios, pues si por la ley se obtuviera la justificación, entonces hubiese muerto Cristo en vano.
Este incidente provocado por el rechazo del Judaismo a los gentiles, rechazo del que ni siquiera
Pedro pudo escapar, motivará que se convoque el Concilio de Jerusalén (Primer Concilio Cristiano).
En esta reunión, de importancia capital para la Iglesia Cristiana, las tesis de Pablo de Tarso a favor de la completa apertura de la Buena Nueva a los gentiles triunfarán frente a las defendidas por los fariseos cristianizados que propugnaban la exclusión de los no judíos. Pero la postura de Pedro, que se decantó por las tesis de Pablo, inclinó la balanza a favor de la universalidad de la Buena Nueva.
A partir de esta fecha histórica, el mensaje de Cristo será proclamado a todos los pueblos de la tierra sin importar su raza. Y así quedó sancionado:
23 Por su medio les enviaron esta carta: "Los apóstoles y los presbíteros hermanos, saludan a los hermanos venidos de la gentilidad que están en Antioquia, en Siria y en Cilicia.
24 Habiendo sabido que algunos de entre nosotros, sin mandato nuestro, os han perturbado con sus palabras, trastornando vuestros ánimos,
25 Hemos decidido de común acuerdo elegir algunos hombres y enviarlos donde vosotros, juntamente con nuestros queridos Bernabé y Pablo,
26 Que son hombres que han entregado su vida a la causa de nuestro Señor Jesucristo.
27 Enviamos, pues, a Judas y Silas, quienes os expondrán esto mismo de viva voz:
28 Que hemos decidido el Espíritu Santo y nosotros no imponeros más cargas que éstas indispensables:
29 Abstenerse de lo sacrificado a los ídolos, de la sangre, de los animales estrangulados y de la impureza. Haréis bien en guardaros de estas cosas. Adiós." (Hechos, capítulo 15).
De esta forma, con un compromiso que obligaba a los cristianos gentiles a lo expuesto en el versículo 29, se les liberaba de la obligación de tener que convertirse al judaismo. La Iglesia ya era verdaderamente una Iglesia Universal.
En la sagrada Biblia Cristiana nos conseguimos bastantes referencias de la circuncisión. En el génesis en su segmento "La Alianza y la Circuncisión" 17,10-
14 se describe el pacto que Abraham realiza con Dios. En el Libro I de Samuel 1,18-25 se menciona la exigencia de Saúl a David de 100 prepucios filisteos como dote, para vengarse de los enemigos del Rey, siendo entregados sin embargo 200. En Epístolas a los Galatas 2:1-5 el apóstol Pablo refiere que "ni siquiera Tito que estaba conmigo con ser griego, fue obligado a circuncidarse".
En los evangelios vemos como en el Evangelio según San Lucas 1: 59-60 en la parte referente a la circuncisión de Juan el Bautista, e iban a dar el nombre de Zacarías como su padre y la madre se opuso y dijo que debería ser llamado Juan.
De nuevo en el Evangelio según San Lucas 2:21-30 se habla de la circuncisión de Jesús. En el evangelio según San Juan 7: 21-24 Jesús enseña en el banquete que el hizo un milagro y todos quedaron maravillados, lo que hace decirles: Si un niño puede ser circuncidado en un Sabbath debido a que la ley de Moisés no debe ser rota, porque se enojan conmigo por haber curado un hombre un Sabbath? Paren de juzgar por las simples apariencias y hagan juicios correctos y certeros.
En el Hecho de los Apóstoles 15: 1-21 sobre el Concilio de Jerusalén y algunos hombres provenientes de Judea hada Antioquia enseñaban que menos que estuvieran circuncidados, de acuerdo a las costumbres impartidas por Moisés no podían ser salvados. Entran en disputa Pablo y Barrabás y al final algunos de los creyentes que pertenedan a la secta de los fariseos se levantaron y dijeron: Los gentiles (paganos) deben ser drcunddados y requieren obedecer la ley de Moisés.
En Epístola a los Galatas 5: 1-12 mendona la Libertad en Cristo. Y menciona que ni la drcundsión ni la reconstrucción prepucial tienen valor para Cristo. La única cosa que cuenta es la fe expresada en ti mismo a través del amor.
En Epístola a los Galatas 6: 12-15 habla de la no-circuncisión. Se mendona que aquellos que quieren dar una buena impresión están tratando de que te dr-cuncides y lo único que quieren es huir de la persecución de la cruz de Cristo.
En 1- Epístola a los Corintios I 7: 17-20 habla de la inutilidad de la drcundsión y que siguiendo los mandamientos de Dios es lo que de verdad cuenta.
En Epístola a los Romanos 3: 28-31 en el segmento "A pesar de las promesas de Dios" se mendona la circuncisión que se justifica cuando se hace por fe y la reconstrucción prepucial a través de la misma fe.
En Epístola a los Romanos 4: 9-12 en el segmento "El ejemplo de Abraham' "Independientemente de la circuncisión" se dice ¿Es la bendición solamente para los drcunddados o también para los des-drcundda-dos?
En Epístola a los Efesios 2:11-13 acerca de Uno en Cristo. Recuerden que antiguamente Uds. que eran gentiles por nadmiento y llamados "no drcunddados" estaban separados de Cristo, excluidos de la ciudadanía de Israel y extranjeros con fe y sin Dios en éste mundo. Pero ahora en Jesucristo ustedes están cerca de él a través de la sangre de Cristo.
En Epístola a los Filipensis 3: 1-11. Se habla de la no confianza en la carne. Se menciona también la circundsión.
En Epístolas a Tito 1:10-16 acerca de la misión en Creta. Se habla de que hay mucha gente rebelde, especialmente aquel grupo de la circuncisión. Jesucristo, judío drcunddado exime a sus cristianos de tal pacto y en la ultima cena según el evangelio de San Lucas XII,19 refiere... éste cáliz es la nueva alianza.
Pablo, en Epístola a los Romanos II, 25-28 dice: por lo demás la circuncisión sirve si observas la ley; pero si eres prevaricador de la ley, por más que estés circuncidado, vienes a ser delante de Dios como hombre drcundsión. De los cuatro evangelios solamente el evangelio de San Lucas reporta que Jesús fue drcun-cidado. Igualmente en éste evangelio se consigue la referenda que Juan el Bautista fue drcunddado.
En el evangelio de Santo Tomas los disdpulos de Jesús le preguntan si la circuncisión es útil o no? Jesús contestó "Si la circuncisión fuera útil entonces el Padre pudiera haber creado a los hombres drcun-cisos desde el vientre de la madre. La circuncisión que de verdad es útil es la circuncisión del alma".
CIRCUNCISIÓN EN LOS PUEBLOS AFRICANOS
En ciertas culturas africanas la naturaleza purifi-cadora de la circuncisión tiene que ver principalmente con el miembro masculino como fundamento de la fertilidad, una vez que ha sido hecha, se derrama dentro de la herida agua fría contenida en una calabaza llenada durante la noche de un río rápido y caudaloso; al carácter purificador del agua se le añade la naturaleza inmutable del tiempo eternamente en progresión representado por el río el cual sobrevive a cada generación. El uso de la calabaza simboliza la fertilidad, recordándonos el huevo, la concha protectora; el padre que sostiene a su hijo durante el ritual le indica la importancia de la viri-lización permitiéndole la entrada al mundo masculino de la iniciacEntre los Masais (pueblo nilótico de Kenya y Tanzania), la circuncisión marca la etapa de cambio de la adolescencia a la adultez con celebraciones, danzas, cantos y manifestaciones pictóricas sobre el rostro de los 'iniciados'. Posteriormente tomará un brebaje compuesto de leche agria sumado a sangre fresca de ternera.
Entre los etíopes Konso, la circuncisión marca el final de la vida sexual y determinaron que la edad a la cual corresponde dicho momento es a los 60 años, posteriormente se convierten en 'travestís' y refiere Hernández (2004) dto textualmente "como si hubieran llegado a una espede de limbo sexual'.
Durante el ritual de la circuncisión de Madagascar el prepudo, encerrado en una fritura es ingerido por un tío paterno o un miembro andano de la comunidad para que el niño pueda vivir tanto como él. El sacrifido de un toro viriliza al niño transmitiéndole su masculinidad. El ritual transforma al niño, un ser neutral cercano a la mujer en un completo varón, quien entonces adquiere conocimiento por su padre y su integradón dentro de la familia paterna.
La palabra gandá significa 'inidacion del joven' entre los Bantú reladonada a la piel, por lo que se cree que la circuncisión está implicada . Y el verbo yénd-/-bénd que significa 'circuncidar' (Marck 1997).
Junod (1962) habla de la circuncisión entre los Tsonga como de origen mítico entre los surafricanos. El propósito de la escuela es introducir al pequeño niño a la adultez, para limpiarse del bukhuna para hacer de él un miembro completo de la comunidad.
El mito de muchas culturas africanas (Dogo, malinka, Bambara) nos narra que originalmente la circuncisión era el resultado de un desorden creado por el protagonista, quien mientras trataba de encontrar su hermana gemela, finalizaba por crear estrago con orden divina. Su aventura trasladada al nivel humano es el origen de la drcundsión y de la esdsión femenina, cada uno de ellos con la intención de suprimir el lado androgino de cada sexo, "fijando" al individuo en su propio genero.
En Africa por lo tanto es un ritual de "pasaje" hecho en la pubertad o durante el periodo inmediato precediendo a la pubertad y es un indicador de la madurez del niño.
La ceremonia africana de la circundsión requiere:
1) Redusión en un sitio secreto de la selva durante el cual el adolescente, retraído del mundo puede encontrarse a si mismo. 2) La extirpación del prepudo acordando al método local-regional violento o no. 3) Dejando fluir la sangre, podría significar la muerte de la infanda previo al renacimiento dentro de una nueva vida. 4) La aplicadón del cuidado posquirúrgico.
La drcundsión es una doble inidación: primero para guiar al niño dentro de su identidad sexual y segundo para llevarlo hada la responsabilidad adulta junto con su igual. Provee ser una escuela de coraje.
Aprendizaje de códigos masculinos algunas veces con la adopción de nuevos nombres, símbolos de renacimiento y testigo de nuevas responsabilidades que serán conferidas al circuncidado.
Vida, muerte, renadmiento. Estos son los tres estadios del niño africano que deberán atravesar simbólicamente antes de adquirir la adultez y permitírsele casarse y adherirse al dan para demostrar su capacidad viril como futuro cazador, guerrero y procreador. Le permite ser aceptado como un igual, le permite cohesión sodal y le confirma al individuo su madurez.
Es la circuncisión una marca física e identificato-ria y un pasaje obligado para obtener una perfecdón mental. Física y cosmogenica. En las sodedades africanas los problemas psicopatológicos son más prevalentes entre los no circuncidados quienes encuentran problemas en ser integrados a la sociedad y partidpar en su vida sodal. No hay en Africa ningún imperativo religioso subyacente.
El adolescente africano que toma parte de un ceremonial de la circuncisión sigue una preparación psicológica larga que comienza con sus primeros pasos por la vida. El día que se anuncia su inminente drcundsión es rodeado de sus compañeros y sometido
a durezas físicas y mentales. Es la completadón de un largo proceso de integración a su vida adulta. Cambia radicalmente sus hábitos, puede pescar y cazar y legitimizar sus acciones sodales. Lo califica para una vida sexual y lo autoriza para vestir ropas.
Sin embargo en el siglo XX en sus últimos 25 años, Africa ha tenido la desgrada de presentar afras alarmantes de infecciones por virus de la inmunodefi-ciencia humana (VIH) por lo cual la drcundsión se ha visto como un aliado en la lucha contra la transmisión de dicho flagelo (Caldwell 1996), (Green 1993).

CIRCUNCISION EN EL RENACIMIENTO
También en el Renacimiento la idea que prevalecía entre los artistas, pintores, escultores, orfebres era el "ideal de prepudo griego-dásico", por lo cual inclusive personajes de la historia bíblica hebrea evidentemente circuncidados, eran representados con el prepucio recubriendo todo el glande.

Vemos arriba uno de lo iconos renacentistas como lo es el David de Miguel-angel Buonarrotti (1504 d.c), el cual no estaba circuncidado aun siendo hebreo, considerándose esto no solo una "moda" de los artistas renacentistas italianos
del siglo XV y XVI, sino como parte de la búsqueda de la antigüedad clásica, como normativa y objetivo renacentista (Ciaglia 1971), (Schultheiss 1997).
CIRCUNCISIÓN EN LOS SIGLOS XVIII-XIXYXX
En 1756 un miembro de la Sociedad Medico-Física de Basilea-Suiza de nombre Tissot SD, escribió un tratado denominado "Onanismo o Tratado sobre los trastornos producidos por la masturbación o los peligrosos efectos de una Venus secreta y excesiva" donde el tema de la masturbación volvía a ser parte del "discurso médico" convirtiéndose en una obligatoria cita de consulta y erigiéndose en el libro fundamental de las campañas antimasturbatorias de la sociedad de su tiempo, llegando hasta nuestra época.
Declarándose entre otras cosas que "la masturbación era mas perniciosa que los excesos cometidos con las mujeres, inclusive con prostitutas". Fue una de las causas del auge de visitar lenocinios o burde-les en los siglos XVIII, XIX y XX con las consecuencias por todos conocidas, de la difusión de infecciones de transmisión sexual, tan devastadoras como la sífilis. Este fallecería en 1797 y gracias a sus campañas y las de Bekkers y muchos otros en contra de la masturbación como actividad perturbadora del hombre, la preferencia por las prostitutas y las casas de lenocinio era considerada "médicamente sensata" por los expertos y autoridades médicas de los siglos XVIII, XIX y comienzos del XX.
No nos olvidemos del manual de los niños exploradores de Robert Badén Powell, fundador de los Boys Scouts, Badén sostenía que el onanismo "provoca una debilidad de la cabeza y del corazón y si es persistente idiotez y locura". Recordando al Presidente del Real Colegio de Medicina de Londres el Dr. Jonathan Hutchinson (1890) en su publicación "On Circumcisión" recomendaba para tal "vicio" la necesidad del bisturí, representado por la circuncisión.
Siete personajes son fundamentales en los criterios prevalecientes en los siglos XVIII, XIX y XX acerca de la masturbación en las sociedades "avanzadas de la época" y en países como Suiza, Inglaterra y Estados Unidos de Norteamérica, que trastornaron la vida de los jóvenes y motivaron conductas que hoy sabemos fueron equivocadas, llevando inclusive a la practica de cirugías como la circuncisión, con secuelas muchas veces definitivas en la vida de dichos jóvenes (tanto desde el punto de vista orgánico como psicológico) (Potenziani JC. Historia de la Urología 2005).
Ellos fueron el Dr. Bekkers en el siglo XVII con su libro Onania, derivado del personaje bíblico Onán, de donde proviene la palabra Onanismo, hermano de Er, primogénito de Judá, a quien Yahvé hizo morir y éste le dijo a Onán "Cásate con la mujer de tu hermano y cumple como cuñado con ella, procurando descendencia a tu hermano". Onán sabía que aquella descendencia no sería suya y así si bien tuvo relaciones con su cuñada, derramaba a tierra, evitando el dar descendencia a su hermano. Pareció mal a Yahvé lo que hacía y le hizo morir también a él (Génesis 38:6-10). Bekkers decía que la sangre era fabricada dentro de la simiente (semen), la cual es ulteriormente elaborada y purificada dentro de los epidídimos. Por lo cual el vaciamiento de los testículos consumirá la parte mas fina y mas balsámica de la sangre llevando a infertilidad, ulceras, insanidad y muerte.
El otro personaje es un medico suizo llamado Tissot SD, quien en su libro Enfermedades producidas por el Onanismo abarca también a las mujeres en dicha practica, ya mencionado anteriormente.
En 1833 Baillie en Londres publicaba un artículo sobre las enfermedades aparecidas en el órgano masculino de generación y con ello finalizaba dando como método terapéutico la circuncisión. Igualmente Hutchinson (1890) recomendaba la circuncisión como medida preventiva para la masturbación.
En el siglo XIX en Estados Unidos de Norteamérica dos eminentes médicos como Sylvester Graham y John Harvey Kellogs (inventor del Cornflake ) éste ultimo en su libro "Hechos simples
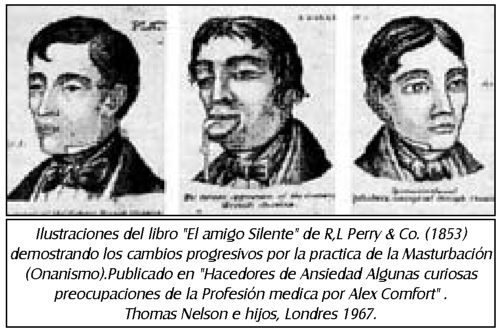
acerca de la Vida Sexual" (1877) enumera 39 signos de degeneración por la masturbación entre los que destacaban...somnolencia, morderse las uñas, hombres redondeados, sudoradón y habito tabaquico, apetito caprichoso. Recomendaba a los padres espiar a sus hijos sobre todo en aspedos referentes a visitas al baño, hábitos nodurnos al dormir entre otras. Cuando un niño se descubría con una erecdón recomendaba drcundsión sin anestesia como disuasivo. No limitándose a los varones hada también sugerendas para las hembras. Su libro fue leído por millones de personas y por supuesto afedó la conduda y comportamiento de padres e hijos hasta bien avanzado el siglo XX (Bishop-Osthelder 2001).
En 1902 Steele WG publicaba en la revista Medical World su articulo "Importance of Circumdsion" donde refería que había repetidas veces casos de convulsiones, llanto constante en los niños, enfermedades que simulaban afectadón de las caderas, enuresis, marasmo, incoordinación muscular, parálisis, masturbación, neurastenia, esterilidad y epilepsia que eran o mejorados o curados por la drcundsión.
En los siglos XVIII, XIX y XX se impuso la indi-cadón "medica" de la circuncisión y vemos como se indica en casos de fimosis congénitas, en fimosis adquiridas como la denominada 'fimosis gonococd-ca' sobre todo después de haber intentado tratamiento médicos con lavados peneanos y posteriormente colocando vendas con calomel. Igualmente se hada con las postitis, donde previamente se intentaba con tratamiento médico y posteriormente en casos de fracaso se solucionaba quirúrgicamente. (Abernathy 1928), (Baillie (1833). Indusive se recomendaba en casos de impotencia asodada a fimosis, así como otros tipos de disfunción sexual (Remondino 1900). Igualmente se recomendaba en casos donde se quería mejorar el 'control sexual'.
Warren (1915) la recomienda para la epilepsia, enuresis nocturna, terrores nocturnos, inquietud sexual precoz, indusive para el homosexualismo dentro de los 'eretismos sexuales'), (Martin 1917), (Remondino 1900). Entendiéndose por eretismo "un estado de irritabilidad de los tejidos o del sistema nervioso" (Larousse Ilustrado 2001
Wolbarst (1950) refería la ausenda de cáncer de pene en la población judía y posteriormente Handley (1947) publicaba su trabajo en el British Journal de
Medicina sobre la poca incidencia de cáncer de cuello uterino en mujeres judías al igual que otros autores (Terris 1973). Bleich (1950) mendonaba el papel de la circuncisión en la profilaxis del cáncer de pene. Además se comprobó Wilson (1947) que la drcundsión disminuía la incidenda de enfermedades de transmisión sexual entre los soldados de la II Guerra Mundial y se propuso la circuncisión como argumento para los conscriptos al servicio militar. Esto ha sido apoyado por sanitaristas africanos como Green (1993). Inclusive en el año 1993, Kreiss demostró en una comunidad homosexual que la transmisión de VIH estaba significativamente asociada al status de no-drcuncisión y se ha propuesto como estrategia (Fink 1989).
Warren-Bigelow (1994) publican el primer cues-tionamiento serio a la practica de la circuncisión neonatal en Inglaterra por la publicación apareada en el articulo llamado "El caso contra la Circuncisión", criticando la practica irrestricta de dicho procedimiento en todo neonato que llegaría hasta la dedaradón de la Academia Americana de Pediatría en 1971 y 1975 donde decía que " no hay indicaciones medicas validas para la drcundsión en el periodo neonatal". Y así se fueron sumando Academia tras Academia de diferentes países (Australia (1971), Canadá (1975) por mencionar algunas.
La Academia Americana de Pediatría (1971) (Thompson et al 1971) a pesar de dedr que no hay una valida indicadón medica para realizar drcun-cisión en el periodo neonatal, y que para su rea-lizadón juega un papel importante aspectos paternos, de sus médicos pediatras, de sus creencias, tradidones, aspectos culturales y aspectos religiosos. Refiere la Academia que se deben considerar dertos aspedos para referírselos a los padres a la hora de realizar la cirugía. Prevendón de fimosis, fadlitación de higiene, profilaxia del carcinoma de pene, que podría redudr la inddenda de cáncer prostático (sin bases dentíficas), profilaxia del cáncer de cuello uterino en la mujer, profilaxia de balanitis y balanopostitis, e infecdones de transmisión sexual. Las contraindicadones absolutas para la circuncisión según la AAP son prematuridad, enfermedades neonatales, anomalías congénitas (especialmente hipospadias), trastornos de coaguladón. Deben sin embargo dedrse a los padres los pro y contra a corto y largo plazo de la drugía de circuncisión.
El año 1975 la Academia Americana de Pediatría (Thompson 1975) concluyó que no había una clara indicación médica para la circuncisión de rutina.
Con éste articulo y otros como el de Boland (1969) quien publicaba en el NEJM su articulo "Cirugía ritualista: Circuncisión y Tonsilectomía, mencionaba que ambos procedimientos eran realizados sin base científica, unido a otros trabajos similares como el de Schlossberg (1971), se creyó que disminuiría sustancialmente el numero de cirugía por circuncisión pero no pasó así.... y en el año 1989 concedieron que podían existir ciertas ventajas en la circuncisión neonatal pero que no la aconsejaban como operación de rutina Schoen (1989).
Igualmente en Australia ya en 1971 Morgan refería en la Asociación Australiana de Pediatría "no deberán ser circuncidados de rutina los infantes".
En 1975 la Sociedad Pediátrica Canadiense refería "no hay indicación médica para la circuncisión en el periodo neonatal".
En 1984 la American Academy of Pediatrics exponía los cuidados que había que tener con un pene no circuncidado.
Hasta 1985 la circuncisión en los Estados Unidos de Norteamérica se hada por motivos de salud. Se basaban en 4 conceptos que eran dolor, enfermedades venéreas, cáncer e higiene. Con la aparición de infecdones de transmisión sexual (ITS), como el virus del papiloma humano, el herpes virus, el virus de la inmunodefidencia humana, la drcundsión toma un nuevo auge para tratar de frenar la transmi-sibilidad de dichas infecdones (Campion 1985).
En reladón al dolor había posiciones encontradas como la de la Procter & Gamble en 1982, fabricantes de pañales Pampers que les decía a los padres "Deberían Uds. estar sorprendidos en conocer que la circuncisión no será dolorosa para sus niños ya que por la corta edad no existen todavía las terminaciones nerviosas para facilitar la percepción del dolor", contraria a la afirmadón de la "American Baby" quien en 1983 refería que la circuncisión ocasionaba gran dolor y stress y que era posible aliviar el dolor con anestesia local.
En reladón a las enfermedades venéreas se creía que la circuncisión prevenía las infecciones de transmisión sexual (I.T.S) y ésta creencia duró hasta mediados del siglo XX donde artículos como el Ravich (1973). Pero ya para finales de la ésa década en 1979 Felman YM diredor del Bureau de Nueva York en el control de enfermedades de transmisión sexual decía: "No creo que la circuncisión sea de ningún valor para la prevención de las I.T.S".
En reladón al cáncer no ha habido un claro y contundente trabajo que sostenga la tesis de la capacidad cancerígena del smegma (células epiteliales descamadas unidas en el adulto a secredón de las glándulas de Tyson).
En reladón a la higiene peneana Kaplan (1977) demostró que no estaba sustentado ni medica ni fisiológicamente.
La dedinación en el numero de casos de niños dr-cunddados ha sido sustancial en numerosos países de habla inglesa (Estados Unidos de Norteamérica, Inglaterra, Australia entre otros).
No es la intención de éste estudio, describir los diferentes enfoques quirúrgicos en las diferentes épocas, éste será motivo de otro estudio. Solo mostraremos dibujos de la técnica, por el valor de los diseños en sí, que creemos puedan ser celebrados por los lectores.

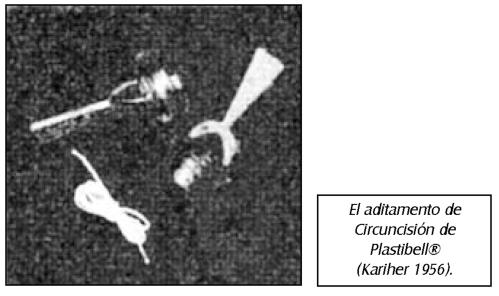
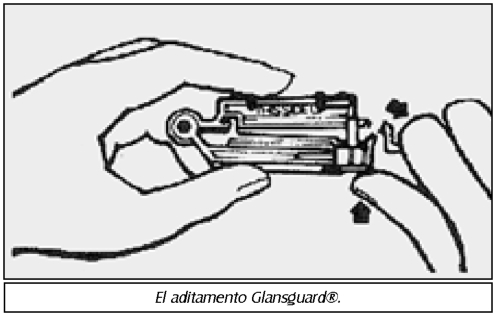
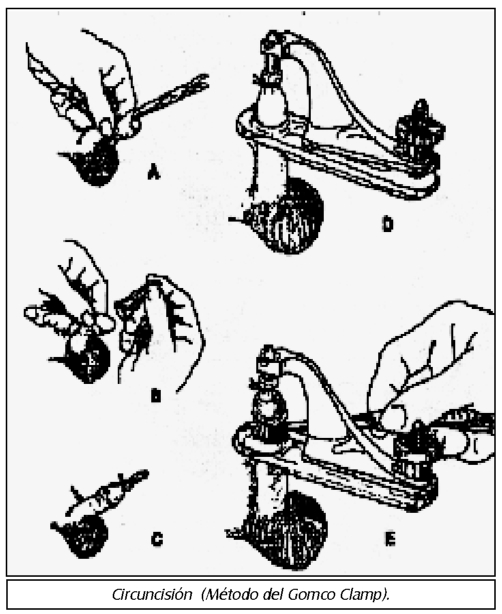
COMPLICACIONES DE LA CIRCUNCISIÓN
Las complicaciones de la circuncisión podrían ser potencialmente sangramiento, suturas mal colocadas, en la uretra, infección, balanopostitis adhesiva, meatitis, hipospadias y epispadias, linfedema, amputación peneana, necrosis, quistes de inclusión, estenosis meatal, cuerda, fístulas uretra-cutáneas, retención urinaria. Kaplan (1983) refería que la incidencia de complicaciones es desconocida se cree que podrían tener una incidencia del 1.5% al 5%.
Las complicaciones intraoperatorias son sangramiento (0.1% a 35%), remoción de insuficiente o excesivo tejido.
En el postoperatorio tenemos la formación de un puente de piel entre el tronco peneano y el glande. La incidencia de infección va del 0.4% al 10%. Retención urinaria por un vendaje muy apretado. Puede haber disuria, vacilación miccional. Meatitis que va del 8% al 31% sobre todo cuando todavía usa pañales. La cuerda puede ser producida por la circuncisión, sobre todo si se hace en estados de inflamación de la piel prepucial. Quistes de inclusión en la línea de la circuncisión. Linfedema, fístulas por la pinza utilizada para el procedimiento (tipo la de Plastibell). Necrosis por isquemia distal, por el uso de epine-frina, o el uso prolongado de torniquete, o por el uso de electrocauterio aplicado directamente al clamp de la circuncisión (Gomco). Hipospadias y epispadias pueden ser producidas por la circuncisión. Con el aditamento denominado Plastibell el anillo puede migrar y producir necrosis por presión. Impotencia se ha visto a continuación de circuncisión en adultos. Trastornos psicosodales como comportamiento psi-cotico. Complicaciones anestésicas.
RESTAURACIÓN PREPUCIAL EN LA HISTORIA
Según Linch (1993), Schultheiss (1997), Rubin (1980), mas de 2000 años de persecudón judía han llevado al desarrollo de procedimientos alternativos quirúrgicos, para tratar de minimizar las consecuencias que la drcundsión le traía a quien la mostraba, teniendo como objetivo restaurar la piel eliminada y volver a recubrir el glande.
Por lo tanto la restauración prepucial como una medida de escape de la opresión del pueblo judío, la podemos ver en todas las épocas históricas, lo cual está atado en numerosas publicaciones, entre las que se cuenta el Antiguo Testamento (I Macabeos 1:14-15), por referirnos solo a una de ellas.
Brandes-McAninch (1999) referían que la pradica de los griegos de bañarse desnudos, así como de pradicar deportes y gimnasia estando desnudos la adoptan también los romanos. Tener el glande peneano al descubierto era sodalmente inaceptable y de mal gusto, por lo cual para prevenir esto se hada una infibuladón que era la oolocadón de un instrumento que era como un alfiler-broche drcular en el borde distal del prepucio para mantenerlo cerrado. (Rubin 1980).
Schneider (1976) refiere que en tiempos antiguos, sobre todo en sociedades helenizadas o en la Roma clásica, la práctica de la restauración prepudal era realizada más por "decoris causa", por razones de aparienda y decoro, más que por razones de salud.
Schultheiss (1997) refiere que en el curso de la historia, la restauración del prepudo después de haber sido sometido a circuncisión fue común, reladonada básicamente a persecudones políticas o religiosas del pueblo judío.
En la Biblia (I.Macabeos 1), se menciona la primera evidencia de tales persecuciones cuando bajo el reino de Antioco IV (168 d.c) asido a los ideales helenísticos en lo referente a juegos deportivos, desnudez o reglas en baños públicos hizo que en Judea se implementara la reversión de la circuncisión a través del "Pondos Judaeus" para cubrir el glande o bien que el atleta o la persona que tuviera una drcun-cisión ocultara sus genitales. Iguales procedimientos se describieron en el Talmud durante el reinado de Adriano (132-135 d.c) y en Corintios 7:18 (mediados del siglo I d.c) hay referencias de la practica de la descircuncisión o restauración prepudal.
La persecución judía bajo el régimen nazista de Hitler a mediados del siglo XX, hacia que el hecho de estar circuncidado fuera un factor de vida o muerte, no haciendo ningún tipo de consideraciones si dicha circuncisión se había efectuado por razones religiosas o por razones medicas por fimosis adquiridas o congénitas. Levin (1976) menciona que durante la segunda guerra mundial e inclusive los 10 años antes cuando ya se preparaba en la mente de los nazistas "la limpieza étnica" hubo sin duda un resurgimiento de la restauración prepucial por parte sobretodo, del pueblo judío.
Bajo éste régimen de angustia vital y de persecuciones sin cuartel, se cometieron los mayores atropellos sin dejar a un lado a los médicos que hacían el procedimiento, quienes explotaban comercialmente a los judíos no lográndose muchas veces el objetivo y si en cambio, con resultados cosméticos y funcionales desastrosos.
En griego el procedimiento de "recubrir el glande" recibe el nombre de epispatikós. Igualmente el pueblo romano lo llama recutitio. El famoso poeta romano Petronio (muerto en el 66 d.c) escribió en su poesía "La Cena de Trimalchio", su saturae dice de un esclavo que tenia dos defectos, sin los cuales seria invalorable: el está des-circumdso y ronca (recutitus est et stertit).
Celso, médico romano (25 a.c-50 d.c) ideó dos procedimientos quirúrgicos que los describió en su libro De medicina libri octo. (Rubin 1980), (Potenziani 2005).
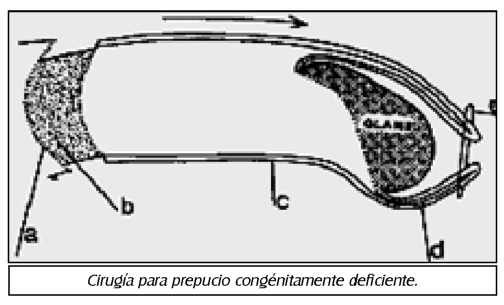
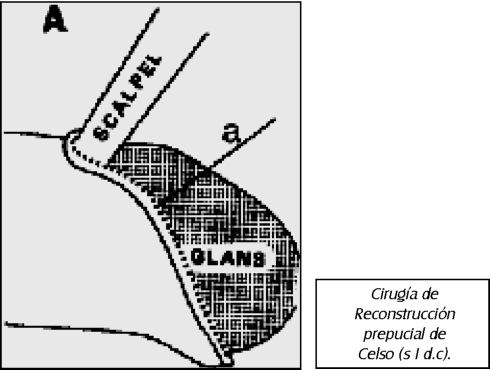
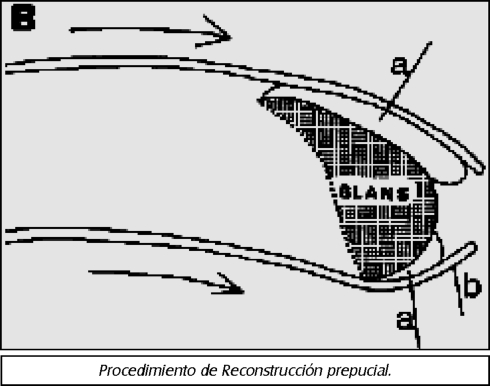
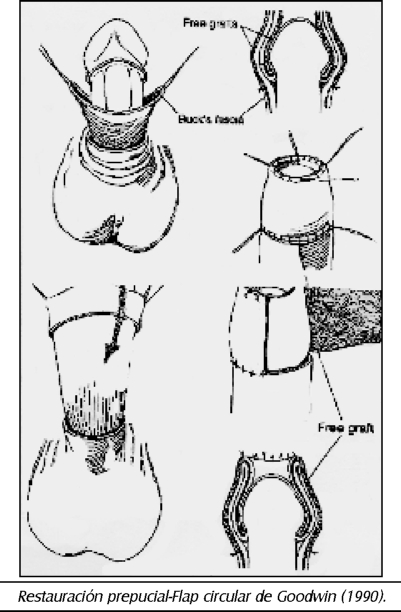
Tushmet (1995) refiere que durante el periodo nazi el terror a ser encerrado en campos de concentración o sentenciado a cualquier tipo de tortura, hizo que el pueblo judío se hiciera restauraciones prepuciales sin las normas requeridas, sino solamente como un intento desesperado por conseguir su "seguridad".
Tushmet (1965) habla de la restauración prepucial desde dos siglos antes de la llegada de Cristo, no por
razones higiénicas ni medicas, sino como resultado de las presiones sociales y políticas sobre los judíos, el grupo social que mas frecuentemente había practicado la circuncisión ritualista para ése momento.
Durante el periodo helénico la rápida expansión de la cultura griega y de sus costumbres, sobre todo durante y después de las conquistas alejandrinas, afectaron al pueblo judío dentro y fuera de Palestina.
Los judíos helenizados adoptaron según Tushmet (1965) el estilo griego en el vestir, en el arreglarse, en su interés en áreas como el deporte. El desnudo era seguido hasta dentro de las áreas del templo sagrado judío con baños y lugares de gimnasia donde se debía estar desnudo siendo esto muy criticado por los que seguían de cerca las leyes de Moisés. Trataron de destruir las evidencias del convenio con Abraham, para los griegos costumbres bárbaras. Se prohibió la circuncisión y si los judíos helenizados se desnudaban trataban de ocultar sus genitales, para parecerse lo más posible a los ciudadanos griegos.
Durante el periodo romano siguiendo la revuelta exitosa de los judíos contra Antioco epifanes, se estableció la dinastía hasmonea en el año 141 d.c y desapareció la costumbre de hacer la circuncisión en Judea. Pronto los romanos se adueñaron de la provincia de Judea y no le prestaron mucha atención a la religión judía y a sus costumbres y consideraron la circuncisión como interesante y una costumbre divertida (Tushmet 1965). Pero posteriormente el emperador Adriano la prohibió por el crecimiento de la secta de cristianos que provenían en su mayoría de los judíos conversos (inicio del cristianismo).
En el año 70 d.c la destrucción del Templo de Salomón fue ocasionado por la oposición de los judíos a la implantación de estandartes y figuras romanas en los lugares sagrados del pueblo judío, unido a las continuas revueltas de los zelotes. Posteriormente en el periodo helénico los judíos querían de alguna manera participar de los lujos de la Roma imperial e igualmente evitar el pago del "Fiscus Judaicus" que cada varón judío tenía que pagar y por esto en numerosas ocasiones trataban de ocultar la circuncisión para evitar dicho pago fiscal, con aditamentos que cubrían el pene o con el ya mencionado anteriormente "Pondos Judaeus" una vaina de bronce que obligaba al prepucio a estar en la posición más distal posible.
En los tiempos actuales no hay evidencia que el pueblo judío se haga procedimiento de reconstrucción prepucial. En los tiempos de la Alemania nazi era cuestión de vida o muerte tener una cicatriz por haberse realizado una circuncisión. En los ghettos eran perseguidos sobre todo cuanto lograban pasar al lado no judío, y la circuncisión era reconocida como un signo judaico incuestionable.
En ocasiones el pueblo judío hacia uso de documentos obtenidos ilegalmente que dictaminaban que la circuncisión había sido practicada debido a una fimosis congénita o que había quedado como secuela de una infecciones venérea por chancro u otra infección balanica secundaria a una infección venérea. Sin embargo los doctores nazis eran escépticos de tales documentos, no sirviendo en muchas ocasiones, absolutamente para nada, ya que de todos modos eran deportados y asesinados en los campos de exterminio.
El Dr. Joseph Tenebaum comenta finalmente que la circuncisión representaba una dicha para los nazis ya que los judíos podían teñir su cabello, asumir inclusive un aspecto ario o cantar himnos católicos pero no podían ocultar la marca del convenio con Dios.
Nietzche (Messadié 2001) refería "Todo el problema de los judíos, sólo existe en los estados nacionales, en el sentido de que allí su actividad, su inteligencia superior, el capital de espíritu y voluntad que han amasado largamente de generación en generación en la escuela del dolor, debe llegar a predominar generalmente en una medida que despierta la envidia y el odio, hasta tal punto que en casi todas las naciones actuales o tanto más cuando afectan el nacionalismo se propaga ésta impertinencia de la prensa que consiste en llevar a los judíos al matadero como chivos expiatorios de todos los males posibles y privados. Toda nación, todo hombre tiene rasgos desagradables y hasta peligrosos: es una barbarie pretender que el judío sea una excepción".
CIRCUNCISIÓN COMO OFENSA ÉTICA Y LEGAL DEL VARÓN
Sin embargo se ha concluido por la mayoría de países que conforman la Organización de las Naciones Unidas que la circuncisión "per sé" es una ofensa ética y legal del varón, a la edad que fuere, cuando se realiza sin una causa debida (médica), y cuando se decida por encima de la opinión de la persona que la sufre. (Brigman 1985).
En la Convención de las Naciones Unidas (1990) sobre los derechos del Niño en su artículo 19(1) provee:
"deberán tomarse todas las medidas apropiadas legislativas, administrativas, sociales y educacionales para proteger al niño contra toda forma de violencia física o mental, injuria, abuso, negligencia o tratamiento negligente, maltrato o explotación, incluyendo abuso sexual, aun cuando tuvieran el cuidado de lo padres, o tutores legales o cualquier otra persona que esté al cuidado del niño". En la Convención de las Naciones Unidas sobre los derechos del Niño en su artículo 2 provee:
Para los efectos de la presente Convención, se entiende por niño todo ser humano menor de dieciocho años de edad, salvo que, en virtud de la ley que le sea aplicable, haya alcanzado antes la mayoría de edad.
1. Los Estados Partes respetarán los derechos enunciados en la presente Convención y asegurarán su aplicación a cada niño sujeto a su jurisdicción, sin distinción alguna, independientemente de la raza, el color, el sexo, el idioma, la religión, la opinión política o de otra índole, el origen nacional, étnico o social, la posición económica, los impedimentos físicos, el nacimiento o cualquier otra condición del niño, de sus padres o de sus representantes legales.
2. Los Estados Partes tomarán todas las medidas apropiadas para garantizar que el niño se vea protegido contra toda forma de discriminación o castigo por causa de la condición, las actividades, las opiniones expresadas o las creencias de sus padres, o sus tutores o de sus familiares.
LA CIRCUNCISIÓN CAUSA DOLOR, TRAUMA Y UNA PERMANENTE PÉRDIDA DEL TEJIDO PROTECTOR Y DEL TEJIDO ERÓGENO... REMOVER EL TEJIDO NORMAL, SALUDABLE, FUNCIONANTE POR RAZONES
NO MÉDICAS TIENE IMPLICACIONES ÉTICAS. LA CIRCUNCISION VIOLA LA DECLARACIÓN UNIVERSAL DE LOS DERECHOS HUMANOS DE LAS NACIONES UNIDAS (art 5) Y LA CONVENCIÓN DE LOS DERECHOS DEL NIÑO DE LAS NACIONES UNIDAS (art 13) Sorger (1994).
Fleiss (1995) refería, dto textualmente: "A pesar de la crueldad irracional obvia de la circuncisión, los incentivos provechosos en la practica medica hacían que los principios de los derechos humanos o los razonamientos científicos no pudieran interrumpir la industria altamente lucrativa de la circuncisión norteamericana. Es tiempo que las asociaciones médicas europeas condenen a la comunidad medica norteamericana por participar y aprovecharse de lo que ha sido una mutilación sexual barbarita sin sentido de niños inocentes".
Del 2 al 4 de Septiembre del año 2004 se realizó en Padova-Italia el Octavo Symposium sobre Circuncisión y Derechos Humanos. Análisis antropológico, medico, legal y ético, llegando a conclusiones similares a las de las Naciones Unidas reseñado más arriba. organizado por la Organización Nacional de Circuncisión y los Centros de búsqueda de Información y el Grupo de Trabajo de Padova FGM conjuntamente con el Departamento de Psicología General de la Universidad de Padova.

BIBLIOGRAFÍA
Abernathy J. The Consequences of Gonorrhoea. Lectures on Anatomy, Surgery and Pathology: Including Observations on the nature and treatment of local diseases; delivered at St. Bartholomew's and Christ's Hospitals, Chapt XXII, 163. The Strand, London: James Bulcock, 1828: 315-6.
Acuña CA, Guerrero GP. Misterios de la Circuncisión. Cap IV:65-81 extraido del libro "El Honorable Miembro. Sexología en la era del Viagra. Edit Grijalbo, 1998.
Aldeeb Abu-Sahlieh SA. To mutilate in the name of Jehová or Allah, legitimization of male and female circumcision. Med Law 13: 575-622, 1994.
Allen JF. Bilharzia Haematobia and Circumcision. The Lancet. 1317-1320, May 1909.
Andrade C. Circuncisión. La diferencia oculta parte II. http://www.sexovida.oom/educacion/drcundsion2.htm.
Anton Hernández L. La Fimosis en la historia y su actual tratamiento BSCP Can Ped 28(1)55-62, 2004.
American Academy of Pediatrics (AAP), Committee on the fetus and newborn. (1971). Standards and recommendations for hospital care of newborn infants (5th ed.) 110, Evanston, IL: AAP.
American Academy of Pediatrics. (1984). Care of the uncircumcised penis. [Brochure].
American Academy of Pediatrics. (1989). Report of the ad hoc task force on circumcision. Pediatrics, 84, 388-391.
American College of Obstetricians & Gynecologists (ACOG). (1983) Guidelines for perinatal care. Washington, D.C.: Committee on Obstetrics, Maternal and Fetal Medicine.
Apt A. Circumcision and Prostatic Cancer. Acta Medica Scandinavica. 178: 493-504, 1965.
Aristófanes Birds, ed Nan-Dunbar (Oxford Clarendon Press 1995) p 81. On psolos in Henderson Maculate Muse (16)(17): 110-111, 1995.
Arnold AB. Circumcision NY Medical Journal 13: 173-179, 1886.
Asimov I. Guía de la Biblia. Antiguo Testamento. Circuncisión: 71, 182. Alfadil Ediciones, Caracas 1985.
Badenoch AW. Operations on the penis. Manual of Urology. 1st edn. London: Heinemann 1953: 513-5.
Bailllie M, Wardrop J. Diseased appearances in the male organs of generation. The morbid anatomy of some of the most important parts of the human body. To which are prefixed, preliminary observations on diseased structures, Chapt XVII. Paternoster Row. London: Longman, Rees, Orme, Brown, Green & Longman, 1833: 251.
Baines J. Moral para el siglo XXI 2da edición Xistral Edit 2000.
Barns E. La Circoncision. Paris: Lipshutz 1-2, 1936.
Barth LM. Brit Mila in the Reform Context. New York: Mila Board of Reform Judaism: 93, 1990.
Biblia de Jerusalem, Desclée de Boruwer (DDB) 1967 Bruxelles.
Bigelow, J. The joy of uncircumcising: Restore your birthright and maximize sexual pleasure. Aptos, CA: Hourglass Book Publishing, 1992.
Bishop C, Osthelder X. Sexualia from prehistory to cyberspace. Genital mutilation pag 40-41. Koneman 2001 Germany.
Bishop C, Osthelder X. Sexualia. From Prehistory to Cyberspace/ Masturbation-The imaginary curse/ Sexuality in Mesopotamiam Myth/ Sexuality in Egyptian Myth/ The Harem and the Great Seraglio/ Initiation Ceremonies/ Priapus/ The secret of Pompei/ The Popes-Myth and Realty/ Cult of the Castrati/ The Language of sex. Koneman2001 Germany.
Bleich AR. Prophylaxis of Penile Cancer. JAMA. 143: 1054-1057, 1950.
Boland RP. Ritualistic surgery: Circumcision and tonsilectomy. New England J Med 280: 591-592, 1969.
Bongaarts J, Reining P, Way P. The Relationship between Male Circumcision and HIV Infection in African Populations. AIDS. 3: 373-377, 1989.
Bousfield P. Notes on Minor Surgery, The Circumcision of Children. St. Bartholomews Hosp J. October 5-7,1916.
Boyd BR. Circumcision: What it does. San Francisco: Taterhill Press, 1990.
Brandes SB, McAninch JW, Surgical methods of restoring the prepuce: a critical review. BJU Int 83(2): 109-
113, 1999.
Brigman W. Circumcision as child abuse: The legal and constitutional issues. Journal of Family Law, 23(3), 337-357, 1985.
Budge EAW. The Book of the dead. The Papyrus of Ani. In the British Museum. Late keeper of Assyrian and Egyptian Antiquities in the British Museum. 1895. scanned at www.sacred-texts.com, Oct-Dec 2000. Dover Publications
Caldwell JC, Caldwell P. The African AIDS Epidemic. Scientific American. March: 62-68, 1996.
Campbell E, Colton J. Warts and tubercles occurring on the penis or other parts of the body: Corns and black warts. The Surgery of Theodoric ca. AD 1267. Chapt. 38. New York: Appleton-Century-Crofts, Inc: 109-
114, 1960.
Campbell's Urology. Harrison JH, Gites RF, Perlmutter AD, Stamey TA, Walsh PC eds. 4th ed. WB Saunders Co. 1978 (2nd ed, Vol. 3). Philadelphia: Saunders, 2003.
Campion MJ, Singer A, Clarkson PK, et al. Increased Risk of Cervical Neoplasia in Consorts of Men with Penile Condylomata Acuminata. Lancet. 943-946, April 1985.
Canadian Pediatric Society. Neonatal circumcision revisited. Canadian Medical Association Journal, 154(6), 769-780, March 15, 1996.
Cansever G. Psychological Effects of Circumcision. British Journal of Medical Psychology, 38: 321-31, Dec 1965.
Cendron M, Elder JS, Duckett JW. Perinatal urology. In JY Gillenwater, JT Grayhack, SS Howards, JW Duckett (Eds) Adult & pediatric urology (3rd ed, pp 2149-2152) St. Louis: Mosley Yearbook, 1996.
Ciaglia P. The 'David' of Michelangelo or 'why the foreskin?. JAMA 218: 1304, 1971.
Circumcision. Catholic Encycopedia. http://www.new advent.org/cathen/03777a.htm.
Circumcision Information and Resource Pages http ://www. cirp.org/
Circumcision (Al-Khitaan) http://www.circumcisionin-fo. com/islam_circl .htm.
Circumcision procedure (Gomco Clamp method). The Gomco Technique. Patient Care 12:82-85, March 1978.
Circumcision and Human Rights. The Eight Internacional Symposium. An Anthropological, Medical, Legal, and Ethical Análisis. Organización Nacional de Circuncisión y los Centros de Busqueda de Información y el Grupo de Trabajo de Padova FGM conjuntamente con el Departamento de Psicología General de la Universidad de Padova. University of Padua, Italy Sept 2004.
Circumcision reduces risk of HIV infection in men. Bull World Health Organ, 82(5): 394-395, May 2004.
Circumcision reduces risk of HIV infection in men. Bull World Health Organ. 82(5): 394-395, May 2004.
www:http://www.scielosp.org/scielo.php?script=sci_art-
text&pid=S004296862004000500023&lng=en&nrm=iso
Cline B. Schistosomiasis and Its Relation to Circumcision. Tulane University. New Orleans: Personal e-mail correspondence; 1997; bcline@mail-host.tcs.tulane.edu.
Convención sobre los Derechos del Niño. Organización Mundial de la Salud (OMS-WHO). Adoptada y abierta a la firma y ratificación por la Asamblea General en su resolución 44/25, de 20 de noviembre de 1989 . Entrada en vigor: 2 de septiembre de 1990, de conformidad con el artículo 49 http://www. unhchr. ch/sp anish/html/menu3/b/k2crc_sp .htm
Cohen MS. Circumcision. In JF Fowler (Ed), Urologic surgery (pp. 422-428). Boston: Little, Brown, 1992.
Cooley DG. Ancient Egypt and Today: Enough Scourges to Go Around. Emerging Infectious Diseases. 2: 362, 1996.
Cuckow PM, Rix G, Mouriquand PD. Preputial plasty: a good alternative to circumcision. J Pediatr Surg 29: 561-563, 1964.
Diccionario de Sinonimos, ideas afines, Antonimos y Parónimos. Miguel Subercaseaux. Cultural SA 2da ed., Junio 1989.
Diccionario básico Latino-Español/Español-Latino. Eustaquio Echauri Martinez. 11a ed. Jul 1983, Bibliograf SA.
Doyen E, Spencer-Brown H. Operations on the genitourinary organs of man. Surgical Therapeutics and Operative Technique III Chapt XXVIII. London: Balliere 423-428, 1920.
Dunsmuir WD, Gordon EM. The History of Circumcision. BJU International 83(1): 1-12, Jan 1999.
Durant W. The Story of Civilization: Part I: Our Oriental Heritage. New York: Simon and Schuster 1954; 328-339, 1954.
Fakjian N, Hunter S, Cole GW, et al. An Argument for Circumcision. Arch Dermatol. 126: 1046-1047, 1990.
Fink AJ. Newborn circumcision: a long term strategy for AIDS prevention. J Roy Soc Med 82: 695, 1989.
Fleiss P. Circumcision Lancet 345: 927, 1995.
Fleiss PM, Hodges FM, Van Howe RS. Immunological functions of the human prepuce. Sexually transmitted infections 74, Number 5: 364-367, Oct 1998.
Freud S. Totem and taboo. Standard Edition (13), 1-161, 1913.
Freud S. Moisés y la religion monoteísta, 1939.
Freud A. The role of bodily ilness in the mental life of children. Psychoanalitic study of the child 7: 69-81, 1952. http://www.cirp.org/library/psych/freud/
Freud S. Introductory Lectures in Psychoanalysis. New York: Boni and Liveright, 1920.
Freud S. The infantile genital organization of the libido. In Collected Papers, 2. London: Hogarth Press, 1953.
Freud y el Exodo. Gustavo Daniel Perednik http ://www.perednik.org/articulo6 .htm
Gairdner D. The fate of the foreskin: A study of circumcision. British Medical Journal, 2(24), 1433,1437,1949.
Ghalioungui P. The Physicians of Pharaonic Egypt. DAI Abteilung Kairo Sonderschrift 10. Mainz Ghalioungui 1983.
Ghalioungui P. BIFAO 68:41-46, 1969. Bulletin de l'institut Français d'Archeologie orientale.
Gelbaum I. Supplement. Circumcision: Refining a traditional technique. Journal of Mid-Wifery, 38,1 8S-30S, March/April 1993.
Gellis SS. Circumcision. American Journal of Diseases of Childhood, 132, 1168, 1978.
Ginsburg CM, McCracken GH. Urinary Tract Infections in Young Infants. Pediatrics. 69: 409-412, 1982.
Gollaher DL. A short history of the world's most controversial surgery. New York, Basic Books 2000.
Gollaher DL. From Ritual to science: The medical transformation of circumcision in america. Journal of social history 28(1): 5-36, 1994.
Goldman RF. Circumcision. The hidden trauma. Boston: Vanguard Publishing, 1997.
Goldman RF. Questioning circumcision: A Jewish perspective (2nd ed.).Boston: Vanguard Publishing, 1997.
Goodwin WE, Uncircumcision a technique for plastic reconstruction of a prepuce alter circumcision J Urol 144: 1203-1205, 1990.
Green EC, Zokwe B, Dupree JD. Indigenous African healers promote male circumcision for prevention of sexually transmitted diseases. Trop Doc 23:182-183, 1993.
Handley WS. Circumcision and carcinoma of the cervix. Br Med J 2: 841-843, 1947.
Health An Islamic Perspective Islamic Ruling on Male and Female Circumcision Islamic Ruling on Circumcision http://www.islamset.com/hip/health5 /circum.html.
Higgins G. "Anacalypsis", London, 1836.
Hodges FM. Phimosis in antiquity. World Journal of urology 17(3): 133-136, 1999.
Hodges FM. The ideal prepuce in ancient greece and RomeN Male genital aesthetics and their relation to lipodermos, circumcision, Foreskin restoration and the kynodesme. The Bulletin of the History of Medicine 75: 375-405,2001 http://www.cirp.org/ library/history/hodges2/
Hoffman LA. Circumcision as a symbol in the Jewish Psyche. Covenant of Blood. Chapter 1. Chicago: University of Chicago Press: 1-26, 1995.
Hutcheson JC. Male neonatal circumcision: indications, controversias and complications. Urol Clin N Am 31(3): 461-467, Aug 2004.
Hutchinson J. On Circumcision as a preventive of masturbation. Archives of surgery Vol II: 267-269, 1890.
Jolly JB. Origins de la circoncision Judaque. Histoire de la circoncision. Paris: Société d'éditions Scientifiques: 5-7, 1899.
Jolly JB. La circoncision che les tribus sauvages. Histoire de la circoncision. Paris: Société d'éditions Scientifiques: 13-16, 1899.
Josephus, Flavius: The Jewish Antiquities, Book XII, Chapter 5, p. 362 (37-100 dc).
Julien N. Enciclopedia de los Mitos. Urano: 384. Robin Book Ed. 1997.
Junod HA. The life of a south african tribe New York University Books Inc 1962.
Kaplan GW. Circumcision: An overview. Curr Prob Pediatr 7: 1-33, 1977.
Kaplan GW. Complications of Circumcision. Urol Clin NA. 10: 543-549, 1983.
Kariher DH, Smith TW. Immediate circumcision of the new bom. Obstet Gynecol 7: 50, 1956.
Kreiss JK, Hopkins SG. The association between circumcision status and human immunodeficiency virus amongst homosexual men. J Infect Dis 168: 1404-1408, 1993.
Kuss R, Gregoir W: Historia Ilustrada de la urología. Paris, Dacosta, 1990.
Lange de Nicholas. El Pueblo Judio. Odisea a través de los siglos. Atlas Culturales del mundo. Editorial Folio.La vida de un judío: 86, 1989.
Levin S. Circumcision and Uncircumcision S Afr Med J 50: 913, 1976.
Lewinsohn R. Belief in Beauty. A History of Sexual Customs. 1st edn. Chapt 3. London: Longmans, Green: 31-32, 1958.
Liebert MH. Circumcision: a symbolic act? A history and attempted interpretation. Historia Urologiae Europaeae 5: 179-208, Mattelaer JJ ed. EA 2002.
Lynch ML. Pryor JP. Uncircumcision: a one-stage procedure. Br J Urol 72: 257-261, 1993.
Noel JFM. Diccionario de Mitología Universal. Edicomunicación SA . Tomo I: 318,1991.
Nuttall I. World Health Organization, Division of control of tropical diseases, http://www.who.ch:80/pro-grammes/ctd/diseases/shis/shisdat.htm, Jan 1997.
Margulis L. History of Circumcision (Art History follows) http ://www. circlist.com/rites/history.html, 2003.
Marck J. Aspects of male circumcision in subequatorial african culture history. Health Transition Review, Supp to vol 7: 337-359, 1997.
Marx JL. Circumcision May Protect Against the AIDS Virus. Science. 245: 470-471,1989.
Martin E. Thomas BA, Moorhead SW. Surgery of the penis. White and Martin's Genito Urinary Surgery and Venereal Diseases, 10th edn. Chapt IX. London: J.B. Lippincott 1917: 99-102.
Messori V. Patti sotto Ponzio Pilato? SEI 2da Ed 1992.
Messadié G. Historia del Antisemitismo. Javier Vergara Edit 2001 Ed B Argentina SA.
Milos MF, Macris D. Circumcision: a medical or a human rights issue? J Nurse Midwifery 37(2): 87S-96S, March-April 1992.
Milos M, Macri D. Body ownership rights of children: The circumcision question Speech at 22nd Annual Convention of American Atheists]. American Atheist, 50-59, April 19, 1992.
Money J. Sexology, body image, foreskin restoration, and bisexual status. Journal of Sex Research, 28( 1), 145-156, 1991.
Morgan WK Penile Plunder Med J Aust 1: 1102-1103,1967. Editorial comments Med J Aust 2: 175, 1971.
Perednik G. Lacan y la circuncisión Puentes del judaismo. Perednik G. 2003 http://jinuj.net/articulos_ver.php ?id=706.
Plaut A, Kohn-Speyer AC. The Carcinogenic Action of Smegma. Science. 105: 391-392, 1947.
Poland RL. The question of routine neonatal circumcision New England Journal of Medicine, 322, 1312, 1990.
Potenziani JC. Cronología Histórica de la urología. Edición ampliada y corregida. En Editorial 2005.
Quereshi B. Male circumcision: A muslim perspective ND. 19 Mar. 2004 http://www.familymedidne.co.uk/fea-tures/drcum3.htm.
Quevedo VE. Cuando la higiene se volvió publica. Rev Fac Med Univ Nal Colombia 52: 83-90, 2004.
Quaintance V. International Circumcision Information Reference Centre (ICIRC). http://www.users. dircon.co.uk/~vernon/ICIRC/index.html Marchl997.
Ravich A. Preventing Venereal Diseases and Cancer by Circumcision. New York: Philosophical Library, 1973.
Remondino PC. History of Circumcision. Philadelphia: FA Davis Co. 1891.
Remondino PC. Some reasons for being circumcised. History of Circumcision from Earliest Times to the Present. Chapt XVII. Philadelphia: F. Davies Co. 200-205, 1891.
Remondino PC. General systemic diseases induced by the prepuce. History of Circumcision from Earliest Times to the Present. Chapt XVII. Philadelphia: F. Davies Co: 284-301, 1891.
Remondino PC. General systemic diseases induced by the prepuce. History of Circumcision from the Earliest Times to the Present, Chapt XXVI. Philadelphia: F. Davies Co, 302-321, 1891.
Report of the United Nations Seminar related to Traditional Practices affecting the Health of Women and Children, Ouagadougou, Burkina Faso, April 29-May 3,1991, E/CN.4/Sub.2/1991/48, Jun 12,1991, p. 9.
Richards D. Male Circumcision: Medical or Ritual? Journal of Law and Medicine 3(4): 371-376, May 1996.
Roberts JA. Does Circumcision Prevent Urinary Tract Infections? J Urol 135: 991-992, 1986.
Roberts JA. Neonatal Circumcision: An End to the Controversy. South Med J. 89: 167-171, 1996.
Rogers SL. Sex Organ Mutilation. Primitive Surgery. Skills before Science. Chapt. 3 Springfield, Illinois: Charles C. Thomas: 56-60, 1956.
Romberg HC: Bris Milah, a book about the Jewish ritual of circumcision, Feldheim, Jerusalem and New York, 1982.
Romberg R. Circumcision: The painful dilemma. South Hadley MA: Bergen & Garvey Publishers, 1985.
Rosner, Fred: Sex ethics in the writings of Moses Maimonides, Bloch publishing, New York, 1974.
Rubin JP. Celsus's decircumcision operation. Urology 16: 121-124, 1980.
Sanabria A. Compendio de Historia Universal de la Medicina y la Medicina Venezolana. Coleccion Ciencias medicas LII. Universidad Central de Venezuela. Ediciones de la Biblioteca-EBUC, 1986.
Sanabria A. Compendio de Historia Universal de la Medicina y la Medicina Venezolana. Ediciones de la Biblioteca- EBUC. Colecdon Ciencias Medicas LE. 1999.
Schlossberg C. Thirty years of ritual circumcisions. Appraisal of personal experiences, aftercare and post circumcision complications. Clin Ped 10: 205-209, 1971.
Schneider T. Circumcision and Uncircumcision S Afr Med J 50: 556-558, 1976.
Schultheiss D, Truss MC, Stief CG, Jonas U. Restoration of the prepuce a historical review. In Mattelaer JJ, ed. De Historia Urologiae Europaeae, EAU Historical Committee: Chapt 11, 175-187, 1997.
Schoen EJ, Anderson G, Bohon C. American Academy of Pediatrics: report of the task force on circumcision Pediatrics 84: 388-391, 1989.
Schoen EJ. The status of circumcision of newborns. New England Journal of Medicine, 322, 1308-1312, 1990.
Snowman LV. Circumcision. Encycl Judaica. Jerusalem: Keter Pub House Ltd; 1971.
Shulman J, Ben-Hur N, Newman Z. Surgical Complications of Circumcision. Am J Dis Child. 107:
149-154, 1978.
Singer I. Circumcision. Jewish Encyclopedia. New York: KTAV Publishing House, Inc. 1901.
Solomon RC, Higgins KM .What Nietzsche Really Said. January 2001. Schocken Books
Sonnex TS, Dawber RP, Ryan TJ, et al. Zoon/Es (plasma-cell) Balantitis: Treatment by Circumcision. Brit J Dermatol. 106: 585-588, 1982.
Sorger L. To AGOC: Stop Circumcisions, Ob.GYN. News :8, Nov 1994.
Statement of the Canadian Paediatric Society: Circuncisión in the newborn period. News Bulletin Supplement 8: 1-2, 1975.
Statement of the Canadian Paediatric Society: Circuncisión in the newborn period. News Bulletin Supplement 8: 1-2, 1975.
Steele WG. Importance of Circumcision" Medical World 20: 518, 1902.
Szasz T. Routine neonatal circumcision: Symbol of the birth of the therapeutic state" Journal od medicine and Philosophy 21: 137-148, 1996.
Schwanitz D. La cultura Santillana Ed. Generales, 2002.
Tannahill R. The sign of the covenant 66-69 in Part Two. The Near East, Egypt and Europe 3.000 BC-AD 1100. In Sex in History. Scarborough House Publishers
1992, USA.
Taylor JR, Lockwood AP, Taylor AJ. The prepuce: Specialized mucosa of the penis and its loss to circumcision, British Journal of Urology. 77, 291-295, Feb 1996.
Tennebaum, Joseph: In Search of a Lost People, New York, 1948, p. 298.
Terris M, Wilson RA, Nelson JH. Relation of circumcision to cancer of the cervix. Am J Obst Gynecol 117: 1056-1066, 1973.
Thompson HC, King LR, Knox E, Korones SB. Report of the ad hoc task force on circumcision. Pediatrics, 56, 610-611, 1975.
Tyndall MW, Ronald AR, Agoki E. Increased Risk of Infection with Human Immunodeficiency Virus Type 1 Among Uncircumcised Men Presenting with Genital Ulcer Disease in Kenya. Clin Inf Dis. 23: 449-453, 1996.
The Torah: The Five Books of Moses. Philadelphia: Jewish Publication Society of America 1962.
Thompson G, Walker L. Other Infections of the Bladder, Bilharziosis.Genito-Urinary Surgery. Philadelphia: WB Saunders; 467-474,1950.
Tushmet L. Uncircumcision. Medical Times, 93(6): 588-593, Jun 1965.
http://www.cirp.org/library/restoration/tushmetl/
Treves F. Circumcision. A Manual of Operative Surgery
11. Chapt VI. London: Cassell 1903: 670-3.
Vera Gamboa L. Historia de la Medicina. Historia de la sexualidad. Rev Biomed 9:116-121,1998. Centro de Investigaciones Regionales "Dr. Hideyo Noguchi", Universidad Autónoma de Yucatán. http://www. uady.mx/~biomedic/rb98927.html.
Voltaire. Obras Selectas de Voltaire. Diccionario Filosofico, Novelas y Cartas Fislosoficas. Circuncisión: 212-215 Libreria El Ateneo Edit. 1958.
Wallerstein E. Circumcision: Ritual surgery or surgical ritual (1983) 2 Med Law 85-87.
Wallerstein E. Circumcision: An American health fallacy. New York: Springer Publishing Company, 1980.
Wallerstein E. Circumcision: The uniquely American medical enigma. Urology Clinics of North America,
12, 123-132, 1985.
Warren R. Circumcision. Textbook of Surgery II. Chapt XXXII. London: Churchchill: 630-633, 1915.
Warren JP, Bigelow J The case against Circumcision. British Journal of Sexual medicine: 6-8, Sep /Oct 1994.
Warner E, Strashin E. Benefits and Risks of Circumcision. CMA Journal. 125: 967-992, 1981.
Weiss GN, Westbrook KC, Sanders M. The Distribution and Density of Langer- hans Cells in the Human Prepuce: Site of a Diminished Immune Response? Israel J. Med Sci. 29: 42-43, 1993.
Weiss GN. Prophylactic Neonatal surgery and infectious diseases. Pediatr Infect Dis J 16: 727-734, 1997.
Weiss GN, Weiss EB. A Perspective on Controversies over Neonatal Circumcision.Clin Ped. 33: 726-730, 1995.
Weiss GN. Current Concepts of Neonatal Circumcision in the United States. Int Surg. 71: 62, 1986.
Weiss GN. Neonatal Circumcision. South Med J. 78: 1198-1200, 1985.
Whipple J. Circumcision: A conspiracy of silence. In F. Abbott (Ed.), New men, new minds: 110-113. Freedom, CA: The Crossing Press, 1987.
Williams N, Chell J, Kapila L. Why are children referred for circumcision? British Medical Journal, 306, 28-30,
1993.
Williams N, Kapila L. Complications of circumcision. British Journal of Urology, 80:1231-1236, Oct 1993.
Wilkes MS, Blum S. Current trends in routine newborn male circumcision in New York State. New York State Journal of Medicine, 90, 243-246, 1990.
Wiswell TE. Routine Neonatal Circumcision: A Reappraisal. Am Fam Practice. 41: 859-863, 1990.
Wiswell T. Circumcision: An update. Current Problems in Pediatrics, 22, 424-431, 1992.
Wiswell TE. Neonatal Circumcision: A Current Appraisal. Pediatrics. 1(2): 93-99, 1995.
Wiswell, T, Hachey WE. Urinary tract infections and the uncircumcised state: An update. Clinical Pediatrics, 32, 130-134, 1993.
Wilson RA. Venereal disease in circumcised and uncircumcised soldiers. Can Med Assoc J 56: 54-57, 1947.
Wolbarst AL. Circumcision and penile cancer. Lancet 1:
150-153, 1950.
Wolbarst AL. Does Circumcision in Infancy Protect against Disease? Virginia Med Monthly: 723-728, March 1934.
Wrana P. Historical review: Circumcision. Archives of Pediatrics, 6, 385-392, 1939.
Yellowlees D Masturbation in a Dictionary of psychological medicine: 784-786. ed D. Hack Tuke London Churchill
Young HH, Davis DM. Operations on the penis circumcision. Young's Practice of Urology, II. Chapt XXI Philadelphia: WB Saunders 643-645, 1926.
Zindler F.Circumcision: The stone age in the steel age. Ameri Atheist, 34-40, Feb 1990.
Zimmermann F. Origin and Significance of the Jewish Rite of Circumcision. Psychoanalytic Rev. 38 (2): 103-112, 1951.
The Circumsicion referente lybrary. The Holy Bible, Circumcision,False Prophets,and Christian Parents by George Hill http://www.drp.oig/pages/cultural/chris-tian.html
Kaplan GW. Complications of Circumcision. Symposium on Complications of Pediatric Urologic Surgery Urol Clin North Am, 10(3): 543-549, August 1983.
http://www.cirp.org/library/complications/kaplan/
Circumcision procedure (Gomco Clamp method) PATIENT CARE, Volume 12, pp. 82-85, March 15, 1978.
http://www.cirp.org/library/procedure/gomco/
Patel DA, Flaherty EG, Dunn J.Factors Affecting the Practice of Circumcision AMERICAN JOURNAL OF DISEASES OF THE CHILD, Volume 136, Pages 634-636, July, 1982.
http://www.cirp.org/library/procedure/dpatel/
PATEL H. The Problem of Routine Circumcision. GENERAL PRACTICE CANADIAN MEDICAL ASSOCIATION JOURNAL, Volume 95: Pages 576-581, September 10, 1966.
http ://www. cirp .org/library/procedure/p atel/
Cansever G. Psychological Effects of Circumcision. BRITISH JOURNAL OF MEDICAL PSYCHOLOGY, Volume 38: Pages 321-31, December 1965.
http://www.cirp.org/library/psych/cansever/
Freud A. THE ROLE OF BODILY ILLNESS IN THE MENTAL LIFE OF CHILDREN. PSYCHOANALYTIC STUDY OF THE CHILD 1952; Volume 7: Pages 69-81. http://www.cirp.org/library/psych/freud/
Wright JE. Non-Therapeutic circumcision, Medical Journal of Australia 1: 1083-1086,May 27, 1967. http://www.cirp.org/library/general/wright4/
American Academy of Pediatrics. The AAP made statements about circumcision in 1971, 1975, 1977, and 1989.1971 Statement of the AAP. American Academy of Pediatrics, Committee on Fetus and Newborn. Standards and Recommendation for Hospital Care of Newborn infants. 5th ed. Evanston, IL: American Academy of Pediatrics: 1971. http://www.cirp. org/library/statements/aap/
Circumcision and urinary tract infection http ://www. cirp.org/library/disease/UTI/
Birley HD,Walter MM, Luzzi GA,Bell R, Taylor-Robinson D, Byrne M, Renton AM Clinical Features and management of recurrent balanitis; association with atopy and genital washing. Genitourinary medicine 69(5):400-403, October 1993.
http://www.cirp.org/library/disease/balanitis/birley/
Gordon A, Collin J. Save the normal foreskin. Widespread confusion over what the medical indications for circumcision are. British Medical Journal (London) 306:1-2, 2 January 1993.
http://www.cirp.org/library/general/gordon/
Circumcision Reference Library http://www.cirp. org/library/
Deibert GA. The separation of the prepuce in the human penis. Anatomical records, 57(4): 387-399, November 1933.
http://www.cirp.org/library/anatomy/deibert/
Circumcision. 1(1). June, 1996 http://facuity.washing-ton.edu/gcd/CIRCUMCISION/vlnl.html
Dunsmuir WD, Gordon EM. The history of circumcision. BJU International 83 suppl 1: 1-12, January 1, 1999. http://www.cirp.org/library/history/dunsmuirl/
Rubin JP. Celsus's decircumcision operation. Medical and Historical Implications. Urology 16(11): 121-124, July 1980. http://www.drp.oig/library/restoration/rubin/
Tushmet L.Undrcumdsion. Medical Times 93(6): 588-593, June 1965. http://www.drp.org/library/restoration/tushmetl/
Denniston G. An Epidemic of Circumcision Presented at The Third International Symposium on Circumcision, University of Maryland, College Park, Maryland May 22-25, 1994. http://www.nocirc.org /sy m pos i a/t h i rd/den n i sto n3. h t m I
Circumcision 1(2) September, 1996 http://faculty.wash-ington.edu/gcd/CIRCUMCISION/vln2.html
Wallerstein E.Circumcision: The Uniquely American Medical Enigma. Urologic Clinics of Northh America 12 (l):123-132,February 1985. http://www. cirp.org/library/general/wallerstein/
Circumcision. Volume 2, Number 1. June 1997 (posted Sept 1997). http://faculty.washington.edu/gcd/CIR-CUMCISION/v2nl.html
Circumcision and Urinary Tract Infections. To the Editor. Pediatrics, 77(2): 267, February 1986. http://www.cirp.org /library/disease/UTI/cunningham/
Ericksen K The Ritual of Circumcision.
http://www.noharmm.org/paige.htm
Herzog LW. Urinary tract infections and circumcision. A case-control study. American Journal of diseases of children 132(3): 348-350. March 1989.
http://www.cirp.org/library/disease/UTI/herzog2/
Male circumcision-Yahoo http://search.yahoo.com /search?p=Male+circumcision&sub=Search&fr=fp-top
Winberg J, Bollgreen I ,Gothefors L, Hertelius M, Tullus K. The prepuce: A mistake of nature? Child Health . Lancet 1:598-599, March 18, 1989. http://www.drp. org/library/disease/Un/winberg-bollgren/
American Academics of Pediatrics. Task Force on Circumcision. Circumcision Policy Statement Pediatrics, 103(3): 686-693, March 1, 1999. http:// www.cirp.org/library/statements/aapl999/
Editorial. The Circumcision Controversy. Ameritan Family Physician, 41(3): 817-820, March 1990. http ://www.cirp .org/Ubrary/disease/UTI/altschull990/
Goldman M, Barr J, Bistritzer T, Aladjem M. Urinary Tract Infection following ritual jewish circumcision. Israel Journal of medical sciencies, 32(11):1098-1102, november 1996. http://www.cirp.org/library/ disease/UTI/goldman/
Fleiss PM, Hodges FM, Van Howe RS.Immunological functions of the human prepuce. Sexually Transmitted Infections 74(5): 364-367, October 1998. http://www.cirp.org/library/disease/STD/fleiss3/
Quevedo EV.Historia. Cuando la Higiene se volvió pública. Rev. Fac. de Med. Univ. Nal de Colombia, 52(1) http://www.revmed.unal.edu.co/revistafm/v52nl/v5 2nlhl.htm
Male Cricumcision: a Muslim perspective. Dr Bashir Quereshi traces the origins of male circumcision, with a focus on the Muslim perspectiva http://www.familymedicine.co.uk/features/cir-cum3.htm
Male Cricumcision a Jewish perspective.Dr Sifman discusses why male circumcision is part of the Jewish religion and outlines the procedures involved in the surgery and function of the Mohel. http://www.fam-ilymedicine. co.uk/features/circum2.htm
Male Cricumcision: the case against. Dr Peter Ball discusses the case against circumcision. http://www. familymedicine. co.uk/features/circum4.htm
Health An Islamic Perspectiva. Islamic Ruling on Male and Female Circumcision Islamic Ruling on Circumcision, http://www.islamset.com/hip/health5/dr-cumhtml
Circumcision (Al-Khitaan). http://www.circumcisionin-fo. com/islam_circl .htm
Khafd and Sunni Islamic Law - why Muslim States may prohibit FGM without violating the Shari'a Principles. Introduction, http://www.kodabu.de /amnesty/jur-ak-koeln/beitraege/schumacherOl.html
Dr. Julio César Potenziani Bigelli
Especialista urólogo Hospital Privado Centro Médico de Caracas
Br. Silvia Daniela Potenziani Pradella
Estudiante de Medicina UCV.. Escuela Luis Razetti.
GUIA DE REEDUCACION VESICAL Y REHABILITACION DE PISO PELVICO, EN PACIENTES CON TRASTORNOS URINARIOS
MANUAL DE REEDUCACIÓN VESICAL
ESTRATEGIAS EN LA URGENCIA URINARIA
FISIOTERAPIA DE PISO PÉLVICO
THE HOPKINS SYMPTOM CHECKLIST (SCL-90-R) FOR PSYCOLOGICAL DISTRESS (L. DEROGATIS)
TEST MINI MENTAL (FOLSTEN Y FOLSTEN 1975) (PARA CONSTATAR SALUD MENTAL)
SHORT FORM HEALTH SURVEY (SF-36)
http://www.swin.edu.au/victims/resources/assess-
ment/health/SF36.pdf
INCONTINENCE IMPACT QUESTIONNAIRE- SHORT FORM nQ-7
CLASIFICACIÓN CLÍNICA DE INCONTINENCIA URINARIA SEGÚN STAMEY (STAMEY-1980)
CLASIFICACIÓN DE LA INCONTINENCIA URINARIA DE ESFUERZO EN LA MUJER (POTENZIANI 1994)
CLASIFICACIÓN DE LA INCONTINENCIA URINARIA DE ESFUERZO EN LA MUJER (IOE) (BLAIVAS 1988)
CUESTIONARIO DE VEJIGA HIPERACTIVA Y CALIDAD DE VIDA (POTENZIANI-QOL-HV-26, 2005)
CUESTIONARIO DE IMPACTO DE LA INCONTINENCIA URINARIA SOBRE LA CALIDAD DE VIDA DEL PACIENTE (QOL) (CüU-Potenziani 99)
DEFINICIONES ÚTILES PARA LA PRESENTE GUÍA
Usualmente las parientes no referirán sus pérdidas urinarias por temor a ser rechazada o por simple
Según uno de los grandes precursores del estudio de mujeres con incontinencia como lo fue Diokno (1986) la incontinencia urinaria es una condición prevalente y costosa que afecta 38% de mujeres de 60 años o más, predisponiendo a la paciente a otras enfermedades (psíquicas y orgánicas) como depresión, ansiedad, alejamiento de toda actividad productiva con afectación de su vida sodal-profesional, problemas del sistema esquelético (caídas, fracturas, invalidez), deterioro de su esfera sexual (disfunción sexual femenina), que afectarán la autoestima y la aislarán socialmente (Herzog 1990), volviéndola a su vez paradójicamente más dependiente de los demás, ya que su problema ameritará, en un alto porcentaje de los casos, la ayuda de familiares, amigos, enfermeros o fisiatras sobre todo si la paciente tiene déficit motores o mentales que así lo condidonen llevando muchas veces a la reclusión en casas o andanatos, con todas las secuelas que esto ocasiona no sólo al padente sino a su entorno familiar.
La prevalencia de la incontinencia urinaria (mayor que la observada en hipertensión arterial, diabetes y depresión) va de un 10 a un 30% en adultos jóvenes y de un 15 a un 40% en personas ancianas (por arriba de 60 años) y es dos veces más común en mujeres que en hombres (Herzog 1990).
Es multiétnica y geográficamente expandida a todos los rincones del mundo. Según Thom (1998) los rangos de prevalencia de la incontinencia urinaria van del 3 al 55% dependiendo de cómo se defina la incontinencia urinaria y de que edad tenga la padente. Herzog (1990) refuerza esto ultimo al referir que la prevalenda aumenta con la edad avanzada viéndose como entre 17% y 55% de mujeres ancianas reportan haber tenido incontinencia urinaria en algún momento comparado con un 12% a 42% en mujeres jóvenes.
vergüenza, además que considera que las perdidas urinarias son consecuencia "inevitable" de la vejez.
En los Estados Unidos de Norteamérica 13 millones de norteamericanos son incontinentes urinarios y de ellos 11 millones son mujeres (AHCPR 2001) y menos del 50% buscará atención y tratamiento medico, al punto que sabemos que como promedio, la mujer espera alrededor de 8 a 10 años antes de buscar atención médica autorizada (AHCPR 2001). Por otro lado autores reconocidos como Retzky (1995) refieren que el número de mujeres incontinentes en Estados Unidos de Norteamérica suman aproximadamente 25 millones lo cual posiblemente sea debido a que se han considerado variables diferentes para tal definición.
Según Wilson (2001) el 82% de los costos de tratamientos por incontinencia en los Estados Unidos de Norteamérica que asciende entre 16 y 26 billones de dólares anuales, corresponden al tipo de la incontinencia urinaria de esfuerzo (IOE). Estas cifras son muy similares a las estimadas en enfermedades como artritis, Alzheimer, osteoporosis, VIH, SIDA.
Resnick (1996) habla de una prevalencia del 2% en mujeres de 20 a 24 años, 9% en mujeres de 50-54 años y 16% en mujeres de 85 años. Más de 250 millones de personas en el mundo sufren tal condición y es una de las entidades nosologicas que más gastos económicos ocasionan a los administradores de salud, bien sea privados o públicos, calculándose en billones de dólares al año el costo por terapias sobre pacientes con incontinencia urinaria cualquiera fuera su tipo.
Según Wilson (1996), Burgio (1996), Alien (1990), Meyer (1998) y Bourcier-McGuire-Abrams (2004), un 30% de mujeres desarrollarán incontinencia urinaria de esfuerzo dentro de los 5 años siguientes a su primer parto. Un 5% de ellas ya presentaban incontinencia urinaria de esfuerzo antes de su primer parto. Sabemos que la mujer que es incontinente en la etapa de la gestación así como en el periodo puerperal tendrá 4 veces mas chance de tener incontinencia urinaria de esfuerzo.
Una de las razones del auge de éstas modalidades desde hace mas de 40 años se debió al hecho de que los resultados reportados por la cirugía en cualquiera de sus cientos de modalidades fueron buenos a corto plazo (80-100%), pero cuando comenzaron a publicarse los resultados a 3,5 y 10 años los porcentajes de éxito de dichas cirugías caían estrepitosamente a porcentajes del 60-70%, que en mujeres de 35 a 55 años, tomando en cuenta que dichos porcentaje bajaban aun mas con cada nueva operación que ésa paciente se sometía, lo que ocasionaba un deterioro importante de su calidad de vida, aspecto esto que en los años 70,80 y 90 no se tomaba tanto en cuenta. Esto dirigió las miradas hacia terapias no invasivas, no quirúrgicas y de más fádl aplicadón y que fueran no sólo bien vistas por las parientes, sino fácilmente aplicables a grandes masas de población.
Esto ha cambiado tanto que en los actuales modelos de decisión de pacientes con incontinencia urinaria de la modalidad que fuere, no se comienza ya por cirugía, sino por terapias de reeducación vesical, fisioterapia o rehabilitación del piso pélvico, urofar-macologia y posteriormente se siguen con la cirugía y otros argumentos más complejos que no se nombrarán en ésta monografía.
La disfunción del piso pélvico muscular en nuestras pacientes con incontinencia urinaria es frecuente y la podemos ver en el síndrome de urgencia-fre-cuenda femenino, en la disdnergia del esfínter interno (lisoesfínter) o del esfínter externo (rabdoesfinter) en hombres y mujeres, en el síndrome de dolor rec-tal-pélvico, en la prostatitis crónica no baderiana, en la incontinencia urinaria posterior a drugía radical prostática, en parientes con cistitis intersticial, en pacientes con enuresis, en casos de constipación crónica, y en incontinencia fecal.
LOS PACIENTES CON DISFUNCIÓN DEL PISO PÉLVICO MUSCULAR VAN A TENER REPERCUSIONES EN CUATRO ÁREAS DETERMINADAS: EL ÁREA SEXUAL, EL AREA URINARIA, EL AREA DEFECATORIA Y EL AREA DEL DOLOR A NIVEL ABDOMINAL BAIO Y PERINÉ, POR LO CUAL NO ES DIFICIL DE ENTENDER SUS REPERCUSIONES EN LA CALIDAD DE VIDA DEL PACIENTE AFECTADO.
Las terapias conservadoras para las pacientes femeninas con incontinencia urinaria de esfuerzo (terapias conduduales, recomendadones alimentarias y estrategias anti-incontinencia urinaria, refortalecimiento del piso pélvico con eledroestimulación o sin ella, con aditamentos o sin ellos, con o sin biofeedback) han realzado su utilización debido a que el 63.9% de las pacientes no estaban satisfechas con el resultado quirúrgico para su incontinenda urinaria. Además el 50% de las mujeres respondieron que la mejor ayuda en los últimos 5 años había sido por los tratamientos no quirúrgicos, no invasivos y no farmacológicos (Abrams 2002 ISC).
Ouslander (NEJM 2004), refiere que las terapias conductuales son eficaces en el manejo de la incontinencia urinaria de urgencia y en la incontinencia urinaria mixta (de urgencia y de esfuerzo). En pacientes menores a 75 años con incontinencia urinaria de urgencia o mixta, con función cognitiva intacta y bien motivados tuvieron una respuesta positiva a los ejercicios de rehabilitación del piso pélvico así como a las terapias conductuales y a la reeducación vesical, tanto como un 70% de reducción en el numero de episodios de incontinencia urinaria en los primeros 90 días de tratamiento.
Bo (2004) de la Universidad Noruega de Deportes y Educación Física en Oslo puntualiza el rol de las estrategias conservadoras, específicamente la Fisioterapia del piso pélvico muscular, en el área uroginecologica en el tratamiento de incontinencia urinaria de esfuerzo, vejiga hiperactiva, incontinencia durante el embarazo y después del parto y en presencia de prolapsos uroginecológicos. Refiere el mismo Bo (2004) en Am J Urol Review 2(5) Supp 4 May 2004, que los resultados exitosos que van del 44% al 70% dependerán de un numero importante de factores asociados a perdidas involuntarias de orina en la población femenina. Refiere que la rehabilitación del piso pélvico muscular es tan importante para el campo uroginecológico como el aerobics y otras formas de ejercicio lo son para el sistema cardiovascular
Además la Health Care Financing Administration (HCFA 2000) desde el mes de Octubre del año 2000 comenzó a dar cobertura nacional en los Estados Unidos de Norteamérica a los tratamientos para la incontinencia urinaria de esfuerzo con biofeedback.
Las alternativas no quirúrgicas en la incontinencia urinaria en la mujer son y serán el futuro de los enfoques terapéuticos en pacientes femeninas con incontinencia urinaria.
Veremos que muchas de las alternativas utilizadas son las mismas que se utilizan en pacientes con hiperactividad vesical, pero no debe resultarnos sorpresivo ya que debemos saber que aprox. un 30 a 50% de las pacientes con Incontinencia de orina de esfuerzo, así como un 50 a 75 % de pacientes con incontinencia urinaria de urgencia cursarán con hiperactividad vesical (Potenziani 1999). Será útil advertir que en nuestra experiencia con mas de 300 casos tratados con terapias o alternativas no quirúrgicas, hemos logrado mejorías clínicas y sobre todo mejorías en la calidad de vida de nuestras pacientes con incontinencia urinaria de esfuerzo uniendo varias de las alternativas abajo mencionadas, usualmente terapias conductuales con fisioterapia muscular y con urofármacos usualmente anticoliner-gicos musculotropicos, antidepresivos con la utilización ocasional de estrógenos y en algunos casos con fármacos estimulantes de los receptores beta adrenérgicos.
LA TERAPIA COMBINADA REPRESENTARÁ EL IDEAL DE LA TERAPÉUTICA EN MUJERES CON INCONTINENCIA URINARIA. MUCHAS VECES TENDREMOS MEJORIA DE LOS RESULTADOS QUIRÚRGICOS CON ÉSTAS ALTERNATIVAS Y MEJORARÁN ASPECTOS QUE SERÁN DE GRAN UTILIDAD EN EL ENFOQUE GLOBAL DE PACIENTES CON PÉRDIDAS INVOLUNTARIAS DE ORINA.
El porcentaje de retiro de los pacientes sometidos a diferentes modalidades de tratamiento es del 37.3% en los pacientes sometidos a autoayuda, del 18.2% en el grupo de Terapia Conductual y de 11.9% en el grupo sometido a electroestimulación del piso pélvico muscular.
¿QUÉ HACER ANTES DE COMENZAR UN PLAN DE REEDUCACIÓN VESICAL?
Es obvio que no podemos comenzar inmediatamente un Plan de Reeducación Vesical en todas las pacientes con incontinencia urinaria que nos llegan a nuestra consulta, si no contáramos con un perfil clínico de la paciente que de ser "favorable" nos garantice un porcentaje de éxito "asegurado" con el Plan de Reeducación Vesical, pues de lo contrario, el tener factores que entorpezcan o impidan el desarrollo de la Terapia reeducativa estaríamos aumentando el porcentaje de fracasos del procedimiento y con ello afectaríamos la calidad de vida del paciente, que es exactamente lo que no queremos lograr.
La evaluación clínica que hagamos antes de comenzar la Terapia cumple con el objetivo de descubrir patologías que puedan alterar los resultados de la reeducación vesical en todas sus variantes. Debemos entonces realizar una exhaustiva historia clínica con pesquisa de los antecedentes clínicos y quirúrgicos donde averigüemos aspectos relacionados con las vías urinarias.
DEBEREMOS INVESTIGAR LOS FACTORES QUE AUMENTARÁN EL RIESGO DE QUE UNA PACIENTE SEA INCONTINENTE URINARIA, POR LO TANTO FACTORES COMO GESTACIÓN, TIPOS DE PARTO Y NÚMERO DE PARTOS, ANTECEDENTES DE HISTERECTOMÍA Y PROLAPSOS GINECOLÓGICOS, ANTECEDENTES UROLÓGICOS Y GASTROINTESTINALES, PRESENCIA DE HÁBITOS COMO TABÁQUICO, ALCOHÓLICO, Y CAFEICO, ANTECEDENTES DE FARMACOTERAPIA Y LA COEXISTENCIA DE ENFERMEDADES QUE HAN SIDO ASOCIADAS A INCONTINENCIA URINARIA COMO DIABETES, HTA, DEFICITS COGNITIVOS, PARKINSON, ARTRITIS, LUMBALGIA, ENFERMEDAD BRONCOPULMOONAR OBSTRUCTIVA CRÓNICA, DEFICITS AUDITIVOS Y VISUALES ENTRE OTROS, GRUPO ETNICO DE LA PACIENTE, STATUS SOCIOECONÓMICO, HABITOS DEPORTIVOS Y PRÁCTICA DE DEPORTES DE ALTO IMPACTO
LA TRASCENDENCIA DE SABER QUE EL FACTOR ETIOPATOGÉNICO PRIMARIO EN MUJERES CON INCONTINENCIA URINARIA ES LA MULTIPARIDAD VAGINAL (NORTON 1996, PESCHERS 1996), LE DA ALA REEDUCACIÓN VESICAL Y A LAS MODALIDADES DE REHABILITACIÓN DEL PISO PÉLVICO MUSCULAR UNA IMPORTANCIA INUSUAL, SOBRE TODO SABIENDO QUE ES DEBIDO A LESIONES DEL TEJIDO CONJUNTIVO, NERVIOSO Y MUSCULAR (ALLEN 1990, SNOOKS 1985, 1986, SMITH 1989)
Es importante saber antecedentes de anomalías congénitas genitourinarias y médulo-vertebrales, así como esqueléticas de la pelvis ósea y anomalías de tipo cerebral.
Es importante saber como ha evolucionado su integridad neurourológica, cuanto tiempo tardó en adquirir pleno dominio de sus hábitos urinarios y fecales, si tuvo o no enuresis, si tuvo o no infecciones urinarias infantiles tanto del sistema urinario inferior como superior.
Es importante saber que tipo de enfermedades infantiles tuvo y que tipo de enfermedades ha tenido luego de superar su juventud y en su adultez temprana y tardía.
En el examen físico es importante saber el status de sus vías urinarias inferiores, el status del soporte vesical a través de músculos, fascias y ligamentos, saber como está la motilidad de su área cervico-ure-tral a través de la prueba del Q-Tips (Karram 1988), donde sabremos que existe hipermotilidad uretro-vesical cuando ésta prueba supera los 30- al esfuerzo (con maniobras de Valsalva). La clasificación de movilidad uretral propuesta por Green en 1962 consistía en: Tipo I o Tipo II como grados de Hipermovilidad uretral y Tipo III describiendo la uretra inmóvil. Podía ser clasificada como normal en referencia al grado de cambio del ángulo uretrovesi-cal posterior al pedirle a las pacientes que hicieran esfuerzo (pujar-toser) denominado maniobras de Valsalva y que se podrían constatar por observación clínica, radiológica, fluoroscópica o con modernos equipos de videourodinámica. La Clasificación de Green (1962) fue ulteriormente desarrollada por McGuire (1980).
Se habla de movilidad normal cuando el grado de ángulo uretrovesical posterior al realizar esfuerzo es menor a 110--120- grados. Tipo I es cuando al esfuerzo el ángulo uretrovesical posterior alcanza 180- grados o más con desplazamiento hada abajo de la uretra de 2 a 3 cm. El tipo II es cuando la hipermovilidad uretral es mayor de 45- grados en el plano vertical (ángulo uretrovertical) que nosotros medimos de manera práctica con la prueba del Q-Tip (Karram 1988). Se asocia éste tipo II a un descenso uretral y rotadón posterior de 3 a 6 cm. o más. Todo esto lo que hace en lugar de que las presiones abdomino-vesicales se transmitan a la uretra proximal con su cierre respedivo oponiéndose a la salida involuntaria de orina, no sucede, ya que al movilizarse anormalmente la uretra se perderá ésta secuenda no lográndose ninguna coaptación uretral con lo cual se obtendrá fuga urinaria. En los tipos I y II de hipermovilidad uretral la uretra proximal tendrá presiones de más de 20 cm. de agua cuando el paciente está en reposo en posición supina. En el Tipo III (deficiencia esfinteriana intrínseca) habrá menos de 20 cm. de agua de presión intrauretral. Es importante referir que puede haber deficiencia esfinteriana intrínseca con hipermovilidad ya que ambas condidones no son excluyentes conocer el volumen de orina residual que queda después de una micdón "normal" para saber si contamos con una vejiga "balanceada". Es muy importante saber si la padente tiene un status mental normal a través de test como por ejemplo el Mini Mental State Examination (Folstein-Folstein 1975), con el cual descartaríamos la presenda de demencia senil en caso de estar tratando pacientes de más de 60 años, donde puntuaciones por debajo de
24 puntos nos repercutiría en todas las actividades que requieran del o de la paciente un nivel de comprensibilidad y sustento cognitivo que ayuden desde la realización del Diario Vesical, prueba básica para investigar síntomas urinarios (Abrams 1983, Larsson 1988, Sitberg 1997), durante 1 a 2 semanas, hasta contar con un(a) paciente que tenga las suficientes armas para afrontar niveles de frustración de diversos grados y superarlos.
LAS TERAPIAS DE REEDUCACIÓN VESICAL CON FISIOTERAPIA DEL PISO PÉLVICO CON O SIN ELECTROESTIMULACIÓN, CON O SIN BIOFEEDABCK, REQUIEREN SIN DUDA ALGUNA, UNA COMPLETA SALUD COGNmVA-NEUROLOGICA Y EMOCIONAL DEL PACIENTE QUE COMPLEMENTEN Y GARANTICEN EN PRIMER LUGAR LA REALIZACIÓN DE LAS MISMAS Y EN SEGUNDO LUGAR EL MAYOR DE LOS EXITOS, UNIÉNDOSE O NO A OTROS TIPOS DE TERAPIAS (FARMACOLÓGICAS O INVASIVAS).
Deberemos descartar y resolver aspectos como la presencia de infecciones urinarias, con criterios más amplios que los ya conocidos de Kass (1956-1957). Todo contaje bacteriano por encima de 102 UFCxml con sintomatología o sin ella, deberá ser enfocado agresivamente tanto en la paciente como también en su pareja.
Debemos resolver historias de constipación fecal o de impactadón fecal ya que tendrán una indudable repercusión en la Terapia Condudual.
Deberemos resolver la posible vaginitis atrófica reflejo de un hipoestrogenismo que afectará todos los tejidos estrógeno-dependientes entre los cuales se encuentran los tejidos de soporte músculo-aponeurótico del piso pélvico y de la uretra y vejiga urinaria, fundamentales en las terapias de refortalecimiento del piso pélvico.
Deberemos determinar que tipo de incontinenda urinaria tenemos, lo cual lograremos en un alto porcentaje con el simple interrogatorio inicial del paciente, aunado a la valiosa información del diario vesical, unido a la realización del estudio urodinámi-co. Deberemos precisar la presencia o no de contracciones vesicales no inhibidas que nos denoten una hiperactividad vesical en su fase de llenado. Deberemos precisar la capaddad funcional de la vejiga para en base a ella saber que modalidad de reedu-cadón es más adecuada para cada padente.
Es importante que siempre tengamos presente los mecanismos que sostienen la continencia urinaria en la mujer y éstos son: el soporte muscular, facial y ligamentoso de la base vesical, la integridad neu-rológica, la ausencia de contradilidad vesical exacerbada (hiperadividad vesical) durante la fase de llenamiento vesical, la presencia de un adecuado endotelio uretral con un efecto sello conservado por tener los componentes vascular, conectivo y neu-rológico normales.
LA RESPUESTA A LA TERAPIA DEPENDERÁ NO SÓLO DEL TIPO DE MODALIDAD SELECCIONADA, PERO SOBRE TODO AL TIPO DE PACIENTE ESCOGIDO,
Y PRIMORDIAL-MENTE A LA EVALUACIÓN, IDENTIFICACIÓN Y CONTROL DE LOS FACTORES CONTRI-BUYENTES PARA DICHA INCONTINENCIA URINARIA.
INDICACIONES DE REEDUCACION VESICAL
Teóricamente las alternativas terapéuticas no quirúrgicas y no farmacológicas para la incontinencia urinaria como las que desarrollamos en éste manual se dejan para aquellos casos leves (dínicamente hablando) de incontinencia urinaria, con un mecanismo esfinteriano ligeramente comprometido (Resnick
1996), donde no haya trastornos anatómicos severos del área ginecourológica (prolapsos grado III,IV), donde no haya alteradones neurourológicas importantes (vejigas neurogénicas) ocasionadas por enfermedades congénitas o adquiridas, donde no haya trastornos anatómicos severos del trado urinario inferior (megavejigas, megaureteres con ectopias ureterales), donde no haya alteradones del área cog-nitiva que entorpezcan cualquier terapia donde la colaboración del paciente sea trascendental, donde el padente no tenga trastornos severos de la motilidad intestinal, donde no haya enfermedades de la vejiga urinaria como dstitis intersticial, cáncer de vejiga, cálculos vesicales entre otros y finalmente donde no haya farmacoterapias que condidonen y faciliten el "efecto incontinente urinario" en las pacientes.
Sin embargo hemos tenido experiencia con pacientes que han tenido incontinencia urinaria como manifestadón de cualquiera de las excepciones arriba mencionadas y nos han servido no para eliminar totalmente la incontinencia urinaria, pero si para sugerir conductas generales, alimentarias y urinarias que en sentido global ayudan también al padente y también nos han servido para preparar el terreno de una cirugía de prolapso(s) uroginecológicos donde a "posteriori" del acto quirúrgico la paciente queda con un condicionamiento "aprehendido" de lo que se debe y de lo que no se debe hacer, aparte de que ya ha aprendido como rehabilitar su piso pélvico y lo poco que se ha podido arreglar antes de la operación ha servido para dejar un substrato útil para lograr mejores cifras de curación a corto, mediano y largo plazo.
REEDUCACIÓN VESICAL (Terapias que modifican la conducta urinaria del paciente)
Burgio (JAMA 1998) refiere que las Terapias Conductuales o de Reeducación vesical en pacientes con incontinencia urinaria reducen un 80.7% los episodios de incontinencia urinaria versus un 68.5% de reducción en pacientes bajo terapia farmacológica y un 39.4% en el grupo placebo. Por otro lado la mejoría de su cuadro clínico, percibida por el paciente con las terapias conductuales fue de un 74% en comparación con la sensación de mejoría percibida por las terapias farmacológicas (50.9%) y por el grupo placebo (26.9%). Pero lo que consideramos más importante es que sólo un 14% de pacientes recibiendo Terapia Conductual para su incontinencia urinaria quería cambiar de modalidad de tratamiento, resultado bien diferente al mostrado por las pacientes pertenecientes al grupo de Terapia farmacológica y al grupo placebo donde cada uno de ellos quiso cambiar de terapia en un 75.5% de los casos.
Esto evidencia no sólo efectividad de la modalidad terapéutica sino confiabilidad y aplicabilidad que aseguran un lugar inequívoco en el enfoque terapéutico de éstas pacientes con incontinencia urinaria.
Modalidad terapéutica recomendada como primera línea por el Urinary Incontinence in Adults Consensus Conference aparecido en JAMA (1989) y también recomendado por Hadley (1983) de la National Institutes of Aging y el Consensus Conference on Urinary Incontinence in Adults (JAMA 1989) y por la Clinical Practice Guideline for Urinary Incontinence bajo los auspicios de la Agency for Health Care, Policy and Research (Fantl 1996).
DEFINICIÓN DE REEDUCACIÓN VESICAL
Son las habilidades o estrategias que el médico imparte a sus pacientes para que aprendan a controlar la vejiga (y por ende el acto de la micción-vaciamien-to urinario y llenamiento urinario) en relación a los factores que actúan sobre ella, y con ello evitar fundamentalmente la incontinencia urinaria (en los casos de hiperactividad vesical con disminución de la distensibilidad vesical) o los episodios de infecciones urinarias por residuo urinario importante (en los casos de vejigas perezosas por hábitos retencionistas o por secundarismos neuro-urológicos).
Los factores que actúan sobre la vejiga urinaria son numerosos, entre ellos, el stress, psicosomatismo, hábitos urinarios equivocados del paciente (orinador habitual, retendonista), alimentación irritante para el urotelio, antecedentes de infecciones urinarias a repetición, en la mujer, antecedentes de infecciones urinarias en el varón (dsto-prostatitis, Infecdones de Transmisión Sexual), antecedentes inflamatorio-infecciosos en el área ginecológica, antecedentes obstrudivos urinarios de la salida vesical tanto en hombres como en mujeres, antecedentes quirúrgicos vesicales-prostáticos, uretrales, antecedentes de tratamiento con Quimioterapia y/o Radioterapia en vejiga, próstata, entre otros.
OBJETIVOS DE LA REEDUCACION VESICAL
1. ENSEÑAR AL PACIENTE A PREVENIR LAS PÉRDIDAS URINARIAS CONTRAYENDO VOLUNTARIAMENTE LOS MÚSCULOS DEL PISO PÉLVICO MUSCULAR Y SER ÉL QUIEN COMANDE ALA VEJIGA Y NO LO CONTRARIO.
2. ENSEÑAR AL PACIENTE A AUMENTAR GRADUALMENTE LA CAPACIDAD VESICAL (AL AUMENTAR SU DISTENSIBILIDAD O CAPACIDAD DE LLENAMIENTO DE LA VEJIGA) Y CON ELLO DISMINUIR LA FRECUENCIA Y LA URGENCIA URINARIA Y POR ENDE LOS EPISODIOS PROBABLES DE INCONTINENCIA URINARIA.
3. ENSEÑAR AL PACIENTE A DISMINUIR LA FRECUENCIA URINARIA, POR AUTOCONTROL, PSICOLÓGICO-SOMATICO.
4. ENSEÑAR AL PACIENTE A TENER PLENA CONCIENCIA DE SUS PROBLEMAS URINARIOS
Y CAMBIAR SU ACTITUD YA QUE SON DOMINABLES.
5. CON TODO LO ANTERIOR MEIORAR LA CALIDAD DE VIDA DEL PACIENTE.
Las Terapias conductuales o reeducativas fueron ideadas para modificar el comportamiento del paciente en referencia a su esfera urinaria, para desarrollar habilidades y nuevas estrategias, para evitar las perdidas involuntarias de orina, para disminuir los episodios de urgencia urinaria, para disminuir la frecuencia urinaria y la frecuencia de los episodios de incontinencia y mejorar por ende el control vesical y para concientizar en el paciente la capacidad que tiene de lograr una mejor control en su almacenamiento y vaciamiento urinario (Potenziani 1999) ,(AMA 2001),(Berghmans 2000),(Bo 2004),(Burgio 1989, 1998,2002,2003), (Datillo 2001), (Fantl 1990), (Goode 2004).
Como veremos posteriormente, tanto la reeducación vesical, como las estrategias para controlar la urgencia urinaria, como la fisioterapia del piso pélvico muscular se fusionaran y sumarán sus efectos beneficiosos para la mejoría clínica del paciente y en consecuencia para una mejor calidad de vida.
Mejorarán el control vesical y serán métodos que complementarán a otros como por ejemplo la cirugía de incontinencia urinaria en la mujer, la cirugía radical de próstata, las cirugías de alivio de la salida vesical con vejigas hipertrofiadas de esfuerzo, entre ellas la mas frecuente es la cirugía por crecimiento prostático benigno, las cirugías de prolapsos del piso pélvico en la mujer, o las cirugías radicales pelvianas ginecológicas, urológicas e intestinales.
En todas las modalidades de cirugía aplicadas a pacientes con incontinencia urinaria, la trilogía de reeducación vesical, estrategias para controlar la urgencia y fisioterapia del piso pélvico muscular representarán la diferencia entre un postoperatorio exitoso y uno problemático, ayudarán a mejorar la calidad de vida diaria del paciente y sobre todo optimizará los resultados quirúrgicos.
En el caso de la incontinencia urinaria femenina, son el presente y futuro de las estrategias terapéuticas, unido a la farmacoterapia y a la cirugía en casos bien seleccionados.
La reeducación vesical forma parte de las terapias conductuales, las cuales tienen como objetivo modificar favorablemente el comportamiento de la paciente en diversas áreas de la vida diaria, con el objetivo de obtener un control sobre los episodios de incontinencia urinaria de esfuerzo, frecuencia urinaria, incontinencia de urgencia, y en aquellos casos de hiperactividad vesical caracterizada por frecuencia urinaria, urgencia urinaria, nocturna, incontinencia urinaria de urgencia.
Están considerados como terapia de primera línea en la población femenina con incontinencia urinaria de esfuerzo o mixta, (AHCPR 2001) donde se ratificó su utilidad por su fácil aplicación, bajo costo, seguridad y efectividad y no ser un procedimiento invasivo con excelentes resultados clínicos, ratificados por numerosos urólogos en todo el mundo.
Serán de gran utilidad cuando se una el entusiasmo del paciente con el del terapista, cuando el paciente siga con bastante precisión las recomendaciones de su médico-urólogo, y cuando se hagan las recomendaciones adecuadas que surjan de un análisis preciso del diario vesical así como de la entrevista con el paciente. El nivel de satisfacción logrado en nuestras pacientes es significativo ya que cuando no se logra un control absoluto de la continencia urinaria, se logrará una reducción significativa en la frecuencia urinaria y en los episodios de incontinencia urinaria, así como en los episodios de urgencia lo que sin duda mejorará la calidad de vida de nuestras pacientes.
Burgio (1989) menciona que un 75% de pacientes se sentirán mejor, un 45% podrían recaer sintomáticamente después de haber sentido mejoría, un 15% desearán retirarse de las terapias conductuales, en comparación con un 75% que desearían hacerlo con las terapias farmacológicas
Es fundamental para su realización que el paciente tenga una función cognitiva adecuada, así como un sistema urinario inferior sin perturbaciones neurourologicas para que junto a la disposición de mejorar den los mejores resultados de su aplicación. En muchas ocasiones tendremos pacientes que no contarán con mucho entusiasmo o que no tengan la capacidad para poder adquirir habilidades que le permitan cumplir con las terapias conductuales (ancianas con estados depresibles, o pacientes minusválidos, o adultos con disturbios emocionales severos por lo que no podrán aplicarse las terapias conductuales.
Muchas veces hay que advertirle a las pacientes que éstas terapias no darán resultados de inmediato, ya que requieren de tiempo y paciencia para tener una mejoría de su cuadro clínico. Muchas veces la frustración tanto del paciente como de sus médicos y familiares hace que se retire del programa de cambios conductuales.
En principio toda reeducación vesical se imple-menta en pacientes con urgencia, frecuencia, donde los intervalos miccionales son cortos y donde se quiera mejorar la sintomatología de la paciente para con ello mejorar la calidad de vida.
Si consideramos que aprox. un 50% de pacientes con Incontinencia urinaria de esfuerzo tienen síntomas de hiperactividad vesical, estaremos entonces en la necesidad de implementar reeducación vesical en ellas, que junto con las estrategias para la urgencia, las estrategias alimentarias, la fisioterapia muscular del piso pélvico y los urofarmacos adecuados tendremos una verdadera mejoría que en muchísimas ocasiones alejará la sombra de la posible cirugía para la incontinencia urinaria de esfuerzo, pero de no poder evitarla, mejorará sin duda alguna los índices de éxito de aquella.
La reeducación vesical logrará la eliminación de la incontinencia urinaria en un 15-18% y la mejoría en un 50% de los casos.
MODALIDADES DE REEDUCACION VESICAL
1. Micción facilitada
2. Micciones programadas horarias.
3. Reentrenamiento progresivo de hábitos miccionales
Para poder aplicar un determinado tipo de reeducación vesical se hace indispensable conocer el perfil miccional que presenta el paciente a través del estudio concienzudo del DIARIO VESICAL (Abrams 1983, Larsson 1988, Sitberg 1997), que no es otra cosa que el perfil urinario de nuestro paciente, con las circunstancias que rodean los episodios de incontinencia urinaria, la presencia o no de urgencia, los intervalos miccionales y la cantidad de agua ingerida, así como la cantidad de orina producida en cada mic-ciona así como la cantidad de perdidas involuntarias de orina.
El diario vesical a realizarse en TRES DIAS, es la bitácora de un paciente con incontinencia urinaria donde se toman en cuenta la cantidad de líquido ingerido, el tipo de liquido ingerido, las veces que la paciente ha ido a orinar tanto en el día como en la noche, si dicha orinada la ha realizado con urgencia o normalmente. Si la ha realizado con urgencia saber si durante el episodio ha perdido orina (incontinencia en contra de su voluntad). Debemos precisar la cantidad de orina en cada micción normal o anormal y la cantidad aproximada de orina perdida durante el episodio incontinente. Es importantísimo precisar que circunstancias rodeaban al paciente en el momento de la perdida involuntaria de orina, así como es importante saber que tipo de tratamiento médico relacionado o no a las vías urinarias está tomando el paciente.
El diario vesical parece un componente simple de la valoración de la paciente incontinente, pero su trascendencia se verá reflejada no sólo en la obtención de datos de gran importancia al urólogo sino que permitirá saber la capacidad funcional vesical, el gasto urinario drcadiano, la presencia de urgenda, frecuencia y nocturna, lo permitirá diagramar una reeducación vesical adecuada, permitirá sugerir cambios conductuales que mejoren a la paciente, permitirá sugerir cambios alimentarios y nos dará el sustento necesario para implantar un terapia farmacológica y sobre todo condentizará al paciente en la obtendón de mejores resultados de su tratamiento para su incontinenda urinaria.
Tenemos básicamente tres tipos de reeducación vesical.
Al conocer el intervalo micdonal, a través del diario miccional, se le recomienda a (1) la paciente acudir al baño a orinar antes de llegar al tope de dicho intervalo. Es dedr si los intervalos miccionales son de tres horas, luego de lo cual se presentaría un episodio de urgencia urinaria con la posible incontinenda urinaria, el paciente deberá ir al baño a orinar a las 2 horas 45 minutos, o a las dos horas y media, por ejemplo. Solamente nos ayudará a evitar los episodios de incontinencia urinaria. No ayuda a soludonar un trastorno de almacenamiento vesical. Aun así mejorará la calidad de vida de las parientes que lo pongan en práctica.
¿CUÁLES SON LOS FACTORES RELACIONADOS QUE SE CONSIDERAN INDISPENSABLES PARA QUE HAYA UNA RESPUESTA ADECUADA AL ESQUEMA DE MICCIÓN FACILITADA O PROMPTED VOIDING? (Specht-Lyons 2002).
Se coloca el nivel de evidencia después de cada factor.
1. Tener una capacidad vesical normal (entre 200 y 700 mi) (A).
2. Tener estado cognitivo normal (A).
3. Reconocer (identificar) normalmente la necesidad de orinar (A).
4. Presentar alta frecuencia de peticiones de ir al baño (B).
5. Completar un numero alto de sesiones asignadas al esquema de micción facilitada, bien sea por las personas al cuidado de (1) la paciente (B).
6. Menos de 4 episodios cada 12 horas de incontinencia urinaria, los primeros 3 días (A).
7. Menos del 20% de presentar episodios de incontinencia urinaria los primeros 3 días del enfoque conductual (B).
8. Más del 66% de de saberse comportar en el baño durante los 3 primeros días (B).
9. Al menos más del 50% de micciones en el baño dentro del receptáculo para tal fin, durante el primer día de enfoque conductual (A).
10. Capaz de miccionar adecuadamente cuando es asistido en el baño (A).
11. Máximo volumen orina de más de 150 mi (A).
12. Tener habilidad de deambular independientemente (B).
13. Presentar volúmenes de orina residual por debajo de 100 ml(A).
Los factores asociados a no tener una respuesta satisfactoria al esquema de micción facilitada son: presentar un status cognitivo deficiente (B), ser incapaz de iniciar exitosamente una incursión en el baño durante el primer día de enfoque conductual con la micción facilitada (A), presentar edad avanzada (B), presentar altos volúmenes de orina residual (A), presentar volúmenes orinados máximos bajos (A), y presentar una alta frecuencia (más del 40%) de idas al baño "seca", pero sin poder orinar adecuadamente dentro del receptáculo para tal fin (A).
Los resultados que deberíamos esperar luego de implementar un enfoque de reducadón vesical con la variedad de micción facilitada son:
1. Tratar de lograr un aumento de el numero diario de episodios urinarios sin "incontinen-da", es decir de lograr "estar secos" (A).
2. Aumentar el numero de micciones continentes (B).
3. Disminuir el average de micdones incontinentes (B).
4. Identificar los patrones individuales de incontinencia urinaria (B).
5. Ser capaces de reconocer la sensación de urgenda al orinar (A).
SE HACE INDISPENSABLE IDENTIFICAR LOS PATRONES MICCIONALES DE CADA PACIENTE PARA OBTENER DE ELLOS LOS MAS ALTOS NIVELES DE CONTINENCIA POSIBLE CON LA MENOR NECESIDAD DE "ASISTENCIA PARAMEDICA" POSIBLE, APLICANDO LOS INTERVALOS MICCIONALES ADECUADOS PARA CADA QUIEN, DETERMINÁNDOSE LUEGO DE 1 A 2 MESES LA VIABILIDAD DE ESTOS MÉTODOS EN DICHOS PACIENTES.
SI EL PACIENTE NECESITA ACUDIR AL BAÑO CON INTERVALOS MENORES A 2 HORAS PARA PODER MANTENER LA CONTINENCIA URINARIA NO SE DEBERÍA SEGUIR UTILIZANDO ESTE ESQUEMA DE MICCION URINARIA FACILITADA.
ES DE RESALTAR LA IMPORTANCIA QUE TIENE EL HECHO DE QUE EL LA(EL) PACIENTE PRESENTEN UN PORCENTAJE ELEVADO DE INTENTOS-PETICIONES DE IR AL BAÑO O DE NOTIFICAR A LA PERSONA QUE TIENE CERCA (familiares o personal de enfermería) DENOMINADO S.I.R ( self-initiated request) LO QUE DETERMINARA UN COMPORTAMIENTO QUE INCLUYE PETICIONES VERBALES, O A TRAVÉS DE SEÑALES LUMINOSAS, O REALIZADO POR PROPIA
CUENTA DEL PACIENTE. ESTO DETERMINARÁ UN AUMENTO DE LA CONCIENTIZACIÓN EN EL PACIENTE DE LA NECESIDAD DE ORINAR, LO QUE LO MANTENDRÁ ALERTA, AUMENTANDO LA POSIBILIDAD DE QUE EL PACIENTE MEIOR PERCEPCIÓN DE LAS SENSACIONES DE LLENADO VESICAL CON SU CORRESPONDIENTE INCREMENTO EN EL NÚMERO DE S.I.R DIARIOS. ESTOS POR SUPUESTOS ESTARÍAN SUPEDITADOS AL NIVEL DE DESARROLLO COGNITIVO DE (L) LA PACIENTE, OBTENIÉNDOSE EL MAYOR NÚMERO DE S.I.R CUANDO SE TIENE UN TEST MINI-MENTAL MAYOR DE 10 o EL (LA) PACIENTE TIENEN MENOS DE 1 AÑO VIVIENDO EN CASAS-HOGARES PARA ANCIANOS.
EXISTE EN LA LITERATURA MUNDIAL EL TERMINO "social feedback" QUE FORMA PARTE DEL PROTOCOLO DE TRATAMIENTO Y TIENE DOS MODALIDADES: EL FEEDBACK SOCIAL POSITIVO Y EL FEEDBACK SOCIAL CORRECTIVO. EL POSITIVO CONSISTE EN ELOGIAR-ESTIMULAR A LA (EL) PACIENTE PARA LOGRAR EL ÉXITO EN EL COMPORTAMIENTO DE SU ESQUEMA MICCIONAL Y SE MANTENGA SECO (sin incontinencia), TENGA EL MAYOR NUMERO DE S.I.R, RESPONDA RÁPIDA Y POSITIVAMENTE AL ESQUEMA DE MICCIÓN FACILITADA Y PARA QUE HAYA UN REPORTE FIDEDIGNO DE SU CONDICIÓN DE CONTINENCIA URINARIA. SIN DEIAR DE LADO, EN CASO DE ESTAR PRESENTE, EL ESTÍMUTO AL PERSONAL QUE SE RESPONSABILIZA DEL CUIDADO DE LA PACIENTE. EL FEEDBACK SOCIAL CORRECTIVO DEBERÁ SER UTILIZADO LO MENOS POSIBLE Y CONSISTE EN CORREGIR LOS REPORTES ERRÓNEOS DE LA CONDICIÓN DE CONTINENCIA DEL PACIENTE; REPETIR LOS ESQUEMAS DE MICCIÓN FACILITADA DOS VECES; RECORDARLE AL PACIENTE MANTENER LA VEJIGA LLENÁNDOSE DE ORINA HASTA EL MOMENTO SIGUIENTE QUE LE TOQUE IR AL BAÑO; MANTENER CONTACTO CON EL PERSONAL DE APOYO ( en caso de necesitarse); ELIMINAR EPISODIOS DE INFECCION URINARIA
2. MICCIONES PROGRAMADAS HORARIAS O CRONOMETRADAS
Se establece un esquema estricto de micciones horarias, el cual debe seguirse a pesar de que al principio cuesta sacrificios tanto al paciente como a las personas que están cuidándolo (familiares, enfermeras, terapistas, entre otros).
El principal enemigo son los episodios de urgencia urinaria la cual se debe combatir con estrategias para controlar la urgencia, como veremos más adelante. Y con terapia farmacológica. Pero sobre todo con una gran fuerza de voluntad y superando todos los posibles efectos indeseables (incontinencia urinaria, angustia, frustración). Es muy útil en pacientes con vejiga hiperactiva "volumen dependiente".
RECOMENDARLE AL PACIENTE QUE ORINE POR RELOJ, CON UN HORARIO PREESTABLECIDO (POR SU MÉDICO AL ESTUDIAR SU DIARIO MICCIONAL) Y NO ESPERAR A ORINAR PORQUE TENGA GANAS DE ORINAR.
El diario vesical permitirá fijar una programación miccional que disminuya los fracasos, que van unidos a éstos esquemas urinarios y con esto a mantener el mayor entusiasmo posible para obtener los mejores resultados.
3. MICCIONES CON REENTRENAMIENTOS PROGRESIVO DE HÁBITOS URINARIOS
Se establece un esquema de micciones basado en el problema clínico que presente el paciente, posterior a estudio preciso del diario vesical.
Se comienza por un intervalo pequeño que el paciente llevará alargando progresivamente hasta llegar a un intervalo miccional ideal de 4 horas, alargando cada semana el intervalo miccional en 15 a
30 minutos.
Debemos utilizar en éste tipo de reeducación vesical, las estrategias para la urgencia y también algún tipo de terapia farmacológica y en pocos casos terapia psicológica.
Por ejemplo, comenzar por orinar cada 45 minutos a 60 minutos, durante la primera semana, posteriormente cada hora y media durante la segunda semana, cada 2 horas la tercera semana, cada 2 horas y media la cuarta semana, cada 3 horas la quinta semana, cada 3 horas y media la sexta semana y cada 4 horas la séptima semana. El tiempo de alargue semanal dependerá del éxito tenido con el tiempo precedente.
El paciente debe tener una gran dosis de paciencia y perseverancia.
El paciente debe acudir al baño sin tener, muchas veces, ningunas ganas de orinar.
Es de gran ayuda no solo para pacientes con distensibilidad vesical disminuida por etiologías diversas como obstructivas, seniles, medicamentosas, iatrogénicas, sino que se utiliza muy bien y con excelentes resultados en pacientes con incontinencia urinaria de esfuerzo.
El porcentaje de mejoría subjetiva es del 60% y la mejoría objetiva a través del estudio urodinámico es del 30 al 50%.
La reeducación vesical, la fisioterapia muscular del piso pélvico y el aprendizaje de como suprimir y superar la urgencia urinaria serán indispensables en el enfoque de una mujer con incontinencia urinaria de esfuerzo, así como de pacientes con hiperactividad vesical de etiologías diversas.
En nuestra experiencia personal los esquemas de reeducación vesical se optimizarán cuando los combinemos con terapias farmacológicas, fisioterapia muscular del piso pélvico, con o sin electroestimu-lación, con o sin biofeedback y por supuesto con estrategias conductuales para manejar la urgencia urinaria.
La gran desventaja de la reeducación vesical es que indudablemente dependerá de la insistencia del paciente ante tales recomendaciones, de su capacidad de soportar una mejoría lenta, y muchas veces con recaídas clínicas y que su eficacia dependerá también de las patologías asociadas que tenga el paciente, entre las cuales las mas perjudiciales son aquellas que afectan el área neurológica-muscular, el área de destrezas personales, el área locomotriz y el área psicológica-emodonal.
Es un procedimiento que en un bajo porcentaje cura al paciente, pero sin duda alguna logrará mejorías dínicas a veces importantes, sola o en unión de otros argumentos terapéuticos.
CAMBIOS CONDUCTUALES GENERALES
Cuando estudiamos el diario vesical, éste nos facilitará informadón de gran importanda ya que nos orientará hada las causas o circunstandas que rodean al paciente en los momentos de perdidas urinarias, o de frecuencia urinaria o de urgencia urinaria, y lo podremos reladonar con la ingesta de líquidos y con la hora del día donde se presente mas frecuentemente el episodio incontinente.
Es importante tener sobre todo "sentido común" ya que nos permitirá entonces sugerir los correctivos.
Por ejemplo tomar menos liquido bien sea en el día o en la noche para reducir el llenado vesical que provocará en muchos casos la perdida urinaria.
Reducir los cambios bruscos de presión intraab-dominal ocasionados por cambios de postura corporal al levantarse bruscamente de la cama o de un mueble, hacer aérobics, trotar, o levantar grandes pesos.
En ocasiones tocar agua, tocar metales, o superficies frías sobre todo en el hogar causará episodios de incontinencia de urgencia. Inclusive cuando el padente nos refiere que tiene insomnio y va mucho a orinar de noche con la posibilidad de que presente episodios de incontinencia, deberemos tratar de que duerma la mayor cantidad de horas posibles, ya que sabemos que hay una estrecha relación entre vigilia y frecuencia urinaria.
Todo lo expuesto hará que indiquemos los correctivos necesarios basados en una dosis importante de sentido común y así recomendar a nuestros parientes que al saber exadamente qué eventos desencadenan en ellos síntomas urinarios de la mas variada índole, sepan que hacer para disminuirlos o induso evitarlos.
CAMBIOS DE HÁBITOS ALIMENTARIOS
En general es importante recomendar una dieta exenta de irritantes urinarios como el café, té, bebidas gaseosas, bebidas chocolateadas, picantes, tomates, comidas fermentadas, mostaza, encurtidos, alimentación muy aliñada o sazonada, eliminar en lo posible lácteos y dtricos de la dieta para disminuir la posibilidad de alcalinizar la orina y con ello aumentar la posibilidad de baderiuria-infecdón urinaria y con ello poder tener episodios de urgenda-inconti-nenda, sobre todo en pobladones con minusvalía de sus defensas titulares vagino-uretrovesicales (menopausia, infecciones vaginales a repetición o hábitos higiénicos inadecuados). Disminuir la ingesta de sal.
Otra de las sugerendas importantes es la cantidad y hora de la ingesta liquida. Esta deberá limitarse en parientes con episodios de incontinencia urinaria a máximo 3 a 4 vasos al día, evitar ingerir líquidos después de las 6 de la tarde, ara que de éste modo no tengamos una frecuencia nodurna incrementada. Son muchos los pacientes que luego de éste simple enfoque, tomarán mayor conciencia de la relación tan importante que existe entre alimentación diaria y desencadenamiento de síntomas urinarios.
ESTRATEGIAS PARA SUPERAR LA URGENCIA URINARIA
Es importante saber cómo manejar los momentos de urgencia urinaria, ya que ésta podría presentarse en cualquier momento en pacientes que están bajo planes de reeducación vesical, o en pacientes que tienen de manera coinddente incontinencia urinaria más hiperactividad vesical.
Una de las características más llamativas en la mujer en un sentido general es su cualidad de presentar urgenda urinaria, por lo cual creo es importante enseñarle cómo frenarla, o indusive eliminarla.
Entendamos que un episodio de urgenda estará reladonado a una contracdón vesical y por ende a tener súbitamente ganas de orinar, urgenda e incon-tinenda urinaria de urgencia, por lo tanto todo lo que hagamos para eliminar dicha contracdón eliminará la sensadón de urgenda, frecuencia e inconti-nenda urinaria de esfuerzo.
Uno de los aliados que tenemos para inhibir una contracción vesical es el piso pélvico muscular, el cual cuando es contraído ocasionará en primer lugar, una inhibidón de las contracdones vesicales por lo cual saber utilizarlo es fundamental en nuestra estrategia.
En segundo lugar al contraer la musculatura del piso pélvico muscular (musculatura roja estriada voluntaria) estaremos también ocluyendo en muchas ocasiones la musculatura estriada periuretral y por lo tanto se estará oduyendo también la luz uretral con la consecuenda detención en la perdida urinaria. En tercer lugar la fisioterapia de contraer y relajar el piso pélvico muscular, refortalecerá los grupos musculares involucrados en la continenda urinaria pasiva y activa.
ACTITUDES PROHIBIDAS A LOS PACIENTES
1. CORRER INMEDIATAMENTE AL CUARTO DE BAÑO CUANDO SE TIENE LA SENSACIÓN URGENTE DE ORINAR.
2. CREER QUE AL LLEGAR LO MÁS RÁPIDO POSIBLE AL CUARTO DE BAÑO SE EVITARÁN LOS EPISODIOS DE INCONTINENCIA URINARIA.
3. ESTAR SIEMPRE PENDIENTE DE LA UBICACIÓN DE LOS BAÑOS PARA TOMAR LAS PREVISIONES DEL CASO (MAPEO DE BAÑOS), Y DE HECHO, MODIFICAR SU VIDA DIARIA TANTO EN LOS AMBIENTES FAMILIARES, DE TRABAJO, COMO DE ESPARCIMIENTO. LAMENTABLEMENTE ES UNO DE LOS ASPECTOS QUE ALTERA LA CALIDAD DE VIDA DE LAS PACIENTES CON URGENCIA URINARIA Y CON INCONTINENCIA URINARIA DE URGENCIA.
4. TOMAR LÍQUIDOS ABUNDANTES EN EL DÍA O LA NOCHE, LO QUE AUMENTARÁ LA FRECUENCIA URINARIA Y LA POSIBILIDAD DE PRESENTAR EPISODIOS DE URGENCIA O DE INCONTINENCIA URINARIA.
5. CONSUMIR LÍQUIDOS O ALIMENTOS IRRITANTES PARA EL SISTEMA URINARIO.
6. NO TENER "CONDUCTOALMENTE" LA MENOR INTENCIÓN DE "AGUANTAR" AUNQUE SEA UN POCO, LAS GANAS DE ORINAR, SINO QUE POR LO CONTRARIO, AL MENOR ASOMO DE SENSACIÓN URINARIA, PRECIPITARSE AL BAÑO A ORINAR.
7. PROMOVER SITUACIONES DE DIFERENTE NATURALEZA QUE "PROVOQUEN" SÍNTOMAS URINARIOS DE HIPERACTIVIDAD VESICAL, ES DECIR QUE PROVOQUEN URGENCIA URINARIA Y CON ELLO LA POSIBILIDAD DE PRESENTAR INCONTINENCIA COMO TENER CONTACTO CON AGUA, O CON SUPERFICIES FRÍAS O METÁLICAS, CAMINAR CON LOS PIES DESCALZOS, LAVAR LOS PLATOS, ESCUCHAR FUENTES O CAIDAS DE AGUA, MINIMIZAR ESFUERZOS FÍSICOS COMO LEVANTAR PESOS, AGACHARSE, SALTAR, ENTRE OTRAS.
8. ESTAR CONSTANTEMENTE NERVIOSO, TENSO YA QUE NO AYUDA PARA NADA A LA OBTENCIÓN DE RESULTADOS POSITIVOS Y ALENTADORES.
9. DORMIR MAL O DORMIR INSUFICIENTE.
Algunas de las conductas inadecuadas elevarán la presión abdominal que se reflejará sobre la vejiga incrementando presiones y por ende la sensación de urgencia se incrementará así como la sensadón de vejiga llena, lo que desencadenará una urgenda urinaria con contracdón vesical y con la consecuente incontinencia urinaria de urgenda.
Por otro lado los fadores que aumenten la sensibilidad propioceptiva u nociceptiva llevarán a baja capaddad funcional, a contracdón vesical no inhibida y esto podría llevar a hiperactividad vesical y a incontinencia urinaria.
ACTITUDES PERMITIDAS A LOS PACIENTES
A pesar de que las recomendadones que se describen a continuación se aplican preferentemente a parientes con urgencia urinaria, no debemos olvidar que muchas pacientes con incontinencia urinaria de esfuerzo tienen hiperadividad-urgencia y tienen incontinencia mixta, es dedr incontinencia de esfuerzo genuina con incontinenda de urgencia.
Las actitudes que el padente debe seguir son las siguientes:
1. AL PERCIBIR LA URGENCIA URINARIA, SI EL PACIENTE ESTÁ HACIENDO ALGUNA TAREA, DEBERÁ SUSPENDER DICHA LABOR Y PERMANECER TRANQUILO, RESPIRANDO PROFUNDAMENTE, RELAJANDO TODO SU CUERPO EXCEPTO LA MUSCULATURA DEL PISO PÉLVICO, LA CUAL TENDRÁ QUE CONTRAER
Y RELAJAR DE MANERA REPETIDA PARA ELIMINAR LA SENSACIÓN DE URGENCIA URINARIA. DEBERÁ TAMBIEN "TENER LA CAPACIDAD DE AISLARSE" DE LO QUE ESTÁ PASANDO EN RELACIÓN A LA URGENCIA Y DE SER POSIBLE DEBERÁ QUEDARSE PARADO O INCLUSIVE ACOSTARSE O RECOSTARSE, O SENTARSE, PERO SIEMPRE CONTRAYENDO Y RELAJANDO LA MUSCULATURA PERINEAL. TODO LO MENCIONADO CONDUCIRÁ A UNA INHIBICIÓN-ELIMINACIÓN DE LA HIPERAC-TIVIDAD VESICAL (CONTRACTILIDAD VESICAL EXACERBADA) LO QUE HARÁ DESAPARECER LA SENSACIÓN DE URGENCIA URINARIA Y CON ELLO EL MAL MOMENTO QUE VIVE EL PACIENTE EN CUANTO A SUS VIAS URINARIAS.
2. EL PACIENTE DEBERÁ ESFORZARSE EN SUPRIMIR LA SENSACIÓN DE URGENCIA URINARIA, Y UNA VEZ LOGRADO, ENCAMINARSE LENTAMENTE AL CUARTO DE BAÑO PARA ORINAR, PERO RECORDANDO SIEMPRE LOS EJERCICIOS DE CONTRACCIÓN-RELAJACIÓN DEL PISO PELVICO MUSCULAR.
3. EN CASO DE QUE LA URGENCIA URINARIA
SUBSISTA.....IR DESPACIO AL BAÑO AL TENER
DESEOS URGENTES DE ORINAR, O INCLUSIVE DESEOS NORMALES. LA SENSACIÓN DE URGENCIA TENDERÁ A PASAR, AUNQUE NO HAYA ORINADO.
4. TENER FORTALEZA ANIMICA PARA SUPERAR LOS FRACASOS INICIALES QUE SON FRECUENTES. EL APRENDIZAJE DE NUEVAS HABILIDADES URINARIAS TOMA TIEMPO Y MUCHO SACRIFICIO PERSONAL, E INCLUSIVE DEL ENTORNO FAMILIAR, SOCIAL Y DEL EQUIPO MÉDICO.
5. HABER APRENDIDO PREVIAMENTE LOS EJERCICIOS DE REFORTALECIMIENTO DEL PISO PELVICO MUSCULAR EN CONVERSACIONES CON SU UROLOGO O CON SU FBIOTERAPEUTA.
6. TRATAR DE ALCANZAR RAPIDAMENTE RESULTADOS POSITIVOS QUE ESTIMULEN Y ENTUSIASMEN AL PACIENTE.
7. REALIZAR TECNICAS DE DISTRACCIÓN (RESOLVER PASATIEMPOS, CRUCIGRAMAS, JUEGOS DE MESA, TEJER, O ESCUCHAR MUSICA) YA QUE DERIVAN LA MENTE HACIA OTRAS OCUPACIONES QUE NO PERMITEN PENSAR EN SU TRANSTORNO URINARIO.
8. RESULTARA ÚTIL EJERCER PRESIÓN PERINEAL.
9. MODIFICAR O DISMINUIR LA INGESTA LIQUIDA.
REFORTALECIMIENTO-REHABILITACION O FISIOTERAPIA DE LOS MUSCULOS DEL PISO PELVICO
TODOS LOS TIPOS DE INCONTINENCIA URINARIA SE BENEFICIARAN DE LA FISIOTERAPIA DEL PISO PELVICO, ASI COMO DE LAS TERAPIAS CONDUCTUALES Y DE LAS ESTRATEGIAS EN MOMENTOS DE URGENCIA URINARIA.
La intención fundamental en la modalidad de rehabilitación de piso pélvico muscular es tratar de que nuestra (0) s parientes tengan un componente muscular que de verdad nos ayude en alcanzar la continencia urinaria y en disminuir los síntomas molestos que usualmente la acompañan como la frecuencia urinaria y la urgencia.
Como veremos en el curso de la descripción de las modalidades iremos de la más fácil de implementar (fortalecimiento del piso pélvico con ejercicios caseros de apretar y relajar dicha musculatura involucrada en la continencia urinaria) sin la ayuda ni de aditamentos, ni de estimulación eléctrica ni tampoco de la asistencia del biofeedback con o sin la presencia de electroestimuladón, a la aplicación de éstas ultimas medidas que usualmente encarecen el tratamiento, complican un poco mas la realización de dicha rehabilitación, a pesar de que con cada una de éstas modalidades se obtendrán mejores resultados tanto clínicos como fisiológicos sobre dicha musculatura.
Todos hemos tenido como experiencia que en la medida que vayamos de menos a más en la fisioterapia muscular del piso pélvico tendremos mejores resultados, confirmado por innumerables trabajos de investigación, entre los cuales uno de los últimos fue publicado por Wang 2004. Menciona que en lo referente a mejoría subjetiva de cuadros de hiperactividad vesical la electroestimuladón es la mejor, secundada por los ejercidos de refortaledmiento muscular del piso pélvico asistidos por biofeedback y por último en resultados estaría la práctica de ejerdcios de rehabilitadón sin ningún tipo de asistenda.
La musculatura del piso pélvico, como el tejido conjuntivo podría debilitarse en determinadas cir-cunstandas como en presenda de exceso de peso (obesidad), en presencia de constipación fecal, cuando la padente realiza esfuerzos frecuentes, cuando presenta hábitos tabaquicos con tos excesiva, y pacientes con trabajos que requieran esfuerzo importante o estar mucho tiempo de pie con la posibilidad de presencia de prolapsos ginecológicos. En estos casos la Fisioterapia del piso pélvico muscular pro-dudrá cambios favorables en la presión uretral con presiones de cierre que favorezcan la continencia urinaria.
Según DeLancey (2003) un piso pélvico fuerte reducirá la movilidad del cuello vesical durante los esfuerzos súbitos y transitorios y con ello ayudará a la continenda urinaria. Por otro lado mujeres con prolapso genital generarán menos contracciones musculares que aquellas que no tienen prolapso genital y tendrán además de 2 a 5 veces más probabilidades de presentar perdida del tono muscular de la musculatura del piso pelviano. El mismo autor refiere que los ejerddos de rehabilitadón del piso pélvico podrían prevenir los prolapsos al contraer voluntariamente la musculatura antes de un evento que aumente las presiones intraabdominales e intravesicales.
Debemos sin embargo personalizar cada caso, ya que los tratamientos multimodales (reeducación vesical, estrategias y farmacoterapia en conjunto con la rehabilitadón muscular) nos dará el mejor de los resultados, muchas veces sin llegar a la utilizadón de aditamentos o tecnología eléctrica de asistencia a nuestras parientes.
Berghmans (2004) refiere que son muchos los factores que afedarán el éxito final de la Fisioterapia del piso pélvico muscular, entre los que encontramos: haber realizado un diagnostico correcto, la presencia o no de fadores pronósticos, de fadores de riesgo como la edad y la obesidad, el tipo de programa de fisioterapia escogido para un determinado padente, o si hemos "medido" o cuantificado objetiva o subjetivamente los resultados obtenidos a través de cuestionarios adecuados, el entrenamiento y experiencia que tenga el terapista físico, y por supuesto la cooperación y animo que pueda mostrar el paciente. Todos son factores que harán que tengamos mejores o peores resultados de una rehabilitación pélvica muscular.
Berghmans (2004) refiere que es importante establecer como punto inicial el o los objetivos de la Fisioterapia y posteriormente diagramar una estrategia correda a la medida de cada paciente, en lo concerniente a tipo de terapia, frecuencia semanal, sesiones en general a realizarse, tiempo de duración de cada sesión, expedativas de éxito para cada padente, y pronostico a largo plazo. En casos de incontinencia urinaria de esfuerzo, disfunción de piso pélvico y no conocimiento o conciencia de piso pélvico, el objetivo fundamental es restaurar la "conciencia" de piso pélvico muscular tocándose el mismo, con estimulación elédrica, con conos vaginales, y con ejercidos de fisioterapia. Los conos serán más importantes para darle a la paciente "conciencia de piso pélvico" que para verdaderamente fortalecer el mismo.
NO DEBERÁ SORPRENDER AL URÓLOGO, LOS RESULTADOS ENTUSIASMANTES DE LA REEDUCACIÓN VESICAL EN CONJUNTO CON LA REHABILITACIÓN DEL PISO PÉLVICO MUSCULAR, EN LOS MÁS VARIADOS CASOS DE PACIENTES CON INCONTINENCIA URINARIA O SIN ELLA, Y CON TRASTORNOS URINARIOS DE VACIAMIENTO Y DE LLENAMIENTO (GHONIEM 2005).
EN RELACIÓN A LA USIOURAPIA-RII lAÍ’.II ILACIÓN
DEL PISO PELVICO MUSCULAR, LOS DOS ELEMENTOS FUNDAMENTALES SON REFORTALECER DICHA MUSCULATURA Y DESARROLLAR HABILIDADES Y PERICIAS EN EL PACIENTE. EL REFORTALECIMIENTO SERA EL RESULTADO DE LA HIPERTROFIA MUSCULAR POR REPETICION DE LOS EJERCICIOS MEJORANDOSE
LA COMPRESIÓN URETRAL DURANTE LA ACTIVIDAD O ESFUERZO. SE VERAN LOS RESULTADOS LUEGO DE SEMANAS O MESES DE EJREICIO CONSTANTE. DISMINUIRA LA FRECUENCIA DE LOS EPISODIOS DE INCONTINENCIA
EN CAMBIO EL DESARROLLO DE HABILIDADES INVOLUCRA APRENDER A CONTRAER LA MUSCULATURA EN LAS DIFERENTES CIRCUNSTANCIAS QUE CAUSARÍAN UNA INCONTINENCIA URINARIA. Y LOS RESULTADOS SE VERAN INMEDIATAMENTE. DISMINUIRA LA CANTIDAD DE ORINA PÉRDIDA EN LOS EPISODIOS DE INCONTINENCIA URINARIA (GHONIEM 2005).
Parientes con embarazo y en periodo post-parto podrían presentar incontinencia urinaria de esfuerzo (12% a 52%), pero también lo podríamos observar en pacientes nulípara como lo refiere Bo (2004). Las cifras de prevalencia de incontinencia urinaria de urgencia en mujeres nulípara van del 16% al 19%. Excesivo estiramiento de los tejidos blandos durante el parto es un factor de riesgo para presentar incontinencia debido al daño en la musculatura del piso pélvico (daño por denervación), y a las estructuras neurológicas y del tejido conjuntivo.
MODALIDADES DE FISIOTERAPIA O REHABILITACION DEL PISO PELVICO MUSCULAR
1. Refortalecimiento del piso pélvico muscular (Ejercicios de Kegel) (1948,1956)
Kegel sin aditamentos.
Kegel con conos vaginales.
Kegel optimizado con electroestimulación del piso pélvico muscular.
Kegel optimizado con electroestimulación del piso pélvico muscular controlado por Biofeedback.
2. Refortalecimiento de la musculatura perineal, glútea, aductores vaginales y de la pared muscular antero-lateral abdominal (opcional).
En todo centro de continencia urinaria se tienen modelos de comportamiento para formalizar la conducta médica a seguir y en todos ellos las terapias conductuales, la fisioterapia del piso pélvico muscular (ejercicios de Kegel 1848,1956) y los tratamientos farmacológicos son la combinación ideal de la terapia inicial, dejando todas las otras alternativas (quirúrgicas, neuromoduladón, entre otras) en su segundo o tercer plano, ya que se persigue dar el mejor tratamiento que ocasione la menor morbilidad y con el mejoramiento de la calidad de vida del paciente afectado.
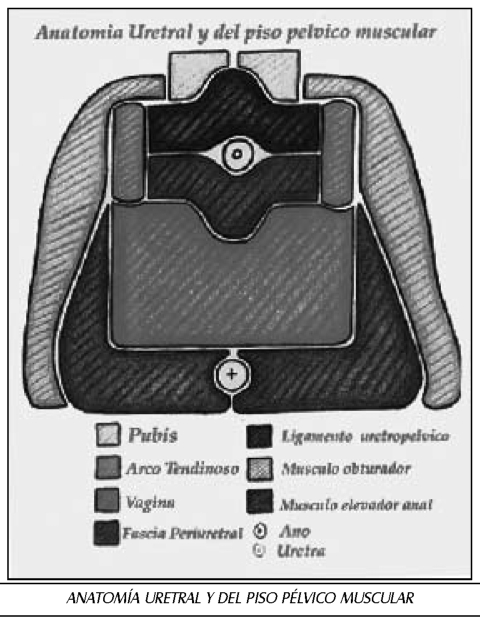
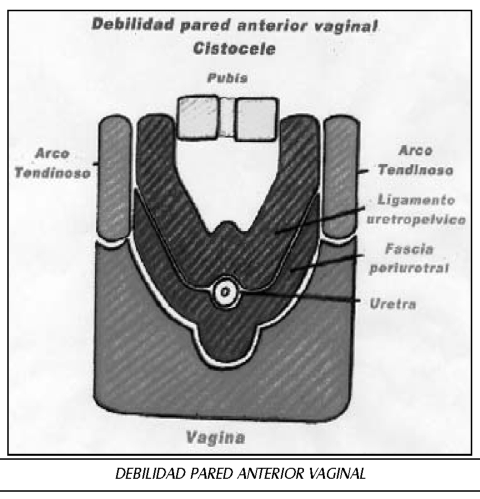
LOS OBJETIVOS QUE SE PERSIGUEN CON LA FISIOTERAPIA O REHABILITACIÓN DEL PISO PÉLVICO MUSCULAR SON IDENTIFICAR Y FORTALECER LOS GRUPOS MUSCULARES MAS DÉBILES DEL PISO PÉLVICO MUSCULAR, CONTROLAR LA URGENCIA MICCIONAL A TRAVÉS DE LA INHIBICIÓN REFLEJA DE LA CONTRACTILIDAD VESICAL, MEJORAR O CURAR LAS MANIFESTACIONES CLINICAS DE LA INCONTINENCIA URINARIA Y DE LA HIPERACTIVI-DAD VESICAL, Y MEJORAR O CURAR LA INCONTINENCIA URINARIA DE ESFUERZO.
Producirá curación de la incontinencia urinaria en un 15 a 20% de los casos, pero lo más importante es que producirá un 75% de mejoría sustancial de la incontinencia urinaria y de los scores de calidad de vida (Burgio 2003, Theofrastous, 2002). Además los ejercicios de Kegel producirán repercusiones favorables en la esfera intima de la mujer lográndose a través de ellos facilitar el clímax en la mujer que lo realiza, la paciente tendrá orgasmos mas intensos, incrementará la sensibilidad de la vagina optimizando la satisfacción sexual, la paciente sanará mas rápidamente en su musculatura vaginal posterior al alumbramiento, mejorará indirectamente la satisfacción intima de su pareja ya que sentirá más estrecho y placentero la sensación del pene dentro de la vagina de su compañera. Los ejercicios de KEgel mejorarán también la función intestinal-defecatoria.
La falta de tonicidad músculo-fasdal representa un factor importante en la aparidón de trastornos urinarios entre las que destaca la incontinencia urinaria sobre todo la variedad de esfuerzo, y un fador importante en la falta de control de la hiperactividad vesical a través de la reeducación vesical.
Es importante recordar que Abrams (2002) menciona que los malos resultados de las curas quirúrgicas en la incontinenda urinaria de esfuerzo se debe a una función uretral deficiente, a un descontrol del músculo detrusor en la fase de almacenamiento urinario, a una contradilidad vesical deficiente en la fase de vadamiento urinario y al hecho también de que se operan muchas mujeres con grados dínicos mínimos de incontinencia urinaria, con una repercusión muy leve en su calidad de vida.
Por otro lado hemos visto como los resultados de la cirugía de incontinencia urinaria de esfuerzo se mejorarán cuando se toman en cuenta muchos factores como el estado de trofismo de los tejidos musculares y ginecológicos, la mejoría de un estado de obesidad, el corregir malos hábitos miccionales, el corregir malos hábitos higiénicos del área perineo-ginecológica-urológica, el tener estrategias hacia la continenda, el tener estrategias hada la alimentadón adecuada, pero sobre todas las cosas al estado de funcionalidad del piso pélvico muscular, es dedr con músculos adivos y enérgicos y a la realizadón al momento de la cirugía de reforzamiento de las paredes vaginales anteriores y posteriores y a la justa colocadón de la zona del cuello vesical en una posición mas alta intraabdominal para que sea fácilmente involucrado en el conderto muscular global de la pared anterolateral abdominal, glúteos, abdudores vaginales, pubouretrales y pubococcigeos y del grupo de los elevadores anales, así como a los músculos de la pared anteroinferior del abdomen (Potenziani 1999).
Es en éstos casos donde las terapias conduduales y la fisioterapia del piso pélvico muscular adquieren gran importanda para el enfoque terapéutico de dichas pacientes. Aunado a lo anterior recordemos las cifras mundiales de éxito en las curas quirúrgicas de la incontinencia urinaria de esfuerzo donde sabemos que en la técnica de agujas se menciona un 20% de éxito a 10 años y con las anchas un 36% de éxito a 10 años, sin olvidar que la cirugía de incontinencia urinaria de esfuerzo en la mujer ocasionará efectos sobre la fundón sexual (disfunción sexual al eliminarse la inervadón sensorial, deficiencias de lubricación, 15 a 25% de dispareunia y deseo sexual hipoactivo). La fisioterapia del piso pélvico muscular produdrá un cambio en la fibra muscular de respuesta lenta, convirtiéndola a respuesta rápida (cambio de la fisiología muscular).
Para poder obtener un refortaledmiento muscular del piso pélvico adoptamos los ejercidos de Kegel ideados en 1948"restauradón funcional de los músculos perineales postparto y en el tratamiento de la incontinencia urinaria de esfuerzo en la mujer". Para su aplicadón y optimizadón tenemos un plan de ejercidos de Kegel, realizados sin la ayuda de ningún dispositivo o con la utilización de conos vaginales o de aparatos de eledroestimuladón con o sin la ayuda de biofeedback, la terapia interferendal, la fadlitadón pro-pioceptiva neuromuscular y la acupuntura.
Consiste en ordenarle al padente un plan de fisioterapia que realizará 2 a 3 veces por día consistente en contraer la musculatura vaginal, en dos modalidades, una de contracciones rápidas y otra de contracciones lentas. Las primeras contraen y relajan la musculatura pubococcigea y pubouretral tan rápido como pueda hacerlo y las segundas contraerán dicha musculatura al principio por 3 segundos hasta llevarlo a 10 segundos de contracción sostenida, seguidas ambas por relajación de dichos grupos musculares, antes de la siguiente contracción.
Dichas contracciones deberán certificarse con la introducción de un dedo dentro de la vagina para constatar que se está contrayendo el grupo muscular adecuado lo cual sentirán como una presión alrededor del dedo, también recomendamos hacerlo durante su relación intima, como parte de su entrenamiento.
Deberemos ordenar contraer por 5 segundos y relajar por 5 segundos al principio hasta llegar al objetivo de 20 segundos de contracción y 10 segundos de relajación de la musculatura del piso pélvico, 3 o 4 veces por día.
Si al cabo de 30 días aprox. no tenemos una mejoría de por lo menos un 50% debemos hacer una nueva sesión de Biofeedback sin se ha hecho con anterioridad o hacerla por primera vez para enseñar al paciente de manera segura cuales son los músculos a contraer y cuales los músculos que no debemos contraer, en su preparación para enfrentar episodios de urgencia urinaria.
SE DEBERÁ ACLARAR A LA PACIENTE QUE SE DEBERÁN CONTRAER Y RELAJAR LOS MÚSCULOS DEL PISO PÉLVICO, MIENTRAS SE MANTIENEN RELAJADOS LOS MÚSCULOS DE LA PARED ABDOMINAL ANTEROLATERAL.
Se le recomienda a las pacientes 3 a 4 series diarias de 10 minutos de duración cada una de ellas, realizadas en todas las posiciones posibles (acostada, de pié, sentada, mientras trabaja, mientras come, mientras realiza su actividad intima, en fin en cualquier circunstancia del día a día.
Esto deberá realizarse por espacio de 16 a 20 semanas, y luego mantenerse haciéndolo ya no de manera tan continua pero si por lo menos tres veces por semana
Aparte de garantizar un refortalecimiento muscular del piso pélvico, obtendrán también un control más efectivo de sus posibles episodios de contracciones involuntarias del detrusor (hiperactividad vesical) y también obtendrán una mayor satisfacción en sus relaciones intimas, lo cual en conjunto llevará a una mejoría de su calidad de vida en todos sus aspectos.
RECORDEMOS QUE LA CONTRACCIÓN MUSCULAR DEL PISO PÉLVICO ES UNA FUNCIÓN ADQUIRIDA Y NO INNATA (WALLACE 1994) POR LO CUAL SERÍA IMPORTANTE PREVENIR LA DISFUNCIÓN DEL PISO PÉLVICO PROMOVIENDO DESDE LA INFANCIA EL REENTRENAMIENTO VESICAL, CUIDANDO QUE NO HAYA ACTITUDES DE PERTURBACIÓN DE LA FUNCIÓN DE ALMACENAMIENTO Y VACIAMIENTO VESICAL.
En las mujeres que practican deportes sería muy útil instruirlas a como realizar fisioterapia del piso pélvico muscular; en los niveles de educación media es importante impartir educación sexual y educación médica en general para advertir sobre tales problemas y llamar la atención del estudiantado en caso de presentar alguno de los síndromes expuestos.
En gimnasios es útil dictar charlas y entrenamiento del piso pélvico muscular, ya que es un modo excelente de llegar a un buen número de pacientes potenciales o inmediatas. Los problemas urinarios de la mujer, así como los problemas del piso pélvico usualmente son de difícil denuncia, ya que se desconoce primeramente a quien se le debe decir y posteriormente se duda de que la resolución y tratamiento sean de fádl obtención.
EJERCICIOS DE KEGEL CON CONOS VAGINALES
Son aditamentos que se utilizan para optimizar la fisioterapia muscular (Kegel 1948,1956) ya que muchas veces los pacientes realizan de manera incorrecta dichos ejercicios contrayendo el grupo muscular equivocado aun peor, no logrando ningún tipo de contracción.
El cono vaginal hará que la paciente tenga una información propioceptiva intensa que ayudará a que la contracción de la musculatura pubococcigea sea lo mas efectiva posible.
Viene en un set de 5 conos de plástico de fádl obtendón y de bajo costo, con peso variable de 20 a 70 gramos, que deberá la padente introdudrse en su vagina comenzando por el más liviano llegando progresivamente al más pesado.
Cada cono deberá introducirse por una semana seguida y la paciente deberá tratar de sostenerlo dentro de su vagina sin que se deslice al exterior logrado al contraer eficazmente el grupo muscular adecuado. Se puede realizar también por 16 a 20 semanas, dos a tres veces por día. El 75% de los pacientes con incontinencia urinaria de esfuerzo mejoran evitando la cirugía o mejorando los resultados de la misma. El objetivo final es fortalecer (hipertrofia muscular) los grupos musculares pubouretrales, pubococcigeos, lograr un tono muscular de reposo normal y mejorar clínicamente a la paciente con una mejoría en su calidad de vida.
LOS CONOS VAGINALES ASI COMO EL BIO-FEEDABCK ESTARÁN INDICADOS EN MUJERES QUE SON CAPACES DE GENERAR ALGÚN TIPO DE CONTRACCIÓN DEL PISO PÉLVICO MUSCULAR.
LA ELECTROESTIMULACIÓN DEL PISO PÉLVICO MUSCULAR ESTARA INDICADA EN MUJERES QUE SON INCAPACES DE GENERAR UNA CONTRACCIÓN DEL PISO PÉLVICO MUSCULAR
Ejercicios de Kegel optimizados por electroestimulación del piso pélvico muscular con aditamentos vagino-rectales
La electroestimulación del piso pelvicomuscular es ampliamente usada en el mundo entero en los principales centros de continencia urinaria. Su acción la produce al activar los nervios pudendos aferentes, lo cual ocasionará la activación de los nervios pudendos e hipogástricos eferentes causando contractilidad de la musculatura lisa e estriada periuretral y de la musculatura estriada del piso pélvico muscular (Ericsson 1987), mejorando las presiones de cierre u oclusión cervicouretral.

Según Berghmans (2004) es usada en pacientes con incontinencia urinaria de esfuerzo para restaurar la actividad refleja en la excitación de lo nervios pudendos para crear una contracción muscular artificial y mejorar entonces la función del piso pélvico. Tiene tasas de éxito del 37% al 92%.
Se utiliza desde hace más de 50 años en el mundo de la urología. El pionero fue Griffiths que en el año 1895 publicó sus descubrimientos acerca de la estimulación del nervio pudendo, produciendo inhibición contráctil del músculo detrusor.
La primera utilización clínica de la electroestimulación del piso pélvico muscular para el tratamiento de trastornos urológicos la hizo Huffman el año de 1952, sin transductores vaginales, para incontinencia urinaria de esfuerzo intratable, posteriormente vendría Caldwell (1963) quien publicó el control de la incompetencia esfinteriana a través del estimulo eléctrico que posteriormente se denominaría Incontinencia urinaria tipo III por disfundón intrínseca del aparato esfienteriano. En 1967 vuelve a la prádica clínica la utilidad de éste procedimiento pero con transductores vaginales y rectales, para ser utilizados tanto en hombres como en mujeres.
Se utiliza preferentemente en incontinencia urinaria de esfuerzo, en los síndromes de urgencia-fre-cuenda tanto en el hombre como en la mujer, en la incontinencia urinaria de urgencia, y en los síndromes dolorosos vesicales. Es útil en la reeducación neuromuscular, en la contraction de grupos musculares determinados, en la contraction refleja de los músculos parauretrales y periuretrales, en la contracción del grupo muscular elevador anal, en mejorar la contractilidad del rabdoesfinter y del esfínter anal y en la inhibición refleja del músculo detrusor en casos de hiperactividad vesical, lográndose dominar las contracciones involuntarias (no inhibidas) del detrusor, por supuesto se deberá contar en todos los casos con un arco reflejo sano.
Se utilizan dos tipos de estimulación eléctrica, una la estimulación eléctrica crónica, administrada por debajo del umbral de sensibilidad, la otra es la electroestimulación funcional máxima aguda la cual se caracteriza por tener un estimulo de la mayor intensidad posible (la máxima intensidad eléctrica tolerada por el paciente sin demostrar dolor), usada de manera intermitente y usualmente dos a tres veces por día con duración de 15 a 20 minutos en cada
sesión por espado de 4 a 6 meses. En hiperactividad vesical se utilizan frecuencias bajas de 10 Hz o menos. En pacientes con incontinencia urinaria de esfuerzo se utilizan frecuencias altas (50 Hz o más).
Existirá una padente que pueda tener incontinencia mixta con los dos componentes tanto de esfuerzo como de urgenda con hiperadividad por lo cual habría que seguir un esquema mixto de electroestimuladón.
Durante años se ha estado utilizando el equipo EMPI (Innosense®) con eledrodos vaginales y rectales con el siguiente protocolo: en parientes con incontinencia urinaria de esfuerzo, 50 Hz dos a tres veces diarias de 15 minutos cada sesión; en pacientes con hiperactividad vesical 12.5 Hz dos a tres veces diarias de 15 minutos cada sesión y en pacientes con incontinencia mixta con componentes de esfuerzo y de urgencia se dan 50 Hz dos veces por día y 12, .5 Hz al mediodía. Todo por un tiempo no menor de 6 meses. Aclarando que deberían hacerse de por vida pero ya con una frecuenda inferior (2 veces por semana), unido a los ejercidos de Kegel sin aditamentos y a la pradica de terapias conductuales previamente mencionadas para mantener los objetivos logrados.
El mecanismo de acdón de la eledroestimulación del piso pélvico muscular es a través de la estimulación aferente del nervio pudendo, lo cual originará una adivación de la innervación eferente hipogástri-ca e inhibición de la actividad de los nervios pélvicos eferentes incrementándose la capaddad vesical y por ende la distensibilidad de la misma y disminuyendo la incidencia de contracciones no inhibidas del músculo detrusor entre un 40 a un 90%. La vejiga responderá de dos maneras a la electroestimuladón. Al prindpio contrayéndose para relajarse prolongadamente, por fatiga gradual de la respuesta contráctil del músculo liso vesical unido a la inhibición del reflejo pélvico-hipogástrico y en segundo lugar Appel en 1998 revela que fisiológicamente la contracción del rabdoesfinter suprimirá la actividad del músculo detrusor, lo que favorecerá la distensibilidad y por ende la capacidad funcional del mismo.
En el caso que nos compete de las mujeres con incontinencia urinaria de esfuerzo y su relación con los partos, tendrán en muchos casos daño neurológico al nervio pudendo y al plexo pélvico con prolapsos vaginales y la aparición de incontinencia urinaria, ya que dichas lesiones producirán una conducción neurológica deteriorada.
LA ELECTROESTIMULACIÓN PRODUCIRÁ UN INCREMENTO DEL VOLUMEN O MASA MUSCULAR DEL GRUPO EJERCITADO, ADEMÁS PRODUCIRÁ UN AUMENTO EN LA PROPORCIÓN DE FIBRAS MUSCULARES DE RESPUESTA RÁPIDA, DTNAMTZANDO ESTA MUSCULATURA PARA LOS CAMBIOS SÚBILOS DE PRESIÓN INLRAABDOMINAL-PRESIÓN INTRAVESI-CAL. AUMENLA LAMBIÉN EL NÚMERO Y FORTALEZA DE LAS FIBRAS MUSCULARES DE RESPUESTA LENTA, ASEGURANDO UNA PRESIÓN DE CIERRE URETRAL PASIVA (EN REPOSO) ADECUADA Y EN MUCHAS OCASIONES LAS TRANSFORMA EN FIBRAS DE RESPUESTA RÁPIDA. ADEMÁS PRODUCIRÁ UN RECLUTAMIENTO DE FIBRAS DEL GRUPO MUSCULAR DE LOS ELEVADORES DEL ANO ANTE CIRCUNSTANCIAS NATURALES QUE OCASIONARÁN LA CONTRACCION DE DICHA MUSCULATURA.
Los efectos colaterales de la estimulación elédrica del piso pélvico podrían ser daño a los tejidos, sobreestimulación de los músculos del piso pélvico ocasionando "sobreentrenamiento y agotamiento de la fibra muscular", irritación vaginal e infecdón del sistema urinario inferior (cistitis).
INDICACIONES ELECTROESTIMULACIÓN PISO PÉLVICO MUSCULAR
1. En déficit motor
2. Para inhibir la hiperadividad vesical preferentemente de causa no neurológica
3. Para incrementar el tono esfinteriano (rabdoesfinter) y/o fortalecer el grupo muscular de los elevadores del ano y del esfínter anal.
4. Para fortalecer los grupos musculares pubouretrales y pubococdgeos
5. Para aumentar el volumen o masa muscular del piso pélvico.
6. Para transformar fibras musculares de respuesta lenta a respuesta rápida.
7. Para mejorar los resultados de los tratamientos quirúrgicos y no quirúrgicos.
CONTRAINDICACIONES ELECTROESTIMULACIÓN PISO PÉLVICO MUSCULAR
1. Alteraciones de la sensibilidad abdomino-vaginoperineal (S2-S4) y ausenda del reflejo sacro.
2. Trastorno severo del ritmo cardiaco y /o utilizando marcapasos.
3. Lesiones anorectales o sangramiento anorectal (transd. anorrectales).
4. Embarazadas o buscando embarazo.
5. Lesiones o infecciones vaginales o sangrado vaginal en fase de diagnostico y/o tratamiento (transductores vaginales).
6. Problemas graves de aprendizaje.
7. Infecdón urinaria significativa (más de 102 UFCxcc).
8. Antecedentes de retención aguda de orina y con residuos urinarios postmicdonales de más de 100 mi.
9. Anatomía vaginal que impida la retención del transdudor.
10. No quiera utilizar transductores redales.
SITUACIONES DIFÍCILES EN LA ELECTROESTIMULACION DEL PISO PELVICO MUSCULAR
1. Desconocimiento del método por parte de paciente y de médicos.
2. Molestia física y mental en su utilizadón y colocadón.
3. Dificultad en su aprendizaje.
4. Irritadón de las mucosas vaginales y rectales sobre todo en pacientes postmenopausicas.
5. Dificultad anatómica vaginal y redal, para la inserción de transductores intravaginal o intraredales.
6. Prejuicios morales, religiosos o personales para su utilizadón.
7. Prohibición de su uso por parte del esposo de la pareja.
EJERCICIOS DE KEGEL OPTIMIZADOS CON ELECTROESTIMULACIÓN DEL PISO PÉLVICO MUSCULAR CON ADITAMENTOS VAGINO-RECTALES ASISTIDO POR BIOFEEDBACK
Se denomina biofeedback o retroalimentación al reacoplamiento de los procesos vitales; es la toma de condencia o también el control conciente de las funciones corporales con la ayuda de aparatos micro-electrónicos, es dedr procesos psíquicos y físicos reconoddos y hechos conciente que pueden ser controlados y modificados.
Kegel fue el primero que utilizó en 1948 el primer perineometro vaginal para realizar biofeedback en pacientes aquejadas de incontinenda urinaria de esfuerzo posterior a los partos y de hecho logró un 90% de mejoría clínica en la reducción de los episodios de incontinencia urinaria de esfuerzo.
Facilitará a través de entrenamiento conductual, la adquisición de control sobre las respuestas fisiológicas, las cuales pasan muchas veces desapercibidas para nosotros, ayudando a contraer y relajar determinados grupos musculares y que dicho efedo (adividad muscular) pueda ser cuantificado (visual y auditivamente).
Burgio (1986) demostró que las mujeres con incontinenda urinaria de esfuerzo tratadas solamente con ejerdcios de refortalecimiento muscular del piso pélvico tenían un 55% de cura en comparación con el 91% cuando se utilizaba biofeedback al igual que Kunkle (1993) en Filadelfia. La terapia con biofeedback ayudará a identificar tanto la adividad muscular pélvica como la actividad muscular abdominal fadlitando un conocimiento inmediato de la eficada de las contracdones musculares que se están realizando. Cuando se aplica electroestimu-lación del piso pélvico podemos utilizar el biofeedback como un test que mida y cuantifique la efedivi-dad de aquel (Kunkle-Payne 1993).
Cuando la fisioterapia del piso pélvico muscular se hace asistida por Biofeedback logrará, al igual que el feedback verbal, una serie de logros que serán trascendentales en la evolución del paciente. El primero más fádl y rápidamente que el segundo que necesita mayor dedicadón y explicación del urólogo o terapeuta urinario.
Lo que logra la asistencia del Biofeedback es enseñarle al paciente como poder controlar las normales respuestas (fisiológicas) de la musculatura del piso pélvico y del detrusor, que intervienen en darle al paciente la capacidad de continencia urinaria, ante una serie de "disparadores" de su contractilidad vesical, que enfrentamos diariamente muchas veces al día. En JAMA 1998 Burgio mencionaba que al utilizar el Biofeedback la tasa de mejoría en pacientes con incontinencia urinaria de urgencia es de un 76% a un 86% y resulta tan efectiva como la terapia farmacológica.
SEGÚN NUESTRA EXPERIENCIA NINGUNA MODALIDAD NO QUIRURGICA QUE ADOPTEMOS EN ÉSTAS PACIENTES DEBE IR SOLA, SIEMPRE DEBEMOS ENTENDER UNA TERAPIA MULTIMODAL MODIFICANDO LO QUE SEA DETERMINANTE PARA PERPETUAR EL CÍRCULO VICIOSO DEL EVENTO INCONTINENTE URINARIO.
Se utiliza en pacientes con contracciones débiles del piso pélvico muscular. A propósito de esto Strasser (1999,2000) demostró que las mujeres seniles con contracciones débiles del piso pélvico muscular y con incontinencia urinaria, tienen un componente relacionado al rabdoesfinter, tienen una disminución progresiva y lineal en la densidad de las fibras musculares estriadas de dicho rabdoesfinter por un aumento de la apoptosis o muerte celular programada. La ventaja del biofeedback es que las respuestas son individuales, precisas, fidedignas e inmediatas. Las desventajas es que conlleva equipos costosos, personal entrenado, no es un método de aplicación universal, a pesar de que se han diseñado equipos ambulatorios con costos más asequibles, tanto para médicos como para pacientes.
LA ASISTENCIA DE LA FISIOTERAPIA DEL PISO PÉLVICO MUSCULAR CON BIOFEEDBACK COMO OBJETIVO PRIMORDIAL EN PACIENTES CON INCONTINENCIA URINARIA DEL TIPO QUE FUERE TENDRÁ BÁSICAMENTE DOS OBJETIVOS MUY PRECISOS COMO SON EDUCAR AL PACIENTE EN COMO IDENTIFICAR LA MUSCULATURA DEL PISO PÉLVICO Y DE LA URETRA QUE NOS AYUDE EN PREVENIR UNA SALIDA INVOLUNTARIA DE ORINA, QUE NOS AYUDE EN INHIBIR EN LA MEJOR MANERA POSIBLE LAS CON-TRACTURAS DEL MÚSCULO DETRUSOR VESICAL "UN POCO FUERA DE CONTROL" Y SI ESTO FALLARA, NOS AYUDARA EN AUMENTAR LA RESISTENCIA DE SALIDA VESICOURETRAL AL MEJORAR LA CONTRACTILIDAD MUSCULAR DE LA URETRA PROXIMAL Y MEDIA EN SU LUCHA PARA IMPEDIR LA INCONTINENCIA URINARIA.
REFORTALECIMIENTO DE LA MUSCULATURA PERINEAL, GLÚTEA, ADUCTORES VAGINALES Y DE LA PARED MUSCULAR ANTERO-LATER AL ABDOMINAL
Los problemas de debilidad de la musculatura anterolateral abdominal, del grupo de los glúteos y aductores vaginales tienen una gran importancia por cuanto reflejan de alguna manera el estado global de la musculatura de la paciente de la cual la del piso pélvico es sólo uno de los grupos musculares afectados. Por lo cual se aconseja que todos estos grupos musculares sean enfocados para su rehabilitación y refortalecimiento.
DEFINICIONES ÚTILES PARA LA PRESENTE GUÍA
Incontinencia urinaria (Diokno 1986)
Es una condición prevalente y costosa que afecta 38% de mujeres de 60 años o más, predisponiendo a la paciente a otras enfermedades (psíquicas y orgánicas) como depresión, ansiedad, alejamiento de toda actividad productiva con afectación de su vida social-profesional, problemas del sistema esquelético (caídas, fracturas, invalidez), deterioro de su esfera sexual (disfundón sexual femenina), que afectarán la autoestima y la aislarán socialmente (Herzog), volviéndola a su vez paradójicamente más dependiente de los demás, ya que su problema ameritará, en un alto porcentaje de los casos, la ayuda de familiares, amigos, enfermeros o fisiatras sobre todo si la padente tiene défidt motores o mentales que así lo condicionen llevando muchas veces a la reclusión en casas o andanatos, con todas las secuelas que esto ocasiona no sólo al padente sino a su entorno familiar.
Incontinencia urinaria (ICS-1976)
Condición en la cual, las pérdidas involuntarias de orina representan un problema social e higiénico y son objetivamente demostrables. Cualquier pérdida incontrolada de orina en los 12 meses previos, sin tomar en cuenta su severidad (Diokno).
Incontinencia urinaria de urgencia motora
Es la condidón urológica en la que se presenta pérdida involuntaria de orina, debida a contracciones vesicales involuntarias, como parte de un síndrome de hiperactividad vesical, asodadas a una sensadón de urgenda y produddas usualmente por numerosas afecdones entre las que destacan las afecciones que obstruyen el trayecto de salida vesical, como por ejemplo, el crecimiento prostático benigno u otros estados obstrudivos, así como estados de vejiga de senedud, debido a hipertrofia y alteradones mioestrudurales de la musculatura vesical.
Incontinencia urinaria de urgencia
Se define como la pérdida involuntaria de orina, asodada con estados de hipersensibilidad de las terminaciones propioceptivas y nociceptivas de la pared muscular vesical, por motivos variados (inflamación de diversas etiologías, infecciones urinarias, antecedentes quirúrgicos, antecedentes de tratamientos quimioterápicos, antecedentes de radioterapia, cálculos, cistitis intersticial, tumores, entre otros).
Incontinencia urinaria refleja
Es la pérdida involuntaria de orina que se produce o bien por hiperreflexia del músculo detrusor vesical -lo que implica una lesión neurológica-, o bien por pérdida del "tono" uretral, que ayuda a la falta de continencia urinaria. Se presenta en etapas posteriores a un daño de la médula espinal, bien sea por traumatismos, o por determinadas enfermedades. Se deberá añadir a todo esto, la falta total de sensibilidad, bien sea propioceptiva o nociceptiva.
Incontinencia urinaria por rebosamiento
Es la pérdida de orina asodada con vaciamiento vesical incompleto o deficiente, debido a una contractilidad disminuida del músculo detrusor o a obstrucción de la salida vesical, ocasionando altos residuos urinarios con la posibilidad de perder orina por rebosamiento.
Incontinencia urinaria de esfuerzo (ICS 2002)
Es la pérdida involuntaria de orina, cuando la presión intravesical excede y supera la presión máxima de derre uretral, pero en ausenda de actividad contrádil del detrusor, determinada a un aumento de la presión intraabdominal produdo de un esfuerzo, tos, risa o actividades varias como la practica de aerobics, ejercidos al aire libre y en contados casos con la relación íntima.
Incontinencia urinaria de esfuerzo urodinamica (ICS 2002)
Perdida involuntaria de orina durante un aumento de la presión abdominal en ausenda de contracción del detrusor.
Incontinencia urinaria Funcional
Condición de etiología multifadorial, con perdidas involuntarias de orina con un fundonalismo urinario normal, que resulta de la incapacidad de un padente senil de utilizar a tiempo la sala de baño, debido a incapacidad física o mental-emocional, por la acción de fármacos que adúan negativamente sobre su capaddad de "continenda" o por barreras psicológica o barreras del medio ambiente, siendo su enfoque terapéutico con fisioterapia del piso pélvico muscular, diuresis horaria, aditamentos de asistencia para el momento de la micdón (en el baño) y/o aditamentos que hagan posible que puedan ser aplicados al momento de la micdón sin que se produzca una incontinencia urinaria.
Condición que asoda frecuentemente la incontinenda urinaria de urgencia con estados de hiperactividad vesical y la incontinencia urinaria de esfuerzo, con todo su cortejo asintomático y signologico, siendo la forma más prevalente de incontinencia en la mujer senil. Perdidas involuntarias de orina debida a mas de un patrón micdonal, como por ejemplo la unión de incontinenda de urgencia, incontinencia de esfuerzo, con incontinenda de rebosamiento con incontinencia fundonal, siendo importante definir cuanto de cada tipo existe en el padente en estudio ya que definirá el tipo de terapia a seguir. En la ancianidad tanto en hombre como mujeres es el tipo más común de incontinencia.
"Es la combinadón de sentirse bien desde el punto de vista físico, mental y sodal, no meramente en la ausenda de enfermedad"
Se entiende por ancianos, el hombre o la mujer que tiene muchos años; Dijese de la persona que sobrepasa los sesenta o sesenta y cinco años de edad (Gran Endclopedia Larousse 1980). Vejez según el
Diccionario de Psicología ediciones Orbis 1985 se define como: Edad senil, senectud "Es el ultimo periodo de la vida que en el hombre se considera iniciado a los sesenta años. En el Diccionario Terminologico de Ciencias Médicas Salvat Editores 11a ed.1974 se define como edad senil, senectud, periodo de la vida humana cuyo comienzo se fija comúnmente a los sesenta años caracterizado por la declinación de todas las facultades.
"Función normal" del músculo detrusor
Es cuando durante la fase de llenamiento vesical, el contenido de la vejiga aumenta en volumen, sin tener un aumento significativo en la presión del detrusor, lo cual es llamado acomodación, cuando no se producen contracciones involuntarias del detrusor, inclusive al ser provocadas y cuando en la fase de vaciamiento normal, ésta se alcanza por una contracción mantenida y voluntaria del músculo detrusor, la cual podrá ser suprimida de manera voluntaria. Esta función "normal" del músculo detrusor se denomina "función estable".
"Función hiperactiva" del músculo detrusor
Hablamos de función hiperactiva del músculo detrusor, cuando durante la fase de llenamiento, hay contracciones involuntarias del músculo detrusor, las cuales pueden ser espontáneas o provocadas, y no pueden ser suprimidas por el paciente. Dentro de los eventos que podemos realizar para la provocación de contracciones vesicales están, el llenamiento vesical rápido, las alteraciones de la postura del paciente, toser, caminar, saltar o marchar durante la prueba.
"Vejiga de bajo compliance o de poca distensibilidad"
Es la relación existente entre volumen urinario y presión generada por dicho volumen, en una vejiga con una elevación sustancial de la presión. Es dedr es una vejiga que con bajos volúmenes de orina en su interior, generará altas presiones intravesicales, con la consecuente sintomatología de urgencia, frecuencia, nocturna e incontinenda de urgencia. La palabra compliance, podría ser tradudda como "adaptadón a la distensibilidad", en este caso, de las paredes vesicales.
Es un término que involucra solamente la fase de almacenamiento vesical, y nunca la fase de expulsión urinaria o fase micdonal, y es diagnosticada específicamente a través de la dstometría del estudio uro-dinámico, y se sospecha por la presenda de sintomatología dínica característica. Se caraderiza por presentar contracciones involuntarias del músculo detrusor, las cuales pueden ser espontáneas o provocadas, estas últimas, por acciones como toser, pujar, saltar, caminar, llenamiento rápido de la vejiga, durante el estudio cistométrico (estudio urodinámi-co), o drcunstancias ambientales y todo esto con el padente intentando suprimir dichas contracciones involuntarias. Se denomina inestable, cuando la etiología no es neurogénica y se denomina hiperrefléxi-ca cuando la etiología es sin duda alguna neurogénica, la cual estará originada por enfermedades, o por lesiones traumáticas, a nivel espinal o supraespinal
Vejiga Hiperactiva (Wein 1998)
Síndrome basado en la sintomatología, caracterizado por urgenda con o sin incontinencia de urgencia, donde usualmente podrían estar presentes fre-cuenda urinaria y nocturna, sabiendo que los síntomas sugestivos de hiperactividad del detrusor podrían también ser causados por otras disfunciones urinarias o micdonales y sin que el paciente presente ningún otro signo de patología o infecdón". Puede ser sintomática o asintomático.
Vejiga Hiperactiva (Ouslander 2004)
Es un síntoma complejo que incluye urgenda urinaria con o sin incontinencia urinaria, frecuenda urinaria (8 o más micciones al día), y nodurna (despertarse dos o más veces por noche para orinar).
Vejiga Hiperactiva Seca (Noble 2002)
Condición sintomática de hiperadividad vesical sin la presencia de incontinenda urinaria de urgencia. Usual en los hombres
Vejiga Hiperactiva Húmeda (Noble 2002)
Condición sintomática de hiperadividad vesical con la presencia de incontinenda urinaria de urgencia. Usual en las mujeres.
Patrones Urodinamicos de Hiperactividad del detrusor (ICS 2002)
Son de dos tipos. Una hiperadividad fasica del detrusor con ondas características que pueden o no llevar a incontinencia urinaria. El otro tipo es la Hiperactividad del detrusor terminal definida como una contracción involuntaria única ocurriendo en la capacidad dstométrica que no se puede reprimir y que causa incontinencia urinaria que a menudo resulta en un vaciamiento completo de la vejiga urinaria a través o no de un acto micdonal. Esta última se ve con frecuenda en parientes ancianos que han o no tenido un accidente cerebro-vascular.
Es la condición urológica en la que se presentan contracciones vesicales involuntarias, por hiperactividad del detrusor (vejiga hiperadiva), producidas por una serie de factores neurogénicos, no neu-rogénicos y miogénicos que condicionan la percepción de que se producirá una pérdida urinaria involuntaria si la micción no se realiza con celeridad.
Es la condición urológica donde se presenta un estado imperioso de orinar producto de un estado de hipersensibilidad vesical, uretral o vesicouretral, originándose urgencia urinaria que se produce anormalmente a bajos volúmenes de llenamiento vesical con dolor o molestias que mejoran al vaciar la vejiga o que desencadenan un deseo constante de orinar que en muchas ocasiones no se mejora con el vaciamiento vesical (Stephenson-Mundy); todo esto sin mostrar en ocasiones evidencias cistométricas objetivas de hiperactividad vesical. Es debida a un estado de hipersensibilidad de las terminaciones propiocep-tivas y nociceptivas de la pared muscular vesical, por motivos variados (inflamación de diversas etiologías, infecciones urinarias, antecedentes quirúrgicos, antecedentes de tratamientos quimioterápicos, antecedentes de radioterapia, cálculos, cistitis intersticial, tumores vesicales, entre otros). A menudo se acompaña de episodios de incontinencia urinaria de urgencia.
Incontinencia urinaria de urgencia motora
Es la condición urológica en la que se presenta pérdida involuntaria de orina, debida a contracciones vesicales involuntarias, como parte de un síndrome de hiperactividad vesical, asociadas a una sensación de urgencia y producidas usualmente por numerosas afecciones entre las que destacan las afecciones que obstruyen el trayecto de salida vesical, como por ejemplo, el crecimiento prostático benigno u otros estados obstructivos, así como estados de vejiga de senectud, debido a hipertrofia y alteraciones mioestrudurales de la musculatura vesical.
Se define como el deseo imperioso de orinar (fuertes deseos de orinar). Está asociada a dos tipos muy definidos de disfunción vesical, o bien en casos de función hiperadiva vesical (urgencia motora), o bien por hipersensibilidad debida a estados inflamatorios de causas variadas (urgencia sensorial).
Hiperactividad vesical con contractilidad vesical deficiente
Son estados de hiperadividad vesical que se presentan en personas ancianas, pero con caraderísticas propias, en los que los parientes presentan contracciones involuntarias del músculo detrusor, pero deben esforzarse mucho para poder vaciar su vejiga, por cuanto las presiones intravesicales generadas, son de poca fuerza. Dicho vaciamiento puede ser completo o incompleto, con la presencia de síntomas de incontinencia de urgencia y elevados niveles de orina residual. Estos pacientes podrían tener síntomas de uropatías obstructivas, o de incontinencia urinaria de esfuerzo, o de incontinencia por rebosamiento, haciendo difícil su diagnóstico.
Es la habilidad del músculo detrusor para permanecer relajado e inactivo durante el llenamiento urinario vesical, aun cuando se realicen maniobras provocativas de la contractilidad vesical.
Es la condición que se presenta cuando el paciente orina más de 8 veces al día.
Es la condición que se presenta, cuando el paciente se levanta 2 o más veces a orinar por la noche, una vez que ya se había dormido.
Residuo urinario postmiccional (RPM)
Es la orina que queda dentro de la vejiga posterior a una micción satisfactoria o no para el paciente, dentro de los siguientes 5 minutos a dicha micción, utilizada como parte del armamentario diagnóstico de pacientes con disfunción miccional de vaciamiento. Se considera anormal cuando supera el 25% de la capacidad funcional vesical o mayor de 100 mi. Es un parámetro que mide la eficacia miccional, presentando una gran variabilidad interpersonal. Es más un factor de indicación de deterioro de la función vesical (deterioro del detrusor) que un indicador de obstrucción de la salida vesical.
Demencia Senil
La demencia senil se define, como un estado de debilitamiento fundamentalmente intelectual profundo, global y progresivo, de evolución crónica, usualmente de etiología multiinfartos cerebrales, que afecta las funciones elementales de la mente, las conductas sociales, el juicio y el razonamiento, acompañado muchas veces, de un deterioro físico, que llevará en lo referente al sistema urinario y más específicamente en la esfera miccional, a un descontrol del acto miccional por afectación de su razonamiento inductivo, lo que sin duda, lleva a episodios de incontinencia urinaria y en general a una variada signología y sintomatología referida a las vías urinarias bajas.
Diario Vesical
Es un argumento clínico que se utiliza a manera de bitácora en los pacientes con incontinencia urinaria útil en determinar la frecuencia urinaria, el volumen orinado y perdido, el patrón miccional y las circunstancias que rodean los episodios incontinentes así como dar los indicios de causas subyacentes y de actores contribuyentes a los episodios de pérdidas involuntarias urinarias.
CUESTIONARIO DE IMPACTO DE LA INCONTINENCIA URINARIA SOBRE LA CALIDAD DE VIDA DEL PACIENTE (QOL) (CMU-Potenzlanl 99)
NUNCA (0 puntos) A VECES (1 punto) SIEMPRE (2 puntos)
1) ¿Presenta Incontinencia urinaria en reposo, acostada o sentada?
2) ¿Presenta Incontinencia urinaria mientras tose, estornuda, o se ríe?
3) ¿Presenta Incontinencia urinaria mientras hace esfuerzos, ejercicios, aerobics o multifuerza?
4) ¿Presenta Incontinencia urinaria mientras realiza su actividad sexual?
5) ¿Presenta Incontinencia urinaria relacionada con momentos de urgencia urinaria?
6) ¿Presenta Incontinencia urinaria con la vejiga llena o con la vejiga con poca orina?
7) ¿La Incontinencia urinaria repercute negativamente en su actividad sexual?
8) ¿La Incontinencia urinaria la ha limitado en su vida social (recreación, reuniones)?
9) ¿La Incontinencia urinaria la ha limitado y afectado negativamente en su trabajo?
10) ¿La Incontinencia urinaria la ha convertido en una persona solitaria y apartada?
11) ¿La Incontinencia urinaria ha provocado en Ud. crisis depresivas o de angustia?
12) ¿Necesita Ud. usar pañales o toallas diariamente por su incontinencia urinaria?
13) ¿Cree Ud. que la Incontinencia urinaria tiene Tratamiento?
14) ¿Se sometería Ud. a alguna modalidad de Tratamiento?
REPERCUSIÓN LIGERA = 0 - 14 puntos
REPERCUSIÓN MODERADA-INTENSA = 15-28 puntos
CUESTIONARIO DE VEJIGA HIPERACTIVA Y CALIDAD DE VIDA (POTENZIANI-QOL-HV-26, 2005)
Instrucdones: Coloque en el recuadro el puntaje de su respuesta y a final del cuestionario presione resultado para ver su puntuación.
1. ¿TIENE UD. UNA FRECUENCIA URINARIA DURANTE EL DÍA DE...?
a) 1 a 4 veces/día = 0 puntos
b) 5 a 10 veces/día = 1 puntos
c) Más de 10 veces/día = 2 puntos
2. ¿SE DESPIERTA UD. A ORINAR DURANTE LA NOCHE (NOCTURIA), CON EL FASTIDIO DE INTERRUMPIR SU SUEÑO HABITUAL Y EL DE SU PAREJA...?
a) No se despierta para orinar = 0 puntos
b) de 1 a 3 veces por noche = 1 puntos
c) más de 4 veces por noche = 2 puntos
MIDE ANTECEDENTE PERSONAL Y TIEMPO CON LA CONDICION HIPERACTIVA
3. ¿HA NOTADO UD, QUE DESDE SU INFANCIA HA ORINADO FRECUENTEMENTE (SI SE COMPARA CON LA GENTE QUE LO RODEA)?
a) No lo ha notado = 0 puntos
b) Creo que si = 1 puntos
c) Francamente si = 2 puntos
4. ¿LA FRECUENCIA URINARIA REPRESENTA PARA UD. Y PARA SU FAMILIA UN ASPECTO NEGATIVO EN EL QUEHACER DE SU VIDA DIARIA (SOCIAL, FAMILIAR PROFESIONAL-LABORAL)?
a) No = 0 puntos
b) En ocasiones = 1 puntos
c) Francamente si = 2 puntos
5. ¿SIENTE UD. QUE CUANDO LE DAN GANAS DE ORINAR DEBE IR URGENTEMENTE AL BAÑO, YA QUE PODRÍA ORINARSE SI NO LO HICIERA?
a) No = 0 puntos
b) En ocasiones = 1 puntos
c) Francamente si = 2 puntos
URGENCIA Y STATUS VESICAL
6. ¿SIENTE UD. UNA URGENTE NECESIDAD DE ORINAR CUANDO.....?
a) Tiene la vejiga llena = 0 puntos
b) Tiene la vejiga con poquísima cantidad de orina = 1 puntos
c) En ambas eventualidades = 2 puntos
URGENCIA Y ACOMODACION VESICAL
7. ¿PUEDE UD. RETARDAR (POSPONER) FÁCILMENTE SU ACTO DE ORINAR?
a) Si =0 puntos
b) en ocasiones = 1 punto
c) nunca puedo posponer el acto de orinar = 2 puntos URGENCIA-CALIDAD DE VIDA PERSONAL
8. ¿LA URGENCIA URINARIA REPRESENTA PARA UD. UN FACTOR NEGATIVO Y DE DETERIORO EN SU CALIDAD DE VIDA DIARIA (FAMILIAR, SOCIAL, PROFESIONAL-LABORAL)?
a) No = 0 puntos
b) en ocasiones = 1 punto
c) francamente si = 2 puntos
URGENCIA E INCONTINENCIA DE URGENCIA COMO ANTECEDENTE PERSONAL
9. ¿RECUERDA UD. EN SU INFANCIA-JUVENTUD HABER TENIDO EPISODIOS DE URGENCIA URINARIA ACOMPAÑADA DE PERDIDA DE ORINA (INCONTINENCIA URINARIA)?
a) No ocurría = 0 puntos
b) Ocurría rara vez = 1 puntos
c) Ocurría frecuentemente = 2 puntos
ANTECEDENTES FAMILIARES DE HIPERACTIVIDAD VESICAL
10. ¿TIENE UD. FAMILIARES DIRECTOS (MADRE, PADRE, HERMANOS, ABUELOS) CON TRASTORNOS DE URGENCIA-FRECUENCIA URINARIA?
a) No = 0 puntos
b) creo que si = 1 punto
c) francamente si = 2 puntos
INCONTINENCIA URINARIA
11. ¿PIERDE UD. ORINA (INCONTINENCIA URINARIA) ?
a) Nunca = 0 puntos
b) En ocasiones = 1 puntos
c) Constantemente = 2 puntos
INCONTINENCIA URINARIA DE ESFUERZO Y CIRCUNSTANCIAS QUE LA RODEAN
12. CUANDO UD. PIERDE ORINA (INCONTINENCIA URINARIA) SUCEDE EN LAS SIGUIENTES CIRCUNSTANCIAS (PARTE I) ?
a) No pierdo orina = 0 puntos
b) Sin estar relacionado con ningún esfuerzo ( sin previo aviso ) = 1 punto
c) Al hacer grandes esfuerzos = 1 punto
d) Al hacer pequeños esfuerzos (tos, estornudo, risa) = 2 puntos INCONTINENCIA URINARIA DE URGENCIA Y CISCUNSTANCIAS QUE LA RODEAN
13. ¿CUANDO UD. PIERDE ORINA (INCONTINENCIA URINARIA) SUCEDE EN LAS SIGUIENTES CIRCUNSTANCIAS (PARTE II)?
a) no pierdo orina = 0 puntos
b) relacionado con circunstancias como tocar agua, estar en casa, entrar a su casa, relacionado con la actividad sexual, siempre relacionado con la sensación de urgencia urinaria = 2 puntos
(Cualquier respuesta de la opción b) vale por igual, y no se debe repetir la sumatoria, aunque tenga positiva varias de las preguntas. Una o todas valdrán por 2 puntos).
VOLUMEN DE INCONTINENCIA URINARIA
14. ¿CUANDO UD. PIERDE ORINA ?
a) Es ocasionalmente y en pequeñas gotas = 0 puntos
b) Se moja su ropa intima en poca cantidad = 1 punto
c) Se moja la ropa y o sus piernas = 1 punto
d) Moja el piso = 2 puntos
INCONTINENCIA URINARIA Y MOMENTO DEL DIA DE OCURRENCIA
15. ¿EN QUE MOMENTO DEL DIA HA NOTADO UD. QUE PIERDE ORINA (INCONTINENCIA URINARIA)?
a) No pierdo orina = 0 puntos
b) Sólo de día = 1 punto
c) Sólo de noche = 1 punto
d) De día y de noche = 2 puntos
ANTECEDENTES FAMILIARES DE LA PATOLOGIA (INCIDENCIA FAMILIAR)
16. ¿TIENE UD. FAMILIARES DIRECTOS (MADRE, PADRE, HERMANOS, ABUELOS) CON TRASTORNOS DE INCONTINENCIA URINARIA?
a) no = 0 puntos
b) creo que si = 1 punto
c) francamente si = 2 puntos
INCONTINENCIA URINARIA DE URGENCIA Y CALIDAD DE VIDA
17. ¿LOS EPISODIOS DE INCONTINENCIA URINARIA DE URGENCIA LO HAN AFECTADO NEGATIVAMENTE EN SU CALIDAD DE VIDA DIARIA (FAMILIAR, SOCIAL, PROFESIONAL-LABORAL)?
a) no = 0 puntos
b) en ocasiones = 1 punto
c) francamente si = 2 puntos
ANTECEDENTES DE ENURESIS POSIBLEMENTE ASOCIADA A HIPERACTIVIDAD
18. ¿HASTA QUE EDAD SE ORINÓ UD. EN LA CAMA, SIN HABER TENIDO NUNCA CONTROL DE SU ORINA ?
a) nunca se orinó en la cama = 0 puntos
b) hasta los 3 años = 0 puntos
c) hasta los 18 años = 1 punto
d) todavía se orina en la cama = 2 puntos
INCONTINENCIA URINARIA Y ACTIVIDAD INTIMA
19. PIERDE UD. ORINA EN SUS RELACIONES INTIMAS (CONTACTO SEXUAL) Y CON ELLO TIENE UD. AFECTADA SU ACTIVIDAD INTIMA?
a) no = 0 puntos
b) en ocasiones = 1 punto
c) siempre sucede = 2 puntos
SINTOMAS DE HIPERACTIVIDAD EN RELACION A AFECTACION DE CALIDAD DE VIDA Y POR ENDE INTENCIONES SERIAS EN RESOLVER SU SITUACION
20. ¿SI UD. PRESENTA URGENCIA URINARIA, FRECUENCIA URINARIA, NOCTURIA E INCONTINENCIA URINARIA DE URGENCIA, LE GUSTARÍA ELIMINAR DICHOS SÍNTOMAS CON ALGUNA MODALIDAD DE TRATAMIENTO?
a) no = 0 puntos
b) creo que si = 1 punto
c) francamente si = 2 puntos
SINTOMAS DE HIPERACTIVIDAD EN GENERAL Y AFECTACION DE CALIDAD DE VIDA
21. ¿UD. HA NOTADO QUE LOS SÍNTOMAS DE FRECUENCIA URINARIA, URGENCIA URINARIA, NOCTURIA E INCONTINENCIA URINARIA LO(A) HAN AFECTADO NEGATIVAMENTE EN SU NIVEL DE ENTUSIASMO VITAL, EN SUS RELACIONES SEXUALES, EN LA PARTICIPACIÓN ACTIVA EN SU TRABAJO, EN SUS FUNCIONALES O ROLES SOCIALES O FAMILIARES?
a) no = 0 puntos
b) creo que si = 1 punto
c) francamente si = 2 puntos
MODIFICACION DE SU COMPORTAMIENTO DIARIO POR LA PRESENCIA DE HIPERACTIVIDAD VESICAL
22. ¿PLANEA UD. SUS ACTIVIDADES RECREATIVAS (VIAJES, VISITAS A CENTROS COMERCIALES, VISITAS A RESTAURANTES, VISITAS A PARQUES) DE ACUERDO A LA DISPONIBILIDAD O NO DE CONTAR CON BAÑOS ADECUADOS QUE ESTÉN A SU ALCANCE, EN CASO DE URGENCIA URINARIA?
a) no = 0 puntos
b) creo que si = 1 punto
c) francamente si = 2 puntos
INTENSIDAD DE LA INCONTINENCIA URINARIA
23. ¿UTILIZA UD. PROTECCIÓN PARA SUS PERDIDAS URINARIAS (PAÑALES U OTROS ADITAMENTOS)?
a) no = 0 puntos
b) si = 2 puntos
INTERES Y MOTIVACION EN BUSCAR ATENCION MÉDICA
24. ¿HA BUSCADO UD. ATENCIÓN MÉDICA PARA SU PROBLEMA URINARIO?
a) no= 0 puntos
b) si— 2 puntos
MIDE LA ATENCION MÉDICA QUE HAN RECIBIDO ESTE TIPO DE PACIENTES
25. ¿HA RECIBIDO UD. TRATAMIENTO MEDICO PARA SU PROBLEMA URINARIO?
a) no= 0 puntos
b) si— 2 puntos
REPERCUSION DE LA H.V SOBRE SU ESFERA PROFESIONAL
26. ¿HA TENIDO QUE CAMBIAR DE TRABAJO U OFICIO POR SU PROBLEMA URINARIO? Resultado
ESCALA DE PUNTUACION
AFECTACIÓN LEVE (MÍNIMA) DE SU CALIDAD DE VIDA (QOL)= 0 A10 PUNTOS AFECTACIÓN MODERADA DE SU CALIDAD DE VIDA (QOL) = 11 A 26 PUNTOS AFECTACIÓN INTENSA DE SU CALIDAD DE VIDA (QOL) = 27 A 52 PUNTOS
SCORE DE PROBABILIDAD DE SINDROME DE VEJIGA DOLOROSA y/O DE DOLOR CRONICO PELVIANO (Potenziani SP-SVD/DCP-15,2005)
1) ¿EN EL ULTIMO MES HA SENTIDO UD. FUERTES DESEO DE ORINAR REPENTINOS SIN AVISO? No= 0 puntos
Casi nunca= 1 punto Moderadas veces= 2 puntos Casi siempre= 3 puntos Siempre= 4 puntos
2) ¿ORINA UD. FRECUENTEMENTE CON MENOS DE 2 HORAS DE INTERVALO EN EL DIA?
No= 0 puntos
Casi nunca= 1 punto Moderadas veces= 2 puntos Casi siempre= 3 puntos Siempre= 4 puntos
3) ¿ORINA UD. FRECUENTEMENTE CON MENOS DE 2 HORAS DE INTERVALO EN LA NOCHE? No = 0 puntos
Casi nunca = 1 punto Moderadas veces = 2 puntos Casi siempre = 3 puntos Siempre = 4 puntos
4) ¿CUÁNTAS VECES VA AL BAÑO A ORINAR EN EL DIA?
3 a 6 veces= 0 puntos
7 a 10 veces= 1 punto
11 a 14 veces= 2 puntos
15 a 19 veces= 3 puntos más de 20 veces= 4 puntos
5) ¿CUÁNTAS VECES VA AL BAÑO A ORINAR EN LA NOCHE?
1 a 2 veces = 0 puntos
3 a 4 veces = 1 puntos
5 a 6 veces = 2 puntos
7 a 10 veces= 3 puntos más de 10 veces= 4 puntos
6) ¿TIENE UD. DOLOR AL ORINAR?
No= 0 puntos
Casi nunca= 1 punto Moderadas veces= 2 puntos Casi siempre= 3 puntos Siempre= 4 puntos
7) ¿SI UD. TIENE RELACIONES SEXUALES PRESENTA DOLOR O URGENCIA URINARIA DURANTE O AL TERMINAR LA RELACION SEXUAL?
No= 0 puntos
Casi nunca= 1 punto
Moderadas veces= 2 puntos
Casi siempre= 3 puntos
Siempre= 4 puntos
8) ¿EVITA UD. SUS RELACIONES SEXUALES POR EL DOLOR O URGENCIA URINARIA QUE LE CAUSAN? No= 0 puntos
Casi nunca= 1 punto Moderadas veces= 2 puntos Casi siempre= 3 puntos Siempre= 4 puntos
9) ¿PRESENTA UD. DOLOR LEVE, MODERADO O INTENSO DE MANERA CRONICA, EN UNA O VARIAS DE LAS SIGUIENTES AREAS: vagina, uretra, pelvis (vientre), periné (zona entre los genitales y el ano), testículos o región mas inferior de la espalda?
No= 0 puntos
Casi nunca= 1 punto
Moderadas veces= 2 puntos
Casi siempre= 3 puntos
Siempre= 4 puntos
10) ¿EL DOLOR QUE UD. TIENE HA DESMEJORADO SUSTANCIALMENTE SU CALIDAD DE VIDA DIARIA?
No= 0 puntos
Posiblemente si= 2 puntos
Francamente si= 4 puntos
11) ¿LAS MOLESTIAS URINARIAS (urgenda urinaria, dolor urinario y frecuenda urinaria, ocasionalmente incontinenda de urgenda) HAN DESMEJORADO SUSTANCIALMENTE SU CALIDAD DE VIDA DIARIA?
No= 0 puntos
Posiblemente si= 2 puntos
Francamente si= 4 puntos
12) ¿TANTO SUS MOLESTIAS URINARIAS COMO EL DOLOR HAN IDO AUMENTANDO SU INTENSIDAD EN EL TIEMPO?
No= 0 puntos
Posiblemente si= 2 puntos
Francamente si= 4 puntos
13) ¿HA RECIBIDO UD. TRATAMIENTOS FARMACOLOGICOS (CON MEDICAMENTOS) PARA SUS PROBLEMAS URINARIOS+DOLOR?
No= 0 puntos
Casi nunca= 1 punto
Moderadas veces= 2 puntos
Casi siempre= 3 puntos
Siempre= 4 puntos
14) ¿SIENTE UD. SENSACION DE FRUSTACION Y DESESPERANZA POR LA DIFICULTAD EN OBTENER BUENOS RESULTADOS CLINICOS CON SUS TRATAMIENTOS FARMACOLOGICOS?
No= 0 puntos
Posiblemente si= 2 puntos
Francamente si= 4 puntos
15) ¿CUÁNTOS ESQUEMAS DE TRATAMIENTO LE HAN SIDO APLICADOS A UD. CON SU PROBLEMA DE DOLOR/TRANSTORNOS URINARIOS?
0 a 2 esquemas= 0 puntos
3 a 5 esquemas= 2 puntos
más de 5 esquemas= 4 puntos
POCO PROBABLE= 0-20 PUNTOS MEDIANAMENTE PROBABLE= 21 A 40 PUNTOS ALTAMENTE PROBABLE= 41 A 60 PUNTOS
CLASIFICACIÓN DE LA INCONTINENCIA URINARIA DE ESFUERZO EN LA MUJER (IOE) (BLAIVAS 1988)
Tipo O = No se demuestra fuga de orina en el examen clínico y urodinámico.
Tipo I = Cuello vesical cerrado en reposo y situado por arriba del borde inferior de la sínfisis pubiana. En el esfuerzo el cuello vesical y la uretra proximal se abren, pero su descenso es mínimo (menos de 2 cm.). Puede haber incontinencia urinaria. Hay poco o ningún grado de cistocele.
Tipo Ha = Cuello vesical cerrado en reposo y situado por arriba del margen inferior de la sínfisis pubiana. Al esfuerzo el cuello vesical y la uretra se abren y hay descenso rotacional del cuello vesical y de la uretra proximal. Puede haber incontinencia urinaria.
Tipo Ilb = Cuello vesical cerrado en reposo y situado en la margen inferior de la sínfisis pubiana o por debajo. Durante el esfuerzo puede haber o no haber más descenso, pero la uretra se abre y la incontinencia urinaria se produce.
Tipo III = Cuello vesical y uretra proximal abiertos en reposo, en ausencia de contracciones del detrusor. Hay una evidente fuga de orina, la cual puede incluso ser por gravedad. Hay deficiencia esfinteriana intrínseca.
CLASIFICACIÓN DE LA INCONTINENCIA URINARIA DE ESFUERZO EN LA MUJER (POTENZIANI 1994)
Tipo O = Pacientes con IOE, que no se les pudo demostrar fuga o escape de orina durante el estudio urodinámico, o durante el examen clínico.
Tipo I = Pacientes con descenso uretrocervical con maniobra de Valsalva, sin presencia de prolapsos genitales. No presentan residuo postmicdonal significativo
Tipo II = Pacientes con descenso uretrocervical con maniobra de Valsalva, con la presencia de cistocele grado I, sin residuo postmiccional significativo.
Tipo III = Parientes con descenso uretrocervical con maniobra de Valsalva, con cistocele grado II-III, con residuo postmiccional significativo
Tipo IV =Pacientes con descenso uretrocervical con o sin maniobra de Valsalva, con cistocele grado II-III y redocele asociado grado I-II-III u otros prolapsos (enterocele, histerocele) con residuo urinario postmiccional significativo
Tipo V =Pacientes con cuello vesical y uretra proximal abiertos en reposo, en ausencia de actividad contráctil del detrusor. Pueden tener o no la presencia de prolapsos genitales. Presenta daño intrínseco del mecanismo esfinteriano
CLASIFICACION CLINICA DE INCONTINENCIA URINARIA SEGUN STAMEY (STAMEY-1980)
(Clasificación clínica basada en la historia)
Grado O = No hay incontinencia urinaria (o por lo menos, no se ha podido demostrar clínicamente).
Grado I = Incontinencia urinaria con tos, risa y esfuerzos intensos.
Grado II = Incontinencia urinaria con cambios de posición corporal o al caminar o con esfuerzos mínimos.
Grado III = Incontinencia total cualquiera sea la posición corporal de la paciente o cualquiera sea la circunstancia del paciente.
INCONTINENCE IMPACT QUESTIONNAIRE-SHORT FORM IIQ-7
Las pérdidas urinarias tienen un impacto sobre áreas íntimas, familiares, sociales y profesionales que afectarán sin duda la emodonalidad de la paciente afectada. Ls preguntas que responderán tienen relación con su problema de incontinencia urinaria. Responda adecuadamente las preguntas en base a la clasificación abajo mencionada.
Las perdidas urinarias la han afectado:
Para nada 0
Ligeramente 1









THE HOPKINS SYMPTOM CHECKLIST (SCL-90-R)
FOR PSYCOLOGICAL DISTRESS (L. DEROGATIS)
EL INVENTARIO DE SÍNTOMAS SCL-90-R de L Derogatis
Maria Martina Castillo. 1999.
Este inventario ha sido desarrollado para evaluar patrones de sintonías presentes en individuos y puede ser utilizado tanto en tareas comunitarias como de diagnóstico clintco
Cada uno de los 90 ítemes que lo integran se responde sobre la base de una escala de cinco puntos ( Q-4)r Se lo evalúa e interpreta en función de nueve dimensiones primarias y tres índices globales de malestar psicológico:
2) Obsesiones y compulsiones ( OBS)
3) Sensitividad interpersonal ( SI)
4) Depresión (DEP)
5) Ansiedad (ANS)
6) Hostilidad (HOS)
S) Ideación paranoide ( PAR)
9) Psicoticismo (PSIC).
1) Indice global de severidad {IGS)
2) Indice positivo de Malestar ( PSDI)
3) Total de síntomas positivos ( TP)
Estos tres indicadores reflejan aspectos diferenciales de los trastornos a ser evaluados.
En lérminos generales una persona que ha completado su escolaridad primaria lo puede responder sin mayores dificultades. En caso de que el sujeto evidencie dificultades lectoras es aconsejable que el examinador le lea cada uno de los ítemes en voz alta
En circunstancias normales su administración no requiere más de quince minutos Se le pide a la persona que está siendo evaluada que responda en fundón de cómo se ha sentido durante los últimos sjete dias. incluyendo el día de hoy (el de la administración del inventario). Los pacientes con retraso mental, ideas delirantes o trastorno psicótioo son malos candidatos para responder el SCL-QÜ. Es aplicable a personas entre 13 y 65 años de edad.
LAS NUEVE DIMENSIONES DE SÍNTOMAS.
Estas dimensiones se definieron sobre la base de criterios clínicos, racionales y empíricos.
SOMATIZACIÜNES (itemes 1,4,12,27,40, 42. 43,49, 52 53 56: 53).
Evalúa la presencia de malestares que la persona percibe relacionados con diferentes defunciones cor perales (cardiovasculares, gastrointestinales, respiratorios),
OBSESIONES Y COMPULSIONEsfíterries 3, 9, 10 23, 38, 45. 46, 51, 55. 65).
Incluye síntomas que se identifican con el síndrome clínico de] mismo nombre: Pensamientos, acciones e impulsos que son vivenciados como imposibles de evitar o no deseados.
SENSITIVIDAD INTERPERSONAL (¡temes 6.21 s 34. 36. 37,41, 61 69, 73).
Se focaliza en detectar la presencia de sentimientos de inferioridad e inadecuación, en especial cuando la persona se compara con sus semejantes
DEPRESIÓN (itemes 5.14 15, 20, 22. 26, 29. 30. 31, 32 54. 71, 79).
Los itemes que integran esta subescala representan una muestra representativa de las principales manifestaciones clínicas de una trastorno de tipo depresivo: estado de ánimo disfóríco, falta de motivación, poca energía vital, sentimientos de desesperanza, ideaciones suicidas.
ANSIEDAD (itemes 2,17, 23 33 39,57,72,76,80,86).
Evalúa la presencia de signos generales de ansiedad la les como nerviosismo tensión, ataques de pánico, miedos.
HOSTILIDAD (ítemes 11,24, 63. 67, 74, 81).
Esta dimensión hace referencia a pensamientos, sentimientos y acciones característicos efe la presencia de afectos negativos de enojo
ANSIEDAD FÓBICA (ítemes 13. 25,47, 50. 70. 75, 82).
Este malestar alude a una respuesta persistente de miedo (a personas especificas, lugares, objetos, situaciones) que es en si misma irracional y desproporcionada en relación con el estímulo que la provoca
IDEACIÓN PARANOIDE (itemes S, 18: 43. 68; 76 83).
Evalúa comportamientos paranoides íun da men talmente en tanto desórdenes del pensamiento; pensamiento proyectivo, suspica-cia, temor a la pérdida de autonomía.
PSICOTICISMO (ítemes 7, 16. 35. 62. 77, 84, 35. 87, 33 90)
Esta dimensión se ha construido con la intensión que represente el constructo en tanto dimensión continua de la experiencia humana. Incluye síntomas referidos a estados de soledad, estilo de vida esquizoide, alucinaciones y control del pensamiento,
El SCL-9Q-R incluye siete itemes que no se incorporan a las nueve dimensiones ya mencionadas pero que tienen relevancia cíínica:
19: Poco apetito 44 Problemas para dormir
59 Pensamientos acerca de la muerte o el morirse
60 Comer en exceso
64 Despertarse muy temprano 66 Sueño intranquilo.
89 Sentimientos de culpa,
INDICES GLOBALES.
1) Indice de Severidad Global: es un muy buen indicador del nivel actual de la severidad del malestar. Combina el número de síntomas reconocidos como presentes con la intensidad del malestar percibido
Se calcula sumando las puntuaciones obtenidas en las nueve dimensiones de síntomas y en los itemes adicionales,
2) Total de síntomas positivos (STP): se estima contando el total de itemes que tienen una respuesta positiva (mayor que cero). En sujetos de población general, puntuaciones brutas iguales o inferiores a 3 en varones e iguales o inferiores a 4 en mujeres son consideradas como indicadoras de un intento consciente de mostrarse mejores de lo que realmente están, (imagen positiva) Puntuaciones brutas superiores a 50 en varones y a 60 en mujeres indican lo contrario: tendencia a exagerar sus patologías.
3) Indice de Malestar Positivo ( PSDI): pretende evaluar el estilo de respuesta indicando si la persona tiende a exagerar o a minimizar los malestares que lo aquejan.
Se calcula dividiendo la suma total de las respuestas dadas a los ¡temes por el valor obtenido en Síntomas Totales Positivos, f SP)
Puntuaciones extremas en este índice también sugieren patrones de respuestas que deben analizarse en términos de actitudes de fingimiento,
En el Manual en el original inglés de la prueba se consignan estudios sobre su Validez Estructura] y Convergente asi como acerca de su consistencia interna y fiabilidad test-retest. ( Derogatis. 1994. Minnesota, National Computer System)
Evaluación e interpretación del inventario.
1) Se calculan las puntuaciones di recías o brutas para cada urna de las nueve dimensiones y los tres índices.
2) Sumar los valores asignados a cada Ítem y dividir ese total por el número de itemes respondidos.
3) Se convierten esas puntuaciones directas en puntuaciones T (Media = 50 y DT.= 10).
4) Se considera indicativa de una persona EN RIESGO toda puntuación T igual o superior a 65.
5) Indica presencia de patología severa toda puntuación igual o superior a T 80.
5) Existen haremos separados según sexo (varones, mujeres).
SCL-9Q-R.
1) SOMATIZACIONES:
1...4... 12,,, 27,. 40.,. 42... 48... 49... 52... 53... 56... 58 .
Total (dividir): T.....
2) OBSESIONES Y COMPULSIONES:
3.. 9,., 10... 28... 38.. 45,,. 46... 51... 55.. 65..
Total (dividir): T.....
3) SENSITIVIDAD INTERPERSONAL:
6. 21.. 34.. 36... 37. 41... 61... 69 .. 73...
Total (dividir): T.....
4) DEPRESIÓN:
5. . 14.. 15. 20... 22... 26.. 29... 30.. 31... 32...S4... 71.. 73... Tolal (dividir); T.....
5) ANSIEDAD;
2... 17... 23... 33... 39... 57... 72... 78... 80... 36...
Total (dividir): T.....
6) HOSTILIDAD:
11. . 24... 63... 67... 74... Si-
Tata! (dividir): T.....
7) ANSIEDAD FÓBICA:
13... 25... 47... 50... 75... S2...
Total {dividir): T______
S) IDEACIÓN PARANOIDE:
5... 18.. 43. . 6S... 76... S3...
Total {dividir): T.....
9) PSI GOTICISMO:
7... 16.., 35.,. 62,. 77... 84.,. 35., 87.., 88.., 90.,.
Tota [(dividir): T ,,,,
IMDICE DE SEVERIDAD GLOBAL:
Total: T.....
TOTAL DE SINTOMAS POSITIVOS ( SP)
Total: T.....
MALESTAR SINTOMATICO POSITIVO ( PSDI)
Total: T.....
ITEMES ADICIONALES
19........ 44...... 59...... ©O....... 64....... S©...... 89.......


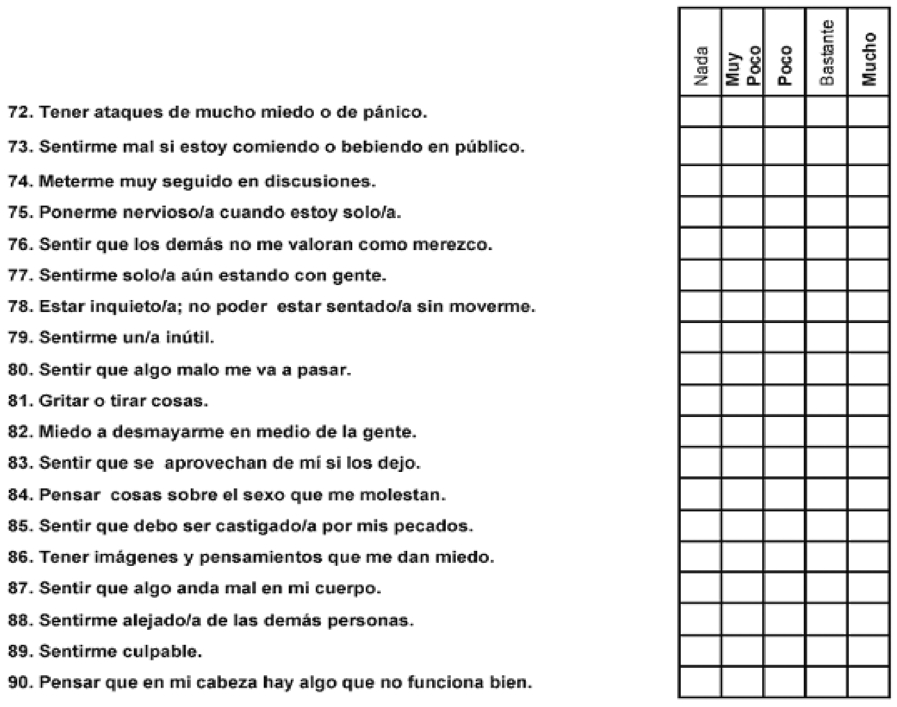
RIRIIOGRAFIA
Abdel-Khalek AM. A Short Version of the Beck Depression Inventory Without Omission of Clinical Indicators European Journal of Psychological Assessment, 17, (3), 2001.
Abrams P, Feneley R, Torrens M. Urodynamics. New York: Springer-Verlag: 15-17, 1983.
Abrams P, Cardozo L, Khoury S, Wein AJ: Incontinence. Health Publication Limited, Plymbridge Distributors, Ltd, 2nd Edition, 2002.
Abrams P, Cardozo L, Fall M, Griffiths D, Rosier P, Ulmsten U, et al. The standardisation of terminology of lower urinary tract function: report from the standardisation sub-committee of the International Continence Society. Neurourol Urodyn 21(2): 167-178, 2002.
Abrams P, Cardozo L, Fall M. The standardisation of terminology in lower urinary tract function: report from the standardisation subcommittee of the international continence society. Urology 61: 37-49, 2003.
Abrams P, Blaivas JG, Stanton SL. The standardization of terminology of lower urinary tract function recommended by the International Continence Society. Int Urogynecol J Pelvic Floor Disfunction 1: 45-58, 1990.
AHCPR. Urinary Incontinence in adults: Acute and Chronic management (2) 1996 Update. Clinical Practice Guideline. US Department of Health and
AHCPR (Agency for Healthcare Policy and Research). Urinary Incontinence in Adults. Rockville, MD, US Department of Health and Human Services, March 27, 2001. http://www.ahcpr.gov.
Allen RE, Hosker GL, Smith ARB, Warell DW. Pelvic floor damage and childbirth: A neurophysiological study. Br J Obstet Gynaecol 97: 770-779, 1990.
Andersson KE. Lower urinary tract symptoms 2002: An Update on storage and voinding symptoms Urology 62(5B) Nov 2003.
AMA-Behavioral Therapy for the treatment of urinary incontinence coverage update. Medicare Focus. Chicago III: American Medical Association 12-14,
2001.
Appell RA. Electrical stimulation for the treatment of urinary incontinence. Urology 51(Suppl 2A): 24-26, 1998.
Berghmans LCM, Hendriks HJM, de Bie RA. Conservative treatment of urge urinary incontinence in women: a systematic review of randomized clinical trials. BJU Int 85: 254-263, 2000.
Berghmans B. New developments in the conservative treatment of stress urinary incontinence in women: patient selection and guidelines. Am J of Urology 2(5) Supp 4: 20-21. May 2004.
Berghmans B, van Waalwijk van Doom E, Nieman F. Efficacy of physical therapeutic modalities in women with proven bladder overactivity. Eur Urol 41: 581-587, 2002.
Berghmans LCM, Hendriks HJM, Bo K. Conservative treatment of stress urinary incontinence in women: a sysematic review of randomized clinical trials. Br J Urol 82: 181-191,1998.
Blaivas JG. Overactive Bladder revisited. Neurourol Urodyn 21: 523, 2002.
Bo K, Talseth T, Holme I. Single blind, randomised controlled trial of pelvic floor exercises, electrical stimulation, vaginal cones, and no treatment in management of genuine stress incontinence in women. BMJ 318: 487-493, 1999.
Bo K. Present-Day Role of conservative treatment in Urogynecology. Am J Urology Review: 2(5) Suppl 4: 20, May 2004.
Bo K. New developments in the conservative treatments of urinary incontinence in women during pregnancy and after delivery. Am J of Urology Review: 2(5) Suppl 4: 24, May 2004.
Borrie MJ. An introduction to urinary incontinence Part I of V. Geriatrics & Aging 1(1): 23, 1998.
Bourcier AP, McGuire EJ, Abrams P. Pelvic Floor Disorders. Saunders Co 2004.
Brubaker L. Electrical stimulation in overactive bladder. Urology 55:Suppl: 17-23,31-2, 2000.
Burgio K, Matthews KA, Engel BT. Prevalence, incidence and correlates of urinary incontinence in healthy, middle-aged women. J Urol 146: 1255-1259, 1991.
Burgio KL, Goode PS, Locher JL, Richter HE, Roth DL, Wright K,Vamer E. Predictors of Outcome in the Behavioral Treatment of Urinary Incontinence in Women Obstetrics & Gynecology 102: 940-947, 2003.
Burgio KL, Goode PS, Locher JL, Wmlauf MG, Roth DL, Richter HE, Vamer RE, Lloyd LK. Behavioral training with and without biofeedback in the treatment of urge incontinent orledr women. JAMA 288-2293-2299, 2002.
Burgio KL, Pearce KL, Lucco A. Staying dry: A practical guide to bladder control. Baltimore Md. Johns Hopkins University Press 1989.
Burgio KL, Locher JL, Roth DL, Goode PS. Psychological Improvements Associated With Behavioral and Drug Treatment of Urge Incontinence in Older Women. The Journals of Gerontology Series B: Psychological Sciences and Social Sciences 56: 46-P51, 2001.
Burgio KL, Locher JL, Goode PS, Hardin M, McDowell BJ, Dombrowski M, Candib D. Behavioral vs Drug treatment for urge urinary incontinence in older women. JAMA 280: 1995-2000, 1998.
Burgio KL, Goode PS, Locher JL, Richter HE, Roth DL, Clark Wright K, varner RE. Predictors of outcome in the behavioral treatment of urinary incontinence in women. Obstet Gynecol 102: 940-947,2003.
Burgio KL, Ives DG, Locher JL, Arena VC. Treatment seeking for urinary incontinence in adults. J Am Geriatr Soc 42: 208-212, 1994.
Burgio KL, Locher JL, Zyczynski H, Hardin JM, Singh K. Urinary incontinence during pregnancy in a racially mixed sample: Characteristics and predisposing factors. Int Urogynecol J 1996; 7: 69-70.
Bums PA, Pranikoff K, Nochajski TH, Hadley EC, Levy KJ, Ory MG. A comparison of effectiveness of biofeedback and pelvic muscle exercise treatment of stress incontinence in older community-dwelling women. J Gerontol Medical Sciences 48(4): M167-M174, 1993.
Caldwell K: The electrical control of sphincter incompetence. Lancet 2: 174-175, 1963.
Canadian Continence Foundation. Urinary incontinence. Retrieved August 28, 2002 from http ://www. continence-f dn. ca.
Cardozo L. Urethral instability in normal pos-menopausal patients. Proceedings of the 15th. ICS Meeting, London; 103, 1992.
Cardozo LD, Abrams PD, Stanton SL. Idiopathic bladder instability treated by Biofeedabck. Br J Urol 50: 27-30, 1978.
Cassel CK. Use it or lose it. Activity may be the best treatment for aging. JAMA 288: 2333-2335, Nov 2002.
Coombes GM, Millard RJ. The accuracy of portable ultrasound scanning in the measurement of residual urine volume. J Urol 152: 2083-2085, 1994.
Chai TC, Tuttle JB, Steers WD. Neuroplasticity of the aged bladder: Evidence for altered neurotrophic interactions. Abstract # 63 AUA 93rd. Annual Meeting, San Diego 1998.
Chan AS, Ouslander JG. The problem of incontinence in the elderly. Problems in Urology-Urinary Incontinence, 4(1): 138-155, 1990.
Contemporary Urology. Supplement Stress Urinary Incontinence 3-22, October 2003.
Consensus Conference. Urinary incontinence in adults JAMA 261 (18): 2685-2690, May 1989.
Cortes-Gallegos V, Villanueva GL, Sojo-Aranda I, Santa Cruz FJ. Inverted skin changes induced by estrogen and estrogens/glucocorticoides on aging dermis. Gynecol Endocrinol 10: 125-128, 1996.
Croft A. The SCL-90-R in Clinical Application. Dynamic Chiropractic, 17, (10), Mayo 3, 1999.
Cruz F. Mechanism involved in new therapies for overactive bladder. Urology 63(Suppl 3A): 65-73, 2004.
Datillo J. A long-term study of patient outcomes with pelvic muscle re-education for urinary incontinence. J Wound Ostomy Continence Nurs 28:199-205, 2001.
De LaFuente J and R. Stewart. Therapeutics in the Elderly; 2nd Edition. Harvey Whitney Books, Cincinnati, Ohio: 467-479, 1995.
DeLancey JO. Levator ani muscle strcuture and function in women with prolapse compared to women with normal support. Neurourol Urodyn 5: 542-543, 2003.
Division of Chronic Disease Control and Community Intervention, National Center for Chronic Disease Prevention and Health Promotion, Centers for Disease Control. Urinary incontinence among hospitalized persons aged 65 years and older—United States, 1984-1987. MMWR Morb Mortal Wkly Rep 40: 433-436, 1991.
Diokno AC, Wells TJ, Brink CA. Urinary incontinence in elderly women: urodynamic evaluation. J Am Geriatr Soc 35: 940-946, 1987.
Diokno AC. Diagnostic categories of incontinence and the role of urodynamic testing. J Am Geriatr Soc 38: 300-305, 1990.
Diokno AC, Brock BM, Brown D. Prevalence of urinary incontinence and other urologic symptoms in the noninstitutionalized patients. J Urol 136: 1022-1025, 1986.
Diokno AC, Sampselle CM, Herzog AR, Raghunathan TE, Hines S, Messer KL, Karl C, Leite MCA. Prevention of urinary incontinence by behavioral modification program: a randomized, controlled trial among older women in the community. J Urol 171(3): 1165-1171, March 2004.
Division of Chronic Disease Control and Community Intervention, National Center for Chronic Disease Prevention and Health Promotion, Centers for
Disease Control. Urinary incontinence among hospitalized persons aged 65 years and older—United States, 1984-1987. MMWR Morb Mortal Wkly Rep 40: 433-436, 1991.
Dmochowski RR, Appell RA. Injectable agents in the treatment of stress urinary incontinence in women: where are we now? Urology 56: 32-40, 2000.
Dmochowski R. Urodynamic evaluation in patients with Parkinson's disease. Issues in Incontinence 2(2), 1995.
Dougherty, MC. Current status of research on pelvic muscle strengthening techniques. J Wound Ostomy Continence Nurs 25: 75-83, 1998.
Elbadawi A, Yalla SV, Resnick NM. Structural basis of geriatric voiding dysfunction. I. Methods of a prospective uItrastructural/urodynam ic study and a overview of the findings. J Urol 150(5Pt2): 1650-1656, 1993.
Elbadawi A,Yalla SV, Resnick NM. Structural basis of geriatric voiding dysfunction III. Detrusor overactivity. J Urol 1993;150(5): 1668-80.
Elbadawi A. Discussion: The neostructural myogenic mechanism of detrusor overactivity. Urology 1997; 50 (Suppl 6A): 71-73.
Elbadawi A. Neuromorp ho logic basis of vesicourethral function. I. Histochemistry, ultrastructure and function of intrinsic nerves of the bladder and urethra. Neurourol Urodynamics 1982; 1:3.
Elbadawi A. Neuromuscular mechanisms of micturition. En: Yalla SV, McGuire EJ, Elbadawi A, Blaivas JG, editores. Neurourology Urodynamics: Principles and Practice. New York: McMillan Publishing Co; 1988. p.3-35.
Erikson BC, Mjolnerod OK. Changes in urodynamic measurements after succesful anal electrostimulation in female urinary incontinence. Br J Urol 59: 45-49, 1987.
Erlandson BE, Fall M, Carlsscon CA, Linder LE. Mechanism for closure of the human uretra during intravaginal electrical stimulation. Scand J Urol Nephrol 1977; 44 (suppl): 49-54.
Fantl JA, Newman DK, Colling J. Urinary incontinence in adults: acute and chronic management. Clinical Practice Guidelines, No. 2 1996 update. Rockville, MD: US Department of Health and Human Services.
Fantl JA, Bump RC, Robinson D, et al. Efficacy of estrogen supplementation in the treatment of urinary incontinence. The Continence Program for Women Research Group. Obstet Gynecol 88: 745-749, 1996.
Fantl JA, Wyman JF, McClish DK, Bump RC. Urinary incontinence in community-dwelling women: clinical, urodynamic and severity characteristics. Am J Obstet Gynecol 162: 946-951, 1990.
Fantl JA, Efficacy of bladder training in older women with urinary incontinence. JAMA 265: 609-613, 1991.
Farrar DJ. Urodynamics in the elderly. En: Mundy AR, Stephenson TP, Wein AJ, editores. Urodynamic principles, practice and application. 2a ed. New York: Churchill Livingstone; 1984, p. 375-341.
Folstein MF, Folstein EF, McHugh P: Mini mental state: a practical method of grading the cognitive status of the patient for the clinician, J Psychiatr Rev 12: 189-198, 1975.
Fonda D, Brimage PJ, D'Astoli M. Simple screening for urinary incontinence in the elderly: comparison of simple and multichannel cystometry. Urology 1993; 42: 536-40.
Fry CH. Discussion: Cellular physiology of detrusor smooth muscle and the development of bladder instability: Possible mechanisms. Urology 1997; 50(Suppl 6A): 70-71.
Fultz NH, Herzog R. Epidemiology of urinary symptoms in the geriatric population. Urol Clin North Am 1996; 23(1): 1-10.
Garrett VE, Scott JA, Costich J, Aubrey DL, Gross J. Bladder Emptying Assessment in Stroke Patients. Arch Phys Med Rehabil 1989; 70: 41-43.
Geirsson G, Fall M, Lindstrom S. Subtypes of overactive bladder in old age. Age Ageing 1993; 22(2): 125-131.
Ghoniem GM et al. A randomized controlled trial of duloxetine alone, pelvis floor muscle training alone, combined treatment and no active treatment in women with stress urinary incontinence. J Urol 173: 1647-1653, May 2005.
Goode PS, Burgio KL. Managing Incontinence in the geriatric patient Ch 33 in Office Urology. The clinician's Guide Kursh ED, Ulchaker JC. Humana Press 453-465, 2001.
Goode PS, Burgio KL, Locher JL, Roth DL, Umlauf MG, Richter HE, Varner RE, Lloyd LK. Effect of behavioral training with or without pelvic floor electrical stimulation on stress incontinence in women. JAMA 290: 345-352, 2003.
Goode PS. Behavioral and drug therapy for urinary incontinence. Urology 63 (Suppl 3A): 58-64, 2004.
Goto M, Yoshikawa Y, Saito M, Kato K, Kondoi A, Miyake K. Results in treatment of urinary incontinence in the elderly. Nippon Hinyokika Gakkai Zasshi 1992; 83(5): 682-689.
Green TH: Development of a plan for the diagnosis and treatment of urinary stress incontinence. Am J Obstet Gynecol 83: 632, 1962.
Griffiths DJ, McCracken PN, Harrison GM. Urge incontinence in elderly people: factors predicting the severity of urine loss before and after pharmacological treatment. Neurourol Urodyn 15: 53-57, 1996
Grosshans CE et al. Urinary Retention in the Elderly: A Study of 100 Hospitalized Patients. JAGS 41:633-638,1993.
Gruber C, Schugguel WS, Schneeberger C,Huber JC. Production and actions of strogens. N Engl J Med, Vol. 346, No. 5. January 31, 2002
Gunnarsson M, Teleman P, Mattiasson A, et al. Effects of pelvic floor exercises in middle aged women with a history of naive urinary incontinence: a population based study. Eur Urol 2002; 41: 556-61.
Harvey MA, Baker K, Well GA. Tolterodine versus oxy-butynin in the treatment of urge urinary incontinence: a meta-analysis. Am J Obstet Gynecol 2001; 185: 56-61.
Hadley E. "Bladder Training and Related Therapies fo urinary incontinence in older people, prepared for the National Institute on Aging's Workshop on Bladder Training, Washington, DC, April 1983. JAMA 1986; (3) 256: 372.
Hanley J, Capewell A, Hagen S. Validity study of the severity index a simple measure of urinary incontinence in women. BMJ 2001; 322: 1096-7.
Hay-Smith EJ, Bo Berghmans LC, Hendriks HJ, et al. Pelvic floor muscle training for urinary incontinence in women. Cochrane Database Syst Rev 2001; 1: CD001407.
Herzog AR, Fultz NH. Prevalence and incidence of urinary incontinence in community-dwelling populations. J Am Geriatr. Soc 38: 237-281, 1990.
Holroyd-Leduc JM, Straus SE. Management of urinary incontinence in women. Scientific Review JAMA Feb
25, 2004; 291 (8): 986-995.
Hu T. The economic impact of urinary incontinence on health-care costs. J Am Geriatr Soc 1990; 38: 292-5.
Huffman JW, Osborne SL, Sokol JK. Electrical stimulation in treatment of intractable stress incontinence. Arch Phys Med Rehabilitation 1952; 33: 674-676.
Incontinence in the Nursing Home. Ouslander J, Schenelle J. Annals of Internal Medicine 1995; 122(6): 438-449.
Janssen CC, Lagro-Janssen AL, Felling AJ. The effects of physiotherapy for female urinary incontinence: individual compared with group treatment. BJU Int 2001; 87: 201-6.
Kadar N. The value of bladder filling in the clinical detection of urine loss and selection of patients for urodynamic testing. Br J Obstet Gynaecol 1988; 95: 698-704.
Karram MM, Bhatia NN. The Q-tip Test: standardization of the technique and its interpretation in women with urinary incontinence. Obstet Gynecol. 71(6 Pt
1): 807-811, Jun 1988
Kass, EH. Asymptomatic infections of the urinary tract. Trans Assoc Am Phys 69: 56, 1956.
Kass EH.Bacteriuria and diagnosis of infections of urinary tract. Arch. Intern. Med 100: 709-714, 1957.
Katz IR, Sands LP, Bilker W, DiFillipo S, Boyce A, D'Angelo K. Identification of medications that cause cognitive impairment in older people: the case of oxybutynin chloride. J Am Geriatr Soc 1998; 46: 8-13.
Kegel AH. Progressive resístanse exercise in the functional restoration of the perineal muscles. Am J Obstet Gynecol 56: 238-248, 1948.
Kegel AH. Stress incontinence of urine in women: physiologic treatment. J Int Coll Surg 25: 498-499, 1956.
Kunkle JC, Payne CK, Whitmore KE.. Urinary incontinence: combined biofeedback and electrical stimulation treatment. J Urol Nurs 12: (3): 537-543, 1993.
Larsson G, Victor A. Micturition patterns in a healthy female population, studied with frequency/volume chart. Scand Journal Urol Nephrol suppl 114: 53-57, 1988.
Levels of evidence and grades of recommendation. Oxford. England: Centre for Evidence-Based Medicine. Jan 27, 2004. http:www.cebm.net/levels_of_evidence.asp
Locher JL, Goode PS, Roth DL, Worrell RL, Burgio KL. Reliability Assessment of the Bladder Diary for Urinary Incontinence in Older Women The Journals of Gerontology Series A: Biological Sciences and Medical Sciences 56: M32-M35 (2001).
McDowell JB, Engberg SJ, Rodriguez E, Engberg R, Sereika S. Characteristics of urinary incontinence in homebound older adults. J Am Geriatr Soc 44: 963-968, 1996.
McGuire EJ, Lytton B, Kohom El, Pepe V. The value of urodynamic testing in stress urinary incontinence. J Urol 124: 256-258, 1980.
Meyer S, Schreyer A, DeGrandi P, Hohlfeld P. The effects of birth on urinary continence mechanisms and other pelvic floor characteristics. Obstet Gynecol 92 (4 pt 1): 613-618, Oct 1998.
Miller JL, Bavendam T. Treatment with the Reliance control insert: one-year experience. J Endourol 10: 287-292, 1996.
Milson I, Abrams P, Cardozo L, Roberts RG, Thuroff J, Wein AJ. How widespread are the symptoms of an overactive bladder and how are they managed? A population-based prevalence study. BJU Int 87: 760-766, 2001.
Mitteness LS. Knowledge and beliefs about urinary incontinence in adulthood and old age. J Am Geriatr Soc 38: 374-378, 1990.
Mold, JW. Pharmacotherapy of urinary incontinence. Am Fam Physician 54(2): 673-680, 1996.
Moore T, Schofield PF. Treatment of stress incontinence by maximum perineal electrical stimulation. BMJ 3: 150-151, 1967.
Morkved S, Bo K, Schei B. Pelvic floor muscle training during pregnancy to prevent urinary incontinence: a single-blind randomized controlled trial. Obstet Gynecol 101: 313-319, 2003 .
Morkved S, Bo K, Fjortoft T. Effect of adding biofeedback to pelvic floor muscle training to treta urodynamic stress incontinence. Obstet Gynecol 100: 730-739, 2002.
Nadège Chéry Defects in Aspects of the Aging Urinary System have Severe Consequences Geriatrics & Aging 3 (10) 8-13. Dec 2000.
Newman, DK. What's New: the AHCPR guideline update on urinary incontinence. J Ostomy/Wound Management 42(10): 46-59, 1997.
Noelker L. Incontinence in elderly cared for by family. Gerontologist 27: 194-200,1987.
Nordling J. The aging bladder a significant but underestimated role in the development of lower urinary tract symptoms. Experimental Gerontology 37: 8-9: 991-999, 2002.
Norton PA. Etiology of genuine stress incontinence. In: Brubaker LT, Saclarides TJ, eds. The Female Pelvic Floor: Disorders of Function and Support. Philadelphia: Davis; 153-157, 1996.
O'Donnell PD. Special considerations in elderly individuals with urinary incontinence. Urology 51(Suppl 2A): 20-23, 1998.
Owens RG, Karram MM. Comparative tolerability of drug therapies used to treat incontinence and enuresis. Drug Saf 19: 123-139, 1998.
Ouslander JG. Lower urinary tract disorders in the elderly female. En: Raz S, ed Female Urology. Philadelphia: Saunders Co 308-325, 1996.
Ouslander JG. Management of overactive bladder. N Eng J Med 2004; 350:786-799.Nilvebrant L, Hallen B, Larsson G. Tolterodine: a new bladder selective muscarinic receptor antagonist: preclinical pharmacological and clinical data; Life sciences 60(13/14): 1129-1136, 1997.
Ouslander JG. Management of overactive bladder. N Eng J Med 350: 786-799, 2004.
Ouslander JG. Geriatrics considerations in the diagnosis and management of overactive bladder. Urology 60 (suppl 5A): 50-55, 2002.
Pace B. Urinary incontinence. A common condition with many treatment options. JAMA Dec 16, 280(23): 2054, 1998.
Palmer MH, German PS, Ouslander JG. Risk factors for urinary incontinence one year after nursing home admission. Res Nurs Health 14: 405-412, 1991.
Parmet S. Stress Incontinence JAMA 290(3): 426, Jul 2003.
Peschers U, Schaer G, Anthuber C, et al. Changes in vesical neck mobility following vaginal delivery. Obstet Gynecol. 88: 1001-1006, 1996.
Potenziani B JC. Protocolo de Estudio Urodinamico en mujeres con IOE (incontinencia urinaria de esfuerzo) en el Servicio de Urologia del Hospital Militar de Caracas "Dr Carlos Arvelo". Estudio Prospectivo de 38 pacientes. Presentado en los XX Coloquios Médicos-Militares Junio 1983. Publicado en la Revista de la Sociedad Venezolana de Urología # 1,
2, 3 y 4, 1982
Potenziani B JC, Nuñez J. Cura de Incontinencia Urinaria de Esfuerzo en la Mujer por técnica de Uretrocervicopexia transvaginal suprapubica modificada (UCPS) Trabajo Prospectivo. Presentado en los XXI Coloquios Médico-Militares del Hospital Militar de Caracas "Dr Carlos Arvelo" Junio 1984. Publicado en la Revista de la Sociedad Venezolana de Urologia vol 38 Enero-Diciembre (1,2,3 y 4): 31-44, 1986.
Potenziani B JC. Alternativas No quirúrgicas en el Tratamiento de la Incontinencia Urinaria de Esfuerzo (o anatómica) en la mujer. Publicado en la Revista Venezolana de Urologia Tomo I 46 (1): 7-18, Mayo 2001.
Potenziani B JC, Martínez NC Morfología Cistometrica urinaria en diferentes patologías ginecourologicas. Presentado en los XXII Coloquios Médico-Militares del Hospital Militar "Dr Carlos Arvelo" de Caracas Junio 1985 Publicado en la Revista Salus Militae 11(1 y 2): 53-59 Enero-Diciembre 1986.
Potenziani B JC. Publicación de Urologiaaldia.com 2(1) Abril 2000. Con los siguientes artículos: #1 Vejiga
Hiperactiva. Visión general #3 Caso Clínico: Paciente femenina con perdidas involuntarias de orina.
Potenziani B JC. Valor de la Cistometria Urinaria en el manejo farmacologico de diferentes transtornos uro-dinamicos. Presentado en los XXII Coloquios Médico-Militares del Hospital Militar de Caracas "Dr Carlos Arvelo" Junio 1985 Caracas.
Potenziani B JC. et al. Cura de Incontinencia Urinaria de Esfuerzo por técnica de Raz modificada. Estudio prospectivo de 125 pacientes desde 1984 hasta 1994. Experiencia Personal. Presentado para optar al Premio José María Vargas de la Academia Nacional de Medicina 1994-1995 con video anexo.
Potenziani B JC. et al. Cura de Incontinencia Urinaria de Esfuerzo (IOE) por Técnica de Raz modificada en 125 pacientes. Publicada en la Revista del Centro Médico de Caracas 41(1): 4-13 Mayo 1996.
Potenziani B JC. Publicación de Urologiaaldia.com 3(2) Abril 2001. Con los siguientes artículos: #1 Guía para pacientes con pérdidas involuntarias de orina.
Potenziani B JC. Publicación de Urologiaaldia.com 2(2) Septiembre 2000. Con los siguientes artículos: #1 Tratamiento de la Vejiga Hiperactiva (I parte), #2 ¿Cómo fortalecer los músculos del piso pélvico muscular y mejorar la incontinencia urinaria de esfuerzo (IOE) en pacientes femeninas? #3 Recomendaciones Conductuales en Incontinencia de urgencia e Hiperactividad Vesical, #4 Incontinencia urinaria de esfuerzo en la mujer (IOE) Un Problema mas frecuente de lo que se imaginan, #5 Factores que aumentan el éxito del Tratamiento Quirúrgico en mujeres con incontinencia urinaria de esfuerzo (IOE).
Potenziani B JC. Publicación de Urologiaaldia.com Vol 3#5 Noviembre 2001 Con los siguientes artículos: #2 Diez factores de éxito en el enfoque terapéutico de la incontinencia urinaria de esfuerzo (IOE) en la mujer de cualquier edad (IOE).
Potenziani B JC. Publicación en Urologiaaldia.com la sección "Consultando al Urólogo" conteniendo las siguientes partes: #2 Recomendaciones urológicas femeninas, #6 Cuestionarios de impacto de la incontinencia urinarias sobre la calidad de vida de la mujer, #7 Cuestionario de Incontinencia urinaria, #8 Cuestionario de calidad de vida (QOL) en incontinencia urinaria, #9 Diario vesical, #10 Quiz de incontinencia urinaria, #13 Cuestionario de Calidad de vida (QOL) en pacientes con Hiperactividad vesical (HV) #17 Cuestionario de Cistitis Intersticial (Indice de síntomas), #18 Cuestionario de Cistitis Intersticial (índice de problemas).
Potenziani B JC. Vejiga Hiperadiva 1-372, editorial Ateproca, Caracas 1999.
Potenziani B JC. Publicación de Urologiaaldia.com Vol 2#3 Diciembre 2000. Alteraciones urinarias anatómi-co-funcionales como causas de Hiperactividad vesical (HV) en la vejez.
Potenziani B JC. Publicación de Urologiaaldia.com Vol. 3#3 Julio 2001 Menopausia en Urología.
Potenziani B JC. Publicación de Urologiaaldia.com Vol. 3#4 Septiembre 2001 Enfermedades neurológicas que ocasionan disfundón micdonal (Transtomos Urinarios).
Potenziani B JC . Publicación de Urologiaaldia.com Vol 3#5 Noviembre 2001 Diez fadores de éxito en el enfoque terapéutico de la incontinencia urinaria de esfuerzo (IOE) en la mujer de cualquier edad (IOE).
Potenziani B Julio C. Capitulo Tres de Consenso Nacional de Vejiga Hiperactiva. Tema Diagnóstico de Vejiga Hiperadiva, Diagnostico diferencial, Test de Validación diagnostica para Vejiga Hiperactiva, Modelo de decisión (algoritmo) de Diagnóstico en Vejiga Hiperactiva. Julio 2005 Hotel Tamanaco. Laboratorios Pfizer.
Potenziani B Julio C, Potenziani Pradella Silvia Daniela. Cuestionarios de Validación Diagnostica para diversas patologías urológicas. Revista Centro Médico Vol 50#1 Nov 2005.
Pranikoff K. Clinical management Decisions Ch 54 Incont in older people. In Urinary Incontinence O'Donnell PD. Mosby 1997. pag 395-398.
Raz S, Erickson DR. SEAPI QMM incontinence classification system. Neurourol Urodyn 11: 187-199, 1992.
Resnick NM. Voiding dysfundion in the elderly, in Yalla SV, McGuire EJ, Elbadawi A, Blavais JG (eds): Neurourology and Urodynamics: Principles and Pradise. New York, McMillan Publishing Co: 303-330, 1988.
Resnick NM. Geriatric incontinence. Urol Clin North Am 23(l):55-74, 1996.
Resnick NM, Griffiths DJ. Expanding treatment options for stress urinary incontinence in women. JAMA 16 290(3): 395-397, Jul 2003.
Resnick NM. Initial evaluation of the incontinent patient. J Am Geriatr Soc 38: 311-316, 1990.
Retzky SS, Rogers RM. Urinary incontinence in women. Clin Symp. 47: 2-32, 1995.
Roe B, Williams K, Palmer M. Bladder training for urinary incontinence in adults (Cochrane Review) In Cochrane Library issue, Chichester England John Willey & Sons 2003.
Rovner ES, Wein AJ. The Treatment of overactive bladder in the geriatric patient. Clinical Geriatrics 10(1): 1-12, Jan 2002.
Salmon UJ, Walter RI, Geist SH. The use of estrogen in the treatment of dysuria and incontinence in postmenopausal women. Am J Obstet Gynecol 42:845,1941.
Sand PK, Richardson DR, Stas kin SE. Pelvic floor stimulation in the treatment of genuine stress incontinence: a multicenter placebo-controlled trial. Am J Obstet Gynecol 173: 72-79, 1995
Sandvik H, Hunskaar S, Seim A, et al. Validation of a severity index in female urinary incontinence and its implementation in an epidemiological survey. J Epidemiol Community Health 47: 497-499, 1993.
Sandvik H, Seim A, Vanvik AH, et al. A severity index for epidemiological surveys of female urinary incontinence: comparison with 48 hours pad-weighing tests. Neurourol Urodyn 19: 137-45, 2000.
Sitberg H, Larsson G, Vidor A. Frequency/volume chart: the basic tool for investigating urinary symptoms. Ada Obstet Gynecol Scand Suppll66: 24-27,1997.
Snooks SJ, Badenock DF, Tiptaft RC, Swash M. Perineal nerve damage in genuine stress incontinence: an eledrophysiology study. Br J Urol 57: 422-426, 1985.
Snooks SJ, Swash M, Henry MM, Setchell M. Risk factors in childbirth causing damage to the pelvic floor. Int J Colored Dis. 1: 20-24, 1986.
Smith ARB, Hosker GL, Warrell DW. The role of pudendal nerve damage in the aetiology of genuine stress incontinence in women. Br J Obstet Gynecol. 96: 29-32, 1989.
Skelly J, Flint AJ: Urinary Incontinence associated with dementia. J Amercan Geriatrics Society 43: 286, 1995.
Specht J, Lyons S, Maas M. Patterns and treatments of urinary incontinence on special care units. Journal of Gerontological Nursing May 28(5): 13-21, 2002.
Stas kin DR, Wein AJ. New Perspectives on the overactive bladder. Urology 60 (suppl 5A), Nov 2002.
Stothers L. The reliability, validity, and gender differences in the SEAPI-QMM Quality of Life Score for urinary incontinence. Neurol Urodynamics,
2002.
Strasser H, Tiefenthaler M, Steinlechner M, Bartsch G, Konwalinka G. Urinary incontinence in the eldery and age-dependent apoptosis of rhabdosphincter cells. Lancet 354: 918-919, 1999.
Strasser H, Tiefenthaler M, Steinlechner M, Eder I, Bartsch G, Konwalinka G. Age dependent apoptosis and loss of rhabdosphincter cells. J Urol 164:1781-1785, 2000.
Subak LL, Quesenberry, Jr CP, Posner SF, Catolica E, Soghikian K.The Effect of Behavioral Therapy on Urinary Incontinence: A Randomized Controlled Trial. Obstetrics & Gynecology 2002; 100: 72-78.
Theofrastous JP, Giman JF, Bump RC, McClish DK, Elser DM, Bland DR, Fantl JA and The Continence Program for women research group. Effects of pelvic floor muscle training on strength and predictors of response in the treatment of urinary incontinence. Neurourol Urodynam 21: 486-490,2002.
Thomas TM, Plymat KR, Blannin J, Meade TW. Prevalence of urinary incontinence. BMJ 1980; 281:1243-1245.
Thom D. Variation in stimates of urinary incontinence prevalence in the community effects of differences in definition, population characteristics and study type. J Am Geriat Soc 46: 473-480, 1998.
Uebersax, J.S., Wyman, J. F., Shumaker, S. A., McClish, D. K., Fantl, J. A., & the Continence Program for Women Research Group. (1995). Neurourology and Urodynamics, 14, 131-139.Short forms to assess life quality and symptom distress for urinary incontinence in women: The incontinence impact questionnaire and the urogenital distress inventory.
Vettera PH, von Pritzbuera J, Jungmanna K, Kroppb P, Kollerc O. The Validity of the ICD-10 Classification of Recurrent Affective Disorders: Do Endogenous and Psychogenic Depressions Form a Homogeneous Diagnostic Group? Psychopathology 34: 36-42, 2001.
Wagner TH, DL Patrick, Bavendam TG, Martin ML, Bueshing DP. Quality of life of persons with urinary incontinence development of a new measure. Urology 47: 67-72, 1996.
Wallace K: Female pelvic floor functions dysfunctions and behavioral approaches to treatment. Clinics in Sports Med. 13(2): 459-480, 1994.
Wang AC, Wang YY, Chen MC. Single-Blind, randomized trial of pelvic floor muscle training, biofeed-back-assisted pelvic floor training, and electrical stimulation in the management of overactive baldder. Urology 63(1): 61-66, 2004,
Wein AJ. Neuromuscular dysfunction of the lower urinary tract, in Walsh PC, Retik AB, Stamey TA, Vaughan ED Jr. (eds): Campbell's Urology 6th Edition. Philadelphia, PA, W.B. Saunders Co, 1992; 573-642.
Wein AJ, Longhurst PA, Levin RM. Pharmacologic treatment of voiding dysfunction. En: Mundy AR, Stephenson TP.
Wein AJ, editores. Urodynamic principles, practice and application. 2a ed. New York: Churchill Livingstone; 1984, p. 43-70.
Wein AJ. Pathophysiology and categorization of voiding dysfunction. En: Walsh PC, Retik AB, Vaughan ED Jr, Wein AJ, editores. Capbell's Urology (8th ed). Philadelphia, London: WB Saunders Co: 917-926, 1998.
Weiss BD. Nonpharmacologic treatment of urinary incontinence. Am Fam Physician 44: 579-586, 1991.
Weiss BD. Diagnostic Evaluation of Urinary Incontinence in Geriatric Patients . American Family Physician June 1998 University of Texas Health Science Center at San Antonio, Texas.
Wells TJ, Brink CA, Diokno AC. Pelvic muscle exercise for stress urinary incontinence in elderly women J Am Geriatr Soc 39: 785-791, 1991.
Wilson PD, Bo K, Hay-Smith J. Conservative treatment in women. In: Abrams P, Cardozo L, Khoury S, Wein A eds. Incontinence Plymouth UK; Health Publication Ltd 573-624, 2002.
Wilson L, Brown JS, Shin GP, et al. Annual direct costs of urinary incontinence. Obstet Gynecol 98(3): 398-406,2001.
Wilson PD, Herbison RM, Herbison GP. Obstetric practice and the prevalence of urinary incontinence three months after delivery. Br J Obstet Gynaecol 1996; 103: 154-61.
Wyman JF, Harkins SW, Fantl JA. Psychosocial impact of urinary incontinence in the community-dwelling population. J Am Geriatr Soc 38: 282-288, 1990.
Wyman JF, Colling J, O'Donnell PD. Incontinence Assensment Ch 55. In Urinary Incontinence O'Donnell PD. Mosby: 399-405, 1997.
Yamanishi T, Yasuda K, Sakakibara R, Hattori T, Ito H, Marakami S. Pelvic floor electrical stimulation in the treatment of stress incontinence: an investigational study and a placebo controlled double-blind trial. J Urol 158: 2127-2131, 1997.
Zimmerm PE, Lin VK, McConnell JD. Smooth-muscle physiology. Urol Clin North Am 23(2): 211-219, 1996.
Dr. Luis Gonzalo Gómez t * Patólogo
Servicio de Anatomía Patológica Hospital Privado Centro Médico de Caracas
GERENCIA EN SALUD
Desde el punto de vista gerendal, los sistemas de salud son de los más complejos. La complejidad comienza con la definición de salud ya que, de acuerdo a la Organización Mundial de Salud, comprende el bienestar del ser humano, por tanto implica, no solo las condiciones físicas y psíquicas propiamente dichas sino, todo lo relativo al medio ambiente y todo aquello que afecta directa e indirectamente la estabilidad física y mental del hombre.
Tal como está conceptualizado, el sistema de salud abarca desde las políticas gubernamentales hasta las políticas individuales. El ejercicio de la medicina es solo una parte del sistema y, lamentablemente, cuando se habla de gerencia de salud la mayor parte se refiere a los servicios médicos propiamente dichos.
Como principio fundamental, debemos entender que los servicios de salud por su naturaleza deben ser sometidos a la regulación y control del Estado, sin que esto signifique, que deben ser administrados por el Estado. Se trate de Instituciones públicas o privadas deben seguir los lineamientos de las políticas de Estado, supervisadas y controladas por una normativa establecidas por un ente regulador.
Debemos entender que los servicios médicos por si solos ya son bastante complejos y abarcan desde la medicina preventiva hasta los servicios diagnósticos y terapéuticos. Es en los aspectos preventivos que tienen mayor importancia las políticas ambientales y sociales implementadas por los gobiernos o los gerentes de los entes sociales.
Adicionalmente y, para hacerlo más complejo, existen varios actores que influyen en los sistemas de salud. Cada uno de estos actores representa diversos intereses particulares o propios que obliga a mantener un equilibrio entre ellos de manera tal que se logre un objetivo o fin común, satisfaciendo a su vez, las metas u objetivos particulares.
El objetivo fundamental de cualquier sistema de salud debe estar centrado en el logro del bienestar del ser humano eje central del sistema y objetivo común.
Al analizar un sistema de salud debemos tomar en consideración un principio básico del cual depende el resultado de dicho análisis. La primera consideración a tomar en cuenta es la característica del sistema, Público o Privado. El primero tiene un objetivo que pudiese llamarse simplemente "social" y su meta fundamental es la de preservar el bienestar de la sociedad y sus miembros, los resultados "económicos" aunque importantes, pasan a un segundo plano. Los sistemas privados aunque deben fundamentarse en el mismo fin, no pueden dejar de lado, por razones de sobrevivencia del propio sistema, los aspectos económicos en los cuáles se sustenta. Esta diferencia fundamental se puede resumir en que en los sistemas públicos el Estado es el responsable del costo de mantenimiento del sistema y, por ende, los resultados se miden por el bienestar de la sociedad más que por la rentabilidad. Los sistemas privados, en sus diversas escalas, deben lograr el bienestar pero manteniendo una rentabilidad razonable que permita la subsistencia de dicho sistema.
Todo sistema, sea público o privado, debe ser eficaz en cuanto a resultados y eficiente en cuanto al uso de recursos.
A pesar de la complejidad de los sistemas por la presencia de diversos actores se debe buscar la suma de esfuerzos con el fin de lograr equilibrio que permita la obtención de los objetivos individuales sin menoscabar el objetivo común.
Para un buen funcionamiento del sistema tenemos que considerar los diversos actores:
• Institución de Salud (Proveedores).
• Profesionales.
• Institución contratante de servicios (Pagadores).
• Institución comercial (Suplidores de material, medicinas y equipos).
• Usuarios (Pacientes).
Las Instituciones de Salud tienen como objetivo la implementadón de los servicios de salud, su mantenimiento y su actualización tecnológica.
Los profesionales, de diversa índole y preparación, tienen un objetivo múltiple, el ejerddo de su profesión en condiciones adecuadas para dar un servicio óptimo, su actualización profesional y su sustento personal.
Las institudones contratantes induye aseguradoras, servicios de mediana "prepagada", e instituciones que pagan por los servicios de sus empleados o afiliados. Su objetivo es la adquisición de servidos de salud al menor costo posible para poder ofrecérselos como un beneficio laboral o en contraprestación a un pago realizado por el afiliado.
Las instituciones comerdales son aquellas que suministran equipos, material médico quirúrgico y medicamentos, tienen como objetivo fundamental su benefido económico ya que esa es la razón fundamental de su existenda. Constituyen un elemento importante en la estructura de costos ya que la utilización de equipos, los materiales médicos quirúrgicos y las medicinas tienen un peso muy relevante especialmente en los estudios diagnósticos y en los procedimientos terapéuticos.
Los usuarios constituyen el ador prindpal del sistema ya que es el centro alrededor del cual los otros actúan. Es el prindpal "insumo", ya que es el receptor del servicio, sea preventivo, curativo o paliativo. Sobre él recae la acción del sistema y es el que, a fin de cuentas, corre con las consecuendas de los servicios demandados. Si el usuario no cuenta con una institudón que lo respalde se convierte en el responsable diredo de los servicios redbidos. El término adecuado debe ser usuario y no padente ya que no esta conformado exdusivamente por enfermos sino por personas en general que son receptores de servicios preventivos.
Así tenemos que, para establecer cualquier sistema de salud, es necesaria una Institudón con unos profesionales que a través de equipos e insumos presten el servicio a la población y que algún ente cancele por los servicios prestados.
El sistema puede ser considerado el de las tres "P" (Padente, Proveedor y Pagador), dejando daro que a veces representa sólo dos "P" ya que el paciente puede ser a su vez el pagador. El proveedor incluye tanto la Institución como los profesionales en su ejercido y, a la vez, salvo excepciones, es el agente que se relaciona con las empresas de suministros y equipos.
Visto la complejidad de los sistemas de salud podemos entender por qué durante la historia se han establecidos numerosos esquemas para mantener los sistemas que abarcan desde un esquema totalmente responsabilidad del Estado hasta sistemas mixtos e incluso casi totalmente privados. En cada uno de ellos el problema fundamental recae en el costo de los servicios que, aunque sea totalmente asumido por el Estado el costo es muy alto. Durante la evolución de la sodedad han apareado y desapareado muchos esquemas con la intención de lograr un bienestar social adecuado a un costo "razonable". El primer indicio de un sistema de gerenda en salud se remonta a la época del Rey Hamurabi de Babilonia el cual estableció, en su famoso código presentado hace aproximadamente 4.000 años (año 1.700 AC), un sistema regulatorio que incluía los servicios médicos. En dicho código se establederon tarifas por procedimientos que variaban de acuerdo a la clase sodal, obligación de pago por parte de los amos de los esdavos, colecdón de datos, medidas para controlar la calidad de acuerdo a resultados. Los médicos eran bien remunerados pero cuando fallaban se aplicaban sanciones considerables. No se cobraba por los medicamentos.
El elevado costo de la mediana es universal y es plausible que se busquen mecanismos para tratar de racionalizar dichos costos. La industria médica en su amplio concepto es muy compleja constituyendo la más numerosa cuando se induye en ella todos sus componentes, profesionales, hospitales, ambulatorios, manufactureras de equipos, industria de insumos de laboratorio, industria farmacéutica, etc.
En el ejerdcio de la medicina, cualquiera sea su nivel, influyen una serie de variables muy difíciles de estandarizar y controlar especialmente en la llamada medidna curativa, es por ello que, la dave fundamental para el éxito, estriba en el establedmiento de eficientes políticas de prevendón ya que en ella influyen el menor número de variables. Estas políticas, en su mayor parte, debe ser estableada por los estados e incluso hay normativas universales dictadas por organismos multinadonales que no sólo las recomiendan sino que tienen instrumentos para ayudar en su implementadón y seguimiento.
En relación a la administradón directa de los servicios de salud, ya sea por entes públicos o privados, se conjugan una serie de pautas o mecanismos que son similares al resto de la industria y cuyo manejo es fundamental para el logro de los objetivos fundamentales con el uso efidente de los recursos. Para esto es indispensable una buena gerencia que abarque tanto la disponibilidad de los servicios a los pacientes como la calidad de dichos servicios.
Por una parte tenemos al actor prindpal, el cual debe solidtar los servicios y disponer de ellos adecuadamente para lograr su objetivo de bienestar. Las institudones de salud y los profesionales deben contar con los equipos y suministros adecuados, a la vez, los profesionales deben mantener un nivel de aduali-zación tal que puedan aplicar las mejores herramientas para lograr el objetivo en el menor tiempo posible y con unos resultados que permitan la incorporación total del padente.
En el ejercido de la profesión médica, induyendo, no solo los profesionales médicos sino también todos aquellos profesionales afines, se observa una característica que influye tanto en la aduadón como en el resultado. Es así como vemos que para el mismo tipo de patología pueden existir varias pautas de tratamiento y va a depender de la disponibilidad de recursos, el conocimiento de los profesionales y la actitud de los pacientes el que se escoja el tratamiento más adecuado. De ahí el famoso dicho que "no existen enfermedades sino enfermos" lo cual se traduce en que lo que debe tratarse es al padente y no una enfermedad determinada. Una misma enfermedad puede produdr efectos diversos dependiendo de otras condidones del padente y su tratamiento puede variar de acuerdo a la persona enferma o, induso, su entorno.
Es por ello que la gerenda de los servicios de salud comprende dos grandes áreas la Gerencia Médica y la Gerencia Administrativa las cuales, aunque con tareas distintas, deben estar coordinadas porque hay mucha interreladón entre ellas. Todos aquellos aspedos reladonados con el servicio médico propiamente dicho, en espedal los servicios profesionales y de apoyo al paciente corresponden a la Gerencia Médica y el resto de los servicios administrativos a la Gerenda Administrativa. El uso de los recursos no puede depender exclusivamente de la Gerencia Médica ya que la disponibilidad tanto de equipos como suministros depende de la Gerencia Administrativa. De la misma manera, hay servidos médicos cuya aplicación es necesaria e independiente de los recursos administrativos por lo cual su uso depende menos de las dedsiones administrativas propiamente dichas.
Por lo antes expuesto las empresas dedicadas a los servidos de salud deben tener una estrudura organi-zadonal de tipo "matridal" en la cual la mayor parte de las dependencias tienen dos líneas de supervisión, la administrativa y la médica, simultáneamente, que trabajen coordinadamente de manera tal que eviten conflidos y mantengan un fundonamiento adecuado.
La gerenda médica tiene la responsabilidad de establecer, supervisar y controlar los servidos médicos y, por consiguiente, la coordinación entre todos los profesionales de la medicina y afines así como de los servicios de apoyo diagnóstico y terapéutico. Debe establecer las normas de fundonamiento y, lo más importante el control de calidad. Cómo función primordial está la responsabilidad de garantizar el adecuado servicio a los pacientes para lo cual tiene a su cargo la supervisión de los actos médicos como tales incluyendo la acdón del profesional médico y todos los servicios auxiliares. Debe ser vigilante de que se cumplan todas las normas médicas umversalmente aceptadas y dentro de los más elementales prindpios éticos.
Dentro de las áreas administrativas la gerencia de "costos" es fundamental ya que con el encarecimiento de los servicios de salud, los "costos" se han convertido en el eje fundamental de muchas de las decisiones y de la reladón entre instituciones proveedoras e institudones pagadoras.
En los últimos años han aparecido cada vez más institudones que tratan de controlar los costos de los servidos de salud e incluso, algunas de ellas, han llegado al extremo de limitar los servicios de salud basados en costos sin importarles el deterioro de la calidad de los servicios. Esto se ha hecho más evidente con las llamadas compañías de servicios médicos prepagados. Cada vez hay más compañías de seguro de riesgo que tratan de emularlas y limitan el acceso a determinados servicios basados exclusivamente en costos. Por otra parte estas instituciones "pagadoras" tratan de desviar a sus afiliados a servicios o profesionales más económicos restándole importancia a la calidad de los servicios y la experiencia de los profesionales.
Lamentablemente, muchas de las compañías administradoras tratan de reducir el gasto en salud a través de mecanismos de presión para disminuir los honorarios profesionales cuando, desde el punto de vista estrictamente del paciente, es lo más importante ya que se convierte en el "director" del equipo profesional y asume la responsabilidad del caso. Aquellos elementos como la relación médico paciente, la experiencia y más aún, la propia decisión del "asegurado" pasan a segundo plano. Existen muchos otros componentes en la estructura de costo de la salud que pueden ser objeto de revisión, número de procedimientos a realizar, exámenes complementarios, laboratorio, etc. No es aceptable que la decisión de los procesos a realizar sea determinada por las compañías administradoras y no por el médico que tiene la responsabilidad directa ante el paciente.
El cambio que se ha presentado mundialmente para tratar de controlar los costos de los sistemas de salud ha ocasionado un cambio en el ejercicio profesional. La presión por parte de las compañías pagadoras o contratantes de servicios para disminuir los costos ha producido una modificación del funcionamiento tradicional.
Los diversos entes involucrados en los servicios de salud deben tomar en consideración todas las variables existentes y entender que cada uno de ellos es parte importante para la preservación del sistema. No es posible la preservación del sistema con el fracaso de alguno de sus actores. Es por ello que si no se comprende las necesidades de cada uno y se aplica la "Ley del más Vivo", indefectiblemente se conduce al fracaso del sistema medido por la disminución de la calidad de los servicios y, en consecuencia, del bienestar del individuo y la sociedad en su conjunto.
Lamentablemente, muchas de las llamadas "Administradoras de Fondos de Salud" tienen objetivos que crean conflicto de intereses. Como cualquier otra actividad económica, estas administradoras están obligadas a responder a sus accionistas o dueños de manera rentable, lo cual puede ser contradictorio con el objetivo de la búsqueda del bienestar de los afiliados. A mayor número de siniestros mayores serán los costos y, por ende, peores los resultados económicos. Por esta razón su enfoque está orientado no sólo al control de los gastos médicos sino a evitar el uso de los servicios por parte de sus afiliados. En numerosas ocasiones, cada vez más frecuente, los parámetros para determinar los estudios o procedimientos médicos a efectuar son decididos por los administradores que pagan y no por los médicos responsables directos de la salud del paciente. Con frecuencia las administradoras no autorizan la realización de algún procedimiento basado en razones estrictamente de costo o dirigen a sus afiliados a otras instituciones de menor alcance tecnológico para disminuir costos.
Muchas de estas administradoras se han convertido en la pesadilla de los pacientes ya que, cuando éstos requieren los servicios médicos, le presentan trabas para lograrlo. Se concentran en el solo criterio de "evitar" la entrada del usuario al sistema y, de esa manera, disminuir sus costos. Incluso algunas han llegado a utilizar médicos como "porteros" con esa finalidad ocasionando un daño al usuario al impedir que utilice los servicios. Otras, menos escrupulosas, dejan la responsabilidad de autorizar el uso de los servicios a administradores con entrenamiento superficial basado en parámetros preestablecidos por "diagnósticos" o "enfermedades", incurriendo en desconocimiento del principio que "no existen enfermedades sino enfermos".
Las compañías se defienden diciendo que ellos no rechazan tratamientos, ellos sólo rechazan el pago. Si, por rechazo de las compañías administradoras, algo sale mal, se trata de responsabilizar al proveedor de los servicios, institución médica o profesionales, y los pacientes quedan desamparados.
En ocasiones se ha intentado utilizar el sistema de capitación, para mí el más nefasto, (paga al médico un monto fijo por cada suscriptor use o no use sus servicios), ya que transforma a los médicos en adversarios de los pacientes, hace a los pacientes más vulnerables, pone al médico en una situación de conflicto ya que tiene que decidir entre los intereses del paciente y los de la compañía que lo contrata, "el médico no puede ser fiduciario del paciente y las compañías al mismo tiempo", desestimula al médico a mantenerse actualizado, ya que, en general, no diferencia entre diversos grados de experiencia.
Cualquiera de estos sistemas, por razones económicas entendibles, intenta funcionar por volumen y disminución de costos. Es por ello que tratan de hacer convenios con médicos basados en el principio de "economía de escala" pagándoles menores remuneraciones, pagan menos por caso porque los médicos que se afilien a ellos tendrán más pacientes. Este razonamiento equipara al acto médico al de una manufacturera en la cual el costo fijo es alto y, por consiguiente, se puede obtener mejores beneficios con volumen. El ejercicio médico y, específicamente el acto médico, no es una mercancía que puede tratarse de igual manera. El profesional de la medicina llega a un nivel de desarrollo luego de muchos años de estudio y su elemento principal para el logro del bienestar del paciente se basa en su experiencia, habilidad y conocimiento por lo cual, la estructura de costo de un acto médico tiene un componente muy alto de gasto variable que está constituido por la actuación del profesional propiamente dicha y por consiguiente el mayor volumen de pacientes trae consigo mayor trabajo profesional y mayor costo. Si un cirujano pudiese operar simultáneamente a dos o más pacientes se pudiese aplicar este criterio pero, sabemos que esa no es la realidad.
Nadie puede dudar que el sistema liberal que hasta ahora hemos tenido necesite cambios. Uno de los cambios fundamentales debe realizarse por los profesionales mismos. Con sus excepciones, el ejercicio de la medicina ha sido independiente, aislado, sin conciencia de los costos y sin preocupación por parte de los profesionales por establecer sistemas eficientes para prestar sus servicios de manera tal de lograr una disminución de los costos para los pacientes y al mismo tiempo una buena remuneración para el profesional. Al mismo tiempo debe realizarse mayor énfasis en la atención primaria y la prevención de enfermedades lo cual a largo plazo produciría ahorro al disminuir los costos de medicina curativa. La aparición de las compañías administradoras debe colaborar en este aspecto al fomentar la prevención y lograr una mejoría sustancial en la utilización de los recursos médicos.
No queda la menor duda que los cambios son necesarios pero si no se logra un entendimiento claro de todo el sistema y se establece como objetivo fundamental el bienestar del paciente, a la larga cualquier fórmula tenderá al fracaso. La ganancia de las compañías, que bien pueden merecérselas, no debe basarse en un detrimento de la calidad de los servicios médicos a costa de deteriorar la función del médico y determinar cuales son los procedimientos que deben realizarse en un momento dado.
La razón por la cual las compañías pagadoras han llegado a extremos muchas veces inaceptables no se limita al interés de ganancia por parte de ellas. Esta bien establecido que en el ejercicio de la medicina el profesional no puede poner en riesgo la salud del paciente por razones de "costo" y es perfectamente justificable que trate de hacer e indicar lo que considere más apropiado para su paciente sin escatimar en los costos. Esto ha traído como consecuencia un intento de condentizar al profesional no con la intención de limitar el tratamiento pero sí en la búsqueda de opdones menos costosas o evitar estudios o indicaciones redundantes que acarrean más costos sin un beneficio real para el paciente. Por una parte el avance tecnológico puede incrementar costos sin embargo, en muchas ocasiones dicho avance ha pro-duddo resultados en menos tiempo que permite la recuperación más rápida con la consecuente incorporación del padente a sus labores en menor tiempo lo que se refleja en un logro más eficiente del bienestar. Estas consideraciones a veces no son tomadas en cuenta por las compañías pagadoras que, por tratar de disminuir los costos de un evento particular, sacrifican el bienestar del padente.
Igual sucede en muchas oportunidades con los estudios de alta tecnología que, aunque costosos, producen un mejor resultado diagnóstico o terapéutico. A manera de ejemplo, podemos ver el significado de los procedimientos laparoscópicos, en muchas oportunidades es más costoso el procedimiento en sí, pero los resultados medidos en tiempo de recuperación han demostrado ser más eficientes y por ello, menos costosos en general.
No deja de ser cierto, que se han produddo muchos casos de intervención inadecuada o rea-lizadón de estudios superfluos que han encareddo los costos innecesariamente y es una de las razones por las cuales las compañías responsables de la cancelación de dichos costos justifican el establedmiento de medidas de control y restricdones al acceso de los servidos sin embargo, esta no es la soludón sensata ya que en vez de obtener un mejor resultado para sus dependientes, produce un rechazo tanto por parte de ellos como de los profesionales de la salud.
El deterioro de la calidad de los servicios y la presión sobre el gremio médico ha traído como consecuencia un creciente número de casos de reclamo tanto por pacientes como por instituciones e incluso formación de asociaciones en defensa del ejercicio profesional, llegando a observarse intentos de sindi-calizar la profesión. Es importante observar como instituciones académicas han establecido una estrategia de adquisiciones de centros ambulatorios y formación de una administradora propia (sin fines de lucro), que permita obtener una buena calidad de servicios médicos y mantener el nivel académico imprescindible para sostener el avance de la medicina.
La auditoria médica bien entendida es un instrumento adecuado para lograr un uso razonable de los recursos. Para ello hay pautas establecidas bien conocidas que permite evitar los abusos y lograr un sistema confiable para todas las partes. Obviamente que estos sistemas deben ser establecidos de común acuerdo entre los profesionales con miras a lograr un sistema más transparente, con costos razonables y, lo más importante, sin afectar al principal elemento del sistema que es el paciente.
"Lo primordial debe ser el bienestar de los pacientes ".
"El médico debe defender al paciente ante las compañías administradoras con miras a lograr, de acuerdo a su juicio, el mejor tratamiento ".
"Las conductas médicas deben ser establecidas y revisadas con regularidad”.
Definitivamente el sistema tiene tres P y no es sino con el trabajo en conjunto Proveedores, Pacientes y Pagadores que lograremos tener un sistema de salud que efectivamente funcione y puedan cubrir y prestar servicios a toda la población tal como se exigía en Babilonia. Es necesario establecer estrategias entre los gremios y las instituciones con miras a lograr que los nuevos esquemas funcionen de manera adecuada para cada una de las P.
"Usaré tratamientos para asistir al enfermo de acuerdo a mí habilidad y juicio e intentaré excluir activamente aquellos tratamientos considerados dañinos, injustos o erróneos”.
Hipócrates
Dr. René Sotelo * Urólogo Dr. Salvador J. Rocafidl G. * Urólogo
Instituto Clínico La Floresta, Caracas
PROSTATECTOMÍA RADICAL LAPAROSCÓPICA
El objetivo primario en el tratamiento del Cáncer de Próstata confinado, es la su resección total, por lo que la Prostatectomía Radical juega un papel fundamental en su manejo, y por esa razón ha sufrido importantes avances técnicos y tecnológicos, en aras de una mayor tasa de curación, una menor morbilidad y una menor pérdida hemática trans-operatoria, así como en una mayor conservación de la continencia y de la potencia postoperatorias. De manera que se inició el desarrollo de las técnicas endoscópicas en la realización de prostatectomías radicales, siendo Schuessler y colaboradores en 1992, quienes efectuaron la primera prostatectomía radical laparoscópica1 llevando a cabo 9 procedimientos de este tipo entre Septiembre de 1991 y Mayo de 1995,2 concluyendo en esa oportunidad que dicho procedimiento no ofrecía ventajas sobre las técnicas abiertas, debido más que todo al excesivo tiempo quirúrgico.3
Gran parte del crédito en el resurgimiento de las técnicas laparoscópicas en Urología después de la experiencia de Schuessler, lo tiene el equipo conformado por los doctores franceses Guillonneau y Vallancien del Instituto Montsouris de París, quienes redefinieron y convalidaron el uso de la laparoscopia en la prostatectomía radical, publicando en 1998 una serie de 40 Prostatectomías Radicales Laparoscópicas transperitoneales con asistencia de robots en un período de 8 meses, reduciendo su uso (en los últimos 4 años) a una practica de rutina,4 realizando en el año 2000 un trabajo con 120 pacientes tratados con esta técnica.5 Después de esa experiencia varios grupos europeos entre ellos el del Dr. Clément-Claude Abbou del Hospital Henri Mondor en el año 2000, con una serie de 43 pacientes, confirmaron la factibilidad y eficacia de la Prostatectomía Radical Laparoscópica en términos de status funcional postoperatorio y resultados oncológicos tempranos.6 Otro grupo en la Cleveland Clinic, ha estado desarrollando una técnica laparoscópica muy parecida a la técnica retropúbica abierta retrógrada de Walsh,7 con la cual ya han realizado más de 100 casos.3
Con la incorporación de procedimientos oncológicos que irían desde la Nefrectomía radical,
Nefroureterectomía radical, Prostatectomía radical y las Cistectomías radicales y con la posible incorporación de Adenomectomías prostáticas, se amplían en forma importante la utilidad de la laparoscopia y Lumboscopia en urología y esto explica el resurgimiento que ha tenido en los últimos años.
A continuación se describe la técnica utilizada por la Sección de Cirugía Urológica Mínimamente Invasiva del Instituto Médico La Floresta, en Caracas, Venezuela, la cual fue desarrollada por el Dr. Inderbir Gill en Cleveland Clinic Foundation. En la misma se describe un abordaje trans-peritoneal en el cual se cumplen ciertas condiciones de preparación preoperatorio, tales como:
1) Dos botellas de Citrato de Magnesio vía oral la tarde previa a la cirugía.
2) Antibioticoterapia profiláctica endovenosa trans-operatoria.
3) Administración de heparina de bajo peso molecular (2.500 Uds.) endovenosa en el preoperatorio inmediato.
4) Colocación de medias de compresión anti-embólicas antes de iniciar la operación.
El paciente es colocado en posición de litotomía modificada con los miembros inferiores en abducción y los brazos en aducción en 30° de Trendelenburg que permita la retracción de los intestinos hacia arriba y fuera del campo de la operación, en una mesa quirúrgica especial que permita la separación de las piernas y la exposición del periné, creando un espacio donde se ubicará el monitor.3 (Ver Figura 1).
Se coloca la aguja de Veress en el ombligo guardando todas las precauciones conocidas para prevenir lesiones viscerales e insuflando hasta obtener una presión media intra-abdominal de 20 mm Hg,
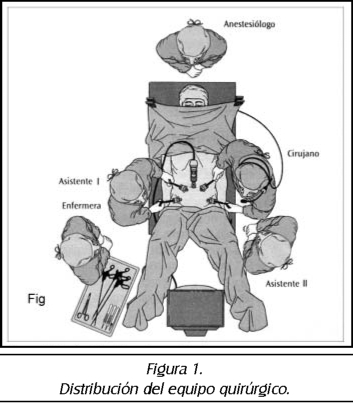
al inicio, a partir de lo cual se coloca el primer puerto a través de esta primera entrada umbilical, previa ampliación de la punción de la aguja de Veress que permita la entrada del trocar de 10 mm por donde se introducirá la óptica de 0o conectada a la cámara. Luego se colocan los restantes 4 puertos o trocares tal como se muestra en la figura 2. Siguiendo dos líneas oblicuas cuyo vértice es el ombligo y sus aristas las espinas ilíacas ántero-superiores, colocando el primero de 10 mm en el ombligo por donde se introducirá la cámara, y luego se vacía la vejiga con un catéter de Foley. Una vez introducidos todos los trocares se desciende la presión intra-abdominal a 15 mm Hg. que se mantendrá hasta el final de la intervención.
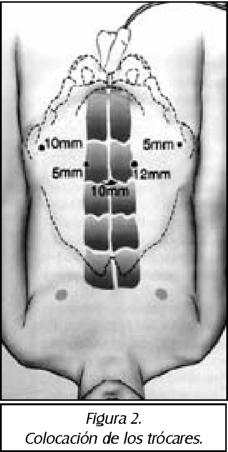
A continuación describiremos los pasos que constituyen esta técnica:
1) Descenso de la Vejiga
Se distiende la vejiga con 300 cc de solución salina a través del Foley, identificando fácilmente sus contornos, esto permite ir progresivamente levantando el peritoneo produciéndose la imagen esférica intra-abdominal que constituye la vejiga, (el límite de la vejiga no es donde aparece la línea que bordea el globo vesical ya que el músculo de la vejiga se proyecta unos centímetros por fuera de esta línea sobre todo en la parte medial, por lo que la disección debe alejarse 2-3 cm en toda la circunferencia de la vejiga) y se incide el peritoneo parietal con gancho en "L" invertida de Hook conectado a electro-cauterio o con bisturí armónico, empezando lateralmente al uraco y hasta tener la vejiga completamente despegada, la cual quedará solamente pendiendo del uraco, el cual se secciona finalmente terminando de caer la vejiga. El tejido graso areolar que rodea dicho peritoneo, es fácilmente disecado, haciendo que la vejiga caiga posteriormente, teniendo cuidado en no incidir muy cerca de la vejiga (sobretodo a nivel de la línea media) ya que ello puede generar una cortina de peritoneo que impediría la correcta visualización endo-scopia del espacio de Retzius, por lo que se debe incidirse lo más cercano posible a la cicatriz umbilical. Después se vacía la vejiga. Es importante utilizar un retractor endoscópico que permita mantener los intestinos cefálicamente. Figura 3.
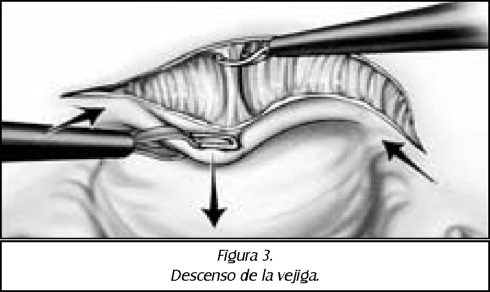
2) Disección del Espacio de Retzius y de la fascia endopélvica
Se diseca el espacio retropúbico de Retzius llegando hasta el complejo dorsal superficial prostático en sentido anterior, y hasta las fascias endo-pélvicas, lateralmente, lo cual se puede realizar con una endo-torunda o con bisturí armónico.
Se coagulan las venas prostáticas dorsales superficiales y la grasa sobre la fascia de Zuckerkandl que cubre la próstata se puede disecar o mover a un lado. Las fascias endo-pélvicas son entonces cortadas exponiendo los músculos elevadores del ano, pudiendo verse en este paso las bandeletas vásculo-nerviosas y
los nervios de continencia descritos por Steiner.8 Se puede seguir usando endo-torunda para separar el ápex de las fibras del elevador del ano. Figura 4.

3) Ligadura Complejo Venoso Dorsal
La disección distal del ápex prostático es minimizada para preservar mejor esta zona esfinteriana, ricamente inervada. En este momento se inciden los ligamentos pubo-prostáticos y el complejo venoso dorsal es ligado con una sutura 2-0 reabsorbible tipo Vicryl con aguja curva CT-1, de un lado a otro sobre la superficie anterior de la próstata, colocando una lazada distal, primero y otra de control proximal después, anudándose cada una por separado, según técnica de nudos intra-corpórea, pudiendo realizar las lazadas de forma simple o en polea.
En un intento para mejorar la continencia, se puede ligar el complejo venoso dorsal asegurándolo a los ligamentos pubo-prostáticos alcanzando una uretropexia retropúbica temporal. La transección del complejo venoso dorsal puede ser hecha más tarde.3 Figura 5.

Para identificar el cuello de la vejiga, el tejido graso anterior prevesical móvil se retrae superiormente quedando el tejido graso prevesical fijo y la superficie anterior de la cápsula prostática desnuda de tejido graso, lo que permite identificar plenamente el cuello vesical. Esto, en conjunto con la tracción zenital de la sutura de la ligadura del complejo proximal y con el "tacto" realizado con pinza endoscopia, permite ver una delineation leve del plano prostato-vesical Como en cirugía abierta, este plano se desarrolla mas con disecciones cortantes y romas, y finalmente se incide a nivel de la pared anterior del cuello vesical realizando un corte perpendicular a la pared anterior de la vejiga realizando finalmente una transección de ambas paredes del cuello vesical a todo lo ancho del mismo llegando hasta los conductos deferentes y vesículas seminales, teniendo cuidado de no lesionar los uréteres. Figura 6.
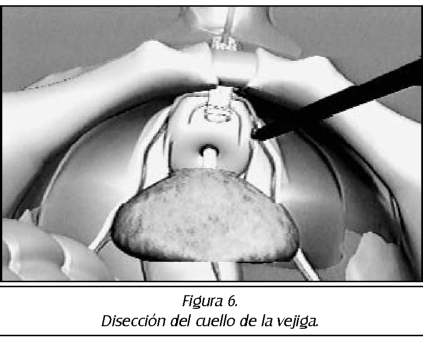
5) Liberación del conducto deferente, vesículas seminales y fascia de Denonvillier
Una vez seccionada la pared posterior del cuello se llega a los conductos deferentes y a las vesículas seminales, y la fascia de Denonvillier. Se disecan los deferentes con una pinza de Allys endoscopia, se clampean con ligaclips, distal y proximalmente y se cortan, pasando posteriormente a disecar las vesículas, las cuales son liberadas de sus conexiones a la vasculatura. Con los conductos deferentes transecta-dos y las vesículas seminales liberadas y retraídas anteriormente, la fascia de Denonvillier es estirada e incidida. Esto descubre el plano posterior a la próstata, que puede ser fácilmente extendido inferiormente. Figura 7.
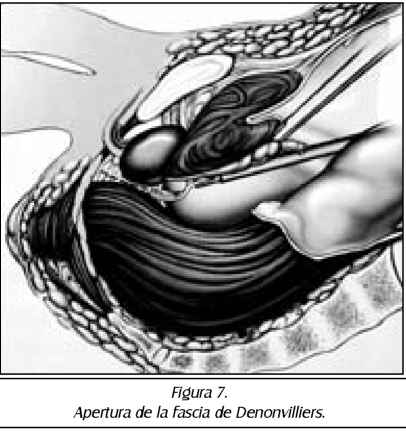
6) Disección de pedículos prostáticos y de las bandeletas neuro-vasculares
Los pedículos se disecan dejándolos virtualmente al desnudo antes de ser cortados. Para exponerlos mejor, se sostienen el conducto deferente y la vesícula seminal, halándolos para exponer el pedículo que se va a incidir. Después de hacer la transección de los pedículos, podemos encontrar un suave tubo de grasa, nervios y vasos que contiene las bandeletas neuro-vasculares. Para conservar las bandeletas, es necesario hacer una incisión lateral en la fascia prostática lateral que cubre lateralmente el tejido graso sobre la bandeleta. Las bandeletas neuro-vas-culares se disecan desde la base de la próstata hasta su entrada en el piso muscular pélvico póstero-la-teral al hipogastrio, esto en el caso que se desee preservar las bandeletas neuro-vasculares Fig. 8.
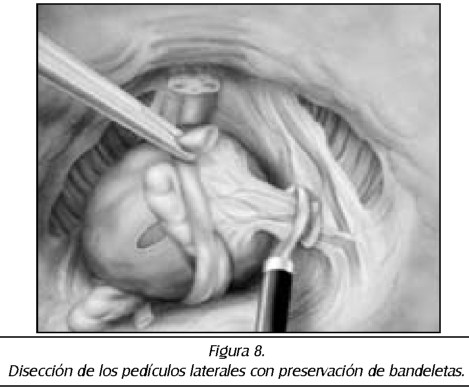
Para minimizar el trauma de las bandeletas en esta región, no debe usarse energía térmica cerca del extremo de las vesículas seminales, para lo cual se deberán usar clips para ligar las arterias vesiculares. Adicionalmente la fascia lateral de la próstata es incidida superficialmente con Endo-tijeras frías para liberar las bandeletas. Los pedículos laterales son controlados mediante la aplicación de Weck clips y con cortes fríos, y con la tijera curva del bisturí armónico. De forma similar las bandeletas son liberadas con la aplicación precisa de clips y cortando en frío. Sino se van a preservar, los pedículos laterales son ampliamente transectados con una auto-sutu-radora Lineal Cortante (Ethicon) o tipo Endo-GIA (US Surgical Corp, Norwalk, Conn.) Figura 9.
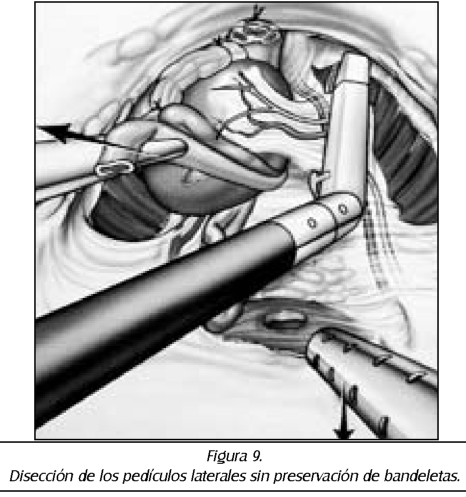
7) Incisión de la Uretra
En este paso se puede transeccionar el complejo venoso dorsal profundo, para lo cual primero se coagula el complejo con tijera curva del bisturí armónico siendo entonces cuando se corta el complejo, y se retrae espontáneamente en sentido anterior, para exponer la pared uretral anterior, la cual es cortada con endo-tijera endoscopia fría. La pared posterior de la uretra también se incide con la misma endo-tijera. Se aplica una suave tracción de la próstata, hacia arriba. El recto-uretralis que representa la última conexión de la próstata, es dividido.8 El balón se desinfla y la sonda se empuja hada arriba y adentro del abdomen para exponer las paredes uretrales laterales y posteriores que son incididas. El Foley es removido y el asistente expone la cara posterior del cuello de la vejiga mientras sostiene la incisión en la mucosa de la vejiga posterior. Después se coloca un dilatador metálico de Benique con orificio en la punta. Inmediatamente después de completada la disección completa del espécimen prostático se introduce una bolsa endoscopia (EndoCatch, US Surgical Corp. o Endopouch, Ethicon) a través del puerto umbilical de 10 mm. El espécimen se coloca dentro de la bolsa y se deja libre en una corredera parieto-cólica.
8) Anastomosis Uretro-vesical
Se realiza con sutura Polysorb 2-0 (USCC) con aguja GU-46 de 5/8 y 27 mm de largo con punta atraumatica, de forma interrumpida o continua. Cuando se realiza de forma interrumpida, las primeras dos suturas se colocan en las posiciones 5 y 7 horario, yendo de adentro hada fuera en la uretra y de afuera hada adentro en el cuello de la vejiga. Estas dos suturas se amarran intracorpóreamente, dentro del conducto uretral. Dos suturas más se hacen simétricamente en las posiciones 2 y 10 horario y se amarran con el nudo fuera del condudo, pero no se anudan inmediatamente sino que se introduce el catéter de Foley definitivo siliconado de 2 vías 20-22 F y su posición correcta es confirmada y posteriormente se amarran dichas suturas. Se coloca un quinto punto de sutura a los 12 horarios, teniendo espedal cuidado de no tomar la sonda con la aguja. Siempre se debe utilizar el Benique perforada en la punta para guiar la aguja de la sutura. Otra alternativa es hacer dos suturas en forma de semidrculos separados entre ellos, con sutura no interrumpida, que se empiezan a los 6 horarios y se encuentran y se anudan a los 12 horarios, una recorre la sutura en sentido de las agujas del reloj y la otra a la inversa. Figura 10.
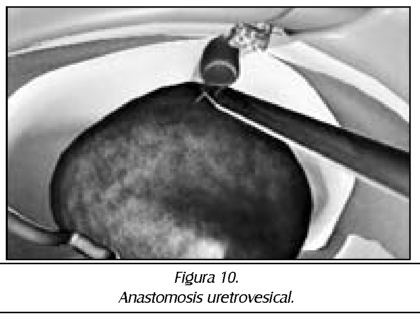
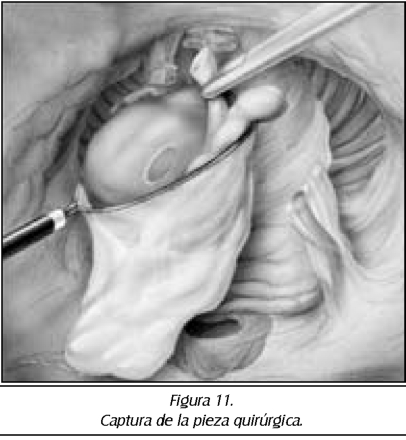
RESULTADOS QUIRÚRGICOS INMEDIATOS
Existe virtualmente ausenda de dolor, lo cual constituye el beneficio más evidente y que mayor satisfacción genera en el paciente. La ausencia de grandes indsiones y del dolor causado por éstas también lleva indirectamente a una mejoría inmediata de la fundón física y evita el uso de analgésicos parenterales y de analgesia epidural postoperatoria. Los parientes se encuentran en el postoperatorio completamente despiertos, alertas, activos físicamente e La pieza es extraída a través del puerto umbilical de 10 mm, no sin antes bajar la presión intra-abdo-minal hasta 5 mm Hg. para buscar áreas de san-gramiento y hacer la hemostasia correspondiente. Un drenaje de Blake® se coloca a través de uno de los puertos inferiores, ubicándolo en la pelvis y se sutura a la piel.8
Para extraer la pieza quirúrgica contenida en la bolsa, es predso ampliar la incisión del puerto umbilical en la menor medida posible, exteriorizando paulatinamente la bolsa a presión con cuidado de no romper la misma. Los demás instrumentos y trocares se remueven y las incisiones se cierran, tomando espedal atendón en el puerto umbilical y el de 12 mm los cuales deberán ser suturados en dos planos de aponeurosis y piel, evitando posteriores eventra-ciones. Figura 11.
ingiriendo sólidos, tan solo horas después de la operación. La alimentación precoz de los pacientes que permite la laparoscopia, contrarresta el síntoma más común de disconfort que presentan estos pacientes en el postoperatorio, como lo es el hambre, permitiendo remover las vías intravenosas más rápidamente, aumentando su movilidad y su comodidad, lo cual permite tener una mejor función intestinal. El uso de pequeños parches tipo Airstrip® de un centímetro de largo, preparan psicológicamente al paciente a ser dado de alta mucho más rápido.
Existe el riesgo de conversión a cirugía abierta que debe ser siempre advertido al paciente, lo cual se hace necesario cuando se presenten sangrados rápidos, lesión rectal o ureteral, problemas con la anastomosis uretro-vesical y otros eventos. Las terapias de supresión de andrógenos, las radiaciones, las resecciones trans-uretrales previas e infecciones, son factores que pueden contribuir a aumentar el riesgo de conversión a cirugía abierta.8 En el grupo de Cleveland Clinic Foundation solamente tuvieron que convertir a cirugía abierta un solo paciente de 125 (tasa de 0,8%), debido a fallas en la progresión de la cirugía 3 y aunque la tasa de conversión se mantiene baja (alrededor del 2%) en la mayoría de las series9'10'11 algunos centros todavía presentan una alta tasa de conversión en sus primeras series.12
Hoy en día este tipo de operaciones son realizadas en los mejores centros tales como el Instituto Montsouris de París y en la Clínica Cleveland de Ohio, en un promedio de 2 horas,13 que reflejan la tendencia mundial en la disminución de los tiempos quirúrgicos8'9'14'15 siendo todavía un poco más lenta que la cirugía abierta, sin embargo estos tiempos mejorarán cuando se tengan más y mejores instrumentos endoscópicos adaptados para esta operación.
El promedio de pérdida hemática es de menos de 300 cc8'9'14'15 lo cual si constituye una gran mejoría en comparación con la cirugía abierta. Esta marcada mejoría probablemente se debe a movimientos quirúrgicos más precisos, una mejor visualización del campo operatorio (aumento de 10-15 X), cauterización más precisa y mantenimiento de una presión de 15 mm Hg., que ayuda a mantener la hemostasia. El promedio de estadía hospitalaria es menor de 3 días y muchos egresan a las 12 horas de operado.8
La sonda se remueve entre los 3 y 5 días de postoperatorio,8 siendo estos dos factores unas evidentes ventajas sobre la cirugía abierta, lo cual se traduce en una marcada reducción de los costos.
En la serie de 40 pacientes del Instituto Montsouris, el 45% tenían una función eréctil satisfactoria y el 83% de los pacientes presentaron continencia total a los 6 meses, siendo la recuperación de la continencia más rápida con la Prostaectomía Radical Laparoscópica.5'8'13 En las series del Hospital Mondor de 43 pacientes, 84% de los pacientes reportaron continencia total un mes después de la cirugía.6 Esto nos hace concluir que la PRL está asociada con continencia urinaria y función eréctil que son comparables y tal vez mejores que lo que se ve con la prostatectomía radical abierta, lo cual concuerda con el hecho de que al trabajar endoscópicamente, el aumento 10-15 X que nos ofrece la óptica en el monitor nos permite observar ciertas estructuras fundamentales en la continencia y en la erección (bandeletas) de tal magnitud que es más fádl manipularlas con predsión minimizando el riesgo de lesionarlas.
La Prostatedomía Radical Laparoscópica es un procedimiento seguro, posible, estandarizado, repro-dudble y extensible a todo Urólogo dispuesto a ser entrenado. En un número creciente de centros médicos, ésta técnica es el método de Prostatectomía radical preferido. Considerando lo que ofrece a los pacientes, hay muchas razones para creer que reemplazará a la prostatectomía retropúbica radical abierta.
(1) Schuessler W W, Kavoussi LL, Clayman RV, et al. Laparascopic radical prodtatectomy: initial case report. J Urol. 1992; 147: 246A.
(2) Schuessler W W, Sculam PG, Clayman RV, et al. Laparoscopic radical prostatectomy: initial shorterm experience. Urology. 1997; 50(6): 854-857.
(3) Steinberg AP, Gill IS. Laparoscopic radical prostatectomy, progres, probblems, and promise. Contemporary Urology. 2002, Vol 14, #5, 34-49.
(4) Guillonneau B, Cathelineau X, Barret E, Rozet F, Vallancien G: Laparoscopic radical prostatectomy: early oncological assesment of 40 operations. Eur Urol 36: 14-20, 1999.
(5) Guillonneau B, Vallacien G. Laparoscopic radical prostatectomy: The Montsouris experience. J Urol. 2000; 163(2): 418-422.
(6) Abbou CC, Salomon L, Hoznek A, et al. Laparoscopic radical prostatectomy: preliminary results. Urology. 2000; 55(5): 630-634.
(7) Walsh PC, Jewett HJ, Radical surgery for prostatic cancer. Cancer 45: 1906-1911. 1980.
(8) Krongrad A. Prostatectomía radical Laparoscópica. Urología Panamericana. 2001, Vol. 13, N° 1, 9-12.
(9) Zippe CD, Meraney AM, Sung GT, et al. Laparoscopic radical prostatectomy in the USA: Cleveland Clinic series of 50 patients. J Urol. 2001; 165(suppl 5): 326-327. Abstract 1341.
(10)Sulser T, Guillonneau B, Gaston R, et al. Complications and initial experience with 1228 laparoscopic radical prostatectomies at 6 European centers. J Urol 2001; 165 (suppl 5): 150. Abstract 615.
(11)Bollens R, Vanden Bossche M, Roumeguere T et al. Laparoscopic radical prostatectomy: análisis of the first series of extraperitoneal approach. J Urol. 2001; 165(suppl 5): 330. Abstract 1354.
(12)Weber HM, Eschholz G, Günnewig M, et al. Laparoscopic radical prostatectomy? Not for us! J Urol. 2001; 165(suppl 5): 150. Abstract 616.
(13) Guillonneau B, Cathelineau X, Barret E, Rozet F, Vallancien G: Laparoscopic radical prostatectomy: assesment after 240 procedures. Urol Clin North Am. 2001; 28(1): 189-202.
(14) Bollens R, Vanden Bossche M, Roumeguere T et al. Extraperitoneal laparoscopic radical prostatectomy: results after 50 cases. Eur Urol. 2001; 40(1): 65-69.
(15) Guillonneau B, Cathelineau X, Doblet JD, et al. Laparoscopic radical prostatectomy: the lessons learned. J Endourol. 2001; 154: 441-445.
Dr. René Sotelo * Dr. Salvador ]. Rocafull G. * Dr. Andrés Hanssen * Dr. Oswaldo Karam
Instituto Clínico La Floresta, Caracas
TÉCNICA DE NEFRECTOMÍA RADICAL LUMBOSCÓPICA CON 3 TROCARES
Autor: Grwpo CAURO
INTRODUCCIÓN Y RECUENTO HISTÓRICO
Las técnicas endoscópicas representan hoy en día una opción efectiva con mínima agresión en el tratamiento quirúrgico de diversas patologías genitourinarias, mostrando un rol consolidado y justificado en la práctica urológica actual.1 La primera nefrectomía laparoscopica fue realizada por Clayman y col. en 1990, siendo la primera operación laparoscopica en humanos en la que se remueve un órgano con parénquima. Ello permitió el desarrollo de otras técnicas endoscópicas en el tratamiento de otras patologías tales como: adrenalectomía, pieloplastias, nefrectomía parciales, nefroureterectomías, etc.2 Las técnicas de nefrectomía endoscópicas tienen como ventajas una menor estancia hospitalaria, una recuperación más rápida y un mejor resultado estético. El perfeccionamiento del instrumental y de la técnica han reducido la duración de las intervenciones, mejorado los resultados y ha permitido practicar intervenciones cada vez más complejas. En general, las ventajas del abordaje laparoscopico son más evidentes en pacientes adultos.11
De todos los procedimientos urológicos endoscópicos empleados hasta ahora la nefrectomía es la que reúne mayor popularidad. Utilizada en un principio solo para la extirpación de pequeños riñones hipoplásicos, el abordaje endoscópico es hoy propuesto como una posibilidad en las nefrectomías entre las diversas situaciones que justifican la ablación renal. Las indicaciones que justifican su uso van desde las patologías renales benignas hasta las de naturaleza maligna tanto del parénquima renal como de las vías excretoras y recientemente la nefrectomía para transplante a partir de donante vivo surge como una nueva alternativa interesante. A pesar de su acelerada expansión, la nefrectomía laparoscopica implica la invasión del espacio intra-peritoneal y el riesgo potencial de agresión de su contenido, lo cual es especialmente válido en los casos de patologías benignas, en las cuales el abordaje lumbar convencional del riñón ha estado tradicionalmente justificado por su naturaleza extra-peritoneal. Es por ello que surgen nuevas técnicas endoscópicas a partir de accesos retro-peritoneales de la celda lumbar. Este abordaje denominado Lumboscópia o Retroperito-neoscopia, supone la confección y distensión sostenida de una cavidad de trabajo quirúrgico retro-renal. Muy extendidos a partir de 1993, estos abordajes han permitido ejecutar con éxito diversos procedimientos sobre el riñón y sus vías urinarias.1
Desde que Gaur reportó la creación de un espacio de trabajo adecuado en el retroperitoneo mediante una técnica de disección roma con balón, ha aumentado el interés en el abordaje retroperitoneal para la nefrectomía laparoscopica. Dicho abordaje proporciona ventajas potenciales porque el riñón es un órgano retroperitoneal, ventajas tales como el control precoz de los vasos renales y la inviolabilidad de la cavidad peritoneal.3
Se le atribuye a Bartel el reporte inicial de acceso endoscópico al retroperitoneo, como una propuesta diagnóstica, para la inspección y biopsia de los órganos localizados en este espacio. Wickham, uno de los fundamentales pioneros de la cirugía mínimamente invasiva, describió en una publicación del año 1979, el abordaje lumboscópico para la práctica de urétero-litotomías. En 1991, Clayman reporta la primera nefrectomía Lumboscópica descrita. Este abordaje sin embargo fue cuestionado por sus mismos autores en virtud de las limitaciones de opera-tividad que ofrecía el estrecho espacio pasivamente distendido. En 1992, Gaur da a conocer su proposición para generar una amplia cavidad de exposición retrorrenal, a partir de la utilización de un balón insuflado en su interior; esta variable metodológica condicionó nuevas perspectivas para el abordaje lumboscópico ampliándose desde entonces las proposiciones de su empleo. En 1994, Rassweiler reporta la primera serie de nefrectomías por vía lumboscópica relativas a la extirpación de riñones con patología benigna, incrementándose desde entonces diversas publicaciones alusivas al uso de la técnica.
En 1996, Ono publica la realización de nefrectomías radicales, por patología maligna, mediante abordajes retroperitoneales. En 1998, Gill reportó 30 Nefrectomías Lumboscópicas por tumor, 7 de las cuales corresponden a nefroureterectomía por cáncer de células transicionales. En 1999, Abbou propone los abordajes lumboscópicos para la realización de las nefrectomías parciales. En el año 2000, Jacobs describe su técnica de nefrectomía laparoscópica para transplante renal, siendo luego implementado el abordaje retroperitoneal, con el mismo fin, por diversos autores.1
Son las mismas que para la cirugía abierta, incluyendo riñones no funcionales o escasamente sintomáticos con diversas enfermedades benignas tales como pielonefritits crónica, enfermedad reno-vascular que causa hipertensión no controlable médicamente, litiasis renal, nefropatía por reflujo, displasia renal e hidronefrosis. Este abordaje es excelente en niños debido a la mínima cantidad de grasa retroperitoneal. Las contraindicaciones generales incluyen deterioro cardiopulmonar severo, coagu-lopatía no corregida y sepsis abdominal. Las contraindicaciones relativas incluyen cualquier condición que cree adherencias perirrenales o retroperitoneales densas, entre ellas tuberculosis renal, pielonefritis xantogranulomatosa, abceso perirrenal y la presencia de adherencias causadas o cirugía retroperitoneal previa. La obesidad hoy en día ya no es una contraindicación relativa en este tipo de abordaje que si lo es para el abordaje laparoscópico transperitoneal.6'10
Es similar a la de las técnicas convencionales, solicitando laboratorio preoperatorio de rutina Sin embargo es importante realizar una tomografía computada helicoidal de abdomen para valorar las características del hilio renal y de precisar el número y distribución de los elementos vasculares involucrados. Adicionalmente este método puede ofrecer valiosa información en los pacientes previamente intervenidos, relativa a la presencia y extensión de adherencias entre los tejidos involucrados y el eventual grado de complejidad quirúrgica a superar. La preparación intestinal indicada rutinariamente en las nefrectomías endoscópicas transperitoneales no se consideran habitualmente para los abordajes retroperitoneales, pero se puede realizar limitándola a la evacuación de fluidos y administración de dos botellas de citrato de magnesio la noche anterior a la cirugía. Se administra un antibiótico de amplio espectro (cefalosporina de tercera generación) por vía parenteral en el momento de ingresar al cuarto operatorio. Se colocan secuencialmente dispositivos antiembólicos de compresión en ambas piernas y se introduce un catéter de Foley hasta ubicarlo en la vejiga urinaria.3
El paciente es posidonado en decúbito lateral, similar a aquella de la lumbotomía clásica, provocando angulación máxima de 90- del flanco a intervenir, mediante la elevación del puente central a nivel de la cicatriz umbilical y el descenso simultáneo de los extremos de la mesa operatoria. Esta posidón genera un desplazamiento conveniente del colon, hada adelante y caudalmente, separándolo de la superficie renal. La movilizadón colónica puede incrementarse mediante una ligera rotación anterior de la mesa, luego de selecdonados y señalados los puntos de ingreso retroperitoneal sobre la piel del enfermo. La inmovilidad de la posición obtenida y el resguardo de las zonas corporales sometidas a roce, deben ser de especial consideración durante esta fase de preparadón operatoria. La cabeza del paciente debe quedar soportada a un mismo nivel de alineación con la columna cervical y torádca. El brazo ipsilateral es gentilmente extendido sobre un soporte o una mesa de mayo. El miembro inferior opuesto es flexionado y el ipsilateral extendido sobre el anterior; varios cojines de protección deben estar previstos para colocarlos debajo de la cabeza, entre los miembros superiores y en las superficies de contacto de los miembros inferiores, a nivel de rodilla, piernas y tobillos. Finalmente la posidón debe mantenerse mediante cintas adhesivas, dispuestas transversalmente a nivel superior del tórax, de la cadera y de los miembros inferiores, asegurando sus extremos en las barandas laterales de la mesa operatoria.1
En resumen el padente se coloca en la posición estándar completamente de costado. Se eleva la parte correspondiente a la ubicación renal y se flexiona la mesa quirúrgica. Esto es necesario para maximizar el espado entre la cresta iliaca y la última costilla. Deben tomarse precauciones para evitar todos los puntos de presión acolchando adecuadamente todas las prominencias óseas; las extremidades se colocan en posición neutra. El cirujano y su ayudante se colocan de pie encarando la espalda del paciente.
Comprende los siguientes pasos:
1) Acceso retroperitoneal,
2) Dilatación con balón,
3) Colocación de los trocares,
4) Control del hilio renal,
5) Movilización del espécimen,
6) Atrapamiento y extracción de la pieza quirúrgica
y
7) Salida.
Se usa la técnica abierta de Hasson.5 Se realiza una incisión cutánea horizontal de 1,5-2 cm a la altura de la punta de la 12a costilla y se penetra el retroperitoneo usando la técnica de separación muscular. Las fibras musculares suprayacentes son separadas secuendalmente inddiendo la fascia tóraco-lumbar anterior para entrar al espacio retroperitoneal. Se crea un espado para el balón dilatador efectuando una disección roma digital -en el sitio del puerto primario- por delante de la fasda y del músculo psoas y por detrás de la fascia de gerota, movilizándose medialmente la reflexión retroperitoneal con una suave disecdón digital antes de la inserción del balón dilatador.3
2. Disección Retroperitoneal con Balón
Se inserta un trocar balón (PDB Origin Medsystems, Menlo Park, CA) o un balón construido con una sonda de Nelaton 18 con un dedo de guante en su extremo, dentro del espado retroperitoneal previamente disecado. Se infla el balón con 500- 800 cc de aire o solución fisiológica creando un espado de trabajo adecuado. El balón se coloca por fuera y por detrás de la fascia de Gerota. El riñón y la fasda de Gerota circundante son movilizados ántero-medialmente por el balón distendido, exponiendo así el aspedo posterior del hilio renal y los grandes vasos adyacentes.3
Se retira el balón dilatador y se coloca un trocar de 10 mm (Versaport V2, US Surgical, Norwalk, CT) como puerto primario. Se crea un neumo-retroperito-neo (15 mmHg) y se realiza una evaluación preliminar retroperitoneoscópica. Los otros dos puertos secundarios pueden ser insertados confortablemente bajo control lumboscópico y se aseguran a la piel con suturas de sostén.3 Una vez introducido el primer portal en el vértice de la duodécima costilla se planifica la introducción de los portales restantes, en base a las siguientes referencias anatómicas las cuales son: Un portal de 5 mm a 4 cm por dentro de la línea entre la espina iliaca ántero-superior y el ombligo y un último y tercer portal posterior de 12 mm en la misma línea del primer trocar en la unión con los músculos paraespinales, estos dos últimos trocars son introducidos con visión Lumboscópica a través de la cámara introdudda en el primer trocar, lo cual eventualmente modifica el sitio de entrada con respecto a las referendas inidales.
Hay ocasiones en las que es difícil insertar los trocares bajo visión Lumboscópica direda debido a limitación de espacio en el retroperitoneo, de manera que se usa una técnica bimanual. En este método, el puerto secundario es dirigido hacia el dedo índice izquierdo y se protege con un retrador-S, insertados a través del puerto primario y localizado retroperi-tonealmente, bajo la pared abdominal en el punto seleccionado para el trocar secundario.3
Durante la inspección lumboscópica se identifican una o más referendas anatómicas importantes, tales como el músculo psoas, pulsaciones de la arteria renal bajo la grasa hiliar, pulsadón de la arteria aorta o la azulada y parcialmente colapsada vena cava inferior, la vena gonadal y la reflexión peri-toneal lateral. Se retrae ántero-lateralmente la fascia de Gerota que recubre el riñón con el instrumento no dominante.3
Se introduce un retractor similar al de la cirugía hepática en abanico de 5 ramas (Endo-retract II, US Surgical) que permite la exposición apropiada rechazando el riñón según sea necesario alejándolo de la superficie del psoas iliaco y exponiendo el hilio renal para su tratamiento.
La fascia de Gerota se escinde paralela y 1-2 cm por delante del músculo Psoas, exponiendo el hilio renal. Las pulsaciones en la región hiliar identifican a la arteria renal, la cual se disecdona individualmente y se asegura con dips (Hemolock Week MLX) vasculares, manteniendo por lo menos tres dips en el lado proximal. La Vena Renal, la cual se localiza más anteriormente y usualmente caudal, es entonces controlada con una engrapadora vascular (Endo-GIA Universal, cartuchos 4,5 x 2,5).3
5. Finalizadón de la Movilizadón Renal
El riñón se moviliza en su totalidad con su fasda de Gerota con disección roma y aguda utilizando a través del trocar dominante un asa de electrocauterio en forma de "L" o con el asa del bisturí armónico. El uréter y, eventualmente, los vasos gonadales son asegurados. En todos los tiempos quirúrgicos se requiere una hemostasia meticulosa.
6. Atrapamiento y Extracción del Órgano
Utilizamos un dispositivo Endocatch (US Surgical, Norwalk, CT). Se extrae la pieza a través de la prolongadón ántero-caudal de la indsión del trocar anterior cuya longitud está estrictamente ajustada al tamaño de la pieza saliendo comprimida en la bolsa (y protegida por ella) y a presión lo cual garantiza un mínimo tamaño de la indsión el cual depende del tamaño de la pieza (la cual fue en promedio de 5 cm).
Se revisa cuidadosamente la hemostasia después de disminuir la presión neumo-retroperitoneal y se retiran los trocars bajo visión directa. Se derra la fascia en la ubicación de todos los trocars de 10 mm o mayores.3 Se introduce drenaje aspirativo cerrado de Blake por el orificio del trocar posterior paralumbar, por 24-48 horas.
En una revisión multicéntrica realizada por el Dr. Indebir Gill en 24 centros urológicos laparoscópicos en todo el mundo se observó una tendenda credente hacia el enfoque lumboscópico.4 En 1993, 24% de los casos fueron abordados de forma Lumboscópica en comparadón con 51% en 1996. En el 75% de los casos se utilizó la técnica de disecdón digital retroperitoneal abierta mediante cánula de Hasson, la cual permite desarrollar un espado retroperitoneal previo a la colocación dirigida del balón dilatador.12 Esta técnica ofrece dertos inconvenientes técnicos como lo son: un pequeño espado de trabajo, anatomía difusa, dificultad de acceso al retroperitoneo, amontonamiento de los trocars (lo cual se evita con la técnica descrita en este estudio de 3 trocars) , escape de aire con el subsiguiente enfisema.3
La colocación del tercer trocar no alineado con los dos anteriores, permite una mayor movilidad de los puertos, adicionalmente este tercer trocar en la posidón anteriormente mendonada, confiere una excelente ubicación en la cual prolongando esta incisión se extrae la pieza quirúrgica preservando las fibras musculares de la pared abdominal anterior al divulsionarlas en el sentido de las fibras. En los casos que ocurra neumoperitoneo por este procedimiento lumboscópico debido a algún desgarro peritoneal, ello no debe ser interpretado como una dificultad mayor, aunque si puede ocasionar algún inconveniente técnico.
El mantener intacta la cavidad peritoneal permite una menor morbilidad en cuanto a íleo paralítico y dolor postoperatorio, ya que se minimiza el riesgo de contaminadón intraperitoneal con orina, sangre o infecdón y evita la manipuladón intestinal.3
En una comparadón retrospediva entre la nefrectomía simple trans y retroperitoneal, McDougall y Clayman7 no encontraron diferendas significativas entre los dos grupos en términos de tiempo operatorio, permanenda hospitalaria o tiempo de conva-lescenda. Sin embargo, hubo una tendencia en el grupo retroperitoneoscópico hacia un menor tiempo operatorio, menos complicaciones febriles y menos malestar postoperatorio.
En investigadones redentes realizadas por Gill y Kaouk, revisaron más de 200 nefrectomías lum-boscópicas retroperitoneales por enfermedades benignas y en ellas el tiempo operatorio promedio fue de 191 minutos (rango de 90 a 336 minutos). El promedio de la pérdida hemática dentro de la revisión realizada por Gill y Kaouk fue de 107 cc (rango de 50 a 150 cc). Aunque los procedimientos laparoscópicos consumen más tiempo, comparados con la drugía abierta, la disminución de la estancia hospitalaria a tan sólo 48 horas en promedio y la rápida convalecenda (promedio 1,9 semanas) implica una ventaja significativa en el tratamiento mínimamente invasivo.
En la Revisión de Gill y Kaouk la conversión a cirugía abierta se realizó en 13 pacientes (6,5%), 7 pacientes (3,5%) se reportaron complicaciones menores mientras que otros 5 pacientes (2,5%) tuvieron complicaciones mayores.
Evidentemente estamos tratando de reproducir una técnica desarrollada en otros escenarios y estamos presentando una experiencia inicial afectada por la curva de aprendizaje, mostrando como a medida que avanzamos se reduce el tiempo operatorio y la capacidad de resolver inconvenientes técnicos lumboscópicamente.
La nefrectomía radical sigue siendo tratamiento de elección para tumores sólidos del riñón. Actualmente existen diversas modalidades para efectuarla entre las que cuentan las técnicas endoscópi-cas, ya sea por Laparoscopia o por Lumboscópia. Describimos una Técnica de nefrectomía radical lumboscópica utilizando sólo 3 trocares, (diferente a la convencional con 4 trocares).
Cuando esté indicada una nefrectomía radical por patología maligna, los procedimientos endoscópicos (laparoscopia o retroperitoneoscopia) puede ahora considerarse como el estándar de atención en la mayoría de los casos. Los datos de eficacia intra-operatoria son comparables con los de la cirugía abierta convencional, con ventajas significativas en la morbilidad postoperatoria, convalescenda y estética. Al evadir la cavidad peritoneal, el abordaje retroperitoneal propordona ventajas adidonales que lo hacen el enfoque preferido en varios centros espedaliza-dos.5'6 La técnica quirúrgica previamente detallada ha resultado un procedimiento confiable y repro-dudble con excelentes resultados en manos de los autores. Es importante la atención en la localización del trocar primario, la posidón del balón dilatador evitar el amontonamiento de los puertos y la familiarización con las referencias anatómicas específicas para el abordaje retroperitoneal.
La Nefredomía Lumboscópica Retroperitoneal se puede considerar un método seguro, relativamente accesible y reproducible en nuestro medio, y puede ser empleada tanto para patologías malignas como benignas, tanto de parénquima renal como de Urotelio.
La Técnica Lumboscópica con tres trocars es sus-tentable y evita el amontonamiento de los trocars, a diferencia de la técnica con cuatro trocars, aumentando el rango de movilidad de las dos manos del cirujano.
En la medida que se pradiquen mayor cantidad de drugías Lumboscópicas por un mismo equipo de trabajo que observe todas las precaudones propias de los procedimientos laparoscópicos, se mejorarán los tiempos quirúrgicos y el manejo de las complicaciones y se disminuirán las pérdidas hemáticas y las complicadones, tomando en cuenta los prindpios de la curva de aprendizaje.
1. Escovar Paúl, Montilla José G. Y cols.: Nefrectomía endoscópica retroperitoneal. Revista Urología Panamericana, 14: 9-16, 2002.
2. Abbou, C.C., Cicco, A., Gasman, D., Hoznek, A., Antiphon, P., Chopin, D.K., Salomon, L. Retroperitoneal laparoscopic versus open radical nephrectomy. J Urol. 161: 1776-1780. 1999.
3. Gill IS: Retroperitoneal laparoscopic nephrectomy. Urol Clin North Am 25: 343-359, 1998.
4. Gill IS, Clayman RV, Abala DM, et al: Retroperitoneal and pelvic extraperitoneal laparoscopy: An International perspective. Urology 52: 566-571, 1998.
5. Gill IS, Grune MT, Munch LC: Access technique for retroperitoneoscopy. J Urol 156: 1120-1124, 1996.
6. Kobashi KC, Chamberlin DA, Rajport D, et al: Retroperitoneal laparoscopic nephrectomy in children. J Urol 160: 1142-1144, 1998.
7. McDougall EM, Clayman RV: Laparoscopic nephrectomy for benign disease: Comparison of the transperitoneal and retroperitoneal approaches. J Endourol 10: 45-49, 1996.
8. Rassweiler J, Fomara P, Weber M, et al: Laparoscopic nephrectomy. The experience of the laparoscopic working group of the German Urologic Association. J Urol 160: 18-21, 1998.
9. Gill I, Kaouk J,: Nefrectomía Laparoscópica Retroperitoneal, Revista Urología Retroperitoneal, 13: 9-13, 2001
10. El-Ghoneimi A., Valla JS., Steyaert H., et al: Laparoscopic renal surgery via a retroperitoneal approach in children. J Urol 160: 1138-1141, 1998.
11. Figenshau S, Yu M.: Nefrectomía y Nefrourete-rectomía laparoscópicas en pacientes pediátricos, Clin Urol de Norteamérica, Vol. 1: 53-60, 2001.
12. Gaur DD: Laparoscopic operative retro-perito-neoscopy. J Urol 48: 1137-1139, 1992.
Dr. Bernardo Vainrub * Infectólogo
Hospital Clínicas Caracas
El término Infecdón Urinaria es muy amplio e induye cualquier infecdón predominantemente bacteriana desde los riñones hasta la uretra, con distintos grados de agresividad, por lo cual, sería más apropiado utilizar una terminología que indique el área anatómica envuelta en el proceso infeccioso.
Las infecdones del trado urinario (ITU), son las entidades más prevalentes en el adulto para lo cual se requiere del uso de antibióticos.
La mayoría de las ITU son en sujetos sanos y requieren tratamiento ambulatorio, pero hay un porcentaje de enfermos crónicos y otro grupo de pacientes con enfermedades severas, que induyen sepsis por Gram negativos e incluso muertes.5
MICROBIOLOGÍA Y PATOFISIOLOGÍA
Desde la edad escolar hasta la edad del adulto joven, las mujeres tienen ITU 30 veces más que el hombre quien comienza a incrementar su porcentaje de infecdones urinarias a partir de los 50 años.
Las mujeres post-menopaúsicas también tienen un aumento en el índice de infecdón urinaria.
La infecdón urinaria en la mujer, se inicia por la colonización vaginal y por ende uretral, con Enterobaderias y el ascenso a la vejiga, en lo cual factores importantes de virulencia por parte de los organismos juegan un rol, así como, alteradones del huésped que permiten que los organismos colonizantes puedan ascender con más facilidad que en otras personas. Los fadores baderianos como P-fim-brias, aerobactinas y hemolisinas.25
Los fadores de riesgo de infecdón urinaria induyen:21
- Edad.
- Vida sexual activa.
- Historia de infecciones urinarias previas.
- Uso de espermiddas y diafragmas.
- Retraso en la micdón post-coital.
Desde el punto de vista patofisiológico y bade-riológico hay una diferenda significativa entre una infecdón recurrente, que implica que el padente se cura con el tratamiento y luego tiene otras infecdones subsecuentes o una infecdón no resuelta, en el cual nunca se pudo documentar la erradicadón de la baderia.
La primera puede ser debido a los fadores antes mencionados y en el segundo caso puede tratarse de organismos resistentes al tratamiento, trastornos estrudurales de las vías urinarias, inmunosupresión, pobre adhesión al tratamiento.10
Los agentes etiológicos más predominantes en infecdones urinarias son las Enterobaderias aeróbicas, que usualmente colonizan la vagina, con la excepción de otros organismos más prevalentes en dertos grupos de riesgo de infecdón hematógena, como es el caso en parientes con catéteres intravenosos, historia de adicción a drogas, endocarditis, cateterización intermitente, por vejiga neurogénica, etc.
En líneas generales las baderias más comunes son:
- E.coli 70 al 90%.
- Stafilococcus saprofiticus 10 a 20%.
- Proteus mirabilis.
- Klebisiella pneumoniae.
- Enterococcus.
- Enterobader.
- Organismos menos comunes como: Ureaplasma urealiticum y Micoplasma ominis, siguen en orden de frecuencia a los antes mencionados.
En nuestro medio la relación porcentual de los organismos responsables de infecdón del trado urinario, es muy similar a lo que ocurre en otros países.
Un análisis comparativo del año 1991 al 2001, de cepas frecuentemente presentes, en estos casos indica un aumento de la resistencia bacteriana. (Datos tomados de múltiples hospitales en Venezuela). (Ver cuadro N°1).
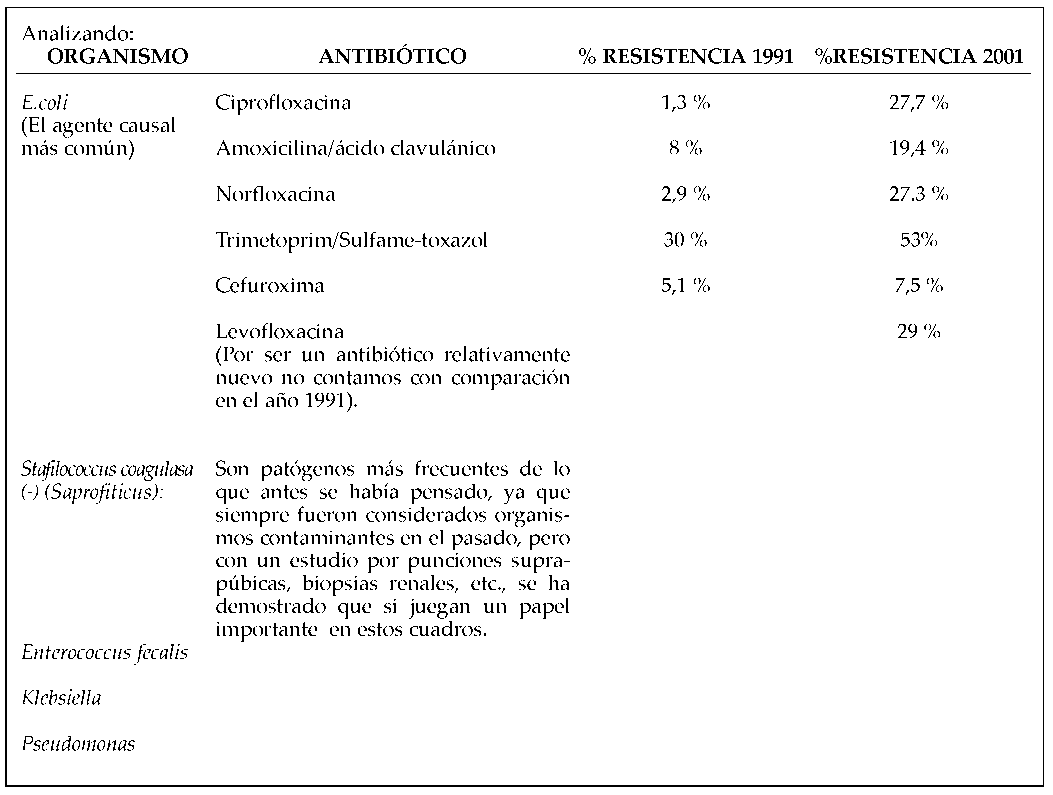
En cuanto a la resistencia de los Gram negativos más comunes a los aminoglicósidos, Amikadna se mantiene en proporciones similares y la Gentamicina ha experimentado un ascenso moderado de su resistencia. En el caso del Enterococcus tecalis, la resistencia a la Penicilina y Vancomidna se han convertido en un problema creciente en la última década, a nivel mundial.
Desde el punto de vista de la severidad las infecciones urinarias se dasifican en:
• No complicadas y complicadas
Las No complicadas usualmente se refieren a mujeres jóvenes no embarazadas o mugres de edades entre 4-60 años, con Cistitis sin anomalías estructurales o neurológicas. También algunos hombres jóvenes adivos sexualmente, con infecciones.
Los factores de riesgo de las infecdones complicadas son los siguientes:24
• Edades extremas
• Alteradones estrudurales del sistema urinario (presencia de catéteres, cálculos, enfermedades renales o de las vías urinarias, cuerpos extraños, etc.).
• Sexo masculino
• Niños
• Obstrucdón de la vía urinaria
• Trasplantados
• Embarazos
• Inmunosupresión
• Enfermedades endocrinológicas
• Uso de esteroides
• Patógenos inusuales bacterianos o micóticos.
Metodología diagnóstica:
Estudios de localización han aclarado que es muy difícil desde el punto de vista clínico, distinguir una infección urinaria alta de una baja.14
La presencia de disuria, frecuencia urinaria, dolor suprapúbico o dolor en fosas lumbares, no son específicos para distinguir estas dos presentaciones.
En mujeres con infección urinaria baja, es muy difícil diferenciar Cistitis de Uretritis y Vaginitis. Estas infecciones son llamadas bajas, son superficiales en la mucosa y más fáciles de tratar.
Los síntomas urinarios en el hombre deben dirigir la atención hada enfermedad prostática. En Cistitis Aguda la disuria o ardor al orinar y urgenda, así como frecuencia y dolor suprapúbico, son asodados con Cistitis, pero pueden estar presentes en otras entidades.
El examen físico generalmente no es revelador, la paciente puede presentar dolor suprapúbico a la palpación, dolor a la percusión de fosas lumbares, sin aclarar esto la localizadón de la infecdón.
En el caso de la mujer se debe pradicar un examen ginecológico y en el hombre un examen rectal. No suele haber síntomas sistémicos en Cistitis. En raras ocasiones hay febrícula.
En la mujer la Vaginitis se debe sospechar y generalmente viene acompañada de prurito vaginal y secredón.
Uretritis: es un problema común en la mujer, aproximadamente 1/3 de las pacientes con síntomas urinarios bajos tienen Uretritis sin Cistitis, en estos casos hay piuría pero puede no haber bacte-riuria y se debe sospechar cuando se presume la posible presencia de una enfermedad de transmisión sexual.
En el hombre este diagnóstico es más fácil, por la presenda de secreción uretral, además de disuria.
Prostatitis: es un cuadro donde los síntomas son similares a los de la Cistitis, pero suele haber adicionalmente síntomas de tipo obstrudivo, los cuales predominan en estos casos, como disminudón de la fuerza del chorro, nocturna, goteo post-micdonal. Hay además con frecuenda dolor perineal o lumbar bajo, en este caso el examen debe incluir la inspección y palpadón para buscar evidendas de secreción uretral, lesiones en los genitales externos, epididimales,
o testiculares, así como, adenopatías inguinales y alteradones a nivel prostático. La prostatitis bade-riana crónica es la causa más frecuente de Cistitis recurrente en el hombre y en raras ocasiones está asociada a epididimitis.
Infecciones urinarias altas: ciertos datos en la historia clínica sugieren la probabilidad de una infección alta, como son: historia previa, Pielonefritis o alteraciones estructurales del tracto urinario, Diabetes, Inmunosupresión, infecdones en niños, falta de respuesta a tratamientos de corta duradón.
Pielonefritis: algunos pacientes con este cuadro, suelen tener escalofríos, fiebre alta y dolor lumbar. Quizás fiebre alta es el criterio dínico más útil para diferenciar infecdones altas de bajas y la presenda de escalofríos puede implicar baderemia, a veces estos síntomas se acompañan de nauseas, vómitos, diarrea u otros síntomas generales con o sin la presenda previa de disuria, el dolor al percutir las fosas lumbares es inespecífico.
El examen de orina generalmente revela piuría, pero aproximadamente en el 5% de casos de Pielonefritis no hay piuría.
El examen microscópico de la orina, los estudios de despistaje de leucocitos en la orina, como la prueba de leucodtos-esterasa en combinadón de nitritos positivos, son de alta sensibilidad y especifiddad, pero pueden dejar de detectar casos en los cuales el contaje de colonias es bajo, esto sucede raras veces, puede verse en un paciente que esté recibiendo un tratamiento inadecuado.9'15'22
La pielonefritis es clasificada por varios autores en complicada y no complicada, estando la Pielonefritis complicada generalmente en relación con anormalidades estructurales, funcionales, manipulaciones urológicas o en combinadón con enfermedad subyacentes, así como también en edad avanzada.
En casos donde a pesar del tratamiento la fiebre persiste por encima de las 72 horas, hay que pensar también en abscesos renales.
En resumen, los métodos diagnósticos de laboratorio para demostrar infecciones urinarias se enfocan en la presencia o ausencia de piuría y bacteriuria. Desde el punto de vista de costo-efectividad, la realización de cultivos no es indispensable en los casos obvios de Cistitis no complicada.
La coloración de Gram en una gota de orina no centrifugada en buenas manos puede ser útil, ya que la presencia de una bacteria por campo de inmersión correlaciona altamente con la existencia de más de 100.000 unidades formadoras de colonias por mi de orina, cuando es necesario revisar múltiples campos para ver estas bacterias generalmente el contaje es de 104-105.
La presencia de "piuría estéril" se puede asociar con uretritis aguda, tuberculosis renal, presencia de cuerpos extraños o tumores, infecciones no bacterianas genitales.
Hematuria está presente solamente en 50% de los casos de Cistitis aguda.
El urocultivo tomado en forma correcta, es un examen obligatorio cuando se sospecha Pielonefritis, infecciones renales complicadas o recurrentes, en el embarazo o cuando hay síntomas posteriores a manipulaciones urológicas.
En el pasado un contaje igual o más de 105, UFC/ml, fue considerado positivo, estudios más recientes sugieren que hay infecciones urinarias presentes, incluso con contajes tan bajos como 102, con una sensibilidad del 95%.
Trabajos de Kunin13 han demostrado que 1/3 de las mujeres con infección urinaria baja tienen contajes de colonias entre 102 y 104 UFC/ml.
A pesar de estos hallazgos la Sociedad Americana de Enfermedades Infecciosas en su definición de consenso de Cistitis, considera que un contaje de colonias mayor o igual a 105 UFC/ml, tiene una sensibilidad de 80% y especificidad de 90% y para Pielonefritis mayor de 104 UFC/ml. tiene una sensibilidad de 90% a 95%, pero se considera un abordaje razonable considerar contajes bajos (103-104 UFC/ml) en poblaciones especiales como positivo (en hombres y en mujeres embarazadas). Contajes bajos de difteroides, lactobadlos, Gardenella vaginalis, Stafi-lococcus epidermidis, son más consistentes con contaminantes.
En caso de que se aíslen múltiples baderias en personas con tractos urinarios normales, usualmente esto representa una contaminadón, sin embargo, el cultivo debe ser repetido con cuidado meticuloso, ya que aunque raras, ocurren infecdones polibaderianas.
En ocasiones existe la necesidad de tomar una muestra por pundón suprapúbica, en cuyo caso, colonias mayores de 102 CFU/ml, se debe tomar en cuenta, si existe más de un organismo, éstos deben ser identificados y tratados.
Es importante tomar en cuenta las limitaciones que tienen los cultivos, como son: retardo en el transporte al laboratorio, alterando el contaje de colonias de maneras significativas, en caso de que esto ocurra, la muestra debe ser transportada refrigerada.
Nuevos exámenes para detedar baderiuria en forma rápida, como son bioluminiscenda, métodos colorimétricos y otros similares están en uso y ensayándose para un diagnóstico rápido, sensible y espedfico de baderiuria.
Hemocultivos; 30 a 40% en pacientes con Pielonefritis, tienen hemocultivos positivos, éstos deben hacerse en caso de escalofríos, pacientes hospitalizados, con terapias previas, historias de patógenos resistentes, pacientes en malas condiciones e inmunosuprimidos.
Un problema que se presenta es cuando tomar en cuenta la presencia de hongos (Cándida, Torulopsis glabrata) en estos cuadros,, esto debe evaluarse en forma individual.
Infecciones por Clamidia tracomatis, Neiseria gonorrea y Herpes simplex, son causas de Uretritis en las mujeres y disuria que simulan Cistitis.
Estudios diagnósticos por imágenes, evaluación urológica: el objetivo de estos estudios es identificar anormalidades anatómicas obstrudivas que puedan predisponer a estas infecdones.
En los últimos años la urografía de eliminación se usa con menos frecuencia en favor del ultrasonido y tomografía computarizada.
- Fiebre persistente después de las 72 horas de terapia.
- Sospecha de infección por organismos que no son E.coli.
- Historia de Litiasis.
- Anomalías estructurales.
- Insuficiencia renal.
- Diabetes Mellitus.
- En niños.
- Adultos jóvenes.
- Mujeres con infecciones a repetición.
- Hombres.
Alteraciones en el Tracto Urinario que son frecuentemente encontradas:
a. Obstrucción: la cual puede estar en cualquier parte del tracto urinario y predispone a infección, puede ser ureteral por cálculos o por anomalías congénitas como estenosis o puede ser obstrucción uretral por Hiperplasia Prostática.
b. Reflujo vésíco-ureteral: el cual predispone a infecciones ascendentes, en ciertos casos puede ser la causa de una infección o a veces la presencia de organismos Gram negativos puede predisponer a la existencia de reflujo, en cuyo caso al resolverse la infección ocurre lo mismo con el reflujo.
c. Vaciado incompleto de la vejiga.
d. Presencia de cuerpos extraños como foco de infección: éstos podrían ser catéteres o cálculos.
Estudios de localización del sitio de infección: frecuentemente es importante distinguir si la infección es alta o baja, ya que las infecciones altas (Pielonefritis) requieren tratamiento más prolongado y tienen implicaciones diferentes desde el punto de vista etiológico y pronóstico.
Para esto, hay técnicas invasivas que incluyen cateterización ureteral con cultivos directos de lavado vesical y muestras secuendales de la vejiga y uréteres, esto bajo supervisión del urólogo y del laboratorio.
Los estudios no invasivos incluyen la detección de baderias cubiertas de anticuerpos.11 esto no está disponible en forma rutinaria y sirve más bien de referencia epidemiológica.
Principios terapéuticos en infecciones urinarias: lo primero que hay que tomar en cuenta son las medidas generales como hidratación, el uso de analgésicos y luego los antibióticos apropiados.
Principios generales de antibioticoterapia: la escogen-cia de un antimicrobiano depende de factores inherentes a la historia y dínica del padente, como son: la edad, sexo, el hecho de que la infecdón sea o no asintomático o que se trate de una infección alta o baja, de que sea o no recurrente y que estén presentes fadores añadidos como, enfermedades previas conocidas, Diabetes Mellitus, inmunosupresión, uso de quimioterapia, que el padente sea de procedencia comunitaria u hospitalaria, que tenga alteraciones en la función renal o del sistema coledor y el poder realizar un cálculo aproximado del patógeno envuelto en el cuadro infecdoso. En este último punto es importante mencionar, que es fundamental el conocimiento del tipo de patrón de sensibilidad o resistenda de los organismos de la comunidad o el hospital en el que el médico se encuentre ejerdendo su actividad profesional.8'28
Infecdones urinarias son las indicaciones más comunes que requieren el uso de antimicrobianos en la actualidad. Como se mostró en la tabla N°1, en los últimos 10 años ha habido un aumento significativo en la resistencia de la E.coli a las Penicilinas, Trimetoprim/Sulfametoxazol a nivel mundial y Venezuela no ha sido una excepdón.
Adicionalmente, en Venezuela hemos tenido un aumento en la resistencia a las Fluroquinolonas, más importante que en otros países, esto probablemente esté en reladón a la falta de control de los usos de antibióticos en nuestro país, sin embargo persiste sensibilidad a la Cefuroxima y a otras Cefalosporinas.
Es importante seleccionar un antibiótico de excreción renal al tratar infecdones urinarias, de este modo la concentración del antimicrobiano en la orina es muy alta, esto explica situaciones en las cuales el organismo siendo resistente a un antibiótico, sin embargo al recibir el resultado del cultivo la infección se ha resuelto, en esos casos se debe completar el tratamiento con el mismo antibiótico, sin tomar en cuenta el patrón de resistencia antes mencionado y se debe hacer un cultivo control varios días luego de terminado el tratamiento para documentar la resolución del proceso infeccioso.
En el caso de infecciones que requieran tratamiento parenteral debido a su severidad o a que la infección haya sido adquirida en el hospital, los organismos se han mantenido sensibles a la mayoría de los aminoglicósidos, los cuales deben usarse tomando en cuenta la toxicidad renal y acústica individualizando cada caso.

Debido a las altas concentraciones de antibióticos que son excretados por la vía renal, en este tipo de infección es factible utilizar la vía oral, aun en ciertos casos de infecciones moderadas a severas.
Uno de los puntos importantes y controversiales, es la duración de la terapia, esto depende sobre todo del sitio de la infección, por ejemplo, en el caso de Cistitis en la mujer tratamientos cortos de 3 a 4 días son aceptables, costo-efectivos y reducen la toxicidad,1 disminuyendo así el riesgo de resistencia bacteriana, además de evitar cambios en la flora intestinal. Los tratamientos de un día como fueron preconizados hace unos años, no son recomendados actualmente, debido al porcentaje importante de recaídas.
En el caso de la Pielonefritis se debe prolongar el tratamiento por un lapso aproximado de dos semanas.
Infecciones urinarias en el embarazo: durante el embarazo las infecciones urinarias son más frecuentes que en otras épocas de la vida de la mujer, esto incluye bacteriuria asintomática, Cistitis y Pielonefritis.
El organismo más frecuente en el embarazo continúa siendo E.coli, la bacteriuria asintomática ocurre en aproximadamente 5% de las mujeres embarazadas y sin tratamiento hay un riesgo de Pielonefritis entre 20 y 30%.
Es importante señalar, que adidonalmente la bacteriuria aumenta el riesgo de embarazos pretérmino, partos de niños de bajo peso, por lo cual, se debe pradicar despistaje de bacteriuria asintomático en el embarazo.3,18
El tratamiento de estas bacteriurias, debe ser con antimicrobianos orales, que son seguros en el embarazo como: Amoxicilina, Cefalosporinas, Nitroforantoina y Sulfonamidas, éstas últimas deben evitarse en el 3er. trimestre. El tratamiento debe ser de 7 a 10 días y debe haber un control ulterior para demostrar erradicación de la baderiuria.
En caso de Cistitis en el embarazo, el tratamiento debe ser similar, sin embargo, no debe ser menor de
10 días.6
La Pielonefritis en el embarazo se ha asodado con retraso en el desarrollo y crecimiento intrauterino, parto prematuro y raras veces problemas respiratorios. En estos casos se ha utilizado aminoglicósidos y Cefalosporinas de 2da y 3ra. generación.
Bacteriura asintomático: es un hallazgo que ocurre entre el 20 y 50% de los residentes de ancianatos. Es más frecuente en parientes con problemas de demencia, con incontinencia intestinal y vesical. El tipo de organismo es el mismo que se observa en la población joven y el origen de estas infecciones está relacionado a dificultades en el vaciado de la vejiga, alteraciones hormonales, etc. Adualmente no se recomienda tratar a los pacientes ancianos asintomáticos. En caso de ser sintomáticos es esencial adecuar el tratamiento, tomando en cuenta patologías previas, toxiddad de los antibióticos e interacciones con otros tratamientos.20
Diabéticos: las infecciones urinarias son más frecuentes que en no diabéticos, sobre todo en mujeres, sin embargo, en ambas poblaciones los riesgos de complicaciones son mayores que en los no diabéticos y éstas suelen ser Abscesos Perinéfricos, Necrosis Papilar, Abscesos Renales y Pielonefritis Enfisema-tosa. Estos pacientes suelen ser menos sintomáticos y produdr confusión desde el punto de vista diagnóstico.
Por las razones antes expuestas, se recomienda practicar estudios radiológicos de ultrasonido en estos pacientes. El tipo de organismo es similar a los presentes en los no diabéticos, sin embargo, Klebsiella pneumoniae, es más común en este grupo de pacientes.
El tratamiento médico suele ser igual, pero se recomienda prolongar el tratamiento a aproximadamente 14 días, dependiendo de la situación y el organismo.4
Hay que tomar en cuenta que el uso de Trimetoprim/Sulfametoxazol en pacientes que toman hipoglicemiantes orales, puede potenciar el efedo de estas últimas medicadones.
Infecciones en pacientes con anormalidades conocidas del Tracto Urinario:
En pacientes con cálculos, uropatías obstructivas u otras anormalidades, la terapia antimicrobiana puede suprimir la infección temporalmente, pero suele no erradicarla, por lo tanto, el tratamiento en estos pacientes debe estar dirigido a la corrección de la anormalidad subyacente, si esto es posible. Estas infecciones son difíciles de tratar por la pobre penetración de los antibióticos.
Infecciones urinarias en hombres:
Ocurren más frecuentemente en hombres con Hiperplasia Prostática, siendo situaciones diferentes las de los niños y ancianos.
La baderiuria asintomática en el hombre sano es muy poco común, exceptuando el anciano, por lo tanto, despistaje de bacteriuria no es razonable en estos pacientes.
En caso de encontrar en estudios de rutina bac-teriuria, debe practicarse un estudio urológico completo, para excluir anomalías estructurales o funcionales, así como Prostatitis Crónica.
Previamente en este capítulo se discutió el tratamiento de esta entidad, sin embargo, hay que enfatizar que desde el punto de vista diagnóstico, además de los estudios de rutina, como son el examen de orina, urocultivo, despistaje de enfermedades venéreas, el examen rectal de la próstata, y del líquido prostático, en ocasiones es necesario practicar también estudios de localización prostática. Esta técnica es rara veces realizada hoy en día y su valor es cuestionable, sin embargo, puede ser útil en casos selectos de sospecha de Prostatitis Crónica y en hombres con infecciones recurrentes.12'16'17
Estos estudios consisten en hacer contajes de colonias bacterianas previo y posterior al masaje prostático y no debe realizarse durante sospecha de prostatitis aguda, debido al riesgo de bacteremia
Hay estudios que sugieren que cerca del 90% de los pacientes con síntomas de Prostatitis, tiene Prostatitis no bacteria o Prostatodinia.19
En la Prostatitis crónica, los organismos son más difíciles de erradicar, quedando así la próstata como un foco de infección crónica, que puede infectar en forma repetitiva a la vejiga y es responsable por la mayoría de las infecciones recurrentes bajas en el hombre.
Estas infecciones suelen ser debidas a Bacilos Gram negativos, aunque a veces, también Entero-coccos y en raras ocasiones S.aureus, puede ser un patógeno, sin embargo, Micrococos, S. epidermidis y Difteroides, probablemente no son patógenos.
La presencia de cálculos prostáticos infectados, puede ser difícil de diagnosticar clínicamente y puede funcionar como un cuerpo extraño, explicando el problema que representa erradicar estas infecciones en algunos casos.
Infecciones recurrentes:
En el caso de mujeres jóvenes que han tenido 3 ó más infecciones en un año, hay que pensar en la posibilidad del uso de antibióticos profilácticos de larga duración. La fuente de estas infecciones suelen ser reinfección a partir de la flora periuretral en la mujer, siendo la vida sexual activa un factor causal de estas infecciones.26
En pacientes con reinfecciones, profilasis con 6 a
12 meses continuos, han demostrado disminuir las recurrencias en un 95%, ésta debe iniciarse luego de haber resuelto la infección aguda.
Los antibióticos profilácticos recomendados son: Trimetoprim/Sulfametoxazol, una tableta al dormir interdiaria o Nitrofurantoina 50mg. diarios.
Ha habido reportes del uso de estas medicaciones luego de la relación sexual, en caso de establecer la causa efecto, esta modalidad terapéutica se ha usado con éxito en la prevención de reinfecciones.
Infecciones urinarias en niños:
Ocurre en el 5% de hembras y el 2% de varones. Diseminación hematógena e infección al riñón es el modo más común de infección en neonatos. En niños mayores la ruta ascendente la más común.
Extasis por obstrucción uretelopiélica o ureterovesical, así como ureterocele ectópico, son los defectos anatómicos más comunes predisponentes de infección urinaria en estos grupos etareos.
El reflujo vesiculoureteral es la más común anormalidad subyacente y puede producir daños en el parénquima renal, que están en relación con la severidad del reflujo.
Los grupos de riesgo mas frecuentes son: niños prematuros que ingresaron en unidades neonatales, niños con enfermedades inmunológicas o niños con anomalías del tracto urinario como cálculos, vejiga neurogénica, disfundón micdonal o historia familiar de reflujo, la etiología bacteriana es similar a la del adulto.
Cualquier varón con bacteriuria debe ser estudiado desde el punto de vista radiológico, así como en el caso de niñas menores de 5 años o de niñas mayores de 5 años pero con episodios recurrentes.
Los tratamientos deben durar de 7 a 10 días y se deben evitar las Quinolonas u otros antibióticos no recomendados en niños.
El tratamiento dependerá del organismo diagnosticado, así como de la severidad del cuadro clínico y la edad del padente.2
Infecciones Urinarias asociadas a catéteres:
Es la infección nosocomial mas frecuente del tracto urinario y representan el 40% de todas las infecciones hospitalarias. La gran mayoría de los pacientes con infecciones urinarias hospitalarias, han tenido manipulación con catéteres.
Las caterizadones intermitentes son utilizadas en pacientes especiales con lesiones de columna dorsal o vejiga neurogénica de cualquier otro origen y tienen un riesgo inferior de infección que la colocación de un catéter permanente.7 En raras ocasiones, es necesario colocar un catéter definitivo que puede ser suprapúbico.
Aún tomando en cuenta todos los cuidados que se deben tener en estos parientes con caterización intermitente definitiva, el riesgo de bacteriuria suele ser alto y en ocasiones se presta a complicaciones, en caso de infecciones agudas, éstas deben ser tratadas, sin embargo, la supresión crónica de estas infecciones no es efectiva en la mayoría de los casos. Se han estudiado para este fin múltiple antibacterianos como Trimetoprim/Sulfametoxazol, Nitrofurantoina, Quinolonas y Metenamina, sin éxito. Tampoco modificaciones en el PH de la orina han resultados útiles en estos pacientes.7'23'27'29
1 Abrutyn E, Berlin J, Mossey J, etc al: Does treatment of asyptomatic bacteriuria in older ambulatory women reduce the subsequent sympotoms of urinary tract infection. J Am Geriatr Soc 44: 293-295, 1996.
2- American Academy of Pediatrics. Practice parameter: the diagnosis, treatment, and evaluation of the initial urinary tract infection in febrile infants and young children. Pediatrics 1999; 103: 843-852.
3 Andriole VT, Patterson TF. Epidemiology, natural history, and management of urina- ry tract infections in pregnancy. Med Clin North Am 1991; 75: 359.
4 Evanoff GV, Thompson CS, Foley R, et al: Spectrum of gas within the kidney: Emphysematous pyelonephritis and emphysematous pyelitis. Am J Med 83: 149-154, 1987.
5 Falagas ME, Gorbach SL. Practice guidelines: urinary tract infections. Infect Dis Clin Pract 1995; 4: 241.
6 Goldaber KG: Urinary tract infection during pregnancy. Hosp Med 5: 14-24, 1997.
7 Gribble MJ, Putterman ML. Prophylaxis of urinary tract infection in persons with recent spinal cord injury: a prospective, randomized, double-blind, placebo controlled study of trimethoprim-sul-famethoxazole. Am J Med 1993; 95: 141.
8 Gupta K, Sahm DF, Mayfiel D, et al. Antimicrobial resistance among uropatho-gens that cause com-munity-acquired urinary tract infections in women: a nationwide analysis. Clin Infect Dis 2001; 33: 89.
9 Hooton TM, Stamm WE. Diagnosis and treatment of uncomplicated urinary tract infection. Infect Dis Clin North Am 11: 551-581, 1997.
10 Ikaheimo R, Siitonen A, Heiskanen T, et al: Recurrence of urinary tract infection in a primary care setting: Analysis of a 1 year follow-up of 179 women. Clin Infect Dis 22: 91-99, 1996.
11 Jones SR, Smith JW, Sanford JP. Loalization of urinary tract infections by detec-tion of antibody-coated bacteria in urine sediment. N Engl J Med 1974; 290: 591.
12 Krieger JN, Nyberg L Jr, Nickel JC. NIH consensus definition and classification of prostatitis. JAMA 1999; 282: 236.
13 Kunin CM. A reassessment of the importance of "low-count" bacteriuria in young women with acute urinary symptoms. Ann Intern Med 1993; 119: 454.
14 Kunin CM. urinary tract infections in females. Clin Infect Dis 1994; 18: 1.
15 Kusumi RK, Grover PJ, Kunin CM: Rapid detection of pyuria by leukocyte esterase activity. JAMA 245: 1653-1655, 1972.
16 Lipsky BA. Urinary tract infections in men. Epidemiology, pathophysiology, diag-nosis and treatment. Ann Intern Med 1989; 110: 138-150.
17 Meares EM Jr, Stamey TA. Bacteriologic localization patterns in bacterial prosta- tis and urethritis. Invest Urol 1968; 5: 492.
18 Millar LK, Cox SM: Urinary tract infections complicating pregnancy. Infect Dis Clin North Am 11: 13-
26, 1997.
19 Nickel JC, Downey J, Hunter D, et al. Prevalence of prostatitis-like symptoms in a population based study using the National Institutes of Health chronic prostatitis symptom index. J Urol 2001; 165: 842.
20 Nicolle LE, et al. The association of bacteriuria with resient characteristics and sur-vival in elderly institutionalized men. Ann Intern Med 1987; 106: 682-686.
21 Nicolle LE, Harding GK, Preiksaitis J, et al: The association of urinary tract infec-tion with sexual intercourse. J Infect Dis 146: 579-583, 1982.
22 Pappas PG: Laboratory in the diagnosis and management of urinary tract infec-tions Med Clin North Am 75: 313-319, 1991.
23 Perkash I, Giroux J. Clean intermittent catherization in spinal cord injury patients; a follow-up study. J Urol 1993; 149: 1068.
24 Ronald AR, Pattullo ALS: The natural history of urinary infection in adults.MedClin North Am 75: 299-312, 1991.
25 Schaeffer AJ, Jones, JM, Dunn JK: Association of in vitro E. coli adherence to vagi- nal and bucal epithelial cells with susceptibility of women to recurrent urinary tract infections. N Engl J Med 304: 1062, 1981.
26 Stapleton A, et al. Postcoital antimicrobial propphy-laxis for recurrent urinary tract infecction: a randomized, double-blind, placebo-controlled trial. JAMA 1990, 264: 703-706.
27 Vainrub B., Muscher D.M.: Lack of effect of methenamine in suppression of, or prophylaxis a gainst, chronoc urinary infection. Antimicrobial agents and chemotherapy 12:5, 625-629, 1977.
28 Warren JW, Abrutyn E, Hebei JR, et al. Guidelines for antimicrobial treatment of un-complicated acute bacterial cystitis and acute pyelonephritis in women. Clin Infect Dis 1999; 29: 745.
29 Warren JW. The catheter and urinary tract infection. Med Clin North Am 1991; 75: 481.
Dr. David Parada D. * Patólogo
Centro Médico Docente La Trinidad, Caracas
CÉLULAS BASALES PROSTÁTICAS • CONDICIONES BENIGNAS Y MALIGNAS
Durante muchos años, diferentes aspectos de las células basales han permanecido desconocidos; sin embargo, en la actualidad se realizan enormes esfuerzos para entender los orígenes, funciones e implicaciones de estas células y su influencia en la patología prostática. Muchos investigadores dirigen sus directrices hada la posibilidad de que el carcinoma de próstata pudiera desarrollarse a partir de una sub-pobladón de las células basales. Esta situación demuestra la necesidad de entender el papel de las células basales no solo para comprender como podrían influir en el desarrollo prostático, sino para tratar de vislumbrar los posibles mecanismos involucrados en el cardnoma de próstata.
COMPARTAMENTALIZACIÓN DEL EPITELIO PROSTÁTICO
El epitelio prostático está constituido por dos compartimientos claramente definidos, el basal y el secretorio. El primero de ellos, está dado por una o dos capas de células, las cuales se ubican entre la membrana basal y las células secretorias; se distinguen histológicamente por su morfología, la cual varía entre células planas con escaso citoplasma y cromatina nuclear condensada, a células cuboidales con aumento en la cantidad de citoplasma y cromatina de aparienda más laxa.1 Por otro lado, el compartimiento secretorio generalmente está constituido por una capa de células dlíndricas luminales; la porción secretora de estas células se proyeda hada la luz, mientras que el lado opuesto, su porción basal, está en contado con las células basales1 (Fig. la).
Al igual que en otros órganos, en el epitelio prostático se ha podido demostrar una población celular conodda como Stem Cells (Células Madre o de Reserva), las cuales se han ubicado en la región de las células basales.2'5 En modelos experimentales llevados a cabo en ratones se ha demostrado que la mayor proporción de las células madre se localizan en el seno urogenital en estadios embrionarios, y que en los estadios adultos se localizan en el compartimiento basal.6'7 Esta teoría además de explicar la homeostasia epitelial prostática, indudablemente
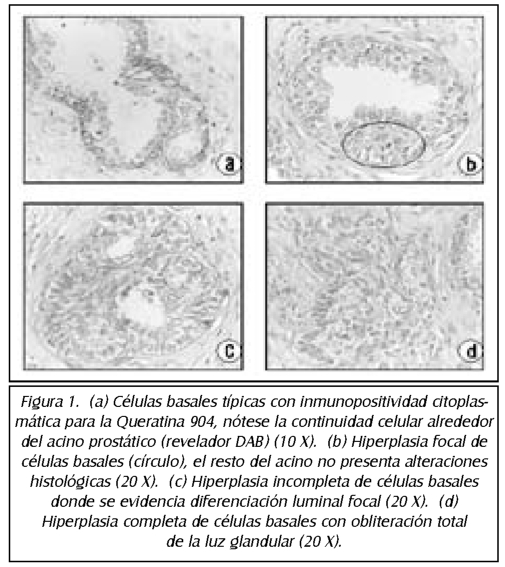
representa un sistema extremadamente útil para el análisis de la cardnogénesis prostática, debido a la capacidad proliferativa que poseen tanto las células neoplásicas como las células de reserva.6'9 Estas células de reserva son capaces de dividirse y diferenciarse en otros tipos celulares tales como las células secretoras, pero este concepto no es totalmente aceptado.10'15 Sin embargo en el año de 1996 el grupo de consenso sobre los orígenes del carcinoma de próstata estuvo de acuerdo en que una pequeña pobladón de las células basales corresponde a las células de reserva.16 Aunque ambos compartimientos, basales y secretoras, mantienen su capaddad de dividirse,14'15 el compartimiento usual de división se ubica en las células basales.17 Es interesante señalar que en células de cultivo se han podido identificar poblaciones celulares que presentan transición entre las células basales, células secretoras y células neu-roendocrinas,18'19 hallazgos que posiblemente sustenten la teoría de la capacidad de las células de reserva para originar diferentes elementos morfológicos.
HALLAZGOS INMUNOFENOTÍPICOS DE LAS CÉLULAS BASALES
En la pubertad, el epitelio prostático inmaduro se diferencia en células basales y células secretoras bajo la influencia de los andrógenos.20 Tanto el epitelio prostático fetal como el pre puberal, expresan un amplio espectro de queratinas, incluyendo las queratinas de alto peso molecular.20'21 En las etapas posteriores del desarrollo prostático las células sufren una clara diferenciación morfológica e inmunofenotípica por parte de las células basales y secretoras.21
Inmunohistoquimicamente las células basales expresan citoqueratinas 5, 14, 15, proteínas pp32, GST-pi, Bcl-2, con bajos niveles de expresión de ARN mensajero para el receptor de andrógeno.1'10'22-24 Ellas pierden la expresión de las proteínas secretorias, como antígeno prostático específico y fosfatasa ácida prostática. Por otro lado, las células secretoras expresan las proteínas secretoras antes mencionadas (antígeno prostático específico y fosfatasa ácida prostática), ARNm del receptor de andrógeno y citoqueratinas 8 y 18.i'10'22'24
En condiciones normales las células basales expresan un marcador exclusivo de este tipo celular, la cual es la Queratina 348E12 conocida también como Queratina de alto peso molecular 903.25 La expresión de este filamento intermedio es exclusiva de las células basales, formando un círculo alrededor de los acinos prostáticos, sin positividad en las células acinares ni mesenquimáticas (Fig. la).25 Es interesante que cuando ocurre neoplasia intraepitelial prostática, la capa de células basales sufre una disruption progresiva; esta falta de integridad de las células basales es más frecuente en los acinos adyacentes a un carcinoma invasor, que en aquellas distantes a esta zona.1'25 La invasión temprana de un carcinoma ocurre precisamente en los sitios de disruption, lugar en el cual las células tumorales penetran y aumentan las brechas celulares permitiendo de esta forma la invasión estromal.1'25 Sin embargo, cabe mencionar que la disruption de las células basales no ocurre exclusivamente en los casos de neoplasias y la misma puede observarse en casos de acinos inflamados, hiperplasia adenomatosa e hiperplasia post-atrófica.1'25'26
PROLIFERACIONES BENIGNAS DE LAS CÉLULAS BASALES
Dentro de este tipo de lesiones se consideran tres patrones de hiperplasia de células basales: la hiperplasia típica, la hiperplasia atípica y el adenoma de células basales.
La hiperplasia de células basales
La hiperplasia de células basales (HCB) está constituida por un engrosamiento de dos o más células basales en la periferia del atino prostático (Fig. Ib). Para el diagnóstico de HCB se requiere un mínimo de dos capas de células para su diagnóstico, aunque este criterio puede ser arbitrario.1'27 En ciertas ocasiones la HCB puede evidenciarse como pequeñas cestas rodeadas por estroma dispuesto de manera concéntrica, asociado a inflamación crónica. Los rasgos arquitecturales de la HCB puede variar entre proliferaciones focales, pasando por formas excéntricas y presentándose como variantes completas o incompletas (Fig. Ib, le, Id). Las características histológicas de las células basales pueden variar entre formas alargadas, ovoides u redonda, con núcleos grandes
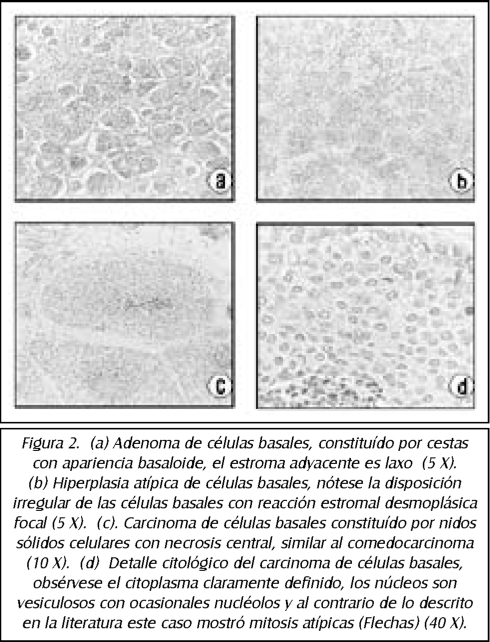
vesiculosos y cromatina finamente reticular. El nucléolo generalmente es pequeño (menos de 1 miera en diámetro).27-29 En ciertas ocasiones se pueden evidenciar células claras en la HCB, y menos frecuentemente la presencia de metaplasia escamosa, la cual puede estar asociada con infarto prostático. Recientemente Epstein describió patrones poco frecuentes de hiperplasias de células basales los cuales representan un reto para el patólogo, sobre todo ante el diagnóstico de Neoplasia Intraepitelial Prostática (PIN).30
Hiperplasia Atípica de Células Basales.
Este tipo de lesión es similar a la HCB excepto por la presencia de un nucléolo grande y prominente (con una media de 1.96 mieras).29 Los nucléolos son redondos u ovales y ligeramente eosinofílico. Asociado a este hallazgo generalmente se puede evidenciar inflamación, lo cual pudiera explicar como un cambio reactivo a la presencia de nucleomegalia. Dentro del espectro morfológico de tamaño nucleolar evidenciado en las proliferaciones basales, ellos son considerados atípicos sólo cuando más de un 10 % de las células exhiben nucléolo prominente (Fig. 2b).29 Clínicamente la HCBA aparentemente no tiene significado clínico, sin embargo representa un reto para los patólogos quirúrgicos en vista de sus diagnósticos diferenciales, dentro de los cuales se considera el adenocarcinoma adnar prostático.29
El adenoma de células basales es una lesión, la cual macroscópicamente es grande, redondeada y que generalmente se drcunscribe a un acino con HCB de apariencia microscópica nodular.1 La lesión nodular está constituida por agregados de células basales, las cuales forman cestas sólidas pequeñas o adnos dilatados. El estroma puede evidenciarse condensa-do hacia la periferia del nodulo. En dertas ocasiones, el estroma prostático adquiere una caraderística de nodulo adenomatoso incompleto; este estroma puede ser basofílico, con cambios mixoides en las adyacencias de las cestas epiteliales. Histológicamente, las células basales que constituyen la lesión presentan núcleo grande con escaso citoplasma y nucléolo pequeño, aunque ocasionalmente, se pueden evidenciar un nudéolo grande y prominente.1 Algunas células pueden presentar una característica cuboidal o epitelioide, sobre todo en la región central de las cestas epiteliales. En ocasiones se pueden evidenciar múltiples adenomas de células basales (adenomatosis de células basales), la cual siempre está relacionada con hiperplasia glándulo-estromal y parece ser una variante de la hiperplasia de células basales (Fig. 2a).1
Los tumores malignos de las células basales incluyen a las neoplasias con poca o ninguna diferen-ciadón luminal (carcinoma basaloide) y aquellos con diferenciadón secretora, los cuales muestran un patrón cribiforme típico, el cual es similar a los carcinomas adenoideos quísticos de las glándulas salivales. Uno de los principales problemas con este tipo de neoplasia los constituye su rareza, por lo que los criterios de malignidad no están claramente definidos.31-34 La media de la edad para los parientes con diagnóstico de CCB es de 50 años, siendo los síntomas de noduria, urgencia miccional, retención urinaria y disuria, entre otros los que se han informado en la literatura. Los niveles séricos de antígeno prostático específico y fosfatasa alcalina prostática no muestran elevación.35
Histopatológicamente los tumores basaloides presentan un patrón de crecimiento infiltrativo, en cestas, cordones, trabéculas y sábanas, las cuales pueden mostrar empalizada periférica.31'36 Los tumores adenoideos quísticos, focalmente presentan aspedo cribiforme, delimitados por dos capas de células, las cuales rodean un material semejante a membrana basal eosinofílico, hialino; en ocasiones, se evidenda material basofílico mudnoso, el cual es positivo para mucicarmín y áddo periódico de Schiff (PAS). Estos tumores pueden mostrar necrosis, invasión perineural, linfática e invasión extraprostática.36 Las características citológicas de las células neoplásicas muestran células con citoplasma eosinofílico, escaso, con núcleos redondos o angulados con cromatina finamente granular. La actividad mitótica es generalmente escasa.31'36 Estos tumores tienen capacidad de invasión local y de producir metástasis a distancia, por lo que se debe asegurar el seguimiento estrido de estos pacientes. En la adua-lidad a estas neoplasias se les consideran como tumores de bajo potencial de malignidad (Fig. 2c, 2d).35'36
1 Bostwick DG, Devaraj LT. Basal cell proliferations and tumors of the prostate. In: Foster CS, Bostwick DG, editors. Pathology of the prostate. Philadelphia: Saunders, 1998: 157-171.
2 Foster CS, Ke Y. Stem cells in prostatic epithelia. Int J Exp Pathol 1997; 78: 311-329.
3 Foster CS, Dodson A, Karavana V, et al. Prostatic stem cells. J Pathol 2002; 197: 551-565.
4 Slack JM. Stem cells in epithelial tissues. Science 2000; 287: 1431-1433.
5 Kinbara H, Cunha GR, Boutin E, et al. Evidence of stem cells in the adult prostatic epithelium based upon responsiveness to mesenchymal inductors. Prostate 1996; 29: 107-116.
6 Tsujimura A, Koikawa Y, Salm S, et al. Proximal location of mouse prostate epithelial stem cells: a model of prostatic homeostasis. J Cell Biol 2002; 157: 1257-1265.
7 Sawicki JA, Rothman CJ. Evidence for stem cells in cultures of mouse prostate epithelial cells. Prostate 2002; 50: 46-53.
8 Hudson DL, O'Hare M, Watt FM, et al. Proliferative heterogeneity in the human prostate: evidence for epithelial stem cells. Lab Invest 2000; 80: 1243-1250.
9 Evans GS, Chandler JA. Cell proliferation studies in rat prostate. I. The proliferative role of basal and secretory epithelial cells during normal growth. Prostate 1987; 10: 163-178.
10 Wang Y, Hayward S, Cao M, et al. Cell differentiation lineage in the prostate. Differentiation 2001; 68: 270-279.
11 Derner GB. Basal cell proliferation in benign prostatic hyperplasia. Cancer 1978; 41: 1857-1836.
12 Cleary KR, Choi HY, Ayala AG. Basal cell hyperplasia of the prostate. Am J Clin Path 1983; 80: 850-854.
13 Heatfield BM, Sanefuji H, Trump BF. Long-term explant culture of normal human prostate. Methods Cell Biol 1980; 21: 171-194.
14 Merchant DJ, Clarke SM, Ives K et al. Primary explant culture: an in vivo model of the human prostate. Prostate 1983; 24: 114-118.
15 Evans GS, Chndler JA. Cell proliferation studies in rat prostate: The effects of castration and androgen-induced regeneration upon basal and secretory cell proliferation. Prostate 1987; 11: 339-351.
16 Bostwick DG. Prospective origins of prostate carcinoma. Prostatic intraepithelial neoplasia and atypical adenomatous hyperplasia. Cancer 1996; 78: 330-336.
17 Bonkhoff H, Steim U, Remberger K. The proliferative function of basal cells in the normal an hyperplastic human prostate. Prostate 1994; 24: 114-118.
18 Robinson EJ, Neal DE, Collins AT. Basal cells are progenitors of luminal cells in primary cultures of differentiating human prostatic epithelium. Prostate 1998; 37: 149-160.
19 Bonkhoff H. Role of the basal cells in premalignant changes of the human prostate: a stem cell concept for the development of prostate cancer. Eur Urol 1996; 30: 201-205.
20 Wemert N, Sitz G. Immunohistochemical investigation of different cytokeratins and vimentin in the prostate from the fetal period up to adlthood and in prostate carcinoma. Pathol Res Pract; 1987:182: 617-626.
21 Kitajima K, Tokes ZA. Immunohistochemical localization of keratin in human prostate. Prostate 1986; 9: 183-190.
22 Brawer MK, Peehl DM, Stamey TA et al. Keratin immunoreactivity in the benign and neoplastic prostate. Cancer Res 1985; 45: 3663-3667.
23 Shah IA, Schlageter MO, Stinnett P, et al. Cytokeratin immunohistochemestry as a diagnostic tool for distinguishing malignant from benign epithelial lesions of the prostate. Mod Pathol 1991; 4: 220-224.
24 Okada H, Tsuburu A, Okamura A, et al. Keratin profiles in normal/hyperplastic prostates and prostate carcinoma. Virchows Arch (A) Pathol Anat 1992; 42: 157-161.
25 Hedrick L, Epstein JI. Use of keratin 903 as adjunct in the diagnosis of prostate carcinoma. Am J Surg Pathol 1989; 13: 389-396.
26 Cheville J, Bostwick DG. Post atrophic hyperplasia of prostate. A histologic mimick of prostatic adenocarcinoma. Am J Surg Pathol 1995; 19: 1068-1076.
27 Devaraj LT, Bostwick DG. Atypical basal cell hyperplasia of the prostate. Immunophenotypic profile and proposed classification of basal cell prolifere-taions. Am J Surg Pathol 1993; 17: 645-649.
28 Bonkhoff H, Remberger K. Widespread distribution of nuclear androgen receptors in the basal cell layer of the normal and hyperplastic prostate. Virchows Arch Pathol Anat 1993; 422: 35-38.
29 Epstein J, Armas O. Atypical basal cell hyperplasia of the prostate. Am J Surg Pathol 1992; 16: 1205-1214.
30 Rioux-Leclercq N, Epstein JI. Unusual morphologic patterns of basal cell hyperplasia of the prostate. Am J Surg Pathol 2002; 26: 237-243.
31 Frankel K, Craig JR. Adenoid cystic carcinoma of the prostate. Report of a case. Am J Clin Pathol 1974; 62: 639-645.
32 Gilmour M, Bell TJ. Adenoid cystic carcinoma of the prostate. Br J Urol 1986; 58: 105-106.
33 Kuhajda FP, Mann RB. Adenoid cystica carcinoma of the prostate. A case report with immunoperoxi-dase staining for prostate-specific acid phosphatase and postatis specific antigen. Am J Clin Pathol 1984; 81: 257-260.
34 Denholm SW, Webb JN, Howard GC et al. Basaloid carcinoma of the prostate gland: histogenesis and review of the literature. Histopathology 1992; 20: 151-155.
35 Bostwick DG. Neoplasms of the prostate. In: Bostwick DG, Eble JN, editors. Urologic Surgical Pathology. St Louis: Mosby, 1997: 343-422.
36 Young RH, Srigley JR, Amin MB, Ulbright TM, Cubilla AL, editors. Tumors of the prostate gland, seminal vesicles, male urethra, and penis. Washington, DC: Armed Forces Institute of Pathology, 2000.
Dr. David Parada D. * Patólogo
Centro Médico Docente La Trinidad, Caracas
CARCINOMA U ROTE UAL DE LA VEJIGA URINARIA Y SUS DIAGNÓSTICOS DIFERENCIALES
En el aparato urinario existen diferentes patologías, las cuales pueden ser confundidas clínica e histopatológicamente con lesiones malignas. En el caso de la vejiga urinaria, este tipo de lesiones lo constituye las cestas de von Brunn, las hiperplasias, el condiloma acuminado, las cistitis glandular y quís-tica, la metaplasia escamosa, y el adenoma nefrogéni-co, entre otros. Algunas de estas alteraciones hasta hace poco habían sido relacionadas como posibles precursores del carcinoma de vejiga urinaria. La idea de esta revisión es dar información clínica y patológica sobre un grupo de patologías vesicales cuyo principal diagnóstico diferencial lo constituye el carcinoma urotelial vesical.
CESTAS DE VON BRUNN
Las cestas de von Brunn, son grupos de células uroteliales bien circunscritas localizadas en la lámina propia, las cuales se desarrollan por un proceso de profusión del epitelio subyacente o por migración celular, que pueden o no tener contacto con el epitelio superficial.1 Su ubicación es mucho más frecuente en el trígono. Hoy en día se consideran como una variación normal del epitelio urotelial, sin ninguna relación con el desarrollo de carcinoma.1 Histológicamente son cestas de células ordenadas sin atipias, lo cual difiere del carcinoma urotelial (Fig. la). En ocasiones, las cestas de von Brunn pueden ser numerosas, muy compactas por lo que el diagnóstico diferencial con papiloma urotelial invertido puede ser difícil.1
Hiperplasias uroteliales
Las hiperplasias del urotelio se clasifican como planas y papilares. Ambos tipos de lesión se caracterizan por un aumento en el número de capas del epitelio, mayor de siete, sin presencia de atipias citológicas (2). Generalmente son asintomáticas y se encuentran en los estudios citoscópicos de rutina en el seguimiento de neoplasias urotelilales (3,4). La hiperplasia papilar posee unos pequeños capilares en
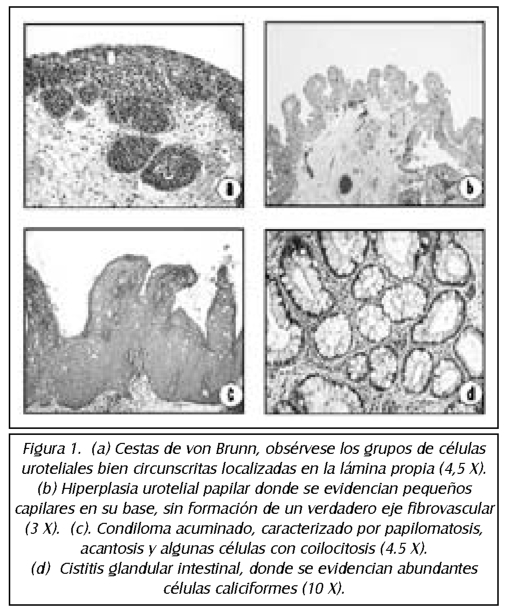
su base, pero no hay formación de un verdadero eje fibrovascular (Fig. Ib).4 Es importante resaltar que el diagnóstico de hiperplasia urotelial papilar de novo no indica necesariamente un mayor riesgo para el desarrollo de neoplasias uroteliales, pero se debe de recomendar su seguimiento.4
METAPLASIA ESCAMOSA
Como su nombre lo indica es un cambio del epitelio urotelial por epitelio plano estratificado con o sin queratinizadón, y éste proceso se asoda con cistitis crónica severa.1'5 Es cuatro veces más frecuente en mujeres que en hombres y se ubica predominantemente en la pared vesical anterior.5'6 Se ha podido demostrar que estas lesiones expresan focalmente citoquinas, las cuales pudieran explicar su desarrollo e inclusive servir de marcador para la presencia de
lesiones malignas.7 Macroscópicamente, las zonas de metaplasia son blanquecinas o grisáceas con una clara demarcación de la mucosa adyacente.6 Las lesiones con abundante queratinizadón pudieran ser confundidas con carcinomas. Histológicamente, se evidencia epitelio plano estratificado con grados variables de queratinizadón, sin evidencias de atipias histológicas.1'5'6 La metaplasia escamosa no queratinizante semeja al epitelio de la vagina y se presenta en el trígono y el cuello vesical en casi un 86 % de las mujeres en etapa reproductiva y en cerca de un 75 % de las post-menopáusicas.1 Este hallazgo es normal, por lo que no se debe diagnosticar metaplasia escamosa no queratinizante en estas parientes.
Este tipo de afectación muestra un predominio del sexo femenino de aproximadamente 2:1.810 Generalmente, se evidencia en pacientes con algún tipo de inmunocompromiso y su manejo en estos casos puede ser difícil.810 Citoscópicamente, se observa una lesión única en el cuello o trígono vesical, con una apariencia papilar lo cual plantea clínicamente el diagnóstico de carcinoma urotelial, así como otras lesiones papilares de la mucosa.10 Histológicamente, la presencia de acantosis, papilomatosis y las alteraciones por el efecto dtopático viral como son la binucleación, la coilodtosis, la irregularidad e hipercromatismo nudeares permiten realizar el diagnóstico de condiloma (Fig. le).10'11 La tipificación viral de estas lesiones ha sido variable y su relación con el desarrollo de carcinoma urotelial no está bien estableada.1012
CISTITIS GLANDULAR Y CISTITIS QUÍSTICA
El término dstitis glandular se refiere a una lesión que se puede desarrollar a partir de las cestas de von Brunn.1315 Algunos autores consideran a este tipo de lesiones como condidones normales del epitelio vesical. En casos excepcionales estas lesiones pueden ser polipoides y grandes, pudiendo ser confundidas con carcinoma urotelial macroscópicamente.13'14'15 Histológicamente, la cistitis glandular muestra estructuras glandulares en la lámina propia, revestidas por epitelio cúbico o dlíndrico, rodeadas por una o más capas de urotelio. En ocasiones, se pueden observar células caliciformes con clara formación de mudnas, lo cual le da una apariencia a epitelio colónico (Fig. Id).16 Tomando en cuenta la presencia de las células caliciformes se ha dasificado a la cistitis glandular como típica e intestinal.15 Cuando la cistitis glandular de tipo intestinal es extensa se denomina metaplasia intestinal y se asocia con procesos irritativos crónicos vesicales.14'15 Lo importante de esta lesión es que en los parientes con el diagnóstico de metaplasia intestinal se ha observado un incremento en el riesgo para desarrollar carcinoma, motivo por el cual se recomienda seguimiento estricto en estos casos.16'17
La cistitis quística se considera como cestas de von Brunn, en las cuales la región central ha sufrido degeneración, formando de esta forma espacios quísticos.1'18 Es más frecuente en adultos, aunque se puede encontrar en pacientes pediátricos.16 Citoscópicamente se puede sospechar debido a la naturaleza quística de la lesión, con una apariencia traslúcida, y tamaños menores de 5 mm generalmente.1'16 Histológicamente los quistes están revestidos por epitelio urotelial y pueden presentar material eosinofílico con pocas células inflamatorias (Fig. 2a).1'16'18
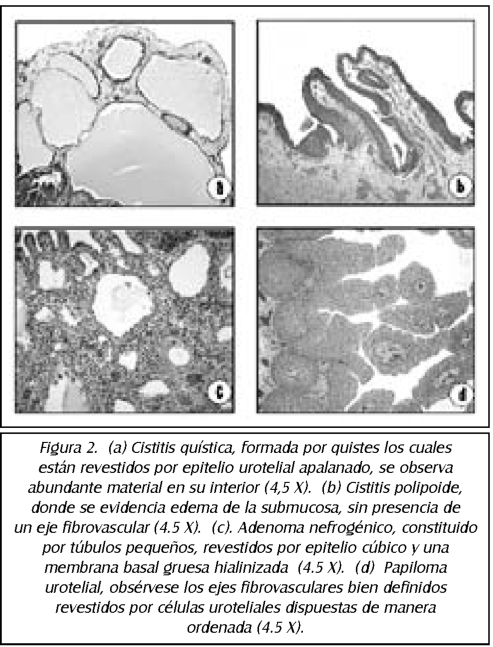
La dstitis polipoide puede desarrollarse como una reacción a cualquier inflamación urinaria.1 Afeda a ambos sexos por igual, con edades que varían entre los 20 meses a 79 años. Citoscópi-camente, se pueden evidenciar áreas de mucosa friable con amplias papilas irregulares o edematosas. Las lesiones generalmente están ubicadas en la región adyacente al área inflamada. El urólogo reconoce más a menudo la naturaleza inflamatoria de la lesión que el patólogo, éste último no debería vacilar ante los casos donde la impresión dtoscópica es de una lesión inflamatoria.1'16
En su forma más prominente, la cistitis polipoide muestra extenso edema de la submucosa con amplias proyecciones bulosas, motivo por lo cual se le denominaba cistitis bulosa19 (Fig. 2b). Otros casos de cistitis polipoide pueden ser más difídles de distinguir de un cardnoma papilar. Sin embargo, estos ejemplos de dstitis polipoide muestran un centro fibrovascular, de base ancha, lo cual contrasta con el tallo fibrovascular delgado y delicado del cardnoma urotelial. Las papilas de la dstitis polipoide no se ramifican en papilas más pequeñas como en los carcinomas uroteliales papilares. Se debería ser cuidadoso ante la presencia de papilas dentro de la dstitis polipoide, las cuales pudieran simular un cardnoma urotelial. Sin embargo, se debe llevar a cabo el estudio de toda la lesión para demostrar que se trata de una cistitis polipoide.1'16'19 La mucosa urotelial que reviste el centro edematoso típico de la cistitis polipoide, puede mostrar atipia urotelial readiva y/o metaplasia escamosa. La dstitis polipoide es una lesión benigna y no presenta ningún riesgo de evolucionar a cardnoma.1'16'19
El adenoma nefrogénico es una lesión benigna la cual está constituida por pequeños túbulos los cuales recuerdan a túbulos renales.20-22 Alrededor de un 90% de los adenomas nefrogénicos se presentan en pacientes adultos con un predominio del sexo masculino.23 Su presencia se ha asociado con el antecedente de cirugía urinaria, litiasis, traumatismo y dstitis.23'24 Macroscópicamente las lesiones pueden ser papilares, sésiles o polipoides y en dos terdos de los casos el tamaño es menor de 1 cm.20-24 Microscópicamente, la arquitedura es tubular en el 96 % de los casos.20-22 Los túbulos son generalmente pequeños, revestidos por epitelio cúbico (Fig. 2c) y uno de los hallazgos más evidentes es la presenda de una gruesa membrana basal hialinizada.20-22 La dilatación quística es frecuente y a menudo tanto los túbulos como los quistes pueden contener secreción eosinófila o basófila.20-22 En ocasiones, la distribución irregular de los túbulos puede dar la apariencia de un adenocarcinoma, sin embargo la falta de crecimiento sólido, atipia nuclear y mitosis atípicas descartan esta posibilidad.25
El papiloma urotelial se considera una lesión benigna, constituida por células uroteliales, las cuales se disponen sobre un eje fibrovascular bien definido.26 Este tipo de neoplasias representa alrededor de un 25 % de todas las neoplasias uroteliales y se presenta en parientes jóvenes (menores de 50 años).26'27 Es importante resaltar que las células que constituyen esta lesión semejan a las células uroteliales tanto en las características cromosómicas, diploidia como en la expresión de antígenos de grupo sanguíneo.27'28 El urotelio que constituye al papiloma no presenta atipias histológicas ni anaplasia y el número de células que forma a la lesión no es importante a la hora de realizar el diagnóstico (Fig. 2d).26 Cabe mencionar que este tipo de tumores tiende a recurrir en un 75 % de los casos y existe la posibilidad de que en los casos de recurrencia, alrededor de un 10 % pudieran desarrollar carcinomas uroteliales.28'29
Los papilomas invertidos se presentan más frecuentemente en pacientes masculinos, con edades que oscilan entre los 50-70 años, con hematuria y/o obstrucción urinaria.30-34 Citoscópicamente, estas neoplasias muestran una apariencia polipoide con superficie lisa o nodular, ubicándose principalmente en el trígono y el cuello vesical.30-34 Generalmente, estos tumores son lesiones pequeñas (menores de 3 cm), aunque pueden adquirir proporciones mayores.30-34
Histológicamente, los papilomas invertidos muestran una superficie generalmente lisa, con tra-béculas revestidas por epitelio urotelial, sin atipias.30-33 Las células uroteliales pueden disponerse en cestas,
columnas anastomosadas, o cordones delgados, pudiendo llegar hasta la lámina propia.30 El estroma adyacente es laxo, delicado, sin evidencias de gran inflamación (Fig. 3a). Focalmente estas neoplasias pueden mostrar proyecciones digitiformes o papilas, a menudo con el mismo crecimiento que las cestas sólidas, con empalizada periférica y agrupamiento nuclear marcado.30-34 Estas proyecciones papilares cuando son focales, no excluyen el diagnóstico de papiloma invertido.30-34 Si este componente ocupa menos de un 10 % del tumor, la lesión debería considerarse y tratarse como un papiloma invertido.30-35
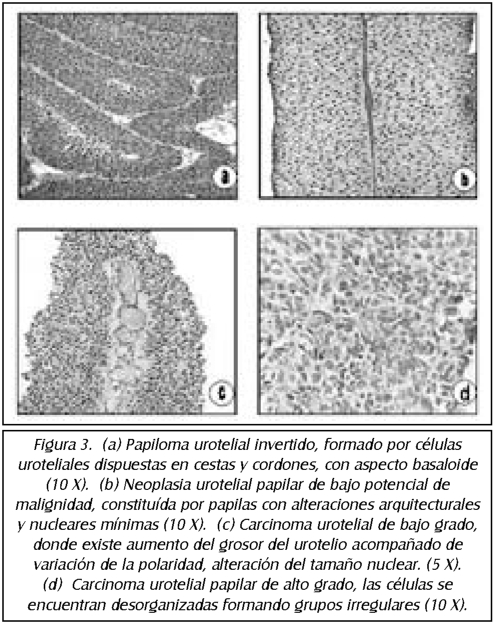
Es interesante resaltar que algunos carcinomas uroteliales pueden poseer una apariencia invertida a menor aumento pero cuando se examinan detenidamente, el infiltrado inflamatorio prominente en el estroma fibroso y/o numerosas mitosis, revela la naturaleza maligna de la lesión.31'32' 35-37 Alrededor de un 5 % de los papilomas invertidos en la vejiga urinaria muestran asociación con carcinoma urotelial papilar; un 18 % de los papilomas invertidos en otras localizaciones han mostrado esta asociación.35-37 Alrededor de un 95 % de los papilomas invertidos son lesiones aisladas sin que presenten recurrencia posterior a la extirpación quirúrgica.35-37 Debido a la ocasional asociación entre los papilomas invertidos y los carcinomas, algunos clínicos recomiendan seguimiento anual con citoscopia y citología urinaria.
NEOPLASIA UROTELIAL PAPILAR DE BAJO POTENCIAL DE MALIGNIDAD
Se considera una lesión urotelial papilar con un arreglo ordenado de las células que constituyen las papilas, con alteraciones arquitecturales y nucleares mínimas, sin importar el grosor del epitelio que constituyen las papilas (Fig. 3b).4 Las mitosis en este tipo de lesiones son infrecuentes y cuando se observan están ubicadas en la capa basal. Esta neoplasia no esta asociada con invasión ni con metástasis; sin embargo, los pacientes con este tipo de tumores presentan un mayor riesgo de recurrencia o de desarrollar nuevas lesiones papilares.4 Debido a lo anterior, es necesario resaltar que estos pacientes necesitan un seguimiento estricto.4
CARCINOMA UROTELIAL DE VEJIGA URINARIA
La incidencia del carcinoma de vejiga urinaria varía a través del mundo, con una mayor tasa en América del Norte y Europa oriental.29 Este tipo de neoplasia muestra una edad máxima de incidencia en la séptima década de la vida, afectando predominantemente al sexo masculino, con una relación de 2.7:1.29 Los posibles factores etiológicos asociados con el desarrollo de carcinoma urotelial se resumen en la tabla 1.38-41 Los síntomas clínicos irritativos, como son urgencia urinaria y disuria se presentan en un 90 % de los pacientes. Menos frecuentemente, los pacientes pueden referir dolor en alguno o ambos flancos, lo cual es debido a la obstrucción de la desembocadura de los uréteres, edema en miembros inferiores por obstrucción linfática o síntomas relacionados con masa pélvica.29
CARCINOMA UROTELIAL PAPILAR DE BAJO GRADO
Estas neoplasias malignas están constituidas por células uniformes, pequeñas dispuestas sobre un eje fibrovascular, las cuales muestran variación arquitectural y citológica. Estos tumores representan entre un 13 a un 30 % de las neoplasias uroteliales. Histológicamente, estas neoplasias son predominantemente

papilares, aunque en ocasiones se puede evidenciar invasión. Otológicamente, hay variación de la polaridad, alteración del tamaño nuclear y de la textura de la cromatina. Las mitosis no son frecuentes y cuando son encontradas generalmente se ubican en la mitad inferior del epitelio, aunque pueden ser evidenciadas en cualquier región (Fig. 3c). Es interesante resaltar que puede existir un espectro de alteraciones arquitecturales y dtológicas dentro de una misma lesión, lo cual obliga a una evaluación completa del material, con la finalidad de diagnosticar el mayor grado de alteración.4
CARCINOMA UROTELIAL PAPILAR DE ALTO GRADO
Estos tumores están caraderizados por la presencia de alteraciones arquitecturales y citológicas de moderadas a marcadas. Arquitecturalmente, las células se encuentran desorganizadas formando grupos irregulares. Citológicamente, la cromatina tienda a ser en grumos y el nudéolo puede ser prominente. Se pueden observar mitosis a cualquier altura del urotelio (Fig. 3d). Es interesante resaltar que en este tipo de tumores se puede evidendar un amplio espectro de alteraciones histológicas, sin embargo para el momento de clasificar a la lesión se debe tomar el mayor grado de alteración. Cuando se realiza el diagnóstico de cardnoma de alto grado, se debe de saber que el riesgo de invasión en este tipo de tumores varía entre un 15 a un 40 % y tienen un riesgo de invasión cuando son diagnosticados por primera vez.4
REFERENCIAS BIBLIOGRÁFICAS
1 Young RH, Eble JN. Non-neoplastic disorders of the urinary bladder. In: Bostwick DG, Eble JN, editors. Urologic Surgical Pathology. St Louis: Mosby, 1997: 166-212.
2 Mostofi FK, Sesterhenn IA, Davis CJ. Dysplasia versus atypia versus carcinoma in situ of bladder. In: McCullough DL, editor. Difficult Diagnosis in Urology. New York, NY: Churchill Livingstone; 1988.
3 Taylor DC, Bhagavan BS, Larsen MP, et al. Papillary urothelial hyperplasia. A precursor to papillary neoplasms. Am J Surg Pathol 1996; 20: 1481-1488.
4 Epstein JI, Amin MB, Reuter VR, et al. The World Health Organization/International Society of Urological Pathology Consensus Classification of Urothelial (Trancisional Cell) Neoplasm of the Urinary Bladder. Am J Surg Pathol 1998; 1435-1448.
5 Delnay KM, Stonehill WH, Goldman H, et al. Bladder histological changes assodated with chronic indwelling urinary catheter. J Urol 1999; 161:1106-1109.
6 Ozbey I, Aksoy Y, Polat O, et al. Squamous metaplasia of the bladder: findings in 14 patients and review of the literature. Int Urol Nephrol 1999; 31: 457-61.
7 Tungekar MF, Linehan J. Patterns of expressions of transforming growth factor and epidermal growth factor receptor in squamous cell lesions of the urinary bladder. J Clin Pathol 1998; 51: 583-587.
8 Kleiman H, Lancaster Y. Condiloma acuminata of the bladder. J Urol; 1962: 52-55.
9 Keating MA, Young RH, Carr CP et al. Condyloma acuminatum of the bladder and ureter: case report and review of the literature. J Urol 1985; 133: 465-467.
10 Del Mistro A, Koss LG, Braunstein J et al. Condyloma acuminata of the urinary bladder, natural history, viral content, and DNA content. Am J Surg Pathol 1988; 12: 205-215.
11 Iwasawa A, Kumamoto Y, Maruta H, et al. Presence of human papillomavirus 6/11 DNA in condyloma acuminatum of the urinary bladder. Urol Int 1992; 48: 235-238.
12 Libby JM, Frankel JM, Scardino PT. Condyloma acuminatum of the bladder and associated urothelial malignancy. J Urol 1985; 134: 134-136.
13 Emmett JL, McDonald JR. Proliferation of glands of the urinary bladder simulating neoplasm. J Urol 1942: 48: 133-138.
14 Ward AM. Glandular Neoplasia within the urinary tract. The aetiology of adenocarcinoma of the urothelium with a review of the literature I. Introduction: the origin of glandular epithelium in the renal pelvis, ureter and bladder. Virchows Archiv A Pathol Anat Histopathol 1971; 352: 296-311.
15 Ito N, Hirose H, Shirai T et al. Lesions of the urinary bladder epithelium in 125 autopsy cases. Acta Pathol Jpn 1981; 31:545-557.
16 Young RH. Pseudoneoplastic lesions of the urinary bladder and urethra: a selective review with emphasis on recent information. Sem Diag Pathol 1997; 14: 133-146.
17 Young RH, Bostwick DG. Florid cystitis glandularis with mucin extravasation: a mimic of adenocarcinoma. Am J Surg Pathol 1996;20 1462-1468.
18 Jost SP, Dixon JS, Gosling JA. Ultrastructural observations on cystitis cystica in human bladder urothelium. Br J Urol 1993; 71: 28-33
19 Young RH. Papillary and polypoid cystitis: A report of 8 cases. Am J Surg Pathol 1988; 12: 542-546.
20 Oliva E, Young RH. Nephrogenic adenoma of the urinary tract: a review of the microscopic appearance of 80 cases with emphasis on unusual features. Mod Pathol 1995; 8: 722-730.
21 Young RH, Scully RE. Nephrogenic metaplasia: A report of 15 cases, review of the literature, and comparison with clear cell adenocarcinoma of the urinary tract. Am J Surg Pathol 1986; 10: 268-275.
22 Rutgers JL, Young RH. Nephrogenic adenoma of the urinary bladder: a comparison of its cytologic and histopathologic features in ten cases. Diagn Cytopathol 1988; 4: 210-216.
23 Peeker R, Aldenborg F, Fall M. Nephrogenic adenoma: a study with special reference to clinical presentation. Br J Urol 1997; 80: 539-542.
24 Porcaro AB, DAmico A, Ficarra V, et al. Nephrogenic adenoma of the urinary bladder: our experience and review of the literature. Urol Int 2001; 66: 152-155.
25 Alsanjari N, Lynch MJ, Fisher C et al. Vesical clear cell adenocarcinoma vs. nephrogenic adenoma: a diagnostic problem. Histopathology 1995; 27: 43-49.
26 Murphy WM, Beckwith JB, Farrow GM, editors. Tumors of the kidney, bladder, and related urinary structures. Washington, DC: Armed Forces Institute of Pathology, 1994.
27 Jordan AM, Weingarten J, Murphy WM. Transitional cell neoplasms of the urinary bladder: can biological potential be predicted from histological grading? Cancer 1987; 60: 2766-2774.
28 Greene LF, Hanash KA, Farrow GM. Benign papilloma or papillary carcinoma of the bladder? J Urol 1973; 110: 205-207.
29 Grignon DJ. Neoplasms of the urinary bladder. In: Bostwick DG, Eble JN, editors. Urologie Surgical Pathology. St Louis: Mosby, 1997: 214-305.
30 Cameron KM, Lupton CH. Inverted papilloma of the lower urinary tract. British J Urol 1976; 48: 567-577.
31 DeMeester LJ, Farrow GM, Utz DC. Inverted papillomas of the urinary bladder. Cancer 1975; 36: 505-513.
32 Kunze E, Schauer A, Schmitt M. Histology and histogenesis of two different types of inverted urothelial papillomas. Cancer 1983; 51: 348-358.
33 Kyriakos M, Royce RK. Multiple simultaneous inverted papillomas of the upper urinary tract: A case report with a review of ureteral and renal pelvic inverted papillomas. Cancer 1989; 63: 368-380.
34 Mattelaer J, Leonard A, Goddeeris P, et.al. Inverted papilloma of bladder: Clinical significance. Urology 1988; 32:192-197.
35 Grainger R, Gikas PW, Grossman HB. Urothelial carcinoma occurring within an inverted papilloma of the ureter. J Urol 1990; 143: 802-804.
36 Renter LG, Kelley J, Belville WD. Inverted papilloma of the urinary tract: Histogenesis, recurrence and associated malignancy. J Urol 1988; 140: 832-834.
37 Schultz RE, Boyle DE. Inverted papilloma of renal pelvis associated with contralateral ureteral malignancy and bladder recurrence. J Urol 1988; 139: 111-113.
38 Howe GR, Burch JD, Miller AB, et al. Tobacco use, occupation, coffee, various nutrients, and bladder cancer. J Natl Cancer Inst 1980; 64: 701-703.
39 Miller AB. The etiology of bladder cancer from the epidemiological viewpoint. Cancer Res 1977; 37: 2939-2942.
40 Sandberg AA, Berger CS. Review of chromosome studies in urological tumors II. Cytogenetics and molecular genetics of bladder cancer. J Urol 1994; 151: 545-560.
41 Me Cullough DL, Lamm DL, McLaughlin AP, et al. Familial transitional cell carcinoma of the bladder. J Urol 1975; 113: 629-635.
Dr. Emilio Álvarez * Oncólogo-Radioterapeuta
Hospital Privado Centro Médico de Caracas
CÁNCER DE VEJIGA URINARIA: ENFOQUE MULTIDISCIPLINARIO
El Cáncer de Vejiga representa el 3% de todos los tumores y ocasiona el 2% de las muertes por cáncer. Desde los inicios de la década de los setenta y hasta los noventa (1973 a 1990) la incidencia del cáncer vesical ha aumentado con una rata de 0,7% anual y su mortalidad ha descendido un 1.8% cada año, en los países desarrollados de Europa y Estados Unidos. Esto representa un incremento en la supervivencia desde la década de los setenta del 61 al 75%. Tal situación se debe al aumento del diagnóstico de un mayor porcentaje de tumores en estadios precoces.1
La carcinogenesis de esta afección se ha relacionado principalmente con la exposición del Epitelio Urotelial a: Fenilalanina, A-Naftilamina, Bencidina y 4-Aminobifenil (carcinógeno presente en el Tabaco). Un estudio realizado en la Universidad de Harvard sobre 47.909 individuos evidenció la asociación significativa que existe entre la ingesta diaria de líquidos y el riesgo de desarrollar Cáncer de Vejiga. En este estudio se demuestra que la incidencia del cáncer vesical disminuye 7% por cada 240ml de líquidos ingeridos, individuos con ingesta superior de 2,5 litros el riesgo es 49% menor respecto a la población con ingesta inferior a 1,3 litros.2
Otros factores implicados como el consumo de tabaco cuyo potencial cardnogénico en tumores de vejiga hacen responsable a este hábito del 30 al 50% de los casos, el uso prolongado de Fenacetina, el antecedente de exposición a la Ciclofosfamida y/o a la radioterapia pélvica han sido ampliamente reseñados en diversos textos sobre la materia.
BASES GENÉTICAS EN LA CARCINOGENESIS DEL CÁNCER DE VEJIGA
El Cáncer de Vejiga suele presentarse como lesiones multifocales sincrónicas (de aparición al mismo momento) ó metacrónicas (de aparición durante la evolución de la enfermedad). Esto se suponía debido a la transformación tumoral de diferentes clonas de células en puntos diversos del urote-lio vesical (origen multiclonal).
Actualmente se acepta el origen a partir de una única célula la cual a través de determinadas alteraciones genéticas experimentaría la transformación tumoral y desde ella primaria se desarrollarían otras a distancia con las mismas características genéticas (origen monoclonal). Desde 1992 esta tesis sostenida por Sidransky y Frost mantiene vigencia pues evidenciaron como diferentes tumores vesicales, de un mismo paciente mostraban el mismo patrón genético idéntico (inactivación del cromosoma X y perdida alelica en el cromosoma 9), por lo que tales hallazgos han venido confirmando el origen monoclonal del cáncer vesical.3
El Cáncer de Vejiga superficial se presenta bajo dos formas claramente diferente; una como tumores limitados a la mucosa, de bajo grado (Ta) con buen pronóstico por su escasa agresividad tumoral y otra como "Carcinoma Insitu" con tendencia a la invasión y metástasis. Estas dos formas de presentación están determinadas por alteraciones genéticas específicas.
¿De esto que sabemos?
1. Los tumores superficiales papilares de Bajo grado presentan alta frecuencia de delecciones alelicas en el cromosoma 9q, mientras que en el "carcinoma insitu" son infrecuentes.
2. Las mutaciones del Gen p53 ocurren raramente en los tumores papilares (3%), mientras que en el "carcinoma insitu" son frecuentes (65% de los casos).
3. En cáncer vesical invasivo ó infiltrante (T2 en adelante), las delecciones del cromosoma 9q ocurren en 60% de pacientes.
En resumen:
"Diferentes alteraciones genéticas determinan distintos patrones de crecimiento tumoral; las delecciones alelicas del cromosoma 9q determinan la transformación del urotelio normal a tumores papilares de bajo grado y la transformación del cáncer insitu a invasivo y la mutación del Gen p53 determina la transformación del urotelio ñor-
mal a carcinoma insitu y la transformación de tumores superficiales a invasivos "A
En fases más tardías del cáncer vesical se encuentran alteraciones de otros cromosomas que se implican en los estadios mas avanzados de la progresión tumoral y pueden apreciarse las perdidas alelicas de los cromosomas 3p, 5q, 6q y 18q, tal como se esquematiza en la figura 1.
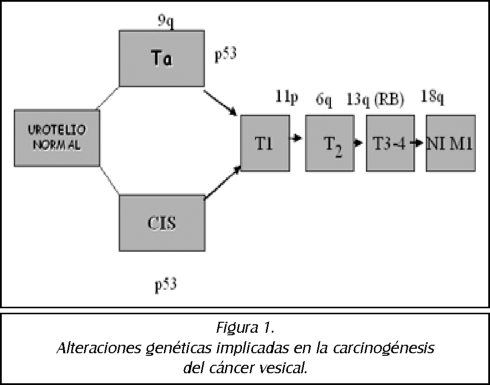
¿Tienen estas expresiones cromosómicas de Biología Molecular aplicación clínica?
Si.
Historia Médica de Mr. H. H 1967:
"Masculino de 68 años con cuadro de Hematuria que ingresa al Hospital Naval de Bethesda. Se practicó dstoscopia y se diagnosticó Cistitis Crónica con un foco de displasia, sus citologías de orina fueron sospechosas para carcinoma urotelial aunque de manera no concluyente.
Dos años mas tarde reingresa a la institución y se diagnóstica carcinoma insitu y no recibe ningún tratamiento hasta 1973 cuando se diagnóstica un carcinoma microinvasivo con un foco de Cis en la uretra, por ello se trata con radioterapia y quimioterapia endovesical.
En 1976 presenta un nuevo episodio de Hematuria y la biopsia vesical demuestra carcinoma invasor practicándose una dstoprostatectomía y en la pieza se evidendaron ganglios linfáticos regionales metastásicos. En 1978 el padente falledó por progresión de enfermedad".
Este padente fue el vicepresidente de Estados Unidos el Senador Humbert Humphrey y recientemente en 1994 investigadores del Johns Hopkins Hospital consiguieron la mutadón del Gen p53 en las citologías de orina practicadas en 1967 y en el tejido tumoral de 1976.5 Esto es realmente ilustrativo para concluir que si los médicos que trataron al Sr. Humphrey entre el 67 y 76 hubieran poseído la infor-madón sobre este marcador biológico muy probablemente su tratamiento hubiera sido diferente.
TRATAMIENTO DEL CÁNCER DE VEJIGA
El tratamiento del cáncer vesical se describe en relación al estadio evolutivo de la enfermedad al momento del diagnóstico y básicamente se explica en 3 fases de la historia natural de esta patología oncológica:
1. TRATAMIENTO DEL CANCER VESICAL SUPERFICIAL
El tratamiento estándar en este momento del desarrollo evolutivo de la enfermedad es la Resecdón Transuretral (RTU), aún cuando se sabe hay entre 30 a 80% de reddivas locales.
La adición de tratamiento endovesical con Quimioterapia o BCG disminuye el índice de reddivas y se debe realizar en todos los parientes con elevado riesgo de recidiva.
¿Cuáles son los factores pronósticos del Cáncer Vesical Superficial?
Los fadores que pueden indicar incremento del índice de recurrencia y progresión del cáncer vesical superficial son:
• Estadio (Ta vs. TI)
Cáncer Vesical Papilar no invasivo contra cáncer que compromete el corion de la mucosa.
• Grado Histológico (G1 vs. G2-3).
• Número de Tumores (< 4 vs. >4).
• Tamaño del Tumor (< 3cm vs. >3cm).
• Configuración del Tumor. (Sólido ulcerado vs. papilar).
• Presencia de CIS.
• Multifocalidad.
De ellos se sabe que la presenda de multifocali-dad es la prindpal determinante de reddiva local y el estadio y grado histológico lo son de la progresión a cáncer vesical invasor.
PAPEL DEL TRATAMIENTO MULTIMODAL EN CÁNCER SUPERFICIAL DE VEJIGA
El papel de la Quimioterapia intravesical en la prevendón de las reddivas del cáncer superfidal de la vejiga se demuestra en la meta-análisis de 3,852 pacientes con tumores Ta - TI induidos en 29 estudios controlados. Se demuestra de manera dara que la vacuna BCG es el fármaco mas activo en la reducción de las tasas de recidivas logrando en el primer año disminudón del 40% contra el 12% de Tiotepa, 13% de la Adriamicina y 15% con la Mitomicina C. de la misma manera el estudio de Herr y Col muestra una reducción de la tasa de progresión al comparar el uso de BCG adyuvante por sobre la RTU sola 37% vs. 62% y la sobrevida a 10 años de 75% vs. 55%.6
En la figura 2 puede verse el esquema de tratamiento multimodal para el cáncer superficial de vejiga donde daramente se aprecia como es del dominio total del urólogo desde el diagnóstico, pasando por el tratamiento y seguimiento de estos pacientes que constituyen el 75% de los casos de esta patología.
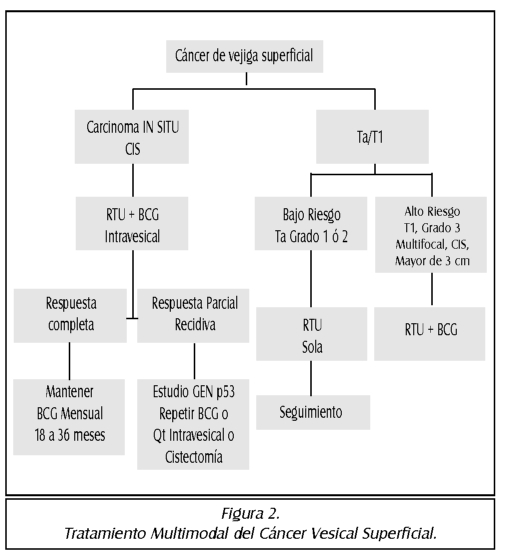
2. TRATAMIENTO DEL CANCER INVASOR O INFILTRANTE DE LA VEJIGA NO METASTASICO
Dentro de este grupo de pacientes se encuentran las siguientes categorías:
T2 a T4,
NO a N2,
M0.
De manera dara y taxativa la cistetomía radical con linfadenedomía pélvica es el tratamiento estándar del cáncer vesical infiltrante no metastático.
En el varón, la operadón incluye vejiga, la próstata y las vesículas seminales mientras que en la mujer se reseca vejiga, útero, anexos, uretra y una porción de la pared vaginal anterior.
En líneas generales la sustitudón de la Vejiga se realiza con ileonterminal fabricándose una derivadón continente ó técnica de Camey que evita la extracdón de orina por vía percutánea ó técnica de Bricker.
Hoy en día la mortalidad operatoria es inferior al 2% y persiste como problema la impotenda que acontece entre el 30 al 90% de pacientes varones.
La sobrevida global lograda con esta operación en las categorías de paciente señalados es de 36 a 48% a 5 años, la tasa de recidivas locales está alrededor del 10% y la mayoría de los pacientes fallecen por progresión de enfermedad a distancia ó metástasis.7
La cistectomía pardal está indicada en menos del 10% de los casos con tumores pequeños, localizados en cúpula vesical y sin evidenda de CIS.
Si bien lo anteriormente citado es derto se pueden inferir algunos hechos importantes:
1. Hay una rata de fracasos mortales situada entre 52 y 64% de pacientes.
2. En los subgrupos de pacientes con invasión a pared pélvica ó estructuras adyacentes, la sobrevida larga es una excepción (categoría T4a y T4b).
3. En los parientes con compromisos ganglionar pélvico la dstedomía radical sola produce sobrevida a 5 años de 5% (serie de Whitmore) y las series mas modernas (Skinner) llegan a 5 años solo 1 de cada 3 pacientes operados.8
Es evidente que el fracaso quirúrgico del cáncer vesical está determinado por la presencia de enfermedad micrometastásica ó subclínica a distancia presente al momento del diagnóstico inicial, su desarrollo determinará la presencia de metástasis y el fallecimiento de los enfermos.
Esto plantea la imperiosa necesidad de tratamiento multimodal, para lo que hoy aun se establecen protocolos de estudios en fase III aleatorizados que permitían establecer con certeza (nivel I de medicina basada en evidencia) la eficacia de los tratamientos con Quimioterapia primaria ó neoadyuvante (antes de la cirugía) y/o adyuvante (post-operatoria) en estos pacientes.9
El principal problema a enfrentar en la realización de estos estudios fase III aleatorizados con grupo control al azar donde se compare la Quimioterapia en cualquiera de sus modalidades pre ó post-opera-toria y cirugía radical contra la sola cistectomia radical esta dado en el número de pacientes afectados en este momento evolutivo de la enfermedad necesarios para ser incluidos en un estudio clínico de esta naturaleza donde la diferencia en sobrevida esperada entre ambos brazos del ensayo es de poca magnitud ejemplo:
"Una detección de diferencia en sobrevida de 10% entre el brazo con Quimioterapia por sobre la cirugía estándar, requiere para ser válido la inclusión de 1000 pacientes en un lapso de 3-4 años y un período de observación (seguimiento) de 2 años. Debería haber al menos 400 muertes para que el ensayo tenga una probabilidad del 90% de detectar la diferencia de sobrevida planteada (10%)".10'11
Es evidente la enorme dificultad estadística, la meticulosidad y lo riguroso del explicado concepto de estudio clínico que habría de llevarnos a conclusiones incontroversibles sobre el tratamiento del cáncer invasor de vejiga no metastático con Quimioterapia, mientras tanto hay que esperar el desarrollo de estos estudios y considerar a la cirugía el estándar de tratamiento.

QUIMIOTERAPIA ADYUVANTE
En la tabla 1 se pueden apreciar algunas series controladas donde se evalúa la eficacia en cuanto a sobrevida al comparar la cistectomia radical sola contra la misma operación y Quimioterapia adyuvante.
El objetivo en tratar con Quimioterapia adyuvante al paciente dstectomizado esta dado en retrazar la aparidón de recidivas metastásicas y por ende mejorar las tasas de sobrevida global, hecho esto logrado en diversos tumores sólidos, si bien es cierto algunas series muestran tal resultado no es menos derto que el punto sigue siendo controvertible dado que la mayoría de las series muestran defedos metodológicos y otras no muestran el benefido esperado.12'13'14'15'16
QUIMIOTERAPIA PRIMARIA Ó NEOADYUVANTE
La administración de Quimioterapia previa a la cistectomia radical, ofrece algunas ventajas al beneficio teórico de incrementar el intervalo libre de enfermedad ó reddivas y la sobrevida global, tal benefido es el permitir la valoración in vivo de la sensibilidad de las células tumorales a las drogas dstostaticas administradas pues si hay respuesta en la disminución y/o desaparición del tumor endovesical medíble por cistoscopia y sistemas de imágenes (TAC, RMN, Ecosonografía Transrectal), constituyen prueba inequívoca de tal reacción de la célula tumoral a los cistostaticos empleados independientemente de su localizadón en la vejiga ó en las micrometástasis a distancia.17
Este concepto de Quimioterapia pre-operatoria ofrece algunas otras ventajas entre las que se dtan mas frecuente:
1. Convertir tumores irresecables localmente avanzados en lesiones resecables.
2. Posibilidad de preservar la vejiga.
3. Establecer valor pronostico según la respuesta a la Quimioterapia.
De lo expresado son bastante alentadores los resultados del estudio aleatorizado en fase III del "Nordic Cooperative Bladder Cáncer Study Group" donde los pacientes 325 en total se dividieron en 2 grupos; el primero recibió un régimen a base de Platino - Adriamicina seguido de Radioterapia y Cistectomia y el segundo solo recibió Radioterapia -Cistectomia, los estadios involucrados en la experiencia fueron T1G3, T2 y T4N0M0. En la interpretación de sus resultados se mostró el beneficio de la Quimioterapia Neoadyuvante sólo en tumores T3 y T4N0M0, lográndose mayores tasas de resecabilidad y sobrevida.18
En la tabla N°2 se aprecian algunas series de Quimioterapia Neoadyuvante predstedomía donde se concluye que el beneficio en términos de sobrevida es controversible en estos momentos.
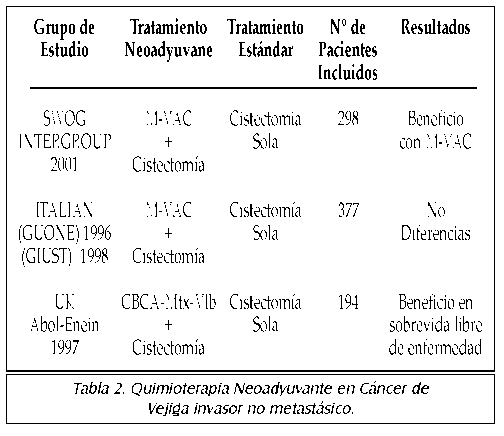
Una serie controlada presentada en la reunión de ASCO (American Society of Clinical Oncology) 2001 en sesión plenaria por el Dr.Crawford (Urólogo Oncólogo del Centro de Cáncer de la Universidad de Colorado) merece espedal atención:
• Es un trabajo multi-institudinal realizado por SWOG, ECOG y CALGB con el régimen de Qt M-VAC + dstedomía radical contra Cistectomia radical sola, el seguimiento es de 7 años y se apreda una significativa diferencia en sobrevida media de 2.4 añosmás en el grupo de tratamiento combinado por sobre la drugía sola.19
• Una segunda consideradón del estudio revela que el 38% de los pacientes que recibieron Quimioterapia con el régimen M-VAC no tenían evidenda de tumor en la pieza operatoria extraída durante la dstectomía y de estos el 85% están vivos 5 años después de la drugía.19
• La toxicidad del régimen es descrita como aceptable y no incrementa los porcentajes de complicaciones quirúrgicas.19
QUIMIOTERAPIA NEOADYUVANTE, RADIOTERAPIA Y PRESERVACIÓN DE LA VEJIGA
¿Es esta una alternativa terapéutica?
La respuesta a esta interrogante solo se aclararía si hubieran estudios controlados para definirla sin embargo algunos eventos ayudan a responder sobre esta novedosa propuesta de tratamiento.
1. Este enfoque se ha venido usando en otros tumores sólidos lográndose iguales resultados a cirugía con la ventaja evidente de preservación del órgano, tal es el caso de Cáncer Anal, Laringe, Mama y Osteosarcoma.
2. La preservación de la Vejiga evitaría operaciones derivativas y vida sexual sin compromiso limitante.
3. La respuesta al tratamiento con Quimioterapia medida como respuesta completa patológica en especímenes de cistectomía radical (pTo) es de 38% en la serie de SWOG intergroup y de 33% en el EORTC - MRC. (20)
4. Si evaluamos series de cistectomía radical sola obtenemos;
• Universidad Sureste de California (USC) con sobrevida a 5 años de 48% para todos los estadios invasores no metastásicos con resultados así;
pT2 = 72%, pT3a = 58%, pT3b = 38% pT4 = 33%.
Total de pacientes 633.21
|
SERIE |
NUMERO DE PACIENTES |
REGIMEN DE QUIMIOTERAPIA |
SOBREVIDA A 5 AÑOS |
SOBREVIDA CON VEJIGA INTACTA |
|
RTOG PROTOCOLO 85-121 1993 |
42 |
CDDP-Rt |
52% |
42% |
|
RTOG 88-02 1996 |
91 |
MCV + Rt-CDDP |
62% |
44% |
|
RTOG 89-03 1998 |
123 |
MCV + Rt-CDDP |
48% |
36% |
• Memorial Sloam Kettering Cáncer Center: Sobrevida global a 5 años 36% con resultados por estadios en;
pT2 = 59%, pT3 = 25% y pT4 = 29%
Total de pacientes 284.22
• Universidad de Padua: Sobrevida Global a 5 años 44% con resultados por estadios así:
pT2 = 63%, pT3a = 53%, pT3b = 32,5% pT4 = 28%.23
5. Es evidente que los resultados enumerados en el punto anterior provenientes de renombrados centros oncológicos norteamericanos y europeos son similares a las cifras reportadas con quimio-radiadón provenientes del Massachussets General Hospital y del Radiation Terapy Oncology Group cuyos resultados a 5 años de sobrevida global de T2-T3 de cáncer vesical invasivo son de 54% y 49% respedivamente logrados con el tratamiento preservador.24'25
Esta comparadón numérica aun cuando es razonable no es conduyente pues no son series comparables por ser de diferentes observadores, métodos estadificación distintos e involucra la selecdón de parientes lo que no permite considerarla sino como una fuente de estudios en progreso.
La tabla N°.3 presenta unos resultados dignos de ser considerados esperando los estudios controlados que vendrán próximamente a despejar este manejo terapéutico posible solo en pacientes muy bien seleccionados.
TRATAMIENTO DEL CANCER VESICAL METASTÁSICO
|
SERIE |
NUMERO DE PACIENTES |
REGIMEN DE QUIMIOTERAPIA |
SOBREVIDA A 5 AÑOS |
SOBREVIDA CON VEJIGA INTACTA |
|
MASS GEN 1997 |
107 |
MCV |
53% |
43% |
|
UNIVERS. ERLANGN 2001 |
199 |
CDDP-CBCA |
52 |
41% |
|
Tabla 3. Tratamiento combinado con quimioterapia y preservación de la vejiga. | ||||
Dado que no es el tema central del capítulo solo se reseñan los aspectos básicos del mismo.26
1. Las tasas de respuestas del cáncer de vejiga metastático permiten afirmar que es un tumor quimiosensible.
2. Las drogas dtostáticas mas útiles en esta situa-dón son: Cisplatino y Metrotexate, más redente el Paditaxel (taxol) y la Gemdtabina (Gemzar) sus tasas de respuestas están entre 30 a 45%.
3. Diversas series han demostrado que la Quimioterapia de combinadón tiene mejores respuestas tumorales que la terapia con Monodrogas (esto es válido para la gran mayoría de los tumores).
El régimen mas usado es el M-VAC con respuestas desde 40 a 72% según diversos autores. Llamativo es el hecho que el uso de este régimen tiene una toxicidad considerable de neutropenia y fiebre neutropénica en estadios IV. No así cuando se usa a título adyuvante ó neoadyuvante en caso de invasión de pared vesical ó tejidos perivesicales sin metástasis a distanda.
4. Recientemente muchos autores han presentado estudios fase II (muestran resultados ó experiendas sin grupo control) con fármacos mas modernos tales como Docetaxel, Gemdtabina y Paditaxel considerándolos y recomendando su uso como agentes de primera línea en cáncer vesical metastático, su índice de respuesta está entre 50 y 70% con menor toxiddad.
Pronto se verán series con estos agentes anti-neoplásicos en tratamientos adyuvantes, neoadyuvantes ó de radiosensibilizadón y preservadón vesical.
Todavía hay mucho por hacer...
1. Rosell, R; Abd, A: Manual de Oncología Clínica y Molecular. Edic. Aram: 2000. Citado A. Font Pous pp 333.
2. Michaud DS; Spielgelman D et al: Fluid Intake and the Risk of Bladder Cáncer in Men NEJM 1999; 340: 1390-1397.
3. Sidransky D; Frost P: Clonal Origin of Bladder Cáncer. NEJM 1992; 326: 737-740.
4. Dalbagnig; Prest; et al: Genetic Alteración in Bladder Cáncer. Lancet. 1993; 342: 469-471.
5. Hruban Rh; Van der Riet P; et al: Molecular Biology and early detection of carcinoma of the Bladder. The case of Humbert H Humphrey. NEJM 1994; 331: 1276-1278.
6. Citado: Ozen H: Bladder Cáncer Current opinion in Oncology 1998; 10: 273-278.
7. Stemgerg CN; Calabro F: Chemotherapoy and Management of Bladder tumours. Br J Urol 2000; 85: 599-610.
8. Lerner SP; Skinner E; et al: Radical Cystectomia in invasive Bladder Cáncer. Uro Clin North Am 1992; 19: 713-723.
9. Ibraham, J; Allegra, C: Handbook of Clinical Oncology. Bethesda NCI/NHI. Capt 14 Noelapu S, Dahut W; pag 175. Lippin Cott Willians and Willians year 2001.
10. Machin D; Campbell M J; et al: Sample Size tables for clinical studies. London: Blackwell 1997.
11. Sternberg; C. M: No adyuvant and adyuvant chemotherapy of Bladder Cáncer. Annals of oncology. Educational Book of 27th ESMO congress, October 2002.
12. Logothetis C J; et al: adyuvant cyclophosphamide doxurubicin and cisplatinun chemotherapy for Bladder Cáncer: an Update. J. Clin Oncol 1988; 6: 1590-1596.
13. Skinner DG; et al: The role of adyuvant chemotherapy following cystectomy for invasive Bladder Cáncer: a prospective trial. J Urol 1991; 145: 459-467.
14. Stocke M; et al: Advanced Bladder Cáncer: J. Urol 1992; 148: 302-307.
15. BONO AV; et al: Adyuvant chemotherapy in advanced Bladder Cáncer. Italy Uro-Oncology cooperative Group. Prog Clin Biol. Resp 1989; 303: 533-540.
16. Otto T; et al: Adyuvant chemotherapy in locally advanced Bladder Cáncer: a phase III study. Eur Urolg 2001; 39 (suppl 5): 147 (abstr).
17. Sternberg CM; et al: Neo-adyuvant chemotherapy in invasive Bladder Cáncer. World J Uro 2001; 19: 94-98.
18. Malmstron PU, Rintala E; et al: Neo-adyuvant CDDP-Mtx chemotherapy on invasive Bladder Cáncer. Nordic Cystectomy Trial 2 Eur Urol 1999; 35 (Suppl 2): 60 (abstr 238).
19. Crawford, D: et al New Bladder Cáncer treatments incresis life expectancy oncology news international ONI Novem 2001. Volume 10 Number 11, pag.3
20. Sternberg CN, Calabro F; et al: Can we select patients for Bladder preservation based upon response to chemotherapy? J Urol 2000; 163; 216 (abst).
21. Stein JP; et al: Radical cystectomy in the treatment of invasive Bladder Cáncer: Long term results. J Clin Oncol 2001; 19: 666-675.
22. Dalbagni G; et al: Cystectomy for Bladder Cáncer: a contemporary series. J Urol 2001; 165: 1111-1116.
23. Chann SS; Cookson MS: Radical Cystectomy is safe in elderly patients at high risk. J Urol 2001; 166: 938-941.
24. Tester W, Porter A; et al: Combined Modality program with posible organ preservation for invasive Bladder Cáncer. Results of RTOG protcol 85-12. Int J Rad Oncol Biol. Phys. 1993; 25: 783-790.
25. Kachnic LA; et al: Bladder preservation by combined modality therapy for invasive bladder cáncer. J Clin Oncol 1997; 15: 1002-1029.
26. Neelapu S; Dahut W: Bladder Cáncer. Handbook of clin oncology bethesda lippincott year 2001.
Dr. Rodolfo Matheus U. * Especialista Urólogo
Clínica El Ávila, Caracas
EVALUACIÓN DEL HOMBRE IN FÉRTIL
Aproximadamente 15 % de las parejas son incapaces de iniciar una preñez sin ninguna forma de asistencia o terapia. Se dice que estamos ante una infertilidad primaria cuando luego de un año de mantener coitos sin ningún tipo de protección no se logra el embarazo. En aproximadamente un tercio de las parejas el factor masculino parece ser el responsable y en un 20% adicional de las parejas existe tanto una causa masculina como femenina responsable de dicha infertilidad, lo que hace que en términos globales, en un 50% de los casos de infertilidad este implicada una etiología masculina.
Existen dos tipos clásicos de hormonas en el cuerpo, las peptidicas y las esteroideas, ambas son encontradas en el axis Hipotálamo-Hipófisis-Gonadal y son importantes para la reproducción. Entre las primeras están la hormona Folículo estimulante (FSH) y la hormona luteinizante (LH). Las hormonas esteroideas originadas a partir del colesterol y no de aminoácidos como las anteriores, son la testosterona y el estradiol.
A través del biofeedback es que las hormonas pueden regular la síntesis y acción de ellas mismas o de otras hormonas.
El hipotálamo libera varias hormonas que actúan a nivel de la pituitaria, entre ellas, la más importante para la reproducción es la hormona liberadora de gonadotropinas (Gn-RH o LH-RH). Esta va a estimular la secreción de LH y FSH a nivel de la pituitaria anterior. La secreción de Gn-RH esta sujeta a una variedad de influencias que incluyen los efectos del stress, ejercicio y dieta desde los cetros cerebrales superiores. Se conocen también sustancias que alteran la secreción de Gn-RH, principalmente inhibiéndola como son los opioides (morfina), cateco-laminas, prostaglandinas y esteroides testiculares. Su secreción es pulsátil o episódica y es este patrón secretor que gobierna la liberación cíclica de LH y en menor intensidad la de FSH desde la pituitaria. Las concentraciones de FSH en sangre son menos variables que las de LH, por lo que una única muestra de sangre para FSH que tiene una vida media mayor (4 horas) es más confiable clínicamente que una única muestra de sangre para LH (0,5 horas).
La secreción de LH es regulada también por andrógenos y estrógenos. La testosterona y la DHT pueden disminuir la secreción de LH en ausencia de estrógenos. Con respecto a la FSH, su secreción es regulada no solo por la Gn-RH, si no también por los esteroides gonadales, testosterona y estradiol así como por proteínas gonadales, como son la inhibina y adivina.
El único efecto conoddo de la LH y FSH es en las gónadas, donde activan la adenilato dclasa lo cual elevan el AMP dclico intracelular; la LH estimula la producción esteroidea en las células de Leydig por inducir la conversión de colesterol a pregnenolona y eventualmente a testoterona. La FSH se une a las células de Sertoli y a las espermatogenias dentro del testículo y es el mayor estimulador del crecimiento del tubulo seminífero durante el desarrollo. La FSH es esendal para la inidación de la espermatogenesis en la pubertad, pero una vez que la espermatogonia comienza a proliferar por su influencia ya la maduración espermática depende de la testosterona.
Una tercera hormona hipofisaria es la proladina, la cual aumenta la concentradón de receptores de LH en las células de Leydig y ayudan a mantener los niveles de testosterona intratesticular normal / altos. Sus niveles normales son esendales para una libido normal. Un factor de inhibidón de proladina es la dopamina de allí que cualquier trastorno en la síntesis, transporte o interaedón de esta, disminuye su acción inhibitoria y eleva los niveles de proladina. También esta influendada la secreción de prolactina por el stress, el ejercido, elevando sus niveles.
Una cuarta hormona implicada en la fertilidad es la hormona de crecimiento. Esta hormona que es liberada en la hipofis en respuesta a un factor liberador de hormona de crecimiento (GHRH) desde el hipotálamo, estimula la secreción de un factor de crecimiento similar a la insulina (IGLF-1) dentro del testículo. Existe evidencia de que es un importante factor de crecimiento para la espermatogénesis. La hormona de crecimiento es esencial en la pubertad para la maduración testicular normal, así estados de deficiencia de esta hormona conlleva a retardo en la pubertad y reducción en la producción de esferoides.
En el hombre normal 2% de la testosterona se encuentra libre y es biológicamente activa, el resto esta unida a una albúmina y a una globulina de unión a hormona sexual (SHBG) dentro del torrente sanguíneo. Esta última también se une en menor proporción al estradiol. Varias condiciones patológicas alteran los niveles de SHBG y como consecuencia los niveles de testosterona activa; elevación de niveles de estrógenos y hormona tiroidea elevan la SHBG, disminuyendo la testosterona libre mientras que la obesidad, los andrógenos y la hormona de crecimiento disminuyen la SHBG y elevan la fracción de andrógeno libre.
La testosterona tiene dos metabolitos: la DHT por acción de la 5 alfa reductasa y estradiol a través de una aromatasa.
La testosterona no requiere a nivel de testículo su conversión en DHT para actuar. Ella estimula a nivel de las células de sertoli la producción de proteína de unión androgenica (ABP), la cual se une a la testosterona y a la DHT. Es secretada en los tubulos seminíferos, en el fluido intersticial y transportado al epidídimo. En estas localizaciones, lleva a que la concentración androgenica alcance concentraciones 50 veces mayor que en la circulación periférica.
En respuesta a la FSH, las células de sertoli se convierten en un huésped de productos secretorios importantes para el crecimiento de las células germinales, incluyendo ABP, transferrina, lactato, cerulo-plasmina, closterina, activador de plasminogeno, prostaglandinas y varios factores de crecimiento.
Como se menciono anteriormente en la regulación de la FSH participan también la inhibina y activina, la primera producida en las células de sertoli, se correlaciona inversamente con los niveles séricos de FSH en hombres normales e infértiles y se correlaciona muy bien con el volumen testicular y la presencia de espermatides. Una función epididi-maria normal es necesaria para maduración espermática. La secreción de proteínas epididimarias necesarias para esto es dependiente de los andrógenos. Los estrógenos a nivel de la cabeza del epidídimo aumentan la concentración de los espermatozoides por promover la absorción de fluido testicular a este nivel.
Entre los trastornos genéticos implicados en infertilidad masculina existen aquellos que producen azoospermia obstructiva y aquellos que ocasionan fallo de la espermatogenesis.
Entre los primeros se encuentra las mutaciones del gen regulador de conducción transmembrana de la fibrosis quistica (CFTR). En esta, existen anomalías de desarrollo del conducto mesonefrico (wolfiano). Estas pueden resultar en ausencia congénita bilateral de ambos vasos deferentes más comúnmente pero puede también expresarse como obstrucción de conducto eyaculatorio o en obstrucción epididimaria idiopatica. Cerca del 80% de hombres con ausencia congénita bilateral de vasos deferentes tendrán al menos una mutación del gen de fibrosis quistica (FQ). Estas mutaciones pueden ser encontradas también en el 4% de esposas sanas. Estas parejas deben recibir consejo genético para informales del riesgo de tener un niño con FQ o de transmitir una mutación genética de fibrosis quistica a sus hijos.
Entre las anormalidades genéticas asociadas con fallo de espermatogenesis tenemos el síndrome de Klinefelter, que es la anormalidad cariotípica más común en el hombre infértil, encontrándose en 7%-13% de hombres azoospermicos. Casi todos los hombres con la forma clásica pura (47, XXY) son azoospermicos, mientras que hombres con un patrón de mosaicismo, tendrán una producción limitada de espermatozoides que pueden ser obtenidos por extracción espermática testicular (TESE).
Se han identificado microdelecdones en el brazo largo del cromosoma Y, en 10-12% de hombres azoospermicos y en 3-10% de oligospermicos. Estos individuos tienen un cariotipo normal. Se han encontrado 3 regiones dentro del cromosoma Y, llamadas AZFa, AZFb, AZFc que contiene genes necesarios para que ocurra la espermatogenesis. Con micro-delecciones, la espermatogenesis esta dañada o ausente. Una región adicional del cromosoma Y, referida como AZFd, se encuentra dentro de AZFc. La región especifica que esta perdida da significación pronostica. Hombres con delecdón de AZFc, tienen la posibilidad de presentar producdón espermática y muchos de estos tienen en ocasiones espermatozoides en el eyaculado y en otros se podrán obtener mediante TESE (hasta un 70%). Sin embargo para hombres con delecciones completas de AZFa, AZFb el chance de poder obtener espermatozoides en el eyaculado o mediante TESE es prádicamente nulo. Por otro lado si las delecciones de estas regiones son pardales, el padente puede presentar espermatozoides dentro del testículo o aun ser oligospermico. Estas anormalidades de delección son transmitidas a los hijos por lo que es recomendable consejo genético a la pareja.
Comenzando con patologías en la niñez como son el criptorquidismo. Aproximadamente 30% de hombres con criptorquidismo unilateral y 50% con criptorquidismo bilateral tienen contajes espermáticos por debajo de 12-20 millones por mi. Historia de orquitis urliana post puberal (después de los 11 años) es también importante; en esta se puede presentar orquitis unilateral en un 30% y 10% bilateral con atrofia testicular. Antecedente de YV plastia de cuello vesical puede ocasionar eyaculadón retrograda y debe ser sospechada ante el antecedente de cirugía vesical junto con volumen de eyaculado menor de 1 cc. y severamente oligospermico. El corredo diagnostico será mediante un examen de orina post eyaculación. Antecedente de extrofia vesi-cal/epispadia en los cuales los condudos eyaculato-rios podrían estar obstruidos o presentar eyaculación retrograda.
La historia debe incluir toxinas ambientales y medicación que puede interferir con la espermatogenesis ya sea diredamente o a través de alteradones en el sistema endocrino. Pestiddas, metales pesados, solventes orgánicos, medicaciones como la Sulfaza-lacina, Cimetidina, Nitrofurantoina, Minociclina, bloqueadores de canales de calcio, Allopurinol, Colchidna, Ketoconazol, Espiroladona, pueden llevar a daño de la espermatogenesis o de la función espermática. La Nicotina, y Marihuana pueden contribuir a la disminución de la concentración espermática, de la motilidad y morfología normal. Excesivo alcohol y varios narcóticos ilídtos pueden directamente afedar la función testicular por causar alteradones en el axis hipotalamo-hipofisis- testicular.
El uso de esferoides anabólicos, ejerce un efedo deletéreo sobre la secreción de gonadotropinas e interfieren con la espermatogenesis normal. Llevan a atrofia testicular y raramente a ginecomastia. Estos cambios al igual que aquellos de muchas de otras drogas mendonadas pueden ser revertidos - pero no en todos los casos- si la droga es suspendida.
Agentes como el calor, radiadones ionizantes y quimioterapeuticos pueden severamente y algunas veces permanentemente interferir con la espermatogenesis. La azoospermia ocurre en 20-40% de hombres tratados con quimioterapia para cáncer de testículo y en 70% de aquellos que redben tratamiento para enfermedad de Hodgkin con esquema de MOPP(mostaza nitrogenada, oncovin, procarbazina y prednisona).
la linfadenectomia retroperitoneal como parte del tratamiento del cáncer de testículo puede implicar esdsión de cadenas simpáticas necesarias para la eyaculación; aproximadamente 75% de todos los parientes podrán mantener el potencial para fertilidad. Algunos pacientes mantendrán la emisión pero muchos de ellos tendrán eyaculadón retrograda y/o perdida de la emisión seminal. La prostatectomia transuretral o abierta producirá eyaculación retrograda en un 40-90%.
Coitos demasiados frecuentes pueden resultar en inadecuado numero de espermatozoides depositados en la cúpula vaginal y por otro lado el coito infrecuente puede llevar a que el periodo ovulatorio pueda ser desaprovechado. Es entonces conveniente el coito cada 48 horas, tomando en cuenta la viabilidad del espermatozoide en el moco cervical normal (48 horas), eso asegurara espermatozoides óptimos durante las 24 horas que dura el oodto dentro de la trompa de Falopio y pueda ocurrir la fertilización.
La mayor probabilidad de concepción ocurre dentro de las 48 horas que preceden a la ovulación.
Se debe establecer la fundón eréctil y eyaculatoria así como el uso de lubricantes vaginales durante el coito ya que muchos de los comúnmente usados, afectan la motilidad espermática.
Dentro del examen físico se debe evaluar el habito corporal; si el padente parece estar inadecuadamente virilizado (defidenda androgenica), evidenciado por disminudón del vello corporal, ginecomastia, pro-pordones eunucoides, etc, el diagnostico de retardo de maduradón debido a anormalidades endocrinas debe ser considerado y evaluado.
El pene deber ser examinado en busca de hipospadia y severa cuerda ventral ya que esto puede interferir con la adecuada deposidón del semen a nivel profundo en la vagina cerca de la cerviz. El contenido escrotal debe ser examinado con el paciente de pie. Los testículos deben ser cuidadosamente palpados para determinar consistencia y exduir la presencia de una masa intratesticular. Las dimensiones testiculares deben ser medidas usando un orquidometro o mediante ecosonografía. En hombres normospermicos la longitud del testículo debe ser mayor de 4 cms y el volumen mayor de 20 mL. Disminudón de la talla testicular esta asodado con fallo de la espermatogenesis.
Cuidadosa palpadón del epidídimo puede revelar una obstrucdón por la presencia de induración o dilatación quistica del epidídimo. Espermatoceles y quistes epididimarios no indican la presencia de obstrucdón. Palpación de vasos deferentes asegurara su presenda, y su nodularidad sugiere obstrucdón. Exámenes de los cordones espermáticos pueden identificar la presenda de varicocele, que pueden aparecer o ser más evidentes mediante maniobra de Valsalva.
Examen digital redal es necesario para establecer tamaño prostático, así como para excluir induración prostática o congestión prostática (esta última sugiriendo infección prostática), la presencia de dila-tadón quistica de vesículas seminales.
EXÁMENES DE LABORATORIO RUTINARIOS
Todos los parientes deben tener al menos dos o tres análisis del semen. El análisis del semen sin embargo no es examen para fertilidad ya que sus resultados son solo una parte del potencial de los espermatozoides para fertilizar, existiendo otros parámetros importantes que configuran la capacidad total de fertilización del espermatozoide (capacitación, reacción acrosomal, etc.).
La organización mundial de la salud (WHO) tiene los siguientes estándares en el análisis del semen: Volumen: igual o mayor a 2cc. PH: 7,2-7,8. Concentración espermática: más de 20 millones/cc. Contaje total: igual o mayor a 40 millones. Motilidad: igual o mayor a 50% con morfología normal. Morfología: mas del 30% normal.
Cuando la densidad espermática es menor de 10 millones/mL en el análisis del semen o existe evidencia de trastornos de la función sexual (impotencia, disminución de la libido), esta recomendado la evaluación hormonal mediante la determinación de FSH y testosterona ya que estas detedaran el 99% de todas las anormalidades endocrinas, especialmente en hombres con testículos blandos y pequeños. Si estos exámenes preliminares son anormales entonces debe solidtarse proladina, LH y repetir testosterona.
Las anormalidades endocrinas como causa primaria de infertilidad masculina representan el 3% y si las elevaciones de FSH son exduidas, la incidencia de endocrinopatia clínicamente significativa en hombres infértiles es de 1,7%.
En general un 20% de los hombres tendrán un nivel hormonal anormal en una evaluación inicial pero solo 9,6% presentan una anormalidad hormonal en exámenes repetidos.
Bajos niveles de testosterona así como de LH y posiblemente baja FSH es sugestivo de problemas a nivel del axis hipotálamo-hipófisis-gonadal y amerita investigación de proladina. Si la proladina es normal, determinadón de los niveles de otras hormonas pituitarias como hormona adenocorticotropa (ACTH), hormona estimulante del tiroides (TSH) y hormona del crecimiento están indicadas para evaluar completamente la hipófisis. Estradiol plasmático debe ser medido cuando existe signos de sobre androgenizadón o ginecomastia en asodación con niveles normales, bajos o elevados de testosterona.
Hombres con severa oligospermia (<10 millones/ml) o azoospermia que se establezca posteriormente que es no obstructiva requiere ser examinado con análisis de cariotipo y evaluación de microdelección de cromosoma Y. Hombres con ausencia congénita de vaso deferente o con obstrucción epididimaria idiopatica debe determinarse si existe mutación del gen para fibrosis quistica; además en estos últimos se debe realizar también este análisis, en la pareja femenina la cual puede ser portadora de dichas mutaciones.
EXÁMENES DE LABORATORIO ADICIONALES
Entre 10% a 20% de las parejas infértiles vistas para evaluación, tienen una infertilidad inexplicada. En el hombre sabiendo actualmente que el esper-matograma no define función o verdadera calidad espermática, se han desarrollado otros exámenes que permiten identificar anormalidades, tales como identificación de leucocitos, anticuerpos antiesperma y exámenes de función espermática.
Un aumento en el número de leucocitos, en el semen ha sido asociado con deficiencia en la función espermática y movilidad. La presencia de mas de un millón de leucocitos por mi es considerado anormal y se plantea entonces la posibilidad de infección del tracto genital o inflamación. Con un análisis rutinario de semen es difícil diferenciar entre células germinales inmaduras y leucocitos, pues ambas aparecen como células redondas. Pueden usarse para identificar y cuantificar leucocitos (granulocitos), la técnica con peroxidasa, donde los granulocitos se colorearan intensamente de color marrón. El uso de anticuerpos monoclonales permitirá identificar todos los tipos de células blancas presentes en el semen mediante el uso de anticuerpos monoclonales específicos para cada tipo celular. Estas células blancas pueden afectar adversamente la función espermática por aumentar los radicales libres (especies oxigeno reactivas - ROS), como aniones súper óxidos, radicales hidroxilo y radicales hipoclorito. Estos han sido identificados hasta en un 40% de hombres infértiles.
Cultivos del semen están indicados si existen síntomas urinarios que sugieran cistitis, uretritis, prostatitis o en piospermia documentada. Se debe investigar Micoplasma y Clamidias; los primeros causan disminución de la motilidad y cambios en la membrana de los espermatozoides, uniéndose a la cabeza y porción media de los mismos; los segundos se unen y penetran el espermatozoide humano ocasionando probablemente daño funcional.
Factores de riesgo para el desarrollo de anticuerpos antiespermaticos incluye condiciones que lesionan la barrera hemato testicular. La presencia de anticuerpos antiesperma se correlacionan con bajas tasas de embarazo, ya que alteran la motilidad espermática, producen aglutinación de espermatozoides, inhiben la capacitación espermática, inducción prematura de la reacción acrosomal, daño de la zona de unión o fertilización del ovocito.
Los anticuerpos antiesperma son detectados en aproximadamente el 10% de hombres infértiles en contraposición al 2% o menos en hombres fértiles.
Factores de riesgo para la presencia de anticuerpos antiesperma son infección genital (orquitis, enfermedad venérea, prostatitis), trauma testicular, biopsia, torsión testicular, daño testicular inducido por calor (varicocele, criptorquidismo) u obstrucción del tracto genital (vasectomía, agenesia vasal o de vesículas seminales). Existen varias técnicas de detección de anticuerpos antiesperma pero los más ampliamente usados son la reacción de aglutinación mixta (MAR) y el inmunobead; en el primero se usan células rojas cubiertas de inmunoglobulinas anti humana que se unirá a anticuerpos adheridos a la superficie espermática.
El inmunobead, usa partículas de poliacrilamida al cual se han ligado anticuerpos antihumanos de conejo, los cuales detectaran anticuerpos IgA o IgG unidos al esperma. Un hallazgo de 20%-50% de partículas de inmunobead unidas al esperma se considera clínicamente significativo.
EXÁMENES DE FUNCIÓN ESPERMÁTICA
Algunos de los más útiles son:
Prueba de interacción moco cervical-esperma:
Este puede ser realizado con moco cervical de la pareja, de donante o moco cervical bovino; este último se ha usado para remover el factor femenino del ensayo. Este examen mide la distancia que el esperma se moviliza en el moco cervical después de 60 minutos. Siendo de 30mm lo normal. Puede identificar problemas con excesiva viscosidad, pobre calidad en cuanto a motilidad y la posibilidad de anticuerpos antiesperma si la penetración es pobre.
Examen de penetración espermática: En esta prueba se usan oodtos de hámster desprovistos de
zona peludda, los cuales son incubados con esperma humano. El número de espermatozoides que penetran y se descondensan en el oodto son determinados; esto mide indirectamente la habilidad del espermatozoide para desarrollar algunos cambios necesarios para llevar a cabo la fertilizadón, a saber capadtadón y reacción acrosomal.
Prueba de reacdón acrosomal: técnicas de colo-radón de tejidos tradicionales han sido desarrolladas para examinar el acrosoma. Este examen determina el porcentaje de células en el semen que tienen reacción acrosomal espontánea, como el porcentaje de células que tienen reacción acrosomal inducida mediante técnicas de lavado, suplementación con fluido folicular, progesterona, glicoproteinas de zona pelúcida, lisofosfatidicolina, ionoforo de calcio A23187.
En general las muestras de semen normal evidencian una reacción acrosomal espontánea en menos de 5% e indudda de 15 a 40%. Muestras de hombres infértiles revelan altas tasas de reacdón acrosomal espontáneas y bajas tasas de reacdón acrosomal inducida.
Exámenes de viabilidad espermática: Estos induyen el de coloración con eosina Y y azul tripano, en el cual solo los espermatozoides muertos se tiñen. Este esta indicado en muestras con motilidad ausente o muy baja (<10%). Se encuentra también el examen de congestión hipoosmotica basado en el principio de que los espermatozoides vivos con membranas intactas son capaces de mantener un gradiente osmótico; por ello al ser colocados en una solución hipoosmotica (150 mOsm/L), los espermatozoides normales absorberán el fluido, lo cual causara en ellos abombamiento de sus membranas; esto es particularmente notable en la cola del esperma. En una muestra anormal menos del 50% de los espermatozoides sufrirán estos cambios, mientras que en una muestra normal más del 60% reaccionaran.
Especies oxigeno reactivas (ROS): Para las células vivas vivas, en condidones aeróbicas, el oxigeno representa una paradoja. Mientras es requerido para su sobrevida y en procesos como hiperadivación espermática y capacitación, sus metabolitos pueden ser potendalmente tóxicos debido a generación de radicales libres. Efectos deletéreos han sido demostrados en el metabolismo espermático, morfología, motilidad y capacidad de fertilización. Tanto espermatozoides como leucodtos en el semen producen ROS, aunque las células blancas las producen en mayor cantidad, 1.000 a 10.000 veces mas que lo que produce cualquier tipo de espermatozoide (morfológicamente anormal o morfológicamente normal pero anormal bioquímicamente y funcionalmente). Hombres infértiles con espermatozoides que producen altos niveles de ROS tienen una probabilidad 5 veces menor de inidar un embarazo que hombres infértiles con bajos niveles de ROS.
Morfología estricta: En 1.986 Kruger introdujo el criterio "estricto" con un umbral clínicamente significativo de 14% de formas normales. Este criterio fue tomado de medidas en espermatozoides que migraban exitosamente a la cerviz (fig.l).
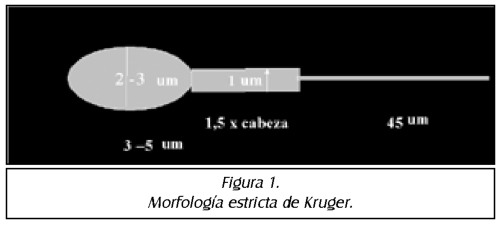
La morfología normal establecida por este criterio es un excelente predidor de tasas de fertilizadón in vitro. Oehninger y col. encontraron que las tasas de fertilizadón in vitro (IVF) con un patrón normal de morfología siguiendo este criterio (>14%) fue 94,3%. Con una morfología intermedia entre > 4% y < 14%, la tasa fue de 87,8% y aquellos con un patrón morfológico pobre, <4% de formas normales, la tasa fue de 14,5%. Más redentes estudios indican que este criterio no es un predictor de tasas de fertilización con ICSI.
EVALUACIÓN RADIOLÓGICA
Dentro de las técnicas diagnosticas que complementan la evaluadón básica del factor masculino que ayuda a diagnosticar varias formas de infertilidad masculina se encuentra el uso de la ecosonografía ya sea a nivel escrotal, transredal y eventualmente abdominal.
El varicocele es normalmente detectado al examen físico pero algunos pacientes puede ser difíciles de examinar o tener hallazgos dudosos. El ecosonograma escrotal es el método no invasivo más frecuentemente usado; existen otros métodos no invasivos como el estetoscopio doppler, termografía y estudios con radionuclidos. El criterio ecosonografico para diagnosticar el mismo, es la presencia de venas de al menos 3mm de diámetro o que alcanzan este tamaño al realizar maniobra de Valsalva o estar en posición de pie (fig. 2).
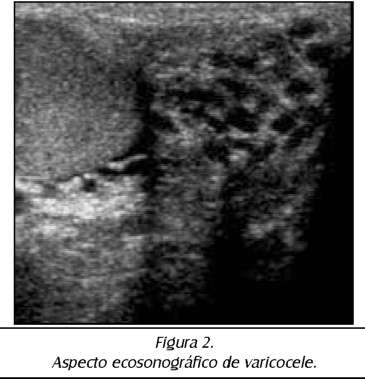
El varicocele esta presente en 15% de la población general, pero puede ser encontrado en 19%- 40% de hombres con infertilidad primaria y en 70% - 81% de hombres con infertilidad secundaria.
El significado y manejo del varicocele subclínico se mantiene controversial. Amelar y Dubin en un estudio de 150 hombres infértiles y con varicocele concluyeron que pequeños varicoceles pueden dañar la espermatogenesis tan a menudo como los grandes varicoceles y que el tamaño del varicocele no se correlaciona con el efecto adverso en la infertilidad. La incidencia del varicocele subclínico en hombres infértiles, ha sido reportada en varias series entre 21%-80%. McClure y col. reporta que hombres tratados por varicocele subclínico presentaron mejoría post operatoria en los parámetros seminales tan a menudo como aquellos tratados por varicoceles dínicos.
La ecosonografia transredal permite la visualization anatómica de próstata, vesículas seminales y pordón ampular del vaso deferente. Su rol primario es detedar obstrucción, dilatación o quistes de conducto eyaculatorio y determinar la ausencia o hipoplasia de vesículas seminales. Esta indicada en parientes azoospermicos en los que se sospeche obstrucción de conducto eyaculador. Los hallazgos seminales típicos en pacientes con obstrucción completa de conducto eyaculador incluye bajo volumen eyaculatorio (<lml), pH ácido, ausencia de fructosa y fallo para coagular debido a la ausencia de secreciones de vesículas seminales. El ultrasonido trans-rectal puede ser combinado con aspiración transrec-tal de vesículas seminales y vesiculografia para investigar obstrucción del conducto eyaculador, especialmente a nivel pélvico e inguinal. Estas técnicas mínimamente invasivas han disminuido la necesidad de desarrollar vasografía abierta.
Los hallazgos sugestivos de obstrucción de conducto eyaculatorios son vesículas seminales con un diámetro mayor a 1,5 cm (fig. 3), conducto eyaculatorio dilatado, mayor a 2,3 mm., quiste, calcificación o litiasis a lo largo del conducto eyaculatorio (fig. 4).
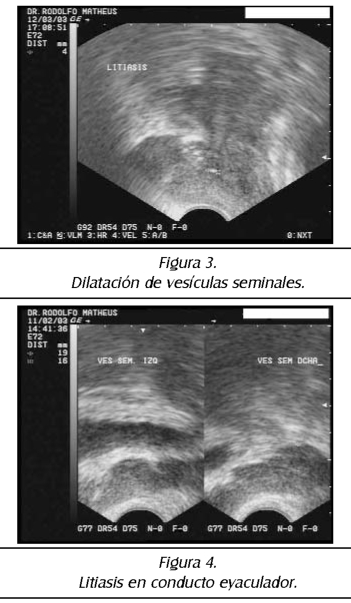
Si se realiza aspiración, de vesículas seminales transrectal en un paciente azoospermico y se encuentra más de 3 espermatozoides por campo de alto poder, es considerado positivo y sugestivo de obstrucción (Jarow).
No todos los pacientes en que se sospecha obstrucción de conductos eyaculatorios a través de ultrasonido transrectal tienen en realidad obstrucción, por lo que puede inyectarse colorantes como azul de metileno o índigo carmín, una vez realizada la punción de las vesículas seminales y proceder a realizar una uretrodstoscopia donde se observaría la salida de contraste a través de los conductos eyacu-ladores a nivel de uretra prostática de no existir obstrucdón de los mismos. Mediante esta técnica solo el 50% de los aparentemente obstruidos por ecosonografía transrectal lo son verdaderamente (Turek). Esto tiene importante implicadón prognosti-ca si se ha considerado la realizadón de resección transuretral de condudos eyaculadores (TURED) basado solo en los hallazgos por ecosonografía transredal.
La ecosonografía abdominal es usada para determinar los riñones en parientes con ausencia de vaso deferente ya que estos tiene el mismo origen mesone-frico. Anomalías renales ipsilaterales están presentes por encima de 80% de hombres con ausencia unilateral de vaso deferente, siendo la anomalía más común, la agenesia renal. En contraste el mecanismo de ausencia bilateral congénita de vaso deferente parece ser a través de un mecanismo diferente y el riesgo para anomalías renales es mucho menor. Así que la ecosonografía abdominal debe ser considerada para excluir agenesia renal en pacientes con un vaso deferente no palpable.
La vasografia es el examen tradicional para la evaluación de la permeabilidad del vaso deferente y conducto eyaculatorio. Esta indicada para determinar el sitio de obstrucción en pacientes azoospermi-cos quienes tienen espermatogenesis activa documentada por biopsia prostática. También puede ser indicada en pacientes severamente oligospermicos donde hay razón para sospechar obstrucción vasal unilateral (antecedente de reparación de hernia inguinal) con un testículo contralateral anormal. Esta debe ser desarrollada al tiempo en que se ha planificado también una eventual reparación quirúrgica, esto con la finalidad de disminuir el riesgo de cicatrización vasal. Esta puede realizarse por punción o por hemi vasotomia transversa. Permite diagnosticar obstrucdón vasal a nivel inguinal, pélvico o escrotal (fig. 5 y 6).
BIOPSIA TESTICULAR
Provee información en casos de sospecha de obstrucción y también en falla testicular. Además
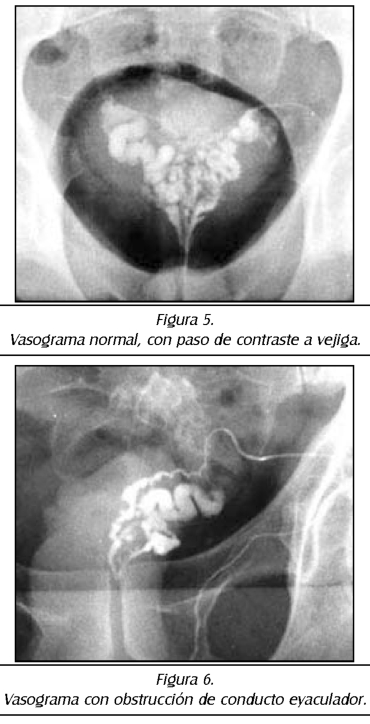
permite establecer candidatos para técnicas de reproducción asistida como el ICSI y obtener espermatozoides para realizar este último. Debe ser desarrollada en azoospermicos con un nivel significativamente elevado de FSH (>2-3 veces lo normal). Aunque una FSH elevada indica que espermatogenesis normal no será encontrada, tiene poco poder predictivo de sí cualquier tipo de espermatogenesis podrá hallarse en el testículo. La obstrucción parcial es sugerida en estos casos si el espécimen de biopsia demuestra espermatogenesis normal. El sistema usado por muchos patólogos para determinar las biopsias testiculares fue popularizado por Levin en 1979 y se basa en la apariencia de la espermatogenesis, en una gama que va de lo normal pasando por arresto de maduración, hipoespermatogenesis y células de Sertoli.
En la biopsia normal, la arquitedura es normal sin la presenda de cáncer; la espermatogenesis es observada en cada uno de los tubulos seminíferos.
Algunos clínicos usan el hallazgo de 20 espermatides por tubulo como un criterio cuantitativo normal.
En el arresto de maduración, la espermatogenesis puede encontrarse detenida en cualquier momento del proceso de maduración espermática. Si la detención en el desarrollo ocurre tempranamente en el proceso, es probable que sea problema durante la meiosis. Arrestos más tardíos reflejan problemas con la regulación de la espermiogenesis.
En la hipoespermatogenesis están presentes todos los tipos celulares pero en poca cantidad, cada uno de ellos. Esto resultara en bajo número de esperma en el eyaculado.
Aplasia de células germinales esta caracterizado por completa ausencia de células germinales y es también llamado solo células de Sertoli.
Otros patrones incluyen completo reemplazo de tubulos seminíferos por esclerosis o fibrosis y patrones mixtos de uno o más de los anteriores.
Brandell RA, Mielnik A, Liotta D, et al: AZFb deletions predict the absence of Sperm with testicular Sperm extraction: preliminary report of a prognostic genetic test. Hum Reprod 13: 2812-2815, 1998.
De Groot LJ (ed):Endocrinology. Third Edition. Chapters 8,13,14,15,23. Philadelphia: WB Saunders Company, 1995.
Girardi SK, Mielnik A,Schlegel PN: Submicroscopic deletions in the Y Chromosome of infertile men. Hum Reprod 12: 101-107, 1997.
Goldstein M: Surgical management of male infertility and other scrotal disordes, Campbell's Urology. Volume 2. Eighth edition. Saunders, 2002 p 1532-1587.
Jarow JP: transrectal Ultrasonography of infertile men. Fertil Steril 60: 1035, 1993.
Kim ED, Lipshultz LI: Role of Ultrasound in the assessment of male infertility. J Clin Ultrasound 24: 437,1996.
Kruger TF, et al: predictive value of anormal morphology in vitro fertilization. Fertil Steril 49: 112,1988
Lipshutz LI, Howards SS (eds): Infertility in the male, Third Edition. St. Louis: Mosby-Year Book, 1997, pp 23-58, 395.
Pryor J, Kent-First M, Van den Bergh K, et al: Microdeletios in the Y Chromosome of infertile men. N Engl J med 336: 534-539, 1997.
Sigman M: laboratory testing in the evaluation of male infertility. World J Urol 11: 96, 1993.
Sigman M, Jarow JP: Male infertility, Campbell's Urology. Volume 2. Eighth edition. Saunders, 2002 pl475-1531.
Tuerlings JHAM, Kremer JAM, Meuleman EJH: the practical application of genetics in the male infertility clinic. J Androl 18: 576-581,1997.
WU DS; Shinohara K, Turek PJ: Eyaculatory duct Chromotubation as a functional diagnostic test in eyaculatory duct obstruction. J Urol 161: 1357A, 1999.
Dr. Ronald Guía Felicite
Cirujano Urólogo. Jefe del Servicio de Urología e Investigación Urodinámica, Hospital Universitario "Dr. Angel Larralde" • Profesor Universidad de Carabobo. Facultad de Ciencias de la Salud. Escuela de Medicina
Dr. William Uzcátegiii Saidman
Cirujano Urólogo. Instituto Docente de Urología
FÍSTULA VESICOVAGINAL NUEVA TÉCNICA QUIRÚRGICA PARA SU CURA
El exceso de confianza por parte del Cirujano, basado en una experiencia sobreestimada, conlleva a distraer principios básicos y de técnicas quirúrgicas elementales que en ocasiones lo enfrentan con sus resultados quirúrgicos y a su propia realidad.
La fístula vésicovaginal al igual que los diferentes tipos, continuarán siendo complicaciones que ocurrirán aun en las más experimentadas manos.
Ronald Guia Feliche
La comunicación anómala entre la vejiga y la vagina constituye una fístula vésicovaginal. Diferentes causas pueden conllevar a esta situación que constituye una de las complicaciones más graves a la cual se enfrenta un cirujano y para la paciente representa, el impacto de lo desconocido y su frustración como mujer.
El trauma obstétrico representa la causa más frecuente en países sub-desarrollados1 y el parto prolongado constituye su principal motivo. En países donde los servicios obstétricos son más adecuados, la incidencia ha disminuido de un 39% en la serie de Judd (1920)2 a menos de 6% reportado por Massie en 1964.3
Sin embargo, la causa más común de fístula vésicovaginal es de origen iatrogénico, principalmente durante la cirugía ginecológica; en la realización de una histerectomía.4'5'6 La fisiopatología de la fístula es secundaria a necrosis vascular.
En procedimientos quirúrgicos de rutina puede ser el resultado de hematoma, ruptura vesical inadvertida, pinzamiento, corte, desvascularización de la vejiga tratando de liberar el mango vaginal y suturas mal colocadas, principalmente en la reflexión de la vejiga y la vagina.
A su vez, las fístulas de origen actínico constituyen un grupo importante de casos,7 una vez concluido el tratamiento radiante principalmente en pacientes con cáncer de cuello uterino y algunas enfermedades pélvicas malignas. La presencia de la fístula vésicovaginal obedece a necrosis del tumor en la pared vaginal o vesical. Las fístulas que aparecen posteriormente son causadas a uso excesivo de radioterapia, condicionando a endarteritis y necrosis posterior del área afectada. Hoy día, con el mejoramiento de las técnicas y equipos, éstas han disminuido. El promedio oscila entre 0.6 a 2%.8
En todas las situaciones indistintamente del motivo de la cirugía pélvica o del tratamiento a instaurar se requiere del conocimiento de ciertos factores de riesgo que pueden condicionar la aparición de una fístula: Cesáreas previas, endometriosis, diabetes, enfermedades pélvicas inflamatorias, obesidad, cirugía previa sobre la vejiga, radioterapia, uso de esferoides, vejiga neurogénica, malformaciones urológicas o ginecológicas. En instituciones donde la cirugía laparoscopica conforma el armamentarium para la cirugía pélvica la aparición de fístulas han comenzado a tener su incidencia.9
CAUSAS DE FISTULAS VESICOVAGINALES
I. Congénitas
II. Adquiridas
a) Iatrogénicas: (cualquier procedimiento médico o quirúrgico que se lleve a cabo a nivel de la pelvis).
Cirugía abierta, vaginal, combinada, laparoscópica.
Procedimientos quirúrgicos para la cura de la incontinencia urinaria:
(Retropúbicos - Vaginales - Laparoscópicos).
Biopsias.
Uso indiscriminado del electrocauterio - Láser. Radioterapia.
Resección endoscópica de tumores vesicales (raro). Formolización de la vejiga.
b) No Iatrogénico Cáncer invasivo pélvico.
Cuerpos extraños en vejiga o vagina (Fig. 3).
Parto prolongado.
Traumatismos pélvicos (fracturas pélvicas). Cálculos.
Tuberculosis - Schistosomiasis.
SIGNOS Y SÍNTOMAS
La mayoría de las fístulas se presentan como una forma de incontinencia urinaria diurna y nocturna, posterior al retiro del catéter uretral después de una cirugía pélvica reciente. Cuando el orificio es pequeño la pérdida es mínima, conllevando a un patrón miccional "normal". La presencia de sangre en la bolsa recolectara de orina y con el antecedente de una cirugía difícil hace sospechar la presencia de una lesión del tracto urinario y el potencial para la formulación de una fístula vésicovaginal.
La pérdida de orina puede ocurrir desde el primer momento y pasado incluso el mes; aunque en promedio es de 5 a 14 días después del post-operatorio. La orina causa irritación vaginal, dermatitis local y perineal, mal olor y, en ocasiones, incrustaciones litiásicas en la vagina. Todo este cuadro hace que la paciente se encuentre en un estado de depresión, insomnio, pérdida de su valía y estima; con las implicaciones sociales y sexuales para ella.
DIAGNÓSTICO
En la mayoría de las pacientes el diagnóstico no ofrece dudas, basado en la pérdida mantenida de orina a través de la vagina, con antecedentes de una cirugía pélvica o de radioterapia previa. La causa que hizo obligatoria la cirugía proporcionará información sobre las condiciones locales y detalles intraoperato-rios que condujeron a la formación de la fístula vésicovaginal. Sin embargo, una evaluación urológica completa es fundamental incluyendo el área abdominal, pélvica y genital. Así como también alguna posibilidad de compromiso neurológico.
En primer lugar, se debe confirmar si la secreción vaginal es orina. Para ello, se toma una muestra y la determinación de creatinina será suficiente. Esta se encontrará aumentada, lo que ayuda a descartar linfa o cualquier exudado vaginal. El uso de colorantes instilados dentro de la vejiga como el azul de metileno o el índigo carmín, diluidos en solución fisiológica pasado a través de un catéter uretral, con una gasa colocada en el fondo vaginal manteniendo llena la vejiga (si se puede), e indicándole a la paciente que camine por algunos minutos y manteniendo cerrado el catéter permitirá confirmar la procedencia de la orina. Pueden ocurrir dos situaciones: la primera, que al retirar la gasa, ésta se encuentre teñida, lo cual inclinará a pensar en fístula vésicovaginal. El segundo hallazgo implicaría que la gasa se obtiene húmeda orientando a pensar en una fístula uréterovaginal. En este caso, se reintroduce nueva gasa en la vagina y se retira el catéter. Posteriormente, se administra 5cc. de índigo carmín vía endovenosa, lo cual a los 15 minutos manchará la gasa.
El clorhidrato de fenazopiridina (pyridium) 100 mgs. cada 8 horas puede ser utilizado; sin embargo, su eliminación a través del riñón para confirmar una fístula urétero-vaginal es más tardía y en ocasiones implica esperar un tiempo prolongado para confirmar el color naranja en una prueba positiva.
La investigación del tracto urinario superior es fundamental y, para ello, la urografía de eliminación, es mandataria. La obstrucción o la fístula uretero-vaginal pueden estar presentes en un 10 a 15% de las pacientes con fístula vésicovaginal.10 La pielografía retrógrada permite demostrar la localización precisa de una fístula uréterovaginal, y también está indicada en casos en que la urografía ofrezca dudas (Fig. 4).

La cistoscopia debe realizarse a todas las pacientes con una fístula vésicovaginal, lo cual permitirá evaluar el proceso fistuloso, su localización, relación con los orificios ureterales, posibles fístulas satélites, compromiso del cuello vesical, descartar cualquier cuerpo extraño dentro de la vejiga, determinar la capacidad vesical y evaluar su distensibilidad.
La vaginoscopia respalda y soporta la evaluación anterior.
Pacientes con tumores pélvicos, radioterapia previa o neoplasias, la biopsia es mandatoria.
El aspecto de la fístula vésicovaginal varía de acuerdo a su tamaño; en los trayectos con poco diámetro se puede apreciar un tejido de granulación, congestivo e hiperémico con irregularidades de la mucosa. En trayectos fistulosos de mayor diámetro puede observarse la vagina y sus pliegues; incluso al realizar un tacto vaginal el dedo del guante se aprecia en el fondo, y haciéndolo protruir hacia arriba se observa con detalle los bordes del orificio fistuloso, permitiendo con ello, evaluar la elasticidad y la calidad de los tejidos y considerarlos aptos o no, para su uso en la elaboración de colgajos o incisiones locales a fin de permitir suturas holgadas y sin tensión (Fig. 5).
El uso de la tomografía computada es recomendable ante la presencia de tumores pélvicos, neoplasias o alguna patología concomitante pelviana.11
El ultrasonido y la resonancia magnética han ofrecido detalles; sin embargo, su indicación no forma parte de la evaluación inicial de una paciente con fístula vésicovaginal.12
La dstografía de llenado o con fase miccional puede establecer la presenda de reflujo vésico renal. Este puede obedecer al mismo proceso inflamatorio, pero su aplicabilidad en ocasiones se ve limitada por la presenda de una fístula de gran diámetro.
Parientes con antecedentes de vejiga neurogénica, diabetes, enfermedad de Parkinson, esclerosis múltiple, etc., pueden ser favorecidos con estudios urodinámicos o videourodinamia a los fines de instaurar tratamiento médico previo a la cirugía.
Muchas veces, la paciente puede presentar una incontinencia urinaria de esfuerzo previo a la formación de la fístula o presentar el trayecto fistuloso a
nivel del cuello vesical; en estos casos la videouro-dinamia es un recurso para distinguir compromiso intrínseco esfinteriano, o detrusor inestable.13 Esto permitirá, sin que ello comprometa los resultados, realizar procedimientos como la colocación de cinchas para la cura de la incontinencia urinaria de esfuerzo, reparaciones de prolapso, así como reparaciones perineales. Cuando la fístula vesicovaginal es producto de una histerectomía clásica y no hay antecedentes que nos induzcan a pensar en una disfunción, la evaluación urodinámica no está indicada.
Insistir en la importancia de la prevención de este tipo de lesión es recomendable; por eso, es fundamental una buena técnica quirúrgica a todo cirujano que penetre en la cavidad pélvica, un juicioso criterio de indicación quirúrgica y una concientizada evaluación preoperatoria, haciendo participar a otros especialistas, cuando las vías urinarias u otros órganos estén comprometidos.
El tratamiento quirúrgico para la cura de la fístula vésicovaginal continúa siendo la base de su referencia. Sin embargo, fístulas de pequeño diámetro no complicadas en pacientes con buenas condiciones generales pueden inicialmente ser abordadas con un tratamiento conservador, el cual va dirigido a drenar la vejiga con catéter uretral durante un período de 4 semanas, tiempo en el cual, si no cede el drenaje vaginal, tendrá que resolverse utilizando algunas de las técnicas quirúrgicas conocidas.
Se han reportado procedimientos conservadores como el uso del fibrinógeno.14 Así como también técnicas para despitelizar utilizando el nitrato de plata o electrocoagulación.
La electrocoagulación con el uso de inyección de pasta de teflón, para producir coaptación de los bordes del tracto fistuloso ha brindado buenos resultados en fístulas con diámetros aproximados de 1 mm a 2 mm.15
La soldadura de tejidos utilizando el láser es una realidad hoy día, que pasa de lo teórico a lo práctico, de hecho reparación de hipospadia, vasovasostomía y cirugía vesical y ureteral han sido llevados a cabo en animales y en pacientes seleccionados, y su aplicación en este tipo de lesiones es sólo cuestión de tiempo.16
Las pacientes ameritan de un apoyo médico y psicológico, considerando su estado emocional y el efecto local de la orina en el área génito-perineal. El cuidado local, el aseo meticuloso, el cambio de toallas sanitarias o los pañales son necesarios para minimizar la irritación vulvar. Cuando es una fístula de diámetro pequeño, el drenaje vesical a través de la uretra, ayuda a contrarrestar la pérdida de orina, y el efecto psicológico y social es favorable. Es fundamental una relación armoniosa con la paciente tratando de explicar de manera sencilla lo que ocurre, las implicaciones y consecuencias, sobre todo en pacientes con enfermedades neoplásicas previas, radioterapia o inmuno-deprimidas. Las cremas protectoras y ungüentos, mejoran la vulvitis. El uso de anticolinérgicos puede ser de ayuda.
Algunas pacientes pueden presentar micosis local e infecciones vaginales, siendo necesario tratamiento antimicótico oral.
El reemplazo estrogénico puede también ser utilizado sobre todo en pacientes postmenopáusicas, o castradas; siempre y cuando no existan contraindicaciones para su uso.
Oxígeno Hiperbárico ha sido utilizado en pacientes con fístulas complejas o irradiadas.17 El uso de esteroides no varía el curso del proceso, quizás mejore localmente la dermatitis o vulvitis local.
Una vez considerada la complejidad de la fístula vésicovaginal se establecerá la logística de "ataque".
Orificios ureterales comprometidos. (Fig. 6 - 7).
Fístula con pérdida de la uretra.
Fístulas múltiples.
Fístulas sobre la base de un proceso cicatricial después de reparaciones múltiples.
Pérdida de la capacidad y elasticidad de la vejiga y vagina.
Radioterapia previa, neoplasia o tumores pélvicos.
Compromiso a otros órganos.
Condiciones y estado general de la paciente Fístulas mayores de 3 cms.
Lesión importante del trígono vesical, cuello y uretra.
Recurrencia.
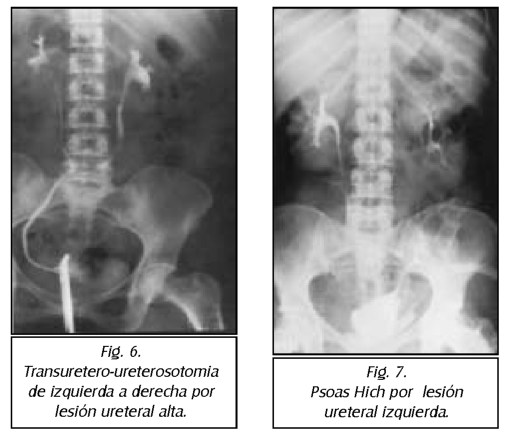
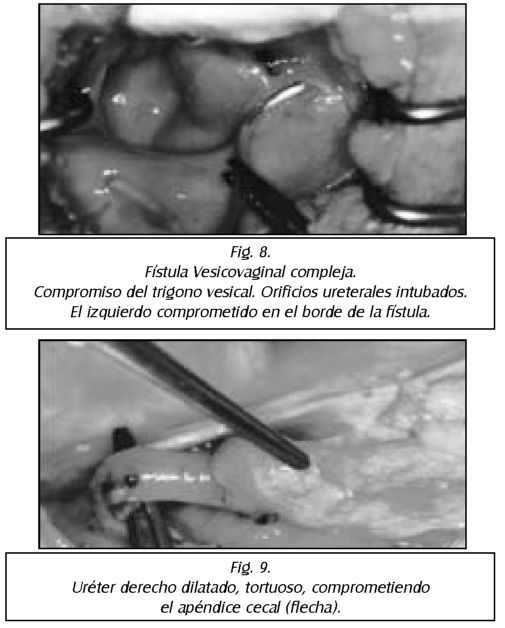
CUANDO INTERVENIR
La reparación de una fístula vésicovaginal tradicionalmente ha sido realizada entre los 3 y 6 meses de ocurrida ésta, con el objetivo de "madurar" el proceso; es decir que el edema y la inflamación cedan. La paciente cada dos semanas es evaluada prestando atención a la calidad de sus tejidos para entonces considerar el momento de la cirugía. Nuestra conducta es dar un plazo de 8 a 12 semanas, tiempo prudencial durante el cual la antibioticoterapia profiláctica es fundamental ya que en la mayoría de las veces existe infección del mango vaginal y del área pélvica. Más aún, si la intervención fue laboriosa, su post-operatorio tórpido, o es una paciente inmunodeprimida.
Raz, recomienda un tiempo más breve 2 a 3 semanas después de la lesión inicial.18 Otros, esperan 4 a 6 semanas tiempo en el cual la inflamación ha cedido.19
Para las fístulas producidas por radioterapia se recomienda un tiempo de espera de un año, antes de considerar una reparación quirúrgica, ya que la endarteritis reduce la vascularización local.20
En general, la complejidad de la fístula marcará la pauta del tratamiento, el enfoque quirúrgico a seguir, y todas ellas implican considerar ciertos factores determinantes que hay que tener presente para la reconstrucción y cura definitiva:
• Condiciones generales de la paciente.
• Radioterapia previa.
• Calidad de los tejidos locales y posibilidad de uso del intestino.
• Interposición de tejidos (tejido fibroadiposo de labios vulvares - colgajo de Marti us -, colgajos miocutá-neos, colgajos peritoneales, apéndices epiplóicos, etc.)
• Cuando intervenir.
• Derivación urinaria o intestinal y forma de llevarla a cabo.
• Escisión del trayecto fistuloso.
• Asociación de patologías pélvicas o abdominales anexas.
• Abordaje abdominal, vaginal o combinado.
• Implicaciones sobre la actividad sexual, impacto psicológico y social de cualquier técnica quirúrgica.
La fístula vésicovaginal puede ser tratada a través de un abordaje abdominal, vaginal o en forma combinada.
La mejor intervención es la que logra la cura en la primera oportunidad, y es el cirujano por su preferencia y experiencia quien elige el mejor abordaje y decide la escisión del trayecto fistuloso. Cualquier enfoque de reparación lleva implícito los mismos principios quirúrgicos:
• Ausencia de inflamación y edema.
• Suturas libres de tensión.
• Planos de disección tisular vascularizados entre vejiga y vagina, con buena separación entre ellos.
• En caso de compromiso vascular local, considerar el uso de injertos pediculados.21
• Evitar espacios muertos...
• Impermeabilidad.
• Drenaje urinario continúo y libre.
• Uso de antibioticoterapia.
• Un concepto importante es afrontar superficies y no bordes, evitando el exceso de suturas
El abordaje vaginal ha recibido recientemente atención por su baja morbilidad, menos pérdida sanguínea y menos efectos sobre la actividad vesical, ya que es poco lo que se diseca de ella, el tiempo de derivación urinaria es menor y el confort para la paciente es mejor.22'23
Sin embargo, ciertas limitaciones tiene, por ejemplo, cuando la fístula es alta a nivel de la cúpula vaginal donde puede lesionarse el intestino, sobre todo si la fístula ocurre posterior a una histerectomía donde éste puede estar adherido. En otras, puede lesionarse inadvertidamente el uréter principalmente cuando la vagina no es elástica, es estrecha, la paciente tiene limitaciones osteo-esqueléticas o cirugía previa de cadera, columna vertebral, postmenopáusica. En tales circunstancias, la colpocleisis parcial sería una alternativa, técnica de Latzko,24 implica la denudación de la mucosa vaginal que rodea el borde de la fístula manteniendo intacto el trayecto; luego se realiza la colpocleisis en tres planos sin comprometer la pared vesical. Puede conllevar acortamiento de la profundidad vaginal. Sin embargo, ha servido para pacientes con radioterapia previa.
Cuando se encuentran los orificios ureterales cercanos a la fístula debe realizarse cateterismo de ellos.
Cuando se prefiere la extirpación del trayecto fistuloso la colocación de un catéter de Fogarty o de Foley permitirá la escisión del tracto fistuloso, o más recientemente, el uso del Fistulotomo Vésicovaginal Guia® (ver más adelante).
Si la vagina es pequeña o la paciente es nulípara, una episiotomía logra ampliar el campo operatorio; posterior a lo cual una incisión alrededor del orificio fistuloso y la extirpación del tejido cicatricial dará comienzo a la separación de la vagina y vejiga con el cierre posterior, utilizando sutura reabsorbible.
En pacientes con grandes defectos o diámetros fistulosos considerables, la utilización de colgajos incrementa la posibilidad de curación ya que incrementan el aporte sanguíneo, mejora el drenaje linfático y separa las líneas de sutura.
En ciertas pacientes, sin que con ello comprometa el resultado final de la intervención, puede llevarse a cabo además de la interposición de colgajos, colocación de cinchas para cura de incontinencia urinaria de esfuerzo, cura de prolapso o de rectocele.
Cuando la fístula es baja o se encuentra en la porción media de la vagina el colgajo de Martius es el más recomendable, para lo cual es fundamental proteger la base del colgajo ya que por él transcurren los vasos sanguíneos.
La creación del túnel subcutáneo a través de la pared vaginal permitirá llevar el colgajo al lugar deseado, fijarlo con material reabsorbible y cubrirlo con la mucosa vaginal. Sin embargo, en pacientes muy delgadas, postmenopáusicas, mal nutridas, el tejido adiposo se hace difícil de obtener ya que los labios en ocasiones son atróficos.
Fístulas altas requerirán colgajo miocutáneo del gradlis, sobre todo en parientes irradiadas o el uso de colgajo peritoneales, fibras mediales del elevador del ano, apéndice epiplóicos del colon sigmoides incluso colgajo del recto mayor.25 También se ha utilizado duramadre liofilizada.26
El acceso transvaginal ha brindado un éxito entre el 82% al 100%.
El abordaje abdominal puede ser transperitoneal o preperitoneal; ambos proveen excelente campo para hacer más accesible la fístula, permitiendo evitar el compromiso ureteral. El procedimiento está indicado en fístulas complejas, en especial orificios fistulosos mayores a los 3 cm. de diámetro, compromiso de los orificios ureterales, fístulas recurrentes, compromiso del cuello vesical o efectos de la radiación o tumores pélvicos. Cuando la situación conlleva a interponer injertos entre vejiga y vagina y la realización de crear una neovejiga este es el abordaje indicado. Desde que O'Connor,27 describió su técnica, diferentes modificaciones han sido llevadas a cabo, tratando de minimizar la disección de la vejiga. Cetin informó de un abordaje transvesical suprapúbico.28 Para ello, una apertura vesical superior, incisión alrededor de la fístula llegando hasta la vagina y realizando la escisión del trayecto fistuloso permitía la reparación de ambas cavidades. Su cura oscila entre el 93% y 100%.
Una debida atención postoperatoria permitirá un resultado favorable y evitará complicaciones como infección, sangrado, trombo-embolismo, dolor, compromiso del colgajo interpuesto e incluso la recidiva del proceso fistuloso.
El tapón vaginal impregnado de antibiótico o alguna crema estrogénica debe ser retirado entre las
24 a 48 horas. Posterior a lo cual se le indica a la paciente deambulación precoz.
El uso de antibióticos durante la cirugía, y posterior a ella deben ser mantenidos incluso mientras permanezcan los catéteres o sistemas de drenaje tratando de mantener una orina lo más esteril posible.
Los catéteres de drenaje deben ser vigilados ya que los coágulos o cualquier esfacelo de tejido pueden obstruirlo. Las acodaduras pueden ocurrir sobre todo en pacientes que se encuentran bajo sistema de analgesia postoperatoria (SAP) o pacientes de edad avanzada.
Analgésicos convencionales son utilizados al igual que los anticolinérgicos para minimizar el dolor y evitar los espasmos vésicouretrales.
El postoperatorio de una fístula compleja con antecedentes de reimplante ureteral, dstoplastia de aumento, etc., conllevan atención cuidadosa por parte del personal de guardia para evitar que se obstruyan. Por ello, el lavado con solución fisiológica a baja presión de estas neovejigas evitará la impactación del moco intestinal. Cuando los catéteres ureterales han permitido la reparación del proceso fistuloso, el reimplante ureteral y mantienen la orina desviada, éstos deben ser retirados entre los
15 a 21 días como mínimo.
El drenaje vesical sea a través del catéter suprapúbico o uretral deben permanecer durante 10 a 21 días, tiempo en el cual, previa cistografía y comprobación de la integridad de la sutura, éstos pueden ser retirados. Puede utilizarse reemplazo hormonal, el cual puede iniciarse previa la cirugía al igual que el uso de antimicóticos orales. Baños locales genitales ayudan al confort y a mantener el área genital adecuadamente limpia.
No es recomendable la evaluación vaginal con espéculos, lavados vaginales, actividad sexual, al menos durante tres meses después de la cirugía.
FISTULOTOMO VESICOVAGINAL GUÍA®
Basado en el principio de la escisión del trayecto fistuloso para obtener tejido sano, eliminar el cicatricial y crear buenos planos anatómicos condujo a la invención de un nuevo instrumento quirúrgico denominado "Fistulotomo Vésicovaginal Guía", el cual por su versatilidad y precisión en el corte ha permitido curar con éxito el 100% de las pacientes tratadas hasta ahora. Incluso ha sido utilizado en pacientes previamente intervenidas mediante las técnicas convencionales conocidas.29'30'31'32
El fistulotomo consta de un equipo de cuchillas individuales con diámetros diferentes, para ser utilizadas acorde al diámetro de la fístula a tratar. Cada fistulotomo consta de un Eje que permite ser introducido a través del orificio fistuloso y servirá para que la cuchilla gire (360 grados) sobre un soporte de diseño especial, y realice un corte con precisión y detalle. Evitando así, aumentar el diámetro de la fístula.
El soporte tiene en su cara anterior un riel acorde con el diámetro de la cuchilla a utilizar, lo cual mejorará la calidad del corte, porque la misma se acoplará a él (Fig. 10 a,b,c).



La paciente es colocada en posición decúbito dorsal, teniendo discretamente flexionadas las piernas. Asepsia y antisepsia del hemiabdomen, vagina y periné son llevados a cabo. Una vez realizada la incisión en la pared abdominal vertical o de Pfannestield, se realizará un abordaje pre-peritoneal de la vejiga y se procede a la apertura de la misma, posterior a lo cual, se identifica el o los trayectos fistulosos, permitiendo un acceso quirúrgico adecuado y la fádl utilizadón del fistulotomo.
®Patente: República Bolivaríana de Venezuela. Ministerio de Industria y Comercio. Boletín de Propiedad Industrial. Tomo II. Año 42. Caracas. 8 de Mayo 1998.
Reg.: 56625. 400-94001584.
Premio Nacional de Investigación Urológica 1994 -1998.
Se procede a introdudr el Eje a través del trayedo fistuloso dirigiéndolo hada la vagina y exteriorizándolo con la ayuda del dedo de la mano del drujano (Fig. 11).
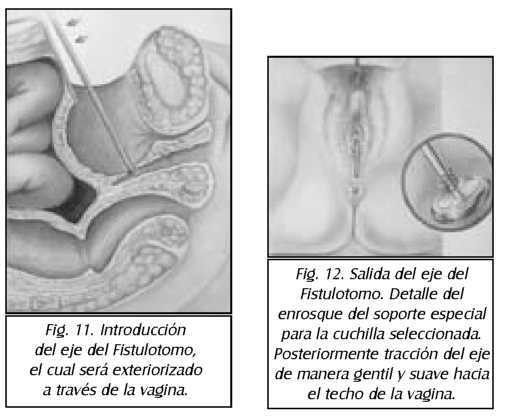
Se efectúa entonces el acople del Soporte, mediante simple enroscamiento del Eje. Una vez completados el ajuste se fracciona éste de manera gentil y suave hada el techo de la vagina (Fig. 12). Ya en posidón, se selec-dona la cuchilla espedfica al diámetro de la fístula. Luego ésta es descendida hasta hacer contado con la mucosa vesical, se realiza una maniobra de giro sobre si misma de 360 grados, efeduándose el corte del trayedo fistuloso Fistuledomía. (Fig. 13 a,b,c).
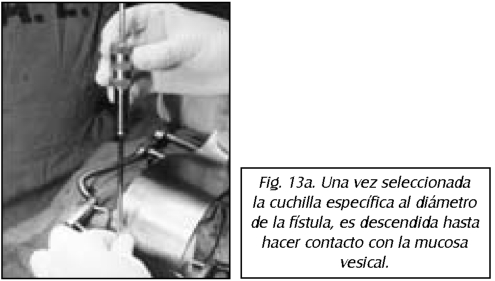
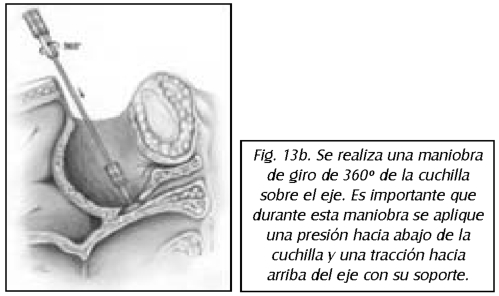
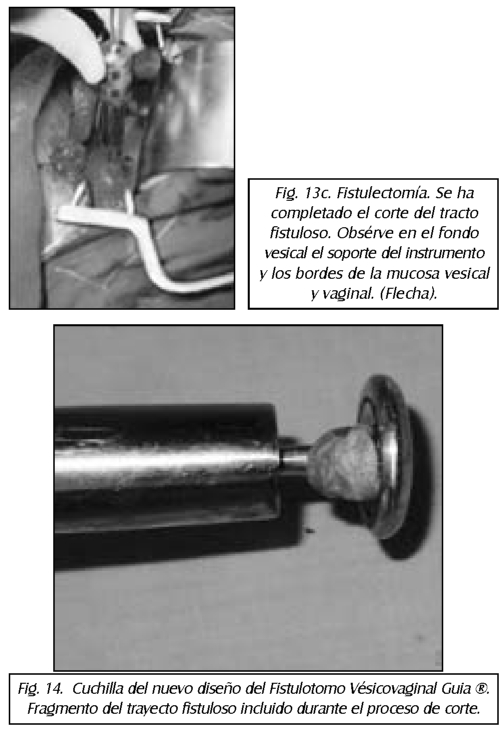
Es importante, que durante esta maniobra se aplique una presión hada debajo de la cuchilla y una tracción hada arriba del Eje con su soporte.
En algunas circunstandas, si es necesario, se debe colocar catéteres ureterales.
Una vez diferenciada la mucosa vesical de la vagina, se toma el fragmento de tejido que queda incluido dentro de la cuchilla para su respectivo estudio histopatológico. En este momento, se extrae el fistulotomo con los elementos que lo conforman. (Fig. 14).
Se realiza una disección cuidadosa que permita la separadón del plano vesical del plano vaginal, lo que ya previamente ha realizado el instrumento. Sin embargo, dertos "toques de disección" con la tijera son necesarios, para que el derre de ambos planos anatómicos sea holgado y sin tensión. Después de esto, se efectúa el derre simple de ambos orifidos utilizando para ello sutura poliglicólico 2/0 para que el cierre de la vagina y catgut crómico 3/0 para la rafia vesical. Un detalle técnico que considero importante es la contraposición de los nudos de la sutura; es decir que estos "miren" cada cavidad (Fig. 15).
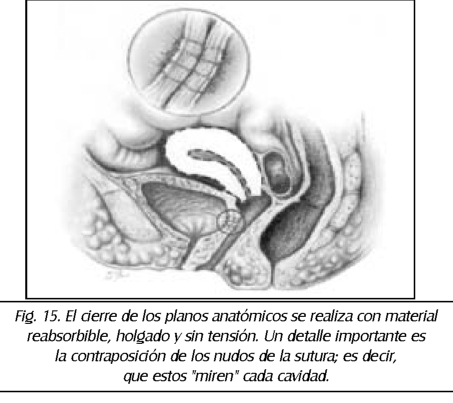
Rafia vesical en dos planos, colocación de un dren de látex en el espacio de Retzius exteriorizado por contrabertura y sutura de los planos anatómicos, finaliza con la intervención, la cual en promedio es de una hora, y es prácticamente exangüe. Un tapón vaginal impregnado con crema antibiótica permanece durante 24 horas. Se coloca un catéter uretral número 16 ó 18 Fr. durante quince (15) días, un antibiótico de amplio espectro y un aminoglucósido se recomienda por el lapso de cinco días. El egreso de la paciente es a las cuarenta y ocho horas. Control radiológico para el retiro del catéter vesical no ha sido necesario.
Hemos realizado desde 1994 hasta Mayo del 2003, 45 procedimientos quirúrgicos con este nuevo instrumento en pacientes, cuya causa de fístula vésicovaginal fue posterior a una histerectomía, consecuencia de fibromatosis uterina. El grupo intervenido osciló en edades comprendidas entre los 40 y 60 años de edad, con un tiempo control de 8 años. El porcentaje de éxito es del 100%.
VENTAJAS DEL FISTULOTOMO VESICOVAGINAL GUIA ®
• Pemiite el corte del trayecto fistuloso en un tiempo.
• Realiza un corte preciso sin deformación, ni distorsión de la mucosa vesical y vaginal, "corte limpio".
• Estabiliza de manera uniforme los tejidos adyacentes al proceso fistuloso, lo cual no se logra con las técnicas habituales al momento de la disección. A diferencia del uso del Foley o del catéter de Fogarty cuando éstos son fraccionados no se crea el suficiente apoyo para utilizar el bisturí de manera adecuada, ya que muchas veces se rompe el globo y el diámetro de la fístula se va incrementando en la medida que protruye el mismo cuando la tracción se mantiene. Evidentemente esto trae como consecuencia mayor sangrado y compromiso vesical.
• El "Fistulotomo Vésicovaginal Guia" sólo implica la escisión y corte de todo el trayecto fistuloso cuando se utiliza la cuchilla adecuada. (Corte en sacabocado).
• Puede ser utilizado en la cercanía de los orificios ureterales sin compromiso de los mismos, ya que su precisión de corte limpio se lo permite.
• Una vez escindido el trayecto fistuloso, la separación por planos tisulares entre la vejiga y la vagina, se realiza cómodamente permitiendo con sus bordes nítidos y sanos hacer un cierre holgado confiable y seguro.
• Menos sangramiento de los bordes seccionados.
• Se aminora el tiempo quirúrgico y, en consecuencia, la estadía hospitalaria y costos.
Este instrumento quirúrgico es un recurso seguro y eficaz para el tratamiento de las fístulas vésicovagi-nales, de origen traumático, por la rapidez de la técnica misma y lo sencillo para desarrollar los planos anatómicos entre la mucosa vaginal y vesical, puede garantizarse un cierre seguro de esta patología, siempre y cuando se utilice la cuchilla adecuada al diámetro de la fístula y se sigan los principios de la cirugía reparadora a fin de lograr dos premisas: mejorar la calidad de vida de estas pacientes y evitar el daño inherente a la vejiga.
FÍSTULAS POR IRRADIACIÓN
Este tipo de fístulas pueden ser consecuencia de procedimientos quirúrgicos sobre el útero o el recto que condicionan tejidos cicatridales mal irrigados en pacientes comprometidas y mal nutridas que al ser irradiadas la endarteritis creada, favorece la aparición de la fístula. Por ello, esperar una resolución espontánea o hacerlo por la vía quirúrgica precoz conllevan al fracaso; más aún, si esta fístula es por la reactivación de un carcinoma o de tejido residual maligno.
Se recomienda esperar un año antes de considerar la reparación quirúrgica. Tiempo en el cual la derivación urinaria o intestinal pueden ser considerados y cuando así lo demande, el apoyo del soporte nutricional.
La atención y cuido genital aunado al apoyo emocional social y familiar de la paciente es uno de los principales soportes que la paciente debe tener.
SÍNTOMAS Y DIAGNÓSTICO
Las fístulas relacionadas con la radioterapia presentan clásicos síntomas: pérdida de orina, síntomas irritativos urinarios destacando la polaquiuria, urgencia miccional, disuria y hematuria. Como la fístula surge posterior a la cirugía o radioterapia adyuvante, el diagnóstico se facilita, el orificio vaginal observado con el espéculo es obvio. En ocasiones se limita por la vaginitis actínica o atrófica.
El resto de los estudios diagnósticos son los mismos indicados para una fístula vésicovaginal. La tomografía computada abdómino pélvica y la resonancia magnética nuclear tienen relevante importancia. La biopsia es mandatoria.
CONSIDERACIONES
Cuando las fístulas vésicovaginales implican réimplanté ureteral, cistoplastias de aumento, antecedentes de reparaciones fallidas, comunicación a otros órganos, estabilización del cuello vesical, extirpación de tumores pélvicos o antecedentes de radioterapia, los procedimientos transperitoneales o combinados ofrecen versatilidad y recursos. En esta situación la paciente suele colocársele con las piernas semi-flexionadas en posición de decúbito dorsal, permitiendo con ello controlar el área perineo-abdominal.33
DERIVACION URINARIA
Fístulas vésicovaginales complejas ocasionadas por tumores pélvicos, radioterapia, en pacientes inmuno-deprimidas, mal nutridas, asociadas a compromiso de otros órganos y con afectación de los uréteres implican de alguna forma derivar la orina.
Hoy día, los diferentes tipos de catéteres y el avance de las técnicas percutáneas impulsan a considerar estos procedimientos cuando las situaciones son extremadamente críticas.
VENTAJAS
El beneficio psicológico y social de la paciente es notorio al no sentirse húmeda, desaparece los malos olores y la dermatitis local se controla.
• Mejora la calidad de los tejidos locales cuando la orina se extravasa en el área comprometida.
• Evita el daño de la unidad renal por pielonefritis frecuente.
• En caso de una derivación externa y la incomodidad de ella, nunca es comparable al disconfort y la dermatitis genital que conduce la pérdida de orina.
• Desde el punto de vista económico el uso de toallas sanitarias, cremas y accesorios vaginales es mucho menor.
Cuando la vejiga se encuentra retraída, con poca capacidad se plantea la cistoplastia de aumento utilizando el intestino delgado o el grueso (Fig. 16).
Es fundamental tener presente el nivel intelectual de la paciente, como también su destreza manual ya que hay que motivarla cuando la posibilidad del autocateterismo se considera y la expectativa de vida supera el año.
Cuando el abordaje abdominal es transperitoneal, una incisión en la línea media y la consideración del omento como recurso para separar ambas estructuras aportan mayor seguridad a la reparación. En primer lugar, la vascularización que posee y el aporte linfático que tiene permite el suficiente aporte sanguíneo y la capacidad de absorción de toxinas locales, lo cual es fundamental para la regeneración local. Además, contrapone las líneas de sutura.
Para su utilización debe ser cuidadosamente protegido y su disección debe por igual ser técnicamente cuidadosa. La rama gastroepiplóica derecha es de mayor aporte movilizándose el omento a partir del colon transverso, luego los vasos gastroepiplóicos izquierdos se dividen de su origen esplénico y los vasos cortos se seccionan si es necesario. Posteriormente, el omento es rotado y descendido hacia la pelvis fijándose con suturas absorbibles entre los planos de vejiga y vagina. Cuando éste se encuentra comprometido o no se dispone suficientemente de él (cirugías previas), entonces la creación o el uso de colgajos peritoneales de la pared lateral pueden ser utilizado.
Como recurso auxiliar la interposición de tejidos, colgajos miocutáneos o cualquier otro que permita separar las estructuras comprometidas ofrecerán una mayor posibilidad de cura. Por otro lado, si la vejiga posee una capacidad adecuada, el diámetro de la fístula es pequeño y la vagina permite su accesibilidad puede considerarse el abordaje vaginal con interposición de tejidos locales para su reparación. De igual manera el cateterismo ureteral y vesical son fundamentales.
NUTRICIÓN
El soporte nutridonal conforma un puntal en el tratamiento de estas pacientes ya que su proceso catabólico acelerado, la mal nutrición en la mayoría de las pacientes hospitalizadas y las condiciones de los tejidos demanda un máximo de efectividad y competencia celular e inmunológica.
Estas pacientes son más prodives a sufrir de infecciones sobre todo a nivel pulmonar, trastornos de cicatrización e íleo postoperatorio.
En tales situaciones, la evaluación por parte de la Unidad de Terapia Nutridonal juega un rol primordial.34'35
FÍSTULA URETRO VAGINAL
Este tipo de fístula poco frecuente resulta de técnicas quirúrgicas inadecuadas, uso excesivo e indebido del eledrocauterio o radioterapia. Entre las patologías más frecuentes que pueden conllevar a esta lesión figuran el divertículo uretral, prolapsos genitales, incontinenda de orina, uretrolisis. Otras causas como tumores, abscesos y necrosis conllevan a la formación de la fístula (Fig 17 -18).
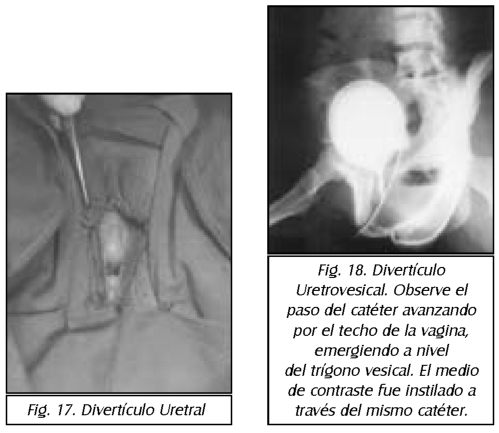
SÍNTOMAS
Si la fístula compromete el cuello vesical, la incontinencia urinaria será mantenida, mientras que fístulas distales al esfínter externo pueden ser asintomáticas.
Durante la evaluadón es obvio el orificio o la discontinuidad del trayecto uretral (Fig. 19 a, b)
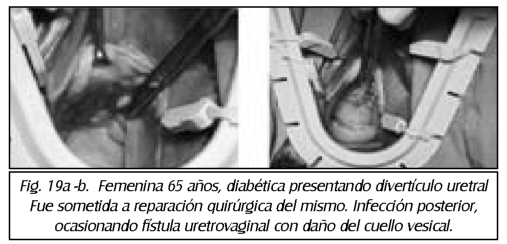
DIAGNÓSTICO
Considerando la incontinenda urinaria hay que plantearse los siguientes interrogantes: fístula vesicovaginal, fístula ureterovaginal, secreciones vaginales, urgenda micdonal o incontinenda urinaria de esfuerzo.
La uretrocistoscopia al igual que la vaginoscopia permitirá establecer detalles como longitud del compromiso uretral. En determinadas pacientes los estudios urodinámicos, videourodinamia e induso la biopsia serán necesarios.
ENFOQUE MÉDICO QUIRÚRGICO
Partiendo de la base que los primeros 2 an de cuello y uretra representan el área de la continencia (Lapides), muchas mujeres postmenopáusicas continentes poseen un cuello vesical incompetente y mantienen su continenda teniendo una uretra proximal intacta.36 La fístula, puede provocar ciertos grados de incontinencia concomitante con los síntomas urinarios irritativos: disuria, urgenda miccional, disconfort genital e incluso infecdón urinaria.
Al igual que la fístula vésicovaginal la prevención y los prindpios quirúrgicos evitan la aparidón de esta lesión.
Para su reparadón hay que tomar en cuenta la localization de la fístula, causas que la produjo y tamaño; así como también, las condiciones generales de la paciente y principalmente los factores locales vaginales. Pacientes menopáusicas con vaginitis atró-fica, el uso de estrógenos pueden estar indicados; si no hay contraindicación.
Diferentes accesos quirúrgicos dependiendo de la localización de la fístula permitirá su reparación. Cuando el cuello vesical se encuentra comprometido el abordaje transpúbico preconizado por Waterhouse puede ser una alternativa, sin embargo tiene importantes implicaciones. En nuestra experiencia hemos utilizado un colgajo rotado de la pared lateral de la vagina, la cual se ha unido a un colgajo hecho con la pared anterior de la vagina, exactamente en el área donde faltaba la uretra. Estos dos colgajos se unen mediante sutura continua con material reabsorbible 5/0. Para asegurar la reparación colocamos un colgajo de Martius, manteniendo una sonda de foley N°16 Fr. durante un período de 20 días. El resultado fue exitoso; sin embargo, hubo que complementar con una cincha, ya que la padente quedó incontinente (Fig. 20).
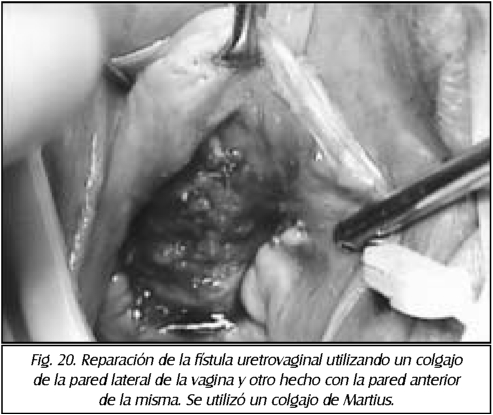
La técnica de Young Dees-Leadbetter es una opdón pero tiende a obstruir. Otros recursos implican colgajo perineal, interposidón de músculo cutáneo.
En fístulas medias, el colgajo de Martius a través de un túnel subcutáneo o vaginal permite dar seguridad a la reconstrucción.
En procedimientos reconstructivos complejos cuando se utiliza el abordaje vaginal la posición de litotomía convencional o exagerada puede conducir a neuropraxia (15.8%).37
La causa exada no se conoce, sin embargo, se plantea el efecto de la compresión directa sobre los nervios periféricos ocasionados por las piemeras, asodado a deltas anormalidades anatómicas, e isquemia neural.38
Se recomienda las pierneras tipo "media caña" para evitar este tipo de lesiones, tromboembolismo y el síndrome compartamental sobre todo en intervenciones superiores a las dnco horas.
Cuando son fístulas de origen actínico se deben seguir principios estrictos de reparación ya que la vejiga puede estar comprometida y los tejidos locales también, por ello, nunca deben realizarse cierre simples por planos, lo adecuado es aear buenos planes tisulares e interponer colgajos.
El drenaje vesical puede ser llevado a través de la vía suprapúbica o uretral.
1. Tahzib A.: Epidemiological determinants of Vesicovaginal fistulas Br. J. Obstet Gynecol 1983; 90: 389.
2. Judd E.: Operative treatment of Vesicovaginal fistu-lae. Surg Gynecol Obstet 1920; 30: 447.
3. Massie J. et.al: Management of Urinary Vaginal fistula: Ten years Survey. Jama 1964; 190: 902.
4. Guia Rv Gadea C., colb: Fístulas vésicovaginales. Experiencia en el Hospital Universitario "Dr. Angel Larralde". Revista Venezolana de Cirugía. Enero -Junio 1998; 35 - 38.
5. Goodwing WE, Scardio R: Vesicovaginal and ureterovaginal fistulas: a summary of 25 years of experience J. Urol 1980; 123: 370.
6. Wein A. et. al: Repair of Vesicovaginal fistula by a Supraputic transvesical approach. Surg, Gynecal Obstet 1980; 150 - 57.
7. Hedlund H., Linds Ted E.: Urovaginal fistulas: 20 years experience with 45 cases. J. Urol 1987; 137: 926 - 928.
8. Pérez C., Grigsby PW et al: Radiation therapy morbidity in carcinoma of the uterine cervix: dosimetric and clinical correlation. Int. J. Radiat Oncol. Biol Phys 1994; 44: 855 - 866.
9. Kadar N., Lemminerling L: Urinary tract injuries during laparoscopic assisted hysterectomy: Causes and prevention. Am. J. Obste Gynecol 1994; 170:47 - 48.
10. Elizabeth A., Miller and George Webster: Current management of Vesicovaginal fistulae: Current. Opinion in Urology. July 2001; 417 - 421.
11. Thorivinger B. Horvath C. et al: Desmonstration of fistulae in patients with gynecological neoplasms. Acta Rad 1990; 31 (4) 357 - 360.
12. Out Water E., Schiebler M. Fistulas. Fiudings on MRI images Ajr 1993, 160(2): 327 - 330.
13. Ghoniem G., Monga M.: Modified pubovaginal slingrand Martius grat for repair of the recurrent vesicovaginal fistula involving the internal urinary sphinter. Eur. Urol 1995: 27(3): 241 - 245.
14. Petterson S., Hedelin H. Jansson I., et al: Fibrin Oclusión of a vesicovaginal fistula, Lancet 1979.
15. Palma P. Cassiol, Viviane H., colb.; Endoscopic teflon inyection for the treatment of small vesicogynecologic fistulas. Urología Panamericana. Die. 2.000; 36 - 37.
16. Scherr D., Poppas D.: Soldadura de tejidos mediante láser en cirugía urológica. Actualización en Urología 2.000. AUA 7 -12.
17. Schoenrock Gj. Ciand P. Treatment of radiation cystitis with hyperboric oxygen. Urol 1986: 27(3): 271 - 272.
18. Raz S., Atlas of Transvaginal Surgery 1992; 142 -165.
19. Miller E., Webster G.: Management of vesicovaginal fistulae. Current opinion in Urología. July 2001: 417 - 421.
20. Wein A.J., Malluy T., Carpiniello V.: Repair of Vesicovaginal fistula by a suprapubic. Transvesicle approach. Surg Gynecol Obstet. 1980; 150: 57 - 60.
21. Chapple C., Turner-Warawick R.: Urinary Tract Fistulae: The use of pedicle flaps and the role of the omentum. Current Opinion Urol. 1993; 3: 234.
22. Zimmeru P., Handley H., Staskin D., Raz S.: Genitourinary fistulae: Vaginal approach for repair of vesicovaginal fistulae. Urol. Clin N. Am. 1985; 12 (2) 361 - 367.
23. Rackley R., Appell R.: Abordaje adual de la fistula vésicovaginal. Actualización en Urología. 2000 (3) 1- 6.
24. Latzkow: Postoperative Vesicovaginal Fisulas Genesis and Therapy. Am. J. Surg. 1942; 58: 211.
25. Salup R., Julian T., Liang M. et al: Closure of large postradiation vesicovaginal fistulas with rectus abdominis myofacial flap Uro 1994; 44: 130 - 131.
26. Ramos C. de la Rosa F., Castro M. et al: Fistulas vesi-covaginales: Corrección con duramadre liofilizada. Adas Uro. Esp. 1991: 15: 143 - 147.
27. O'Connor V., Sokol J.: Vesicovaginal fistula from the standpoint of the Urologist J. Urol. 1951; 66: 367 - 369.
28. Cetin S., Yazicioglu A., Ozgur S., et al: Vesicovaginal fistula repair, a simple suprapubic transvesical approach. Int. Urol Nephrol 1988, 20: 265 - 268.
29. Guia R.: Fistulotomo Vésicovaginal Guia (Nuevo instrumento para la cura de la fístula vésicovaginal traumática) Revista Venezolana de Urología. Enero - Junio 1996. Pág. 11. Detalles y Técnica.
30. Guia Rv Uzcátegui W.: Nueva Técnica para la Cura de la Fístula Vésicovaginal Traumática. XVII Congreso Venezolano de Urología. Video: Primer Premio 1998 - Caracas.
31. Guia R.: Fistulotomo Vésicovaginal Guia. Congreso Venezolano de Urología. Margarita. Primer Premio Investigación Urológica. 1994.
32. Guia Rv Uzcátegui W.: Fistulotomo Vésicovaginal Guia. Nuevo instrumento para la cura de la fístula vésicovaginal traumática. XXV Congreso Confederación Americana de Urología (CAU). XI Congreso Sociedad Ibero-Americana de Urología Pediátrica. Argentina 2000 (SIUP).
33. Arrowsmith S.: Genitourinary reconstrucción in obstetric fistulas J. Urol 1994: 152: 403 - 406.
34. Consequences of malnutrition in the surgical, patient. Surg Clin North Am. 1981; 61: 465.
35. Weinsier R., et al: Hospital malnutrition: a prospective evaluation of general medical patients during the course of hospitalization. Am. J. Clin Nutr. 1979; 32: 418.
36. Leach G.: Urethrovaginal Fistula repair with Martius labial fat pad graft. Urol. Clin. North Am. 1991; 18: 409.
37. Angermeier K., Jordan G.: Complications of the exaggerated lithotomy position: a Review of 177 cases. J. Urol. 1994; 151: 866 - 868.
38. Miller K., Leekwew P., Cowan R., et al: Neurologic Complications of the exaggerated lithotomy position: Detailed analysis. Abstract J. Urol. 1998; 159: 1.008.
Dr. Ricardo Szemat Daher
Médico Interno
Dr. Irwing Goldstein
Departamento de Urología, Universidad de Boston - USA
Dr. Ricardo Munarriz
Departamento de Urología, Universidad de Boston - USA
RECONSTRUCCIÓN ARTERIAL PENEANA REVASCULARIZACIÓN PENEANA
INTRODUCCION
La Disfunción Eréctil se define como la imposibilidad consistente para lograr ó mantener una erección peneana satisfactoria para tener relaciones sexuales. Estudios epidemiológicos comunitarios han revelado que 52% de los hombres en edades comprendidas entre 40 y 70 años han reportado; 17 % de forma leve de impotencia, 25% de formas moderada y 10% de forma completa ó graves. Opciones de tratamiento no quirúrgicas para la impotencia incluyen la Psicoterapia, hormonal, farmacológica, e intervenciones con aparatos externos.4 Las opciones de tratamiento quirúrgicos, consisten primariamente en inserción de prótesis peneanas, cirugía microvascular con baypas arteriales, y lo más reciente, cirugía para la disfunción corporovenosa oclusiva.1 Esta última cirugía ha demostrado que tiene un pobre porcentaje de éxito a largo plazo y por lo tanto nosotros actualmente no realizamos la cirugía para la fuga venosa. La revascularización peneana es corrientemente la única modalidad de terapia que tiene el potencial de curar permanentemente a los pacientes, ella permite el regreso de erecciones que se desarrollen espontáneamente sin la necesidad de ningún aparato externo ó interno.
Este procedimiento ha sufrido muchas mejoras desde la primera descripción hecha por Michal en 1973 5,6 Muchas variaciones han sido descritas por especialistas como Virag, Hauri, Crespo y Goldstein.3 Nosotros corrientemente utilizamos en un procedimiento primario, que consiste en anastomosar la arteria epigástrica inferior a una ó a las dos arterias dorsales del pene. La meta en general de la cirugía de revascularización peneana es la de baypasear las lesiones arteriales obstructivas en el lecho de la arteria hipogástrica-cavernosa.
El objetivo especifico de la cirugía, es aumentar la presión de perfusión en la arteria cavernosa y la entrada de sangre en los pacientes con disfunción eréctil secundaria a la insuficiencia arterial pura. Los hombres jóvenes, sin otros factores de riesgo vasculares, que tengan disfunción eréctil de naturaleza arte-riogénica pura, representan la población de pacientes ideales para este procedimiento y las investigaciones y la evaluación preoperatoria deben ser rigurosas en asegurarnos; un estatus hormonal adecuado, una función neurológica y función oorporo-veno oclusiva adecuadas.
DIAGNÓSTICO
El algoritmo diagnóstico nos permite asegurarnos que esta intervención se realice en un candidato ideal. Ejemplo, un candidato quien presenta una disfunción eréctil pura, que posea una insuficiencia arterial. Todos los pacientes jóvenes con una historia sugestiva de una impotencia asociada a traumatismos (Fractura pélvica y trauma perineal) se les debe llevar a cabo una historia clínica y un examen físico exhaustivo. Ellos deben poseer una evaluación endocrinológica de rutina para asegurarnos niveles adecuados de testosterona circulante y se les debe practicar el test de tumescencia peneana nocturna, para descartar una disfundón erédil de causa neu-rogénica ó de origen psicogénico. Una Ultrasonografía Doppler Dúplex, nos asegura un diagnóstico hemodinámico, con datos como; veloddades de pico sistólicos cavernosos y velocidades finales diastólicas e informadón preoperatoria como las siguientes: 1. La presencia de ramas comunicantes desde la dorsal a la arteria cavernosa (FiglA) direcdón del flujo a través de las comunicantes septales (FiglB), los diámetros de la arteria dorsal y las veloddades de los picos sistólicos, lo cual es crítico en la selecdón de la mejor arteria dorsal receptora. Finalmente evaluación vascular por infusión dinámica cavernosometría/ cavernosografía (DICC), necesario para demostrar los gradientes de presión entre la arteria braquial y las arterias cavernosas y evaluar de inmediato la función veno-oclusiva. El criterio para la definidón de la disfundón erédil arteriogénica pura esta más allá de lo programado en este capítulo y ha sido bien detallado en otras publicaciones.2 El propósito de hacer estos test es el de descartar la disfunción oclusiva corporovenosa. Luego del diagnóstico hemodinámico, si el padente presenta una insuficiencia arterial pura, se le realiza una arteriografía selectiva de la pudenda interna para: confirmar la localización de la lesión obstructiva (Fig 1C), la cual por lo general se localiza en la arteria peneana común ó en la arteria(s) cavernosa(s), seleccionar entonces, la mejor arteria epigástrica inferior. Solo después de completar esta evaluación, es cuando se procede a realizar la revascularización.
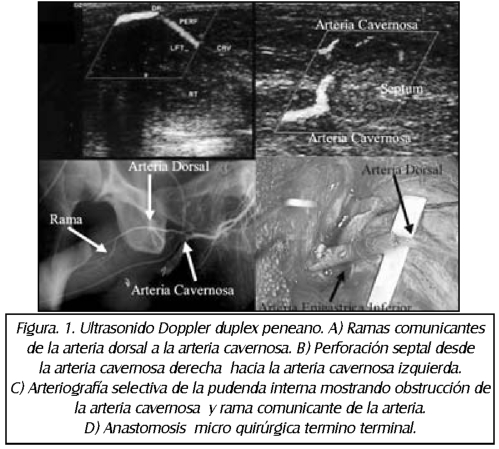
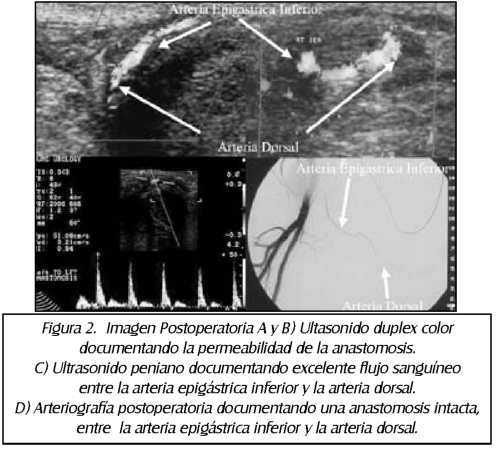
INDICACIONES DE CIRUGIA
El éxito de esta operación esta basado en la selección del candidato correcto y de la capacidad microquirúrgica del cirujano. Es por esto, que hemos desarrollado una lista de criterios que el paciente y el cirujano deben cumplir para asegurar unos resultados óptimos. Los criterios son los siguientes:
La historia del paciente debe estar caracterizada por (a) Libido fuerte, (b) una reducción consistente en la rigidez de la erección durante la actividad sexual, (c) aumento de la rigidez de la erección durante las erecciones de la mañana, (d) capacidad variable de sostén, con el mejor mantenimiento de la rigidez durante las erecciones matutinas, y (e) pobre espontaneidad en las erecciones, requiriendo de un gran esfuerzo y tiempo para lograr una respuesta eréctil rígida muy pobre. Evaluación hormonal y Neurológica normal. Aumento de los gradientes arteriales durante la determinación de la presión de oclusión de la arteria cavernosa en el momento del DICC indicador de insuficiencia arterial. Los parámetros veno oclusivos normales (Flujo para mantener valores, valores de presión decrecientes durante DICC. La presencia de una lesión oclusiva en uno ó en los dos lechos arteriales hipogástricos-cavernosos localizados en la arteria peneana común ó en la arteria cavernosa que se pueda utilizar para la realización del baypass distal. La presencia de una arteria epigástrica inferior de suficiente longitud que permita la anastomosis a la arteria dorsal sin troncos comunes, con las arterias obturatrices, la cual teóricamente puede disminuir la presión de perfusión de la arteria epigástrica inferior (síndrome del robo). La presencia de ramas comunicantes entre la arteria dorsal y la arteria cavernosa distal a la oclusión que permitirá el influjo sanguíneo nuevo y el desarrollo de un aumento de presión intracorpórea. El desarrollo de destreza quirúrgica permitirá adherirse estrictamente a los principios operativos microquirúrgicos siguientes: (a) Evitar cualquier trauma mecánico de las arterias del donante ó el recipiente debido a torce-dura ó excesiva tensión (b) evitar cualquier cambio térmico debido al electrocauterio, exposición a irritantes fríos, ó resequedad por exposición al aire, (c) evitar isquemia resultado de la compresión ó disección y (d) una técnica microquirúrgica meticulosa de la anastomosis. Evitar el trauma del pene, como el que ocurre durante la masturbación ó en un encuentro sexual, por un periodo de 6 semanas post operatoriamente, para evitar una disrupción de la anastomosis.
Como los candidatos son hombres jóvenes, no hay necesidad de exámenes preoperatorios, solo los ya mencionados al comienzo. En el pabellón el paciente se coloca en posición supina en la mesa operatoria y los brazos se colocan cerca del cuerpo para minimizar el traumatismo de los nervios en las extremidades superiores. Debido a que esta intervención puede durar alrededor de 5 horas, mucho cuidado se debe tener apoyando las extremidades inferiores con una almohadilla, particularmente en los puntos neurovasculares en la parte superior del miembro. En intervenciones pasadas, hemos tenido algunos pacientes que desarrollaron parálisis braquial y ulnar, postoperatoria transitoria, debido a presión prolongada en el área epicondílea medial. Anteriormente, desde que cambiamos nuestra política dándole instrucciones al anestesiólogo de poner los brazos pegados al cuerpo del paciente y alternado la posición de la banda del tomador de presión arterial periódicamente a lo largo del procedimiento, nunca más se han presentado una parálisis transitoria de los nervios. La anestesia general endotraqueal con relajación muscular completa facilita mucho el sacar los vasos del donante. Es nuestra política la presencia en la sala de operaciones, los arteriogramas y el Doppler dúplex del pene ya que pueden ser necesitados en cualquier momento de la intervención. Una vez que el paciente se encuentra en quirófano tanto genitales y el abdomen son cuidadosamente afeitados y se le coloca una dosis de antibióticos preoperatorios (Cefazolina ó Vancomidna en los alérgicos a la penicilina). Una vez que el padente se prepara y se cubre con sus sabanas, se le coloca un foley N° 16 usando una técnica lo más estéril posible y la vejiga queda drenada de su orina.
Desde el punto de vista técnico la operadón se divide en tres etapas: disecdón de la arteria dorsal, limpieza de la arteria epigástrica inferior y la anastomosis microquirúgica.
Disecdón de la Arteria Dorsal
Se realiza una incisión curvilínea abdominal, generalmente en el lado opuesto a la incisión planificada para limpiar la arteria epigástrica inferior. La indsión se hace a dos dedos de la base del pene, en el punto opuesto a la raíz ventral del mismo, hada el rafe medio escrotal. Esta indsión se prolonga hada abajo a través de la membrana del dartos usando cauterio. Las ventajas de esta incisión es que ella ofrece(a) excelente exposición proximal y distal de la bandeleta neurovascular del pene, (b) la habilidad de preservar los ligamentos fundiformes y suspensorios, previniendo el acortamiento del pene y (c) la ausenda de cicatrices postoperatoria en el forro ó en la base del pene. Usando un anillo retractor con sus garfios elásticos se maximiza la exposición operatoria del pene con mínima asistencia.
Inversión peneana
La túnica albugínea ipsolateral es seguidamente identificada a nivel del forro medio peneano. Con el pene en redo, se realiza una disecdón roma con el dedo a lo largo de la túnica albugínea en direcdón distal profunda e inferior de las estruduras del cordón espermático a lo largo y lateral parte del forro del pene evitando el traumatismo del ligamento fun-diforme. En este momento el pene es invertido a través de la incisión en la piel, teniendo cuidado de empujar el glande fuertemente. El pene no debe tener tumescenda durante esta maniobra. Si se presenta una erección pardal, se debe administrar un agonista alfa adrenérgico intracavernoso (lOOug de fenile-frina). Una disección roma con los dedos alrededor del forro del pene distal permite establecer un plano entre la fasda de Bucks y la fasda de Colles, colocando un dren de látex en ese plano.
Preparación de las Arterias Dorsales
del recipiente
Luego se realiza exposición de la vandeleta nerviosa y en particular de las arterias derechas e izquierda del pene. Las arterias son usualmente obvias, localizadas en cada lado de la vena dorsal profunda y rodeada por los nervios dorsales. El Aislamiento de la arteria dorsal del pene para la cirugía del bypass arterial, requiere de una disección limitada en este momento del procedimiento; para minimizar un trauma térmico, mecánico ó isquémico de las arterias dorsales del pene. Para evitar un vasoespasmo por el trauma se debe aplicar frecuentemente una irrigadón con hidroclorato de papaverina tópica. De esta manera se asegura la preservación endotelial y la morfología de la célula del músculo liso durante la preparadón de la arteria dorsal. Esto es muy crítico, como también lo es la medición de la temperatura del quirófano, y el uso de soluciones irritantes a temperatura del quirófano, y aun con la indsión en piel se puede indudr vasoconstricdón, espasmo, y posible daño de la célula endotelial. Para la irrigadón intraluminal utilizamos papaverina diluida, heparina y soludón eledrolítica, asegurándonos de que sea capaz de inhibir el desarrollo temprano de lesiones proliferativas miointimales durante la preparadón quirúrgica.
Las arterias dorsales del pene derechas e izquierdas se identifican primero a través de la piel en la mitad del pene. Su curso es seguido proximalmente por debajo del ligamento fundiforme, con el cuidado necesario de dejar el ligamento fundiforme intado. Una ventana se diseña proximalmente al ligamento fundiforme, usualmente cerca de la unión del fundiforme y el ligamento suspensorio en el sitio donde el forro pendular del pene se hace fijo proximal. Una disección roma se hace por debajo del aspedo proximal del ligamento fundiforme por encima del hueso púbico hada el anillo externo. Esta disección le permite a la arteria epigástrica inferior pasar de su localización abdominal hacia una localizadón apropiada en el pene mientras simultáneamente se preserva el ligamento fundiforme. El pene es colocado hacia atrás en su posición anatómica normal y la incisión inguinoescrotal se cierra cuidadosamente con grapas.
Aislamiento de la arteria epigástrica inferior
Incisión Abdominal
Una indsión transversa semilunar siguiendo las líneas de Langer es la indsión preferida. Alternativamente, una indsión paramediana puede ser usada especialmente si la arteria epigástrica inferior es corta, tiene múltiples ramas, ó los hábitos del paciente contraindican una indsión Standard transversa. La indsión transversa nos propordona una exposición operativa excelente de la arteria epigástrica inferior y presente una dcatrizadón más estética comparada con aquellas observadas con las ind-siones de piel paramedianas. El punto de comienzo de la incisión transversa se encuentra aproximadamente 11/16 de la distancia total desde el hueso púbico hasta el ombligo en la línea media. Esta se extiende lateralmente a lo largo de las líneas de piel por aproximadamente 5 cm. La fascia del redo se indde verticalmente. La unión entre el músculo recto y la grasa preperitoneal subyacente se identifica y se penetra al espacio preperitoneal. El músculo redo se separa hada la línea media.
La arteria epigástrica inferior y sus dos venas acompañantes están localizadas entre el músculo recto en el plano preperitoneal. El anillo retractor se utiliza de nuevo para optimizar el campo operatorio. Es de suma importancia preservar una arteria epigástrica inferior de suficiente longitud para prevenir tensión en la anastomosis micro vascular. La aplicadón de papaverina tópica se utiliza en la arteria epigástrica inferior a través de la disecdón. Se debe evitar un trauma térmico usando un equipo de cauterio de corriente baja micro bipolar a un nivel mínimo necesario para una adecuada coaguladón y la vasavasora es preservada disecando la arteria en bloque con sus venas y grasa que lo rodean. La disección de la epigástrica inferior se necesita desde su origen al nivel de la arteria iliaca externa hasta el punto, a nivel del ombligo. Es en este punto que la arteria se bifurca. En el pasado nosotros hemos hecho un gran esfuerzo en usar la bifurcadón donde nos permitiera de realizar la anastomosis a las dos arterias dorsales, pero no observamos una mejoría significante en la función erédil en los pacientes en los cuales se les realizó una anastomosis de la arteria epigástrica inferior, a las dos arterias dorsales, cuando se comparó con los pacientes que se les realizó una sola anastomosis. Es por esto que corrientemente hacemos una anastomosis sola, minimizando el tiempo quirúrgico y preservando una arteria dorsal en caso de que se desee una segunda revascularizacion peneana.
Transferencia de la artería epigástrica inferior
La ruta de transferencia de la fuente de influjo neoarterial se prepara desde la perspediva abdominal, antes de cortar los vasos distalmente (La ruta de transferencia peneana se disecó previamente). Las grapas escrotales temporales se quitan y el pene se reinvierte. El anillo interno en el lado de la arteria aislada se identifica lateral al origen de la arteria epigástrica inferior. Usando una disección roma con los dedos a través del canal inguinal se pasa un clamp vascular fino a través la ventana en el ligamento fundiforme, y de los anillos inguinales internos y externos y un dren de penrose se coloca para proteger esta ruta de transferencia.
La bandeleta vascular donante se corta a nivel del ombligo entre dos liga clips y se inspecdona cuidadosamente por si hay algún sitio de hemorragia proximal. Un clamp vascular fino y largo se saca a través del anillo inguinal interno de nuevo, esto nos da tiempo de tomar el final de la arteria epigástrica inferior. El paquete vascular con la epigástrica inferior se transfiere hada la base del pene. Esta debe tener un pulso rápido y debe tener una longitud adecuada. El origen de la arteria epigástrica inferior debe ser revisada de que no este acodada ó torcida. Luego de revisar y lograr una hemostasia completa, se cierra la herida abdominal en dos planos. La fascia del recto se cierra utilizando una sutura continua de ácido poliglicolico o, una sutura comenzando en cada extremo de la incisión. Los bordes de la piel se acercan usando grapas de piel.
Preparación de los vasos
Un anillo retractor con sus ganchos elásticos se utilizan de nuevo en la incisión inguinoescrotal y la ventana del ligamento fundiforme para ganar exposición al paquete neurovascular dorsal proximal. La arteria epigástrica inferior, pulsátil, se coloca al lado de la arteria peneana dorsal receptora y se busca una localización conveniente para la anastomosis vascular. La anastomosis ó (las anastomosis) están basadas en los hallazgos del ultrasonido Doppler Dúplex y en la arteriografía. Una anastomosis término- terminal, es mejor debido a las condiciones comunicantes de la arteria peneana, que existen con la arteria cavernosa. Agregaremos algo más ya que la anastomosis término- terminal transfiere las presiones de perfusión más efectivamente que las anastomosis término-laterales y con menos turbulencia. Es nuestra experiencia, que la ligadura de las dos arterias peneanas dorsales para la elaboración de una anastomosis termino-terminal proximal, nunca ha causado un daño isquémico al glande del pene.
El segmento apropiado de la arteria peneana dorsal se libera de sus ataduras a la túnica albugínea, con el cuidado de evitar daño a las ramas comunicantes de la arteria cavernosa. La hemostasis vascular de este segmento de la arteria peneana dorsal se debe lograr con clamps vasculares para aneurismas de (baja presión) bañado en oro ó pasarle una lazada vascular, bajo mínima tensión, para minimizar el tiempo operatorio. El único sitio donde la adventicia debe ser cuidadosamente removida es en el lugar de la anastomosis vascular, ejemplo, la parte final de la arteria epigástrica inferior y la parte final libre de la arteria dorsal, para evitar que pueda causar posteriormente trombosis. Si un segmento de adventicia penetra la anastomosis, la viabilidad de la misma esta comprometida, debido a que la adventicia activa factores de coagulación desde el sistema extrínseco. La adventicia remanente debe ser preservada en los vasos debido a que la vasa vasorum tiene un papel nutri-cional en la pared de los vasos. La preservación de la adventicia es adicionalmente importante en término de inervación de los vasos.
Técnica de la Anastomosis
Nosotros usamos un material plástico coloreado hasta la raíz para ayudar en la visualización bajo el microscopio.
Se practica una anastomosis termino terminal (Fig ID), entre la arteria epigástrica inferior y la arteria dorsal, usando una sutura de nylon 10-0 interrumpida (simple ,100-un, aguja curva 149 grados) con una magnificación de 10-X. Luego de soltar los clamps vasculares oclusivos temporalmente (ó un lazo de vasos) en la arteria dorsal del pene, el segmento anas-tomosado debe demostrar pulsaciones arteriales a lo largo de su longitud y retrogrado dentro de la arteria epigástrica inferior. Esta observación implica una anastomosis que esta presente. En este momento, el clamp dorado para aneurismas que esta en la arteria epigástrica inferior debe ser retirado. La intensidad de las pulsaciones arteriales en la anastomosis aumenta. Ocasionalmente la aplicación de pequeñas porciones de material hemostático puede ser necesaria para ayudar a lograr la hemostasia en los huecos que dejan las agujas de la sutura en la pared de los vasos. Luego que una buena hemostasia ha sido lograda y una cuenta correcta de gasas y de instrumentos ha sido realizada, comienza el cierre de la incisión inguino escrotal. La capa del dartos se aproxima usando una sutura de ácido poliglicolico, 3-0 de una manera continúa. Las paredes de la piel se cierran con grapas para la piel. Se le deja una sonda de Foley a un sistema cerrado drenando a gravedad durante la noche.
Modificaciones al procedimiento anteriormente descrito pueden ser realizadas. La anastomosis arterial alternativa más común es una anastomosis término lateral, entre la arteria epigástrica inferior y la arteria dorsal del pene. Se coloca un 10-0 a lo largo del axis longitudinal de la arteria dorsal del pene en un segmento de lmm en la región de la anastomosis deseada. Luego de darle tensión a la sutura, una secdón oval en la pared de la arteria se reseca con una micro tijera curva resultando en una arte-riotomía horizontal de 1.2-1.5. Un stent de silastic 2F se coloca entre la arteriotomía para definir claramente el lumen del vaso. La sutura es colocada inicialmente a cada ápex de la anastomosis y luego subsecuentemente de 3-5 suturas ininterrumpidas se colocan dentro de cada pared lateral. Todas las suturas usadas para completar la anastomosis son insertadas equidistantes una de la otra para evitar una anastomosis desigual. Un lado de la anastomosis se termina antes de comenzar el otro lado. Si se usa un stent vascular temporal este se retira una vez que todas las suturas están colocadas. El uso de stents vasculares temporales permite una inspecdón cuidadosa de la pared posterior de los vasos.
Una disrupción mecánica de la anastomosis microvascular y una subsiguiente hemorragia arterial incontrolada, puede ocurrir por un trauma cerrado en las primeras semanas postoperatorias, luego de un coito, masturbadón ó por un accidente. Nosotros recomendamos una abstención postoperatoria de las actividades sexuales que impliquen una erección peneana, hasta por 6 semanas.
Otras complicadones, dolor en el pene, disminución de la sensación del pene por una posible injuria al contiguo, nervio dorsal del pene.7 Pérdida de la complianse postoperatoria de los ligamentos suspensorio y fundiforme puede llevar a una disminución de la longitud del pene. La preservadón de los dos ligamentos ha minimizado marcadamente estas complicaciones en nuestra serie. La hiperemia del glande, veíamos este tipo de complicadón, cuando se hace la anastomosis de la arteria epigástrica inferior a la vena dorsal profunda (arterialización de la vena dorsal), ya no la vemos porque ya no emplea este tipo de anastomosis. 3
En el pasado nosotros tuvimos muchos parientes que desarrollaron una parálisis transitoria, braquial y Ulnar debido a una prolongada presión en el área epicondílea media. Desde que cambiamos nuestra tádica, instruyendo al anestesiólogo de colocar los brazos pegados al cuerpo del padente y alternando la posición del mango de tomar presión sanguínea periódicamente a lo largo del procedimiento, no tuvimos más parálisis transitoria del nervio.
Nosotros hemos reportado objetivamente el estatus hemodinámico postoperatorio (Fig 2A); (Fig. 2B), incluyendo un equilibrio seguro de las presiones intacavernosas y de los parámetros chequeados de las funciones arteriales y veno oclusivas, en los pacientes que presentan resultados clínicos exitosos (Fig 2C); (Fig 2D), como los que fallan, luego de una cirugía de baypass microvascular arterial, para la impotencia.
De los 226 pacientes a quienes se les pradicó una cirugía de baypass microvascular arterial peneana desde 1985 a 1992, a 68 (30%) (Edad promedio 34 años) se les hizo, preoperatoriamente y postoperatoriamente farmacocavernosometría y farmacocaver-nosografía. La duración promedio entre el procedimiento del baypass y los test de seguimiento postoperatorios fue de 6-8 meses. Los baypases quirúrgicos en estos 68 pacientes incluyen 65 de arteria epigástrica inferior a la arteria dorsal peneana, incluyendo 30 con anastomosis arterial dorsal dual. Adicionalmente tuvimos, 9 anastomosis de la arteria a la vena dorsal profunda, incluyendo 6 que se elaboraron en conjunto con una anastomosis arterial. 49 pacientes (72%) tuvieron concomitantemente cirugía venosa por tener disfunción venooclusiva (46 excisiones de la vena dorsal profunda, 35 pli-caturra crural, 19 ligaduras de la vena cavernosa y 3 espongiolísis).
Doce parientes (21%) con impotencia arteriogé-nica pura presentaron un aumento postoperatorio sostenido y un equilibrio estable con presiones intra-cavernosas de 25-12.3 mm Hg (rango 13-45 mm Hg). De los 56 pacientes restantes ,49 tuvieron cirugía venosa concomitante. En este último grupo no hubo cambio significantes en promedio del equilibrio estable, con presiones intacavernosas (38-20mmHg preoperatorio y 43-17 mm Hg postoperatorio), el promedio de presión decayó en 30 segundos (67-9 mm Hg preoperatoriamente versus 64-26 mm Hg postoperatoriamente) ó el flujo promedio para mantener valores (38-36 ml/min preoperatoriamente versus 28-28 mm Hg postoperatoriamente). A Los 7 restantes, que no se les hizo cirugía venosa, tuvieron una fundón venoodusiva normal pre y postoperatoria; sin embargo la presión intracavernosa postoperatoria (54-22 mm Hg preoperatorio; 58-27 mm Hg postoperatoria); no aumento.3
Revisando la literatura reciente, han sido reportados una tasa de éxito variable luego de la revascularización peneana, entre 30% y 74%. Uno de los problemas para interpretar estos datos es que no existe una estandarización en la definición de éxito luego de esta operación. El éxito ha sido variablemente definido por cuestionario, entrevista del paciente y evaluación hemodinámica. La población de pacientes ha sido heterogénea con un variable número de pacientes con impotencia venogénica. Ya nosotros no ofrecemos esta operación a los pacientes con fuga venosa. El tercer problema con la literatura hasta hoy, es la inclusión en las series reportadas de procedimientos de la arterializadón de la vena dorsal, que nosotros creemos que las tasas de éxito que se obtienen son inferiores a los procedimientos que utilizan anastomosis arterial pura. Finalmente, la mayoría de los estudios solo tienen cortos períodos de seguimiento que van desde 16 a 36 meses. El estudio más reciente posee una tasa de éxito a corto plazo de 80% y a largo plazo (más de 5 años) una tasa de éxito de 64%, utilizando un criterio estricto en la selección de los pacientes.
Para evaluar esta operación como una estrategia válida en su manejo, análisis prospectivos del seguimiento y evolución de estos parientes, es esencial. Debemos estandarizar; la definición de éxito, técnicas de seguimiento, los pacientes necesitan ser seguidos por un largo período postoperatoriamente. La finalidad de esta operación es restaurar las erecciones en el hombre joven con disfundón eréctil, en forma natural y espontánea, sin la ayuda de material externo ó interno.
Debemos investigar mucho, necesitamos comprender y resolver, porque un número importante de hombres, continúan fallando con la cirugía de revascularización peneana.
1. Goldstein I. Arterial revascularization procedures. Semin Urol 1986; 4:25.2.
2. Goldstein I. Vascular diseases of the penis. In: Pollack HM, ed. Clinical Urography. 3rd ed. Philadelphia: WB Saunders, 1990; 2231-2252.
3. Hatzichristou DG, Goldstein I. Arterial bypass surgery for impotence. Curr Opin Urol 1991;1.
4. Krane RJ, Goldstein I, Saenz de Tejada I. Impotence. N Engl Med J 1989; 321: 1648-1659.
5. Michal V, Kramer R, Popischal J, Hejhal L. Direct arterial anastomosis on corporal cavernosa penis in therapy of erectile dysfunction. Rozhl Chir 1973; 52: 587-590.
6. Michal V, Kramer R, Popischal J. Femoropudendal bypass, internal iliac thrombendarterectomy and direct arterial anastomosis to the cavernous body in the treatment of erectile impotence. Bull Soc Int Chir 1974; 33: 341-345.
7. Zorgniotti AW, Lizza EF. Complications of penile revascularization. In: Zorgniotti AW, Lizza EF, eds. Diagnosis and management of impotence. Philadelphia: BC Decker, 1991. J. Mulhall: Department of Urology, Loyola University Medical Center, Maywood, Illinois 60153. I. Goldstein: Boston Medical Center, Boston, Massachusetts 02118.
Dr. Ricardo Szemat Daher
Médico Interno
Dr. Irwing Goldstein
Departamento de Urología, Universidad de Boston - USA
Dr. Ricardo Munarriz
Departamento de Urología, Universidad de Boston - USA
PRIAPISMO
El término priapismo es derivado del Dios griego Priapus, Dios de la seducción, fertilidad, y amor sexual, también conocido por su falus gigante.1 Desde el primer caso reportado de priapismo en 1824 por Callaway,2 Atención limitada se le ha puesto al estudio de incidencia, etiología, fisiopatología, diagnóstico y tratamiento del priapismo. Por tanto, el priapismo se encuentra asociado, en parte, con una evolución poco ideal del paciente que incluye la disfunción eréctil permanente y las consecuencias psicosociales devastadoras asociadas.
El panel líder en la evaluación y tratamiento del priapismo desarrollado bajo el auspicio de la Fundación Americana de las Enfermedades Urológicas, contando con un panel multidisciplinario que incluye expertos en pediatría, hemato-oncólogos, psiquiatría, y urología, definen priapismo como la condición patológica de la erección peneana que persiste en el tiempo o que no esta relacionado con la estimulación sexual.3 Este panel también ha clasificado al priapismo de la siguiente manera:
1. Priapismo isquémico (veno-oclusivo) es la
forma más común de priapismo; es usualmente una erección rígida dolorosa caracterizada clínicamente por ausencia del flujo sanguíneo cavernoso. Aquel priapismo isquémico que se prolonga por más de 4 horas es un síndrome compartimentai requiriendo intervención médica de emergencia. Consecuencias potenciales son fibrosis corporal irreversible y disfunción eréctil permanente.
2. Priapismo arterial (no-isquémico) es una
forma menos frecuente de priapismo causado por un flujo cavernoso no regulado. La erección es usualmente no dolorosa y no es totalmente rígida. Este tipo de priapismo requiere evaluación pero tampoco es un síndrome compartimentai, por tanto no es una emergencia médica.
INCIDENCIA
Estudios epidemiológicos bien diseñados basados en la comunidad, que investiguen la prevalencia o incidencia del priapismo, son limitados. Cifras obtenidas en la actualidad revelan que la incidencia del priapismo en la población general es baja. Un estudio culminado, basados en datos obtenidos de la hoja de egresos de un hospital, establece la incidencia del priapismo entre 0.3 a 0.5 casos por 100,000 personas-año con un pico de incidencia de 1.1 casos por 100,000 personas-año en el año culminante del estudio. Esto fue atribuido al nuevo uso de agentes vasoactivos intracavernosos introducidos para el tratamiento de la disfundón erédil.4 Mas recientemente, Eland et al., condujo un estudio de cohorte retrospedivo basado en la población usando los datos del "Integrated Primary Care Information", el cual es un record computarizado de todos los parientes atendidos por practicantes generales en Holanda.5 El estudio demostró una incidencia ligeramente mayor de priapismo no iatrogénicos (0,9 casos por 100,000 personas-año) y una incidencia similar de priapismo iatrogénico. La incidencia de priapismo en los Estados Unidos y otros países, fueron hemoglobinopatías por drepanodtos, siendo mayoritariamente prevalente en otros países. Un estudio basado en un cuestionario de cinco centros en el Reino Unido y Nigeria, de 130 parientes con enfermedad drepanocitica, reportaron que la prevalencia del priapismo en pacientes con esta patología fue del 35%.6
ETIOLOGÍA DEL PRIAPISMO ISQUÉMICO (VENO-OCLUSIVO)
1. Drogas, toxinas, hormonas e hiperalimentación parenteral
Las drogas son responsables de hasta un 80% de los casos.7 La inyección intracavernosa de drogas vasoactivas para el manejo de la disfundón eréctil se ha convertido en la causa mas común de priapismo inducido por fármacos.8 El riesgo de priapismo luego de la inyección intracavernosa de agentes vasoactivos tales como la papaverina y la prostaglandina El o una combinación de ambos es alto, en hombres con insuficiencia arterial cavernosa pura, neurogénica o psicogénica.
Drogas Antihipertensivas (phenoxybenzamine,9 labetalol10, prazosin11'12), se piensa que inducen priapismo a través de la actividad alfa adrenérgica, previniendo o retardando la detumescencia fisiológica, o por relajación directa del músculo liso del cuerpo cavernoso.13
Duggan et al. Reportaron al comienzo una asociación entre la heparina y el priapismo, luego de que
4 pacientes desarrollaron priapismo isquémico durante el uso de heparina para el manejo del infarto al miocardio.14 Esta asociación fue estudiada posteriormente por Singhal et al. En el cual 17 de 3337 pacientes en hemodiálisis quienes recibieron heparina y experimentaron un episodio de priapismo en un tiempo corto o durante la hemodiálisis.15 A pesar de que el mecanismo por el cual la heparina induce el priapismo no se encuentra claro, se plantea la hipótesis que un estado relativo de hipercoagulabilidad puede desarrollarse luego de que la terapia con heparina se descontinúa.16 En forma complementaria, los pacientes hemodialisados pueden tener un defecto del factor de Von Willebrand, una molécula plaque-taria de adherencia que perpetua un estado de hipercoagulabilidad. Sin embargo, aun así, que estos sean los medicamentos con mayor susceptibilidad a producir priapismo, la Warfarina también ha sido asociado a esta patología.17
A pesar de que los antidepresivos tridclicos han estado asodados raramente al priapismo, el trada-zone, un antidepresivo e hipnótico muy usado, es comúnmente asociado con erecciones prolongadas y priapismo.18'22 Se piensa que el mecanismo es a través de la mediadón por bloqueo alfa-adrenérgico, el cual interfiere con el mecanismo normal de detumescenda.23'24 Drogas Antipsicóticas tales como las fenotiazidas, también han sido asociados con priapismo isquémico usando la vía del bloqueo de receptores dopaminérgicos DI y en un menor grado por las propiedades de bloqueo alfa antihistamina, antiserotonina, anticolinérgica.25'26
La administración de cocaína vía intranasal o tópica27'28 se ha convertido en una causa común de priapismo isquémico. El mecanismo fisiopatológico es complejo y multifadorial, por un lado, la cocaína es un inhibidor potente de la recaptadón de nore-pinefrina, el cual depleta los depósitos de norepine-frina y previene la detumescenda.29 Por otra parte, la cocaína es un inhibidor potente de la recaptación de serotonina, el cual puede causar estimulación del sistema nervioso central y vasodilatación periférica.30'31 La Marihuana también ha sido asociada al priapismo.32'33
En el pasado, cuando la hiperalimentación parenteral contenía altas emulsiones de grasas, el priapismo isquémico era frecuentemente reportado. Diversos mecanismos fisiopatológicos tales como la hipercoagulabilidad, embolismo graso, trombosis capilar y disminución del flujo sanguíneo, han sido hipótesis propuestas, de ser responsables por el desarrollo del priapismo isquémico induddo por hiperalimentación parenteral.34-36
Finalmente, las toxinas (Araña, viuda negra),37 sobre la preparación de contenidos de efedra29 y la administradón de diversas hormonas (testosterona)38'40 o antiestrógenos (tamoxifen)41 han sido asociados con priapismo isquémico.
Los desordenes hematológicos, en particular las hemoglobinopatías, son causas comunes de priapismo en la población pediátrica.42 La incidencia de enfermedad de células sickle, en Afroamericanos se ha estimado en 8,2 %,43 y aproximadamente 10-89% de los pacientes con esta enfermedad experimentan priapismo.44'45 La vasta mayoría de priapismos que ocurren por esta causa tienen lugar durante las erecciones nodurnas. Es posible que la combinación de anormalidades fundonales y estructurales de los eritrocitos, una tensión de oxigeno baja y un pH corporal disminuido durante las erecciones nocturnas prolongadas, pudieran indudr la formadón irreversible de eritrodtos sickled cell, el cual previene el flujo venoso y la detumescencia peneana normal. Esta alteración es probablemente la causa más común de priapismo tartamudeante, un síndrome raro y pobremente descrito, caracterizado por episodios recurrentes o múltiples de priapismo isquémico
Otras hemoglobinopatías (talasemia)46 y estados de hiperviscosidad tales como leucemia y polidtemia también han sido descritos en su asociadón al priapismo.47'48 La fisiopatología es probablemente similar a la anemia de células sickle.47'48
3. Desórdenes metabólicos, neurológicos y malignos
Desordenes metabólicos tales como la amiloidosis49 y la enfermedad de Fabry50 son causas raras de priapismo y la literatura esta limitada a reportes de pocos casos. El mecanismo fisiopatológico más probable es dado a la obstrucción de las vías de drenaje sanguíneo del pene.
Traumatismos de la medula espinal,51 compresión medular,52 y neuropatía autonómica son causas raras de priapismo y generalmente se resuelven espontáneamente o requieren intervención mínima.
El priapismo maligno es una condición rara, sin embargo,53-55 la presentación maligna primaria mas común responsable es el tumor de vejiga, próstata, rectosigmoides, colon, y riñón (30, 30,16 y 11 en porcentaje respectivamente).56 El mecanismo fisiopatológico por el cual los tumores causan priapismo se debe probablemente a la obstrucción del drenaje venoso o al reemplazo parcial de los sinusoides, mediante el cual puede ocasionar estasis y trombosis.
4. Idiopático
La etiología del priapismo isquémico es desconocida en aproximadamente un 30-50% de los casos.57 Una evaluación detallada y completa es mandatario para excluir causas que sean amenazantes para la vida. Otras causas asociadas a priapismo tales como la hipertrigliceridemia,58 abscesos corporales,59 y enfermedades infecciosas (tularemia, sífilis congéni-ta, parotiditis)60 son listados en la tabla 1.
Tabla 1. Etiología del Priapismo
Priapismo Isquémico
Drogas
Agentes Intracavernosos: papaverina, prostaglandina El, fenoxybenzam¡na,Trazadona, benzodiazepinas, fenoti-azinas, Prazosin, fenoxybenzamina, labetalol, bloqueantes de canales de calcio, Beta bloqueantes, hidralazina).
Anticoagulantes: Heparina, warfarina.
Agentes Hormonales: testosterona, Horomona liberadora de Gonadotropinas, Antiestrógenos (tamoxifen)
Drogas Ilegales: cocaína y marihuana.
Nutrición parenteral
Otras: monóxido de carbono, veneno de viuda negra, alcohol.
Desórdenes Hematológicos
Estados de Hlpervlscosldad: Policitemia.
Hemoglobinopatías: Anemia de células Sickle, talasemia.
Desórdenes Inmunológicos: Lupus, Deficiencia de Proteína C.
Desórdenes Metabólicos: Gota, Diabetes, Síndrome Nefrítico, insuficiencia renal, Amiloidosis, Enfermedad de Fabry.
Desórdenes Neurológicos: Lesiones medulares, Neuropatía autonómica, Estenosis espinal.
Malignas: Leucemia, mieloma múltiple, cáncer prostático, de vejiga, uretral, renal y cáncer colorectal.
Idiopático.
Priapismo Arterial
Traumatismo perineal sin punto de localización.
Traumatismo perineal penetrante: (laceración de la arteria cavernosa/ administración intracavernosa de agentes vasoactivos).
Idiopático: Traumatismo no reconocido.
FISIOPATOLOGÍA DEL PRIAPISMO ISQUÉMICO
Este resulta de una pérdida del balance entre los mecanismos vasoconstrictores y relajantes, conllevando a un síndrome compartimentai, bioquímicamente caracterizado por hipoxia, hipercapnia y acidosis. La exposición prolongada del músculo liso corporal a estas condiciones resulta en daños irreversibles a los tejidos eréctiles con fibrosis corporal subsiguiente (Figura 1). Los agonistas alfa-adrenérgico atenúan la contractilidad del músculo liso trabecular producto de la addosis.61 En consecuencia, altas dosis de agonistas adrenérgicos pueden ser requeridos para sobreponerse a la disminución de afinidad de los receptores en orden de alcanzar la detumescenda.62
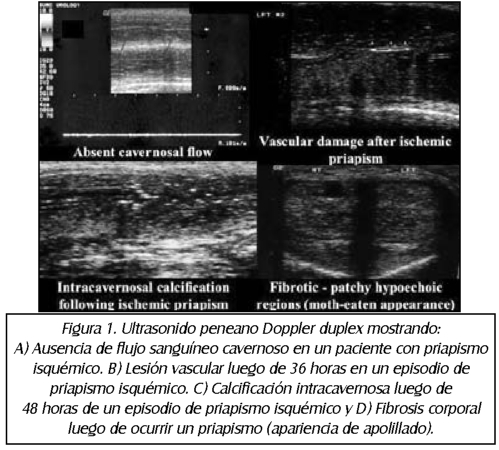
En resumen, la hipoxemia activa las células endoteliales, conllevando a una cascada de reacciones caracterizadas por incremento de la adhesión de neutrófilos, disminución de la cadena respiratoria en la mitocondria y un incremento en la concentración de calcio intracelular. El restablecimiento de flujo sanguíneo corporal durante el manejo del priapismo isquémico esta asociado con reperfusión de los tejidos isquémicos. Este drástico aumento en la tensión de oxigeno corporal genera especies reactivas al oxígeno que pueden causar daño tisular. Basado en el modelo de reperfusión cardíaco descrito por Goldhaber y Weiss,63 hemos sugerido una serie de eventos que toman lugar en la isquemia y reperfusión del pene en el manejo del priapismo: i) Radicales libres endógenos pueden disminuir durante la isquemia resultando en niveles reducidos de efectos antioxidantes, ii) disminución del metabolismo aeróbico resulta en la producción de especies reactivas al oxigeno (ROS), iii) incremento en la hidrólisis de ATP resulta en la acumulación de hipo-xantina, el cual es subsecuentemente convertido a ácido úrico, otra fuente de ROS, iv) la vía del ON genera peroxinitrito, peroxinitrito amónico y radicales hidroxilos (radicales libres), v) la peroxidación lipídica e infiltración de la vasculatura con neutrófilos producen diversos radicales libres (radicales libres oxigeno. Peroxido de hidrógeno, radicales hidroxilo y aniones hipoclorosos) que son liberados en respuesta a la reacción isquemia/reperfusión.64
PRIAPISMO ARTERIAL (NO ISQUÉMICO)
El priapismo de alto flujo resulta de un flujo arterial cavernoso no regulado como consecuencia de un traumatismo perineal agudo, el cual termina en la formación de una fístula lacunar arterial.65'66 El flujo sanguíneo arterial turbulento dentro de la fístula causa liberación no regulada de óxido nítrico endotelial, un potente vasodilatador y anticoagulante, que previene la detumescencia peneana y coagulación de la fístula arterial lacunar. El priapismo arterial es caracterizado por una erección parcial indolora permanente con rigidez axial normal durante la actividad sexual en la mayoría de los casos. Si el priapismo arterial esta asociado a una erección peneana persistente inadecuada durante el acto sexual, se debe sospechar que el evento traumático, resultó en una laceración arterial cavernosa suficientemente severa como para causar lesión endotelial, produciendo una patología arterial obstructiva. Alternativamente, el evento traumático pudo haber sido causa de una lesión del tejido corporal que resulta en una disfunción veno oclusiva corporal. En tales casos, un estudio vascular (ultrasonido Doppler duplex, Cavernosometría de Infusión Dinámica y Cavernosografía) se encuentran indicados para diferenciar la insuficiencia arterial cavernosa de la fuga venosa y determinar si la reconstrucción vascular es apropiada para el restablecimiento de la potencia.
El priapismo isquémico debe ser diagnosticado y tratado inicialmente para el restablecimiento del flujo sanguíneo arterial cavernoso, siguiendo estos pasos.
V. Manejo
Priapismo Isquémico (síndrome compartimentai de los cuerpos cavernosos): El diagnostico de priapismo es usualmente hecho por historia clínica y examen físico, pero algunos exámenes diagnósticos generales tales como (CBC, plaquetas, diferenciales, cuenta de reticulocitos, electroforesis de hemoglobina, uro-análisis, metabolitos en orina como cocaína o para drogas psicoactivas) deben ser considerados en la búsqueda de agentes etiológicos.
El Antígeno Prostático (PSA) es también recomendado para descartar la posibilidad de cáncer prostático invasivo en los cuerpos cavernosos. La evaluación del status del flujo sanguíneo de los cuerpos cavernosos DEBE ser llevada a cabo en TODOS LOS PACIENTES tanto por aspirado corporal (color, consistencia, gases de cuerpos cavernosos) o por ultrasonido Doppler duplex peneano (Figura 2) y ser repetidos luego del tratamiento para evaluación del flujo sanguíneo cavernoso.
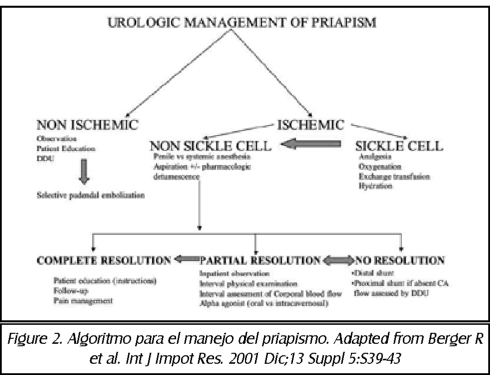
Anestesia del pene (nervio dorsal, subcutáneo produciendo el bloqueo local o circunferencial) y/o analgesia sistémica debe ser considerada antes de llevar a cabo los esfuerzos terapéuticos para minimizar el sufrimiento del paciente y maximizar la eficacia de los procedimientos invasivos ya que estos tienden a ser muy dolorosos. La administración de agentes farmacológicos con o sin aspiración corporal con moni-toreo cardiopulmonar de ser necesario es simple y en muchos casos es efectivo. La Fenilefrina ha sido sugerido como una droga de elección debido a su actividad alfa 1 agonista y baja actividad beta l.67 La dosis recomendada es 300 a 500 ug intracavernoso cada 5 a 10 minutos hasta una dosis máxima de 1,5 mg de fenilefrina. Recientemente, McAuley et al., para sobrevenir la disminución de la afinidad de los receptores alfa-adrenérgicos observada durante la presencia de acidosis y priapismo isquémico, de forma exitosa uso altas dosis de fenilefrina (1000 ug /mi cada 10 minutos tanto como se necesite para 7-10 dosis) sin complicaciones significantes.62 Otros agentes adrenérgicos pueden ser usados (tabla 2)
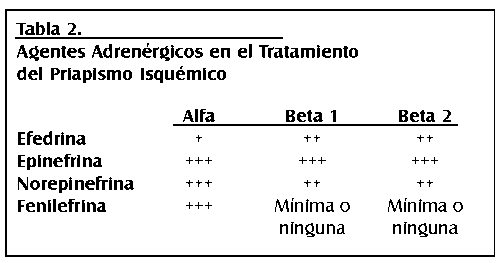
Si la administración de agentes farmacológicos falla, la irrigación corporal con solución salina con o sin agentes farmacológicos para inducir la detumescencia debe ser el siguiente paso lógico. En adición, la analgesia apropiada, hidratación, oxigenación, con o sin cambio de transfusión son indicados en el paciente con células de sickle.
El tratamiento exitoso deber ser llevado a cabo por el examen físico del pene, y en casos de resolución parcial, es mandatorio llevar a cabo estudios del estatus del flujo corporal por aspirado corporal o por ultrasonido Doppler dúplex. Si el episodio de priapismo ha sido resuelto satisfactoriamente, el paciente puede ser dado de alta médica con instrucciones detalladas, seguimiento y analgésico vía oral. En el caso de resolución parcial o dado a edema isquémico, erección parcial persistente, o dolor persistente, mantener al paciente en observación es recomendado. Es mandatorio el examen físico periódico del pene y/o conocer el estatus del flujo sanguíneo corporal bien sea por aspiración cavernosa o ultrasonido Doppler dúplex. Agonistas adrenérgicos pueden ser administrados (intracavernosa y/o oral) en un intervalo base para inducir detumescenda completa. Si luego de intervenciones repetitivas de primera línea durante varias horas, no se logra resoludón del priapismo isquémico, la conduda hada el establedmiento de shunts quirúrgicos es indicada. En la vasta mayoría de casos los shunts dístales son efedivos. Los shunts proximales no son mas eficaces que los dístales y adi-donalmente poseen mayores tasas de complicadones, así que los shunts proximales deben ser evitados como intervendones de primera línea.
El valor predictivo más importante en el mantenimiento de la función eréctil premórbida, es dependiente de la duración del priapismo, por tanto su intervención rápida es necesaria. Kulmala et al. Reportaron que los hombres con menos de 24 horas de priapismo tienen 92% de probabilidades de retornar a una función erédil premórbida en contra de un 22% si el episodio priapístico se extiende por un plazo mayor a 7 días.68
Manejo del priapismo arterial: el diagnostico de priapismo con flujo alto es usualmente realizado por historia dínica (el trauma perineal es casi siempre reportado por los parientes) y por el examen físico (erecciones parciales y no dolorosas). El ultrasonido Doppler dúplex es una modalidad no invasiva que permite la visualizadón y determinación sendlla de la fístula arterial lacunar (Figura 3A y B). Esta forma
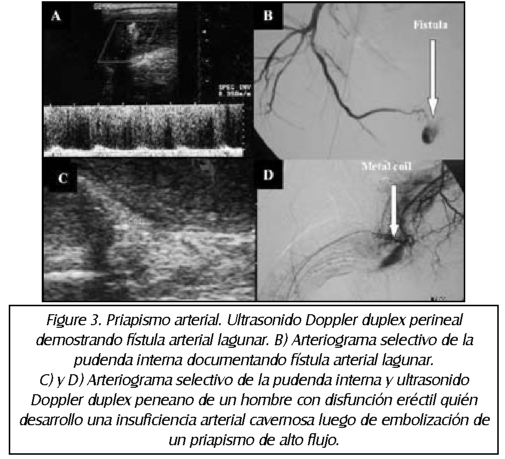
de priapismo no es un síndrome compartimentai, por tanto no es una emergencia médica. Luego de extensas consultas, la arteriografía selectiva de la pudenda interna y embolización superselectiva con inyección antologa con coagulantes ocluirán temporalmente la arteria lacerada permitiendo al vaso dañado su regeneración. El uso de láminas de metal esta asociado con oclusión permanente e irreversible de las arterias cavernosas, liderizando a una disfundón erédil (Figura 3C/D).
1. Papadopoulus I, Kelami A. Priapus and priapism: From Mythology to Medicine. Urology 32: 385, 1988.
2. Callaway T. Unusual case of priapism. London Medical Repository 1: 286, 1824.
3. Berger R, Billups K, Brock G, Broderick GA, Dhabuwala CB, Goldstein I, Hakim LS, Hellstrom W, Honig S, Levine LA, Lue T, Munarriz R, Montague DK, Mulcahy JJ, Nehra A, Rogers ZR, Rosen R, Seftel AD, Shabsigh R, Steers W. Report of the American Foundation for Urologic Disease (AFUD) Thought Leader Panel for evaluation and treatment of priapism. Int J Impot Res. 2001 Dec;13 Suppl 5: S39-43.
4. Kulmala RV, Lehtonen TA, and Tammela TL: Priapism, its incidence and seasonal distribution in Finland. Scand J Urol Nephrol 29: 93-96, 1995.
5. Eland, IA,Van Der Lei J, Strieker BHC, Sturkenboom MJCM: Incidence of Priapism in the General Population. Urology 57: 970-972, 2001.
6. Adeyoju AB, Olujohungbe AB, Morris J, Yardumian A, Bareford D, Akenova A, Akinyanju O, Cinkotai K, O'Reilly PH. Priapism in sickle-cell disease; incidence, risk factors and complications - an international multicentre study. Br J Surg 57: 172, 197096.
7. Banos JE, Bosch F Farre M. Drug-induced priapism: Its etiology, incidence and treatment. Medical Toxicology 4: 46, 1989.
8. Junemann KP, Aiken P. pharmacotherapy of erectile dysfunction: A review. Int J Impotence Res 1: 71, 1989.
9. Funderburk SJ, Philippart M, Dale G, Cederbaun SD, Vyden JK. Priapism after phenoxybenzamne in a patient with Fabry's disease. N Engl J Med 290: 60,
1984.
10. Law MR, Copland RFP, Armitstead JG, Gabriel R. Labetalol and priapism. Br J Urol 280: 115, 1980.
11. Adams JW, Soucheray JA. Prazosin induced priapism in a diabetic. J Urol 132: 1208, 1984.
12. Bullock N. Prazosin-induced priapism. Br J Urol 62: 487, 1988.
13. Rubin SO. Prapism as a probable sequel to medication. Scand J Urol Nephrol 2: 81, 1968.
14. Duggan ML, Morgan C. Heparin : A cause of priapism? Med J 63: 1131, 1970.
15. Singhal PC, Lynn RI, Scharschmidt LA. Priapism and dialysis. AM J Nephrol 6: 358, 1986.
16. Burke BJ, Scott GL, Smith PJB, Wakerley GR. Heparin-associated priapism. Postgrad Med J 59: 332, 1983.
17. Gralnick H, McKeown LP, Williams SB, Shafer BC, Pierce L. Plasma and platelet von Willebrand's factor defects in uremia. Am J Med 85: 806, 1988.
18. Kem DL, Posey DJ, McDougle CJ. Priapism assodated with trazodone in an adolescent with autism. J Am Acad Child Adolesc Psychiatry 2002 Jul; 41(7): 758.
19. Lansky MR, Selzer J.. Priapism associated with trazodone therapy: case report. J Clin Psychiatry 1984 May; 45(5): 232-3.
20. Carson CC 3rd, Mino RD.Priapism associated with trazodone therapy. J Urol. 1988 Feb; 139(2): 369-70.
21. Hanno PM, Lopez R, Wein AJ. Trazodone-induced priapism. Br J Urol. 1988 Jan; 61(1): 94.
22. Correas Gómez MA, Portillo Martín JA, Martin García B, Hernández Rodríguez R, Gutiérrez Banos JL, del Valle Schaan JI, Roca Edreira A, Rado Velázquez MA, Hernández Castrillo A. Trazodone-induced priapism. Actas Urol Esp 2000 Nov-Dee; 24(10): 840-2.
23. Azadzoi, K. M., Payton, T., Krane, R.J., and Goldstein, I.: Effects of intracavernosal trazodone hydrochloride: Animal and human studies. J Urol. 144: 1277 - 1282, 1990.
24. Saenz de Tejada, I., Ware, J.C., Blanco, R., Pittard, J.T., Nadig, P.W., Azadzoi, K., Krane, R.J. and Goldstein, I.: Pathophysiology of prolonged penile erection associated with trazodone use. J. Urol. 145: 60 - 64, 1991.
25. Hyttel J, Larsen JJ, Christensen AV, Amt. J. Receptor-binding profiles of neuroleptics. In Casey DE, Chase TN, Christensen AV, Gerlach J, eds. Dyskenesia: Research and treatment. New York: Springer-Verlag, 1985: 9.
26. Van Rossum JM. The significance of dopamine-receptor blockade for the mechanism of action of neuroleptic drugs. Arch Int Pharmacodyn Ther 160: 492, 1966.
27. Fiorelli RL, Manfrey SJ, Belkoff LH, Finkelstein LH. Priapism associated with intranasal cocaine abuse. J Urol 143: 581, 1990.
28. Rodriguez-Blasquez HM, Cardona PE, Rivera-Herrera JL. Priapism associated with the use of topical cocaine. J Urol 143: 358, 1981.
29. Munarriz R, Hwang J, Goldstein I, Traish AM, and Kim N. Cocaine And Ephedrine-Induced Priapism: Case Reports And Investigation Of Potential Adrenergic Mechanisms. In Press, Urology.
30. Lakoski JM, Cunningham KA. The interaction of cocaine with central serotonergic neural sytem: Cellular electrophysiologic approaches. Natl Inst Drug Abuse Res Monogr Ser 88: 78, 1988.
31. Cocores JA, Dackis CA, Gold MS. Sexual dysfunction secondary to cocaine abuse in two patients. J Cxlin Psychiatry 47: 384, 1986.
32. Cannabis and Priapism.
33. Cannabis and Priapism.
34. Klein ea, Montague DK, Steiger E. Priapism associated with the use intravenous fat emulsion: Case reports and postulated pathogenesis. J Urol 133: 857,
1985.
35. Amris CJ, Brockner J, Larson V. Changes in the coagulability of blood during the infusion of intralipid. Acta Chir Scand (suppl) 325: 70, 1964.
36. Brockner J, Amris CJ, Larsen V. Fat infusions and blood coagulation: Effect of various fat emulsions on blood coagulability. A comparative study. Acta Chir Scand (suppl) 343: 48, 1965.
37. Stiles Ad. Priapism following a black widow spider bite. Clin Pediatr 1982; 21: 174.
38. Zelissen PMJ, Strieker BHCh. Severe priapism as a complication of testosterone substitution therapy. Am J Med 85: 273, 1988.
39. Zargooshi J. Priapism as a complication of high dose testosterone therapy in a man with hypogonadism. J Urol 2000 Mar; 163(3): 907.
40. Madrid García FJ, Diez Hernández A., Madronero Cuevas C, Rivas Escudero. Priapism secondary to testosterone administration in the treatment of delayed puberty. Arch Esp Urol 2001 Sep; 54(7): 703-5.
41. Fernando IN, Tobias JS. Priapism in a patient on tamoxifen. Lancet 1989; 1; 436.
42. Hamre MR, Harmon EP, Kirkpatrick DV, Stem MJ, Humbert JR. Priapism as a complication of sickle cell disease. J Urol 145: 1, 1991.
43. Tarry WF, Duckett JW, Snyder HM. Urological complications of sickle cell disease in a pediatric population. J Urol 138: 592-594, 1987.
44. Fowler JEJ, Koshy M, Strub M, Chinn SK. Prispism associated with the sickle cell hemoglobinopathies: prevalence, natural history and sequelae. J Urol 145: 65-68, 1991.
45. Mantadakis E, Cavender JD, Rogers ZR, Ewalt DH, Buchanan GR. Prevalence of prispism in children with sickle cell disease. J Ped Hematol/Onco 21: 518-522, 1999.
46. Jackson N, Franlin IM, Hughes MA. Recurrent priapism following splenectomy for thalassaemia intermedia. Br J Surg 73: 698, 1986.
47. Leifer W, Leifer G. priapism caused by primary thrombocythemia. J Urol 121: 254, 1979.
48. Winter CC and McDowell G. Experience with 105 patients with priapism: Update review of all aspects. J Urol 140: 980, 1988.
49. Amyloidosis y priapism.
50. García-Consuegra J, Padrón M, Jaureguizar E, Carrascosa C, Ramos J. Priapism and Fabry's disease: A case report. Eur J Pediatr 149: 500, 1990.
51. Bedbrook G. Anonymous. The care and Management of Spinal Cord Injuries/ New York, Springer Verlag pl55, 1981.
52. Baba H, Maezawa Y, Furusawa N, Kawahara N, Tomita K. Lumbar spinal stenosis causing intermittent priapism. Paraplegia 33: 338-345, 1995.
53. Hattori T. Otani T. Ito Y. Takeda H. A report of two cases of priapism with metastatic penile tumor. Jap J of Urol. 93(4): 568-72.
54. Casoli E. Di Fiore F. Longobardi S. Intilla O. Pone D. Metastatic penile lesions secondary to transitional cell carcinoma of the bladder: a rare cause of "malignant priapism" Arc Ital Urol, Androl. 74(1): 48-9, 2002.
55. Morga Egea JP, Ferrero Doria R, Guzmán Martinez-Valls PL, Navas Pastor J, García Ligero J, Garcia García F, Sempere Gutiérrez A, Rico Galiano JL, Tomas Ros M, Fontana Compiano LO. Metastasis priapism. Report of 4 new cases and review of the literature.Arch Esp Urol. 2000 Jun; 53(5): 447-52.
56. George S. Benson Priapism, AUA Update Series, M.D. Lesson.Volume XV,11
57. Pohl J, Pott B, Kleinhans G. Priapism: A three phase concept of management according to aetiology and prognosis. Br. J Urol 58(2): 113-118, 1986.
58. Gerstenbluth RE. Kick PS. Srodes AD. Seftel AD. Priapism secondary to hypertriglyceridemia. J Urol. 169(3): 1088, 2003.
59. Fernández Durán AM, Martin García C, Fernández Gómez J, Jiménez López-Lucendo N, Sampietro Crespo A. Priapism secondary to a bilateral abscess of the corpora cavernosa. Actas Urol Esp. 1999 Jan; 23(1): 64-6.
60. Bloom DA, Wan J, Key D: Disorders of the male external genitalia and inguinal canal, in Kelalis PI?,
King LR, Belman AB (eds): Clinical Pediatric Urology, ed 3 Philadelphia, WB Saunders, 1992, p 1023.
61. Saenz de Tejada, Kim NN, Daley JT, Royai R, Hypolite J, Broderick GA, García-Díaz F, Levin R. Acidosis impairs rabbit smooth muscle contractility. J Urol 157(2): 722-726, 1997.
62. Iain McAuley, Ricardo M. Munarriz, Yue Hua Huang, Terry Payton, Michael Lasalle, Robert Moreland, Noel Kim, Abdulmaged Traish and Irwin Goldstein. Intracavernosal high dose phenylephrine in the treatment of veno-occlusive priapism: from bench to bedside. AUA meeting, 1999.
63. Goldhaber JI and Weiss, JN, Oxygen free radicals and cardiac reperfusion abnormalities, Hypertension 20: 118-127, 1992.
64. Ricardo Munarriz, Kwangsung Park, Yue-Hua Huang, Iñigo Saenz de Tejada, Robert B. Moreland, Irwin Goldstein and Abdulmaged M. Traish. Reperfusion of Ischemic Corporal Tissue: Physiological and Biochemical Changes in an Animal Model of Ischemic Priapism. In Press, Urology 2003.
65. Hakim LS, Kulaksizoglu H, Mulligan R, Greenfield A, Goldstein I. Evolving concepts in the diagnosis and treatment of arterial high flow priapism. J Urol 155(2): 541-8, 1996.
66. Witt MA, Goldstein I, Saenz de Tejada I, Greenfield, Krane RJ. Traumatic laceration of the intracavernosal arteries: The pathophysiology of non-ischemic, high flow, arterial priapism. J Urol 143: 129, 1990.
67. Bodner DR, Lindan R, Leffler E, kursh Ed, Resnick MI. The application of intracarvernous injection of vasoactive medications for erection in men with spinal cord injury. J Urol 138: 138, 1987.
68. Kulmala RV, Letonen TA, Tammela TL: Preservation of potency after treatment for priapism. Scand J Urol Nephrol 30: 313-316, 1916.- Eadie DG, Brock TP. Corpus saphenous by-pass in the treatment of priapism.
Dr. Ricardo Szemat Daher
Médico Interno
Dr. Irwing Goldstein
Departamento de Urología, Universidad de Boston - USA
Dr. Ricardo Munarriz
Departamento de Urología, Universidad de Boston - USA
MANEJO DE LA DISFUNCIÓN SEXUAL FEMENINA
I. INTRODUCCIÓN
Los estudios epidemiológicos randomizados basados en la comunidad sobre disfunción sexual femenina, son muy limitados. Datos obtenidos actualmente revelan que por encima del 76 % de las mujeres presentan algún tipo de disfunción sexual.1'2 Durante los censos realizados en los Estados Unidos, se obtuvo que aproximadamente 10 millones de mujeres americanas en edades comprendidas entre los 50-74 años, refieren disminución en la lubricación vaginal, dolor e incomodidad durante las relaciones sexuales, disminución de la libido y dificultad para alcanzar el orgasmo. Recientemente, Laumann y Rosen3 encontraron que la disfundón sexual femenina tiene mayor prevalencia en las mujeres (43 %) que en los hombres (31 %) y esto se encuentra asociado a varias caraderísticas sododemográficas tales como la edad, la educadón y una salud física y mental baja. Pero más importante es hacer notar que, la disfunción sexual femenina se encuentra asodado a experiencias sexuales negativas. A pesar de la alta preva-lenda de la disfunción sexual femenina, existen muy pocos centros en el mundo que pradiquen la investigación y manejo comprensivo y multidisdplinario de este problema.
El manejo de los pacientes con disfundón sexual femenina comienza con la identificadón y diagnóstico de los problemas relacionados y esto es basado en el interrogatorio del paciente en conjunto con una evaluación clínica. La disfunción sexual femenina se define como desordenes del deseo sexual, exdtadón, orgasmo y/o dolor durante las relaciones sexuales, que resulta en un stress personal significante y esto puede tener un impado en la calidad de vida de la persona. Aunque cada condidón específica puede ser definida separadamente en términos médicos, clínicamente estas condiciones coexisten y se mezdan en el padente afligido. El reporte desarrollado sobre las conferencias internadonales de consenso sobre disfundón sexual femenina clasificó este desorden en: I Desórdenes del Deseo Sexual: IA. Desórdenes del Deseo Sexual Hipoactivo. El cual es la defidenda persistente o recurrente (o ausenda) de fantasías sexuales/ pensamientos, deseo y/o receptividad para la actividad sexual, el cual causa stress personal. IB. Desórdenes de Aversión Sexual. Esto se refiere al stress personal que causa la persistente o recurrente aversión fóbica y evasión de tener contacto con una pareja sexual. II Desórdenes Sexuales de la Excitación, se refiere al stress personal que causa la inhabilidad de contener o mantener un grado suficiente de exdtadón sexual. Este puede ser expresado a través de una falta de exdtadón subjetiva o falta de (lubricadón), genital u otras respuestas de tipo somáticas. III Desórdenes del Orgasmo: se hace mención de este desorden cuando existe un stress personal causado por la dificultad, retardo o ausenda persistente o recurrente para mantener el orgasmo, seguido de una estimulación sexual suficiente y alcance de la excitación. IV Desórdenes Sexuales Asociados al Dolor IVA. La Dispareunia es el dolor genital persistente o recurrente asociado al ado sexual. IVB. Vaginismo se refiere al espasmo involuntario recurrente o persistente de la musculatura que involucra el tercio externo de la vagina, el cual dificulta la penetradón vaginal, causando a su vez stress personal.
IVC. Desórdenes Sexuales Asociados al Dolor No Coitales, denominación que se le otorga al dolor genital persistente o recurrente, inducido por una estimulación no coital. Cada uno de estos diagnósticos pudieran ser subtipificados en los siguientes: A. Tipo Congénito vs Adquiridos. B. Tipo Generalizado vs Situacional, C. Origen Etiológico (Orgánico, Psicógeno, Mixtos, Desconocidos).4
En algunos casos, pudiera ser necesario para el médico prestar atención espedal a la sensibilidad del tópico y a los niveles de confort en el paciente durante la investigadón del funcionamiento sexual del mismo. El uso de cuestionarios tales como el índice de Fundón Sexual Femenina y la Escala de Stress Sexual pudieran ser herramientas útiles en la evaluación de la fundón sexual. La piedra angular de la evaluación del paciente se encuentra en una detallada historia clínica, sexual, psicológica en conjunto con un examen físico y exámenes paradíni-cos específicos. Test diagnósticos especializados como la biotesiometría o estudios vasculares del área genital (ultrasonido Doppler duplex), a pesar de no ser indicado siempre, este puede corroborar las impresiones diagnósticas realizadas a la evaluación inicial. Es preciso mencionar, que la reacción psicológica dada a estos factores orgánicos no debe ser ignorada.
II. ANATOMÍA Y FISIOLOGÍA DE LA EXCITACIÓN SEXUAL GENITAL
Existen muy pocos datos concernientes a la anatomía, fisiología y fisiopatología de la función sexual en la mujer. Los genitales externos consisten en varias estructuras. La vagina es un órgano medial, cilindrico que conecta el útero con los genitales externos. La pared vaginal consta de tres capas a) una capa mucosa tapizada por un epitelio plano estratificado escamoso soportado por una lámina basal que se somete a cambios cíclicos hormonales b) La muscular compuesta por fibras longitudinales de músculo liso y fibras circulares, y c) una capa externa fibrosa, rica en colágeno y elastina, la cual provee sostén estructural a la vagina. La vulva, limitada por la sínfisis del pubis, el esfínter anal y las tuberosidades isquiáticas, consiste en las formaciones labiales, el espacio interlabial, y tejido eréctil. Las formaciones labiales se constituyen en dos estructuras cutáneas; a) Los labios mayores son laminas grasas cubiertas por piel y vellos que se fusionan anteriormente con el monte venus, o la prominencia anterior de la sínfisis pubiana, y posteriormente con el cuerpo perineal o comisura posterior b) Los labios menores son hojas mas delgadas cubiertas por piel sin la presencia de vello y por mucosa vaginal en forma medial, que se fusionan anteriormente para conformar el prepucio del clitoris y posteriormente por la fosa navicular.
El espacio interlabial esta compuesta por el vestíbulo, el meato urinario, y el introito vaginal y esta a su vez esta limitada por el espacio medial de los labios menores, la fosa navicularis y el clitoris. El clitoris es un órgano en forma de Y de 7-13 cm compuesto por glándulas, cuerpo y crura.5 El cuerpo esta rodeado por la túnica albugínea y consiste de un par de cuerpos cavernosos constituidos por trabéculas de músculo liso y sinusoides lacunares. Finalmente, el bulbo vestibular consta de estructuras pares localizadas debajo de la piel de los labios menores y representa al homólogo del cuerpo esponjoso en el hombre.
Existe poco entendimiento sobre la localización precisa de las estructuras neurovasculares autonómicas relacionadas al útero, cuello cervical y vagina. Los nervios uterinos ascienden desde el plexo hipogástrio inferior, formado por la unión de los nervios hipogástricos (simpático TIO- Ll) y las fibras esplánnicas (parasimpáticos S2-4). Este plexo posee tres porciones. Plexo Vesical, plexo rectal, y el plexo uterovaginal (ganglio de Frankenhauser), el cual yace en la base del ligamento ancho, en situación dorsal a los vasos uterinos, y lateral a los ligamentos cardinales y uterosacros. Este plexo provee inervación por vía del ligamento cardinal y ligamentos uterosacros al cuello cervical, vagina superior, uretra, bulbo vestibular y clitoris. En el cervix, los nervios simpáticos y parasimpáticos de los ganglios paracervicales. El más largo es llamado ganglion utero-cervical. Es a este nivel que la lesión de las fibras autonómicas de la vagina, labios, cervix, pueden ocurrir durante la histerectomía, Los nervios pudendos (S2-S4) alcanzan el perineum a través del canal de Alcock y provee sensibilidad e inervación motora hada los genitales externos.
Muchos caminos existen para el conocimiento y compresión de cómo el sistema nervioso central controla la fundón sexual femenina. Estudios limitados sugieren que la modulación supraespinal de los reflejos genitales femeninos emanan de 1) Estructuras del cerebro como la del núdeo paragigantocelularis (vía inhibitoria serotoninérgica), locus ceruleus (norepinefrina, neurotransmisor durante el sueño REM) y el cerebro medial periaquedudal gris 2) Estructuras hipotalámicas tales como el área preóptica, núdeos ventromediales y paraventriculares y 3) Estructuras del Diencéfalo tales como la amígdala. Múltiples factores interactúan en los niveles supraespinales para influendar la exdtabilidad en los reflejos espinales sexuales, tales como: 1) Hormonas gonadales, 2) Información sensitiva de los genitales conducido por la vía mielinizada espinotalámica y la no mielinizada espino reticular 3) conexiones de los centros superiores cognitivos.
Las respuestas a la exdtadón sexual de las múltiples estruduras anatómicas periféricas genitales y no genitales son a la larga producto de los mecanismos reflejos de la médula espinal. Los segmentos espinales se encuentran controlados por múltiples centros supraespinales a través de vías descendentes exdtatorias e inhibitorias. El brazo reflejo aferente es primariamente a través del nervio pudendo. El brazo reflejo eferente consta de la coordinación de actividad somática y autonómica. Un reflejo sexual espinal es el reflejo bulbocavernoso los segmentos S 2,3 y 4 en el cual la estimulación del nervio pudendo resulta en una contracdón del piso pélvico.
Otro reflejo sexual espinal involucra la estimulación autonómica del nervio cavernoso vaginal y del clítoris, resultando en engrasamiento del clítoris, paredes vaginales y de sus labios.
Durante el estado basal, el cuerpo del clítoris y el músculo liso de la vagina se encuentran bajo un tono contrádil. Seguido de estimulación sexual, se libera oxido nítrico (ON) vía neurogénica y endotelial, jugando así un papel importante en la relajadón de la arteria cavernosa y arteriolas del clítoris.8 Esto conlleva a un aumento en el flujo arterial intracavernoso, luego aumento de la presión intracavernosa seguido del engrosamiento del clítoris. Resultando en una extrusión y aumento de la sensibilidad.
En un modo similar, la vagina durante su estado basal, el epitelio reabsorbe sodio del transudado plasmático de los capilares de la submucosa. Seguido de estimulación sexual un número de neurotrans-misores incluyendo el ON y el péptido intestinal vasoadivo (PIV) son liberados, modulando así la relajación de la musculatura lisa vascular y no vascular. Incrementos dramáticos en el flujo capilar en la submucosa sobreviene una reabsorción de sodio, resultando en un transudado vaginal de 3-5 mL, que permite la lubricación esendal para un coito placentero. La relajación del músculo liso vaginal resulta en un incremento del diámetro luminal, espedalmente en los dos tercios distales de la vagina. El (PIV) es un polipéptido neurotransmisor no adrenérgico, no colinérgico, que juega un papel en el flujo sanguíneo vaginal y la lubricación de la misma.6
1. Estudios en animales in vivo: Datos derivados de modelos de animales in vivo, indican que los estrógenos más no los andrógenos modulan el flujo sanguíneo genital, la lubricación vaginal e integridad estructural de los tejidos vaginales. Debe hacerse notar que los niveles de estradiol usados en estos estudios fueron suprafisiológicos con efectos farmacológicos potenciales diferentes de aquellos alcanzados fisiológicamente.7'12 Además el reemplazo estrogénico incrementa la lubricación vaginal y restaura la integridad epitelial; esta terapia pudiera no ser apropiada para todos los pacientes, dado al riesgo asodado al cáncer de endometrio y mama. Estudios limitados se encuentran disponibles sobre los efedos de las sustancias vasoactivas en la hemo-dinamia genital. Park et., 1997 demostraron que la inyección de hidrodorato de papaverina y mesilato de fentolamina dentro de la capa muscular esponjosa vaginal, incrementa la presión intramural y el flujo sanguíneo.10 Se ha demostrado que la administración de Sildenafil causa aumento significativo en el flujo genital y lubricadón vaginal en animales intactos con ooforedomía.13 Sin embargo, esta respuesta fue mas pronunciada en animales tratados con estradiol. Estos datos sugieren que la vía del GMPc-ON esta involucrada, por lo menos en gran parte de los mecanismos fisiológicos de la excitación genital femenina y que el sildenafil fadlita esta respuesta en modelos in vivo de animales.14 Los efectos de la apo-morfina, un receptor agonista dopaminérgico no seledivo, en el flujo sanguíneo fueron investigados por Tarcan et al., quien sugirió que la administradón sistémica de apomorfina mejoraba el engrosamiento vaginal y del dítoris por incremento del flujo arterial intracavernoso e intramural.15 En resumen, derivados de modelos de animales in vivo, indican que los agentes vasoactivos juegan un papel en la exdtadón genital. Además el sildenafil y la apomorfina promueven el flujo sanguíneo genital en modelos de animales, el uso díni-co de agentes vasoactivos continua siendo controversial.
2. Estudios en órganos: Datos reportados de varios laboratorios sugieren que el ON es la llave en la mediación de la relajadón del músculo liso del clitoris.16'17 Sin embargo, en la vagina, el ON parece jugar un papel pardal en la mediadón de la relajadón del músculo liso.18 El PIV también induce la relajación del músculo liso vaginal, aunque su verdadero desempeño funcional aun permanece desconocido.19-23 Receptores funcionales alfa-adre-nérgicos son expresados en la vagina y median la contracdón inducida por norepinefrina.24-26 Hemos observado que los andrógenos mas no los estrógenos a dosis farmacológicas promueven la relajadón del músculo liso27 Estudios posteriores con manipulación hormonal a dosis fisiológicas son necesarios para establecer el papel de las hormonas en la relajadón del músculo liso vaginal.
3. Estudios en cultivos celulares: Park et al. y Traish et al. Recientemente subcultivaron y caracterizaron células de músculo liso provenientes del clítoris de conejo y humano, como también investigaron la síntesis de los nucleótidos para segundos mensajeros cíclicos en respuesta a vasodilatadores y determinaron la actividad y cinética de la fosfodiesterasa tipo 5.2S'29 Estos estudios sugieren que el cultivo de células musculares lisas vaginales de conejo y humano retenían su integridad funcional metabólica y que estos sistemas experimentales debían probar utilidad en la investigación de las vías que modulan el tono de las células musculares lisas. Investigaciones de la distribución del ON en la vagina de rata en respuesta a ooforectomia y reemplazo estrogénico fue recientemente interpretado, empleando análisis inmuno-histoquímico con anticuerpos n-NOS Y e-NOS.30 El reemplazo estrogénico resultó en aumento significativo en la expresión de e-NOS y n-NOS cuando fueron comparados con animales intactos. Se sugirió que los estrógenos jugaban un papel crítico en la regulación de la expresión del NOS vaginal de la rata y que el ON podía modular el flujo sanguíneo y musculatura lisa vaginal. Estudios mas recientes han demostrado la observación opuesta. En estos se observaron que la actividad NOS vaginal del conejo fue considerablemente reducida por el tratamiento con estradiol o progesterona.31'32 Esta discrepancia en la regulación del NOS por estrógenos en estos estudios pudo ser debido a especies diferentes o a métodos de determinación de la expresión del NOS y su actividad. Nosotros hemos usado tanto inmunohis-toquímica (Western blots) y ensayos de actividad en-zimática para determinar la regulación del NOS vaginal en el modelo de conejo. En este estudio hemos demostrado que la oxido nítrico sintetasa fue predominantemente expresada en la vagina proximal.33 La razón por la cual ocurrió este fenómeno se encuentra todavía en vías de determinación. Posteriormente observamos que la ooforectomia promueve la actividad NOS en la vagina proximal sugiriendo regulación especifica del NOS por hormonas sexuales esteroideas. El tratamiento de animales ooforectomizados con estrógenos resultaron en disminución de la expresión de la actividad del NOS en el tejido vaginal, concordando con la investigación realizada por AI-Hiji et al. En contraste, el tratamiento con animales ooforectomizados con andrógenos resultó en incremento de la actividad de expresión del NOS. Estas observaciones sugieren que el NOS en el tejido vaginal se encuentra regulado por andrógenos y estrógenos en forma antagónica.
III. HISTORIA MÉDICA, PSICOSOCIAL Y SEXUAL
Una historia sexual detallada y completa debería incluir la forma de ver el deseo sexual (libido), la excitación y capacidad de alcance d el/los orgasmo(s) en el pasado y presente. En forma complementaria la respuesta sexual fisiológica y satisfacción sexual deben ser también tomadas en cuenta.
La historia clínica debe incluir preguntas focalizadas en la enfermedad que aqueja al paciente (patologías medicas crónicas (ejemplo diabetes, anemia, insuficiencia renal) enfermedades neurológicas (ejemplo traumatismos de la médula espinal, esclerosis múltiple, enfermedad de disco lumbosacro), enfermedades endocrinológicas (ejemplo hipogo-nadismo, hiperprolactinemia, desórdenes tiroideos), factores de riesgo para ateroesclerosis (ejemplo hiper-colesterolemia, hipertensión, diabetes, cigarrillo, historia familiar), hábitos psicobiológicos, medicamentos (ejemplo antihipertensivos, antidepresivos, alcohol, cocaína), traumatismos genitales/perineales/pélvicos (ejemplo traumatismos por bicicleta), dolor genital (tabla 1), quirúrgicos (ejemplo histerectomía, laminectomía, cirugía vascular de bypass) e historia psiquiatrita (ejemplo depresión y ansiedad).
Tabla 1. Etiología del dolor genital
Superficial o externo Infeccioso/inflamatorio:
Herpes genital
Enfermedades de transmisión sexual Infecciones vaginales recurrentes Adenitis Vestibular Tumores:
Neuroma
Pólipo fibroepitelial Quistes de inclusión Papilomas Melanoma
Carcinoma de células escamosas Síndrome doloroso genital miofascial Vaginismos
Endometriosis Fibromas uterinos Tumores o quistes ováricos Adhesiones
Enfermedad inflamatoria pélvica
Dadas las implicaciones personales, interpersonales, sociales y ocupacionales de los problemas sexuales, una historia breve psicosodal es mandatario en cada paciente. El estado psicológico actual, autoestima, historia de traumas sexuales/ abuso así como también historia de relaciones interpersonales pasadas y presentes así como desarrollo sodal y ocupadonal.
IV. EXAMEN FÍSICO
En adidón al examen cuidadoso del sistema vascular y neurológico, un examen sistemático de los genitales externos, bajo el uso de lupas quirúrgicas magnificadoras y evaluaciones Q-tip de los genitales externos pudiera confirmar aspectos de la historia médica (ejemplo adenitis vestibular (Fig. 1A) y neuropatías), y ocasionalmente revelar hallazgos como neuromas del dítoris (Fig. IB).
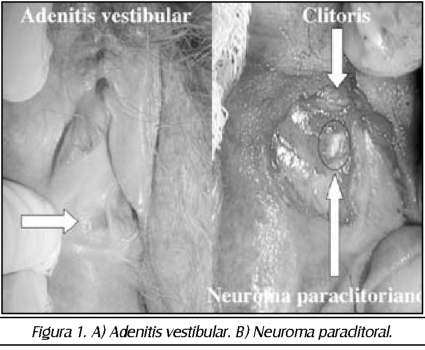
V. EXÁMENES DE LABORATORIO
Los exámenes de laboratorio son altamente recomendados. Química sanguínea, CBC y perfil lipídico pueden elucidar factores de riesgo vasculares como la hipercolesterolemia, diabetes e insuficiencia renal. La determinación de TSH sérica pudiera ser indicada en ciertos casos.
La integridad del eje hipotálamo-hipófisis-gónadas debe ser examinada en cada paciente con disfundón sexual. Son altamente recomendados la determinadón de andrógenos ováricos y adrenales, estrógenos y FSH y LH. No se encuentra daro que fracción de testosterona debiera solicitarse (total, libre o biodisponible), sin embargo existe un consenso sobre que al menos una de estas fracdones debiera ser solicitada. La fracdón total de producción de andrógenos es el mejor reflejo del total de testosterona, pero la testosterona disponible es mejor evaluada a través de los valores de testosterona libre, determinada por diálisis de equilibrio. En cualquier momento en que la testosterona total o libre sea medida, el valor circulante de globulina unida a esferoide (SHBG) debe ser tomado en consideradón. Para evaluar el estatus adrenal androgénico, se recomienda el obtener niveles de DHEA-S. El valor de andrógenos debe ser idealmente determinado en la mañana y en el terdo medio del cido menstrual, pero estas recomendaciones hacen la prádica clínica extremadamente difícil.
A pesar de que los adenomas pituitarios son causas raras de disfunción sexual, estas enfermedades con potendal amenazante para la vida y causas reversibles de disfundón sexual no deben ser olvidadas.
VI. EDUCACIÓN DEL PACIENTE Y SU PAREJA
La educación del paciente y su pareja son componentes críticos del diagnóstico de la disfunción sexual y deben llevarse a cabo en cuanto sea posible. El resultado de la historia, examen físico, exámenes de laboratorio, y la necesidad de empleo de métodos diagnósticos adicionales, deben ser revisados en detalle con el paciente y su pareja, y de ser indicado, las interconsultas apropiadas deben realizarse. La educadón del paciente y pareja no solo facilitan la comunicadón entre el eje médico-padente-pareja, si no también desarrolla el éxito y optimo cumplimiento del tratamiento
VII. EXÁMENES DIAGNÓSTICOS ESPECIALIZADOS
Las modalidades diagnosticas tales como el ultrasonido Doppler dúplex, y test de sensibilidad vibratoria y temperatura del clítoris y vagina, arte-riograma pudendo selectivo, expande al médico y paciente en la comprensión de los mecanismos fisiopatológicos por el cual ocurre la disfunción sexual, sin embargo desventajas tales como invasivi-dad, costo, el riesgo asodado a complicadones, y falta de datos en la normativa, han limitado el uso de exámenes complementarios.
El calentamiento, enfriamiento, sensibilidad vibratoria vaginal y del clítoris pueden ser determinados a través del Sistema analizador sensitivo térmico/analizador sensitivo vibratorio (TSA-3000 and VSA-3000; Medoc, Israel) y comparado con los nomogramas comúnmente validados, permitiendo establecer en forma cuantitativa la actividad neuroló-gica de los genitales femeninos.34 Esta es una herramienta diagnostica no invasiva, la cual prueba validez en el manejo de la mujer con disfundón sexual.
Diversos investigadores han reportado el empleo de estudios vasculares no invasivos en mujeres con disfundón sexual. Estos incluyen fotopletismografía vaginal, el cual es el estudio mas ampliamente usado en técnicas vasculares, cuantificando el engrasamiento de la mucosa vaginal y los volúmenes de sangre vaginal, este método provee datos sobre la extensión de la congestión vaginal.31-34 La mayor desventaja de esta herramienta diagnostica es que provee datos arbitrarios y no números absolutos. En adidón, este es susceptible a la aparidón de artefactos.
El papel de la ultrasonografía por Doppler dúplex, en el manejo de la disfundón sexual femenina, persiste indeterminado. Aunque varios investigadores han reportado series pequeñas de parientes usando este método antes y después de estimulación (Visual y Vibratoria) como herramienta diagnostica en mujeres con disfundón sexual, no existe técnica ultrasonografica estandarizada para maximizar la información diagnostica. Nosotros rutinariamente obtenemos datos volumétricos y hemodinániicos, antes y después de estimulación sexual audio-visual usando transdudor de 11 MHz pequeños en un lado del clítoris. El diámetro del clítoris (Fig. 2A) es medido desde la túnica albugínea medial del cuerpo a lo largo del septum hasta la túnica albugínea lateral del cuerpo contralateral.
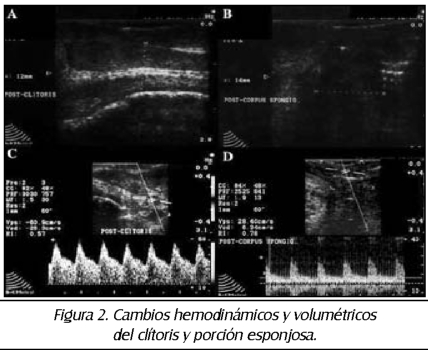
El ángulo del cuerpo del clítoris se encuentra formado por el ligamento suspensorio, esta es la ventana sonográfica para las medidas volumétricas. Manteniendo esta ventana, el transdudor es colocado lateralmente para evaluar la zona enferma, que se traduce como una imagen hipoecoica, del cuerpo esponjoso en forma de zanahoria que posee una túnica delgada, ocasionalmente visible, cuantificándose su diámetro (Fig.2B). Datos hemodinámicos (valores picos sistólicos, diastólicos y de resistenda) de las arterias cavernosas y cuerpo esponjoso son obtenidos (Fig. 2C-D). Se ha encontrado que el incremento de los diámetros del clítoris y cuerpo esponjoso se correlacionan de manera importante con la velocidad del fin de la diastolica durante la pre y post excitación, determinándose una implicación fisiológica en el engrasamiento de los genitales.
Una de las limitaciones de esta metodología es la falta de consenso en el uso de agentes vasoactivos tópicos para maximizar la relajación genital del músculo liso. Diversos investigadores han utilizado el ultrasonido Doppler duplex antes y después de estimulación audio-visual en combinación con aplicaciones tópicas de alprostadil al 2% con mayor consistencia en los datos volumétricos hemodinámicos.35-36
VIII. INDICACIONES PARA REFERENCIAS
Los médicos con el entrenamiento apropiado en medicina sexual deberían manejar la mayoría de las mujeres con disfunción sexual. Sin embargo, existen varias indicaciones para referir:
1. Pacientes jóvenes con historia de traumatismo pélvico/perineal
2. Pacientes con anorgasmia dado a neuropatía pudenda traumática o histeredomía
3. Parientes con dolor genital dado neurmomas, síndrome doloroso miofascial, adenitis vestibular, etc.
4. Pacientes con aneurisma aórtico o enfermedad del disco bulbosacral o intervenciones neuroquirúrgicas
5. Pacientes complicados con endocrinopatías
6. Pacientes con desórdenes complicados psiquiátricos o psicosexuales (ejemplo. Depresión refradaria, transexualismo).
7. Parientes o Médicos que soliciten por evaluación especializada.
8. Razones Medico-Legales (ocupacionales o lesiones iatrogénicas)
IX. CAUSAS REVERSIBLES MODIFICABLES
Los profesionales de la salud deben trabajar con los pacientes para modificar causas reversibles de disfundón sexual femenina como psicógenas, desbalances hormonales, hiperprolactinemia, relacionados a fármacos (e.j. SSRIs), disfunción sexual vascular o neurológica secundaria a traumatismo perineal y anorgasmia dado a neuropatía pudenda.
1. Hormonas Sexuales Esteroideas
El papel de las hormonas sexuales esteroideas en la función reproductiva ha sido sujeto de estudio en forma extensa y ha contribuido al éxito clínico en el manejo de mujeres con infertilidad por hormonas sexuales o análogos hormonales. Sin embargo, el papel de las hormonas esteroideas sexuales en la regulación de la excitación ha sido sujeto de poco estudio. En el presente no existe fundamento para el manejo farmacológico de la mujer con disfundón sexual por hormonas sexuales o análogos hormonales. Bachmann et al. (1999) Reportaron que la defidencia de estrógenos asodado con estado post-menopáusico resulta en perdida del colágeno y tejido adiposo en la vulva, atenúa la maduradón epitelial de la vagina, perpetúa la perdida del grosor y elasticidad de la pared vaginal, sangramiento y ulceración del epitelio vaginal por traumatismos, retardo del establecimiento de la lubricadón con estimulación sexual, y aumento del pH vaginal causando la vulnerabilidad de los patógenos urogenitales y flora.37
Sarrel (1987, 1998, 2000) reporto que en mujeres con niveles de estradiol plasmático por debajo de 50 pg/ml presentaban sequedad vaginal, mayor frecuencia e intensidad de dispareunia y sensadón quemante en forma más significativa comparado con aquellas mujeres con valores de estradiol mayores de
50 pg/ml.38-40 Muchos investigadores señalan que el tratamiento con estradiol incrementa el flujo sanguíneo vaginal y lubricadón, mejora la maduración epitelial, normaliza el pH vaginal y previene la atrofia vaginal. (Sarrel, 1987; Semmens & Wagner, 1982;Utian et al., 2001 )>s<41 <42
La insufidenda androgénica, en mujeres que se encuentran adecuadamente estrogenizadas, se encuentra también asociado a disfunción sexual (Sarrel, 1998; Sherwin et al., 1985; Davis, 1998; Bachmann et al., 2002).39'43-45 El reemplazo andro-génico en mujeres con disfundón sexual esta asociado a cambios en los genitales externos incluyendo sensibilidad incrementada, engrosamiento e hipertrofia del dítoris e hiperemia vulvar (Greenblatt et al., 1942; Cárter, 1947; Salmón, 1941).46'48 Ha sido reportado que las mujeres con altos niveles de testosterona poseen niveles significativamente mayores de flujo sanguíneo vaginal a estímulos eróticos comparado con aquellas con bajos niveles de testosterona (Schreiner-Engel et al., 1981, 1989).49'50 La adminis-tradón exógena de andrógenos ha resultado en un incremento significativo en rangos subjetivos de excitación sexual en mujeres post-menopausicas (Hackbert et al., 2002).51 En mujeres ooforec-tomizadas tratadas con testosterona, que poseían tasas mayores de testosterona a hormona ligada a globulina presentaban mayor excitación sexual (Sherwin et al., 1985).43 Shifren et al., (2000) han demostrado que la testosterona transdérmica mejoraba la fundón sexual y el bienestar psicológico en las mujeres que habían sido sometidas a ooforectomía o histerectomía.52 Arlt et al., (1999, 2000) han demostrado que el tratamiento en mujeres con insuficiencia adrenal con dehiepiandrosterona (DHEA) mejoraban su bienestar físico-mental y función sexual.53 Munarriz et al. (2002) han señalado que el reemplazo androgénico con DHEA en mujeres con disfunción sexual e insuficienda androgénica disminuían significativamente el stress sexual, aumentaban significativamente la función sexual en el concepto de deseo, exdtadón, lubricación, satisfacción y orgasmo, y normaliza los niveles plasmáticos de andrógenos dentro del rango fisiológico.54
El tratamiento de la hiperprolactinemia en la mujer con disfunción sexual, consiste de 1) interrupción del medicamento que cause hiperprolactinemia (e.g., estrógenos, alfa-metildopa), 2) la administración de bromocriptina, o 3) extirpación quirúrgica del tumor hipofisiario secretor de prolactina.
Agentes psicotrópicos como el SSRIs, neurolépti-cos y antipsicóticos, han sido asociados con disfunción sexual en mujeres. En adición, los agonistas LH-RH y anti-andrógenos, comúnmente usados en el tratamiento de la endometriosis, infertilidad y fibromas uterinos, también están asociados con disfunción sexual.
Pacientes con conductas destructivas, alcoholismo, cigarrillo, y drogas recreacionales, deben ser consideradas como potenciales agentes etiológicos de DSF.
El dolor genital es una condición altamente prevalerte (14%), incapacitante y devastadora asociado con stress personal significativo y disminuye la calidad de vida. Los neuromas genitales y adenitis vestibulares pueden ser tratados exitosamente por escisión del área afectada.
Intervenciones de primera línea, caracterizados por facilidad de administración, reversibilidad, naturaleza no invasiva, y bajo costo, incluyen agentes erectogénicos orales (e.g. sildenafil, apomorfina, fentolamina oral), dispositivos de cámara al vacío tipo vacum, y terapia de pareja psicosexual.
La introducción del sildenafil en 1998 revolucionó el manejo del hombre con disfundón eréctil38 y le dio poder a las mujeres con disfunción sexual para buscar atención médica. Este potente y selectivo inhibidor PDE 5, el cual bloquea la hidrólisis del GMPc, permitiendo la acumulación de este segundo mensajero, potenciando el efecto relajante del ON en el clítoris, no se encuentra aprobado su uso por la FDA en mujeres. Sildenafil ha sido utilizado en el tratamiento de las mujeres con desórdenes sexuales de la excitación con resultados mixtos.55'56 Estudios clínicos que evalúan la eficacia y seguridad de esta droga en mujeres se encuentran en progreso.
La Fentolamina es un antagonista alfa 1 y 2 adrenérgicos el cual disminuye el tono adrenérgico, facilitando la vasocongestión y retardando el entumecimiento. Un estudio ciego simple piloto (dosis única de fentolamina oral (40mg) y placebo en dosis escaladas) de 6 mujeres posmenopáusicas con disminución de la lubricación y dificultad para la excitación, reportaron una respuesta positiva leve a
lo largo de la excitación medida en todos sus momentos, con cambios significativos en la lubricación y sensaciones placenteras en la vagina reportados por las pacientes.57 Rubio-Aurioles et al., demostró que las lecturas psicológicas y reportes subjetivos fueron significativamente diferentes del placebo en las mujeres usando terapia de reemplazo estrogénico con 40 mg de fentolamina y solución vaginal.58 Estudios posteriores son necesitados para acceder al valor potencial de la fentolamina y otros agente vasoactivos en el tratamiento de la disfunción sexual femenina.
Apomorfina es un agonista dopaminérgico central conocido por inducir erección peneana leve a moderada en el hombre. Su uso en mujeres con disfunción sexual es experimental.
Prostaglandína El: La simplicidad, no invasiva y seguridad de la administración tópica de agentes vasoactivos son ideales para el tratamiento de mujeres con disfunción sexual. Reportes preliminares en el uso de alprostadil tópico es alentador, pero investigaciones posteriores son necesitados antes de establecer este agente como terapia de primera linea.59
En el presente, la terapia con EROS es el único tratamiento aprobado por la FDA para la disfundón sexual. EROS fue diseñado para incrementar el flujo plasmático hada el dítoris, fadlitando el engrasamiento del mismo y permitiendo la excitación genital periférica. Se encuentra generalmente aceptado que la estimuladón del dítoris y engrosamiento son aspectos importantes en la excitación sexual femenina. Se cree que la dificultad o inhabilidad para encontrar tumefacdón máxima del dítoris puede estar relacionado a otros síntomas del desorden sexual de excitación.10
Durante su uso en mujeres, los desordenes de exdtadón u orgásmicos, el EROS es colocado sobre el clítoris, proveyendo 3 niveles de succión al vacío (bajo, medio, alto). El incremento del flujo plasmático hacia el clítoris es asociado al incremento de la sensación y alcance de la excitación incluyendo incremento de la lubricación vaginal y engrosamiento labial. En mujeres con desordenes sexuales de excitación, el uso del EROS pudiera mostrar mejoría en la función sexual y satisfacción.60'61
3. Terapia sexual: Individual o de Pareja
La terapia sexual dirigida hada el stress en las reladones interpersonales, las preocupaciones sobre el desempeño sexual, y patrones de comunicación disfuncionales esta dado hacia mejorar el funcionamiento sexual. Es recomendado que involucre tanto el padente y su pareja durante la terapia. La terapia sexual también es indicada y en forma beneficiosa en parientes o parejas quienes deseen resumir su actividad sexual luego de períodos prolongados de abstinencia. Por ultimo, la terapia sexual es efectiva en dirigir las reacciones psicológicas hacia el tratamiento médico o quirúrgico.
XI. TERAPIAS DE SEGUNDA Y TERCERA LÍNEA
Desafortunadamente, no existen segundas o terceras líneas terapéuticas disponibles para el manejo de la disfunción sexual femenina.
A pesar de la alta prevalencia de la disfunción sexual femenina, los estudios concernientes a la anatomía, fisiología y fisiopatología de la función y disfunción sexual femenina son limitadas. Una evaluación multidisciplinaria, psicológica y médica seriada en el paciente y su pareja, con modificación de causas reversibles e individualización de farma-coterapia son altamente recomendadas.
1. Frank E, Anderson C, Rubinstein D. Frequency of sexual dysfunction in normal couples. N Engl J Med. 1978; 299: 111-115.
2. Spector I, Carey M. Incidence and prevalence of the sexual dysfunction: a critical review of the empirical literature. 19: 389-408, 1990.
3. Laumann EO, Paik A, Rosen RC. Sexual Dysfunction in the United States. Prevalence and Predictors. JAMA Feb 1999, Vol 281(6): 537-544.
4. Basson R, Berman J, Burnett A, Derogatis L, Ferguson D, Fourcroy J, Goldstein I, Graziottin A, Heiman J, Laan E, Leiblum S, Padma-Nathan H, Rosen R, Segraves K, Segraves RT, Shabsigh R, Sipski M, Wagner G, Whipple B. Report of the international consensus development conference on female sexual dysfunction: definitions and classifications. J Urol. 2000 Mar; 163(3): 888-93.
5. O'Connell H, Hutson J, Anderson C, Plenter R. Anatomic relationship between urethra and clitoris. J Urol 1998; 159(6): 1892-1897.
6. Palle C, Bredkjaer HE, Ottesen B, and Fahrenkrug J. Vasoactive intestinal polypeptide and human vaginal blood flow: comparison between transvaginal and intravenous administration. J. Clin. Exp. Pharm. Physiol. 1990; 17: 61-68.
7. Giuliano F, Allard J, Compaigne S, Alexandre L, Droupy S, Bernabe J. Vaginal physiological changes in a model of arousal in anesthetized rats. Am J Physiol Regul Integr Comp Physiol. 2001; 281: R140-149.
8. Min K, O'Connell L, Munarriz R, Huang YH, Choi S, Kim NN, Goldstein I, and Traish AM. Sex Steroid Hormone Modulation Of Vaginal Hemodynamics In The Female Rabbit Model.Female Sexual Function Forum, 2001.
9. Min K, Munarriz R, Kim NN, Choi S, O'Connell L, Goldstein I, and Traish AM. Effects of ovariectomy and estrogen replacement on basal and pelvic nerve stimulated Vaginal Lubrication in an animal model. Accepted for publication, J Sex Marital Ther. 2002.
10. Park K., Goldstein I, AndryC, Siroky M, Krane RJ, and Azadzoi K.Vasculogenic female sexual dysfunction: The hemodynamic basis for vaginal engorgement insufficiency and clitoral erectile insufficiency. Int J. Impotece Res. 9: 27-3.
11. Park K, Ahn K, Lee S, Ryu S, Park Y, Azadzoi KM. Decreased circulating levels of estrogen alter vaginal and clitoral blood flow and structure in the rabbit. Int J Impot Res. 2001; 13: 116-24.
12. Vachon P, Simmerman N, Zahran AR, Carrier S. Increases in clitoral and vaginal blood flow following clitoral and pelvic plexus nerve stimulations in the female rat. Int J Impot Res 2000 Feb; 12(1): 53-7.
13. Min K, Munarriz R, Berman J, Kim Nn, Goldstein I, And Traish AM, and Stankovic MR. Hemodynamic evaluation of the female sexual arousal response in an animal model. J Sex Marital Ther. 2001; 27: 557-565.
14. Min K, Kim NN, McAuley I, Stankowicz M, Goldstein I, and Traish AM. Sildenafil augements pelvic nerve-mediated female genital arousal in the anesthetized rabbit. Int J Impot Res. 2000; 12 Suppl 3: S32-39.
15. Tar can T, Siroky MB, Park K, Goldstein I, Azadzoi KM. Systemic administration of apomorphine improves the hemodynamic mechanism of clitoral and vaginal engorgement in the rabbit. Int J Impot Res 2000 Aug; 12(4): 235-40.
16. Cellek S and Moncada S. Nitrergic neurotransmission mediates the non-adrenergic non-cholinergic responses in the clitoral corpus cavernosum of the rabbit. Br. J. Pharmacol. 1998; 125: 1627-1629.
17. Vemulapalli S and Kurowski S.SildenafQ relaxes rabbit clitoral corpus cavernosum. Life Sei. 2000; 67: 23-29.
18. Ziessen T, Moncada S, and Cellek S. Characterization of the non-nitrergic NANC relaxation responses in the rabbit vaginal wall. Br. J. Pharmacol. 2002, 135: 546-554.
19. Levin RJ. VIP, vagina, clitoral and periurethral glans
- an update on human female genital arousal. Exp Clinic. Endocrinology 1991; 98: 61-69.
20. Ottesen B, Ulrichsen H, Fahrenkrug J, Larsen JJ, Wagner G, Schierup L, and Sondergaard F. Vasoactive intestinal polypeptide and the female genital tract: relationship to reproductive phase and delivery. Am. J. Obstet. Gynecol. 1982; 43: 414-420.
21. Otessen B. Vasoactive intestinal peptide as a neuro-transnitter in the female genital tract. Am. J. Obstet/Gynecol. 1983; 147: 208-224.
22. Ottesen B, Pedersen B, Nielsen J, Dalgaard D, Wagner G, and Fahrenkrug J. Vasoactive intestinal polypeptide (VIP) provokes vaginal lubrication in normal women. Peptides 1987; 8: 797-800.
23. Palle C, Bredkjaer HE, Ottesen B, and Fahrenkrug J. Vasoactive intestinal polypeptide and human vaginal blood flow: comparison between transvaginal and intravenous administration. J. Clin. Exp. Pharm. Physiol. 1990; 17: 61-68.
24. Meston CM and Heiman JR. Ephedrine-activated physiological sexual arousal in women. Arch. Gen. Psych. 1998; 55: 652-656.
25. Meston CM, Gorzalka BB, and Wright JM. Inhibition of subjective and physiological sexual arousal in women by clonidine. Psychosom. Med. 1997; 59: 399-407.
26. Riley AJ, and Riley EJ. The effect of labetalol and propanolol on pressure response to sexual arousal in women.Br. J. Pharmacol. 1981; 12: 341-344.
27. Min K, Munarriz R, Kim NN, Goldstein I, and Traish AM. Effects of Ovariectomy and Estrogen and androgen treatment on vaginal nitric oxide synthase activity and smooth muscle contractility. Female Sexual Function Forum 2001, Podium.
28. Park K, Moreland, RB, Atala A, et al: Characterization of phosphodiesterase activity inhuman clitoral corpus cavernosum smooth muscle cells in culture. Biochem. Biophys. Res. Com. 1998; 249: 612-617.
29. Traish Am, Moreland RB, Huang YH, Kim NN, Berman J, and Golstein I. Development of human and rabbit vaginal smooth muscle cultures: Effects of vasoactive agents on intracellular lvels of cyclic nucleotides. Mol. Cell. Biol. Res. Commun. 1999; 2: 131-137.
30. Berman JR, McCarthy MM, Kyprianou N. Effects of estrogen withdrawal on nitric oxide synthase expression and apoptosis in the rat vagina. Urology 1998, 51: 650-656.
31. Al-Hijji J, Larsson B, and Batra S. Nitric oxide synthase in the rabbit uterus and vagina: hormonal regulation and functional significance. Biol. Reprod. 62: 1387-92.
32. Batra S. and Al-Hijji J. Characterization os NOS activity in the rabbit uterus and vagina: down regulation by estrogen. Life Sci. 198; 62: 2093-2100.
33. Traish AM, Kim NN, Min K, Munarriz R, and Goldstein I. Role of androgens in female genital arousal: receptor expression, structure and function. Accepted for publication in Fertility and Sterility, 2002.
34. Vardi Y, Gruenwald I, Sprecher E, Gertman I, Yartnitsky D. Normative values for female genital sensation.Urology. 2000 Dec 20; 56(6): 1035-40.
35. Becher E., Bechara A. & Casabe A. Clitoral Haemodynamic Changes after a Topical Application of Alprostadil. Journal of Sex and Marital Therapy,
27, 405-410, 2001.
36. Bechara, A., Bertolino, M.; Casabe A., Munarriz R., Goldstein, I., Morin, A.,Secin, F., Literat B., Pesaresi M., Fredotovich N. Duplex Doppler Ultrasound Assessment Of Clitoral Hemodynamics After Topical Administration Of Alprostadil In Women With Arousal And Orgasmic Disorders. Accepted for publication in Journal of Sex and Marital Therapy.
37. Bachmann GA, Ebert GA, Burd ID. Vulvovaginal complaints. In Treatment of the postmenopausal woman: Basic and clinical aspects. RA Lobo, Ed. (Lippincott Williams & Wilkins) pp. 195-201, 1999.
38. Sarrel PM. Sexuality in the middle years. Obstet Gynecol Clin North Am. 14: 49-62, 1987.
39. Sarrel PM. Ovarian hormones and vaginal blood flow: using laser Doppler velocimetry to measure effects in a clinical trial of post-menopausal women. Int J Impot Res. 10 (Suppl 2): S91-93; 1998.
40. Sarrel PM. Effects of hormone replacement therapy on sexual psychophysiology and behavior in postmenopause. J Womens Health Gend Based Med. 9 (Suppl 1): S25-32, 2000.
41. Semmens JP, Wagner G. Estrogen deprivation and vaginal function in postmenopausal women. JAMA 248: 445-448,1982.
42. Utian WH, Shoupe D, Bachmann G, Pinkerton JV, Pickar JH. Relief of vasomotor symptoms and vaginal atrophy with lower doses of conjugated equine estrogens and medroxyprogesterone acetate. Fertil Steril. 75: 1065-1079, 2001.
43. Sherwin BB, Gelfand MM, Brender W. Androgen enhances sexual motivation in females: a prospective, crossover study of sex steroid administration in the surgical menopause. Psychosom Med. 47: 339-351, 1985.
44. Davis SR, Burger HG. The rationale for physiological testosterone replacement in women. Baillieres Clin Endocrinol Metab. 12: 391-405, 1998.
45. Bachmann G, Bancroft J, Braunstein G, Burger H, Davis S, Dennerstein L, Goldstein I, Guay A, Leiblum S, Lobo R, Notelovitz M, Rosen R, Sarrel P, Sherwin B, Simon J, Simpson E, Shifren J, Spark R, Traish A. Female androgen insufficiency: the prince-ton consensus statement on definition, classification, and assessment. Fertil Steril. 77: 660-665, 2002.
46. Gebhart JB, Rickard DJ, Barrett TJ, Lesnick TG, Webb MJ, Podratz KC, Spelsberg TC. Expression of estrogen receptor isoforms alpha and beta messenger RNA in vaginal tissue of premenopausal and postmenopausal women. Am J Obstet Gynecol. 185: 1325-1330, 2001.
47. Carter AC, Cohen EJ, Shorr E. The use of androgens in women. Vitamins Hormones 5: 317-391, 1947.
48. Salmon U. Rationale for androgen therapy in gynecology. J Clinic Endocrinol 1: 162-179, 1941.
49. Schreiner-Engel P, Schiavi RC, Smith H, White D. Sexual arousability and the menstrual cycle. Psychosom Med. 43: 199-214, 1981.
50. Schreiner-Engel P, Schiavi RC, White D, Ghizzani A. Low sexual desire in women: the role of reproductive hormones. Horm Behav. 23: 221-234. 1989.
51. Hackbert L, Heiman JR. Acute dehydroepiandros-terone (DHEA) effects on sexual arousal in postmenopausal women. J Womens Health Gend Based Med. 11: 155-162, 2002.
52. Shifren JL, Braunstein GD, Simon JA, Casson PR, Buster JE, Redmond GP, Burki RE, Ginsburg ES, Rosen RC, Leiblum SR, Caramelli KE, Mazer NA. Transdermal testosterone treatment in women with impaired sexual function after oophorectomy. N Engl J Med. 343: 682-688, 2000.
53. Arlt W, Callies F, Allolio B. DHEA replacement in women with adrenal insufficiency-pharmacoki-netics, bioconversion and clinical effects on wellbeing, sexuality and cognition. Endocr Res. 26: 505-511, 2000.
54. Munarriz R, Talakoub L, Flaherty E, Gioia M, Hoag L, Kim NN, Traish A, Goldstein I, Guay A, Spark R. Androgen replacement therapy with dehydroepian-drosterone for androgen insufficiency and female sexual dysfunction: androgen and questionnaire results. J Sex Marital Ther. 28 (Suppl 1): 165-173, 2002.
55. Caruso S, Intelisano G, Lupo L, and Agnello C. Premenopausal women affected by sexual disorder treated with sildenafil: a double blind, cross over, placebo controlled study. BJOG 2001, 108: 623-628.
56. Kaplan SA, Reis RB, Kohn IJ, Ikeguchi EF, Laor E, Te
AE, Martins AC. Safety and efficacy of sildenafil in postmenopausal women with sexual dysfunction. Urologyu 1999; 53: 481-48.
57. Rosen RC, Phillips NA, Gendrano NC 3rd, Ferguson DM. J Oral phentolamine and female sexual arousal disorder: a pilot study. Sex Marital Ther 1999 Apr-Jun; 25(2): 137-44.
58. Rubio-Aurioles E, Lopez M, Lipezker M, Lara C, Ramirez A, Rampazzo C, Hurtado de Mendoza MT, Lowrey F, Loehr LA, Lammers P. Phentolamine mesylate in postmenopausal women with female sexual arousal disorder: a psychophysiological study. J Sex Marital Ther 2002; 28 Suppl 1: 205-15.
59. Islam A, Mitchel J, Rosen R, Phillips N, Ayers C, Ferguson D, Yeager J.Topical alprostadil in the treatment of Female Sexual Arousal Disorder: a pilot study. J Sex Marital Ther 2001 Oct-Dec; 27(5): 531-40.
60. Billups KL, Berman L, Berman J, Metz ME, Glennon ME, Goldstein I. A new non-pharmacological vacuum therapy for female sexual dysfunction. J Sex Marital Ther. 2001 Oct-Dec; 27(5): 435-41.
61. Wilson SK, Delk JR 2nd, Billups KL. Treating symptoms of female sexual arousal disorder with the Eros-Clitoral Therapy Device. J Gend Specif Med. 2001; 4(2): 54-8.
Dr. Ricardo Szemat Nikolajenko
Urólogo Jefe y Director del Postgrado
Dr. Vicente Diegiiez
Adjunto docente
Dr. Juan Carlos Jaime
Residente de Urología del Hospital General El Llanito "Dr. Domingo Luciani" Dr. Oscar Martínez Estudiante de Medicina, UCV
Dr. Ricardo Szemat Daher
Médico Interno
OSTEOPOROSIS EN EL HOMBRE VENEZOLANO
INTRODUCCION
Si tomamos en cuenta que la disminución de la influencia hormonal en la menopausia es predisponente para la pérdida de masa ósea en las mujeres, entonces seria lógico pensar que el urólogo cuando somete al hombre a castración bien sea hormonal o quirúrgico, entonces debería ocurrir una pérdida importante de masa ósea. Basados en esta premisa varios investigadores tales como Melton LJ determina que en hombres con cáncer de próstata existe una alta incidencia de fracturas las cuales son explicadas por la edad de los pacientes, pero si se le suma la orquidectomia, el riesgo de fractura se eleva consi-derablementel. Preston DM al evaluar la perdida de masa ósea en pacientes sometidos a bloqueo hormonal encuentra que todos los hombres con bloqueo hormonal presentaron mayor perdida de masa ósea en trocánter, cuello femoral, muñeca y triangulo de Wards que aquellos no sometidos a bloqueo hormonal.2
Robert Ross logra concluye que en los pacientes con deprivación androgenica se pierde de 3 a 5 % de la masa ósea anualmente y se incrementa por ende el riesgo de fracturas osteoporoticas.3 Por su parte Harry Daniell presenta resultados similares encontrando en los hombres orquidectomizados un descenso de la densidad mineral ósea 2.4% y 7.6%, respectivamente durante los años 1 y 2 de la drugía.4
Ante estos resultados y en virtud del alto índice de pacientes sometidos a deprivation androgenica en nuestro servicio de urología del Hospital Dr. Domingo Luciani, asumimos la tarea de estudiar la masa ósea en la población masculina Venezolana, haciendo notar que los reportes sobre osteoporosis en el hombre en Latinoamérica son muy escasos, y en nuestro país no existen cifras sobre este tipo de pacientes.
La mayor parte de la atención, en cuanto a osteoporosis se refiere, se ha centrado en mujeres, dado que ellas están expuestas a un mayor riesgo de desarrollo de dicha entidad. Sin embargo, la osteoporosis en varones no es rara.
La osteoporosis en el hombre, es un problema al que se otorga escasa atención a pesar que el riesgo de fracturas en sujetos de 60 años está alrededor de 25%, y estas cifras representan un problema importante desde el punto de vista económico.5
De manera errónea, los conocimientos sobre osteoporosis en mujeres han sido aplicados al hombre. Pero ahora se está comenzando a conocer la enfermedad en el sexo masculino y resulta evidente que la osteoporosis en varones es distinta de la de mujeres en muchos aspectos.
Pero además del poco conocimiento que se tiene de esta patología, nos enfrentamos también a un alto desconocimiento por parte de la población venezolana, lo cual queda demostrado en un estudio realizado en el Servicio de Urología del Hospital Domingo Luciani, donde solo el 14 % de la población encuestada lograba definir la osteoporosis en el hombre.
Si quisiéramos evaluar la osteoporosis con un método diagnóstico, tendríamos que tener en cuenta tres aspectos:6'7
• Densidad mineral ósea disminuida,
• Alteración de la microarquitectura, y,
• Aumento en la susceptibilidad a las fracturas que es consecuencia de los dos aspectos anteriores.
El hueso normal está compuesto en un 30% por sustancias orgánicas. Este 30% está conformado a su vez en un 98% por una sustancia denominada matriz ósea la cual está compuesta en su mayoría por colágeno. El colágeno es una proteína que crea un armazón sobre el cual se depositan los componentes inorgánicos o minerales del hueso. El otro 2% del
material orgánico, está conformado por las células encargadas de formar el hueso, y remodelarlo (osteocitos, osteoblastos y osteoclastos). El 70 % restante está compuesto por materiales inorgánicos como fosfatos y principalmente calcio, que son los encargados de dar la consistencia dura a los huesos y los que a su vez permiten soportar las cargas a que estos son sometidos, tales como sostener el peso del propio cuerpo, las caídas y los golpes.6'7
Alrededor de 95% de la masa ósea total de un adulto se logra hacia los 20 años en los hombres y los 18 en las mujeres, y el 5% restante se logra hasta los 28 años de edad. La masa ósea es la cantidad de hueso (proteínas y minerales, en particular calcio) que presenta una persona en su esqueleto en un momento determinado. La masa ósea depende de su edad, sexo y su raza. Por ejemplo, a igual edad y sexo, las personas de la raza negra tienen masa ósea mayor que las de la raza blanca o amarilla.8
El hueso no es un órgano muerto, sin vida. En su interior se realizan continuamente procesos de remodelamiento, con un equilibrio entre fases de destrucción y de formación o sea, reguladas por distintas sustancias hormonales, la actividad física del sujeto y la vitamina D, entre otras. El hueso se forma por la actividad de los osteoblastos, al mismo tiempo que es reabsorbido por los osteoclastos un tipo de células óseas encargadas de este proceso, su función está regulada por la hormona paratiroidea. Los osteoclastos liberan enzimas proteo líticas, y ácidos como el cítrico y láctico. Las enzimas disuelven y digieren la matriz orgánica del hueso, y los ácidos producen la disolución de las sales cáldcas. Normalmente este proceso de depósito y reabsordón ósea son casi iguales, por lo que la masa total ósea permanece constante. Los osteodtos no son mas que osteoblastos que quedan inmersos dentro de la matriz ósea.6'7
Los osteoclastos se encuentran en grupos pequeños y concentrados, y una vez que el grupo de osteoclastos se desarrolla, reabsorbe tejido óseo durante 3 ó 4 semanas, formando un túnel de hasta 1 mm de diámetro y varios milímetros de longitud. Enseguida desaparecen los osteoclastos y el túnel es invadido por los osteoblastos que comienzan a formar tejido óseo nuevo. El depósito de hueso se prolonga varios meses y toma forma de círculos concéntricos a partir de la superficie interna del túnel, hasta rellenarlo por completo: cesa cuando alcanza el centro destinado a los vasos sanguíneos. El canal vascular central llamado túnel de Havers es lo único que permanece de la cavidad original.6'7
El hueso tiende a adoptar una solidez de acuerdo a las cargas que debe soportar. Por este motivo los huesos de atletas o de quienes realizan trabajos pesados, son más anchos y pesados que los que no cumplen estas tareas. En una persona que utiliza muletas y apoya sólo un pié, se observa una diferencia de hasta 30% del diámetro del fémur.6'7
La cantidad de masa ósea de una persona va aumentando poco a poco desde el nadmiento, a medida que va creciendo el esqueleto, hasta alcanzar un valor máximo (que llamamos "pico de masa ósea") alrededor de los 28 años, en el momento de la madurez esquelética. Después de esto comienza una pérdida de la masa ósea.9
La medición de la densidad mineral masa ósea es la parte crítica de la definición de la Osteoporosis, por cuanto el deterioro de la microarquitedura ósea, es difídl de valorar clínicamente. La utilidad de la medición de la densidad mineral ósea (DMO) es incuestionable en términos de definición, epidemiología y tratamiento de la Osteoporosis, pero cuestionado un poco en términos de costo. La limitadón de la medición de la DMO, es que la Osteoporosis no sólo significa disminución de la DMO, sino también fragilidad, ésta última determinada por la microarquitedura ósea es dedr por las interacdones de las micro-trabeculas, valorada únicamente por la biopsia ósea, o de una manera aproximada con el ultrasonido óseo.6'7
Se define Osteoporosis como una DMO de -2.5 desviadones estándares (DS), por debajo de un valor de referenda normal, el cual debe ser determinado para cada sexo, raza e idealmente para una misma zona geográfica. Hoy en día existen varios aparatos de medidón de la DMO, y en diferentes partes del cuerpo, pero sin lugar a dudas la medición con DEXA (Absordometria de Energía Dual de rayos X ) en columna lumbar y cadera son las más recomendadas en términos de precisión, exactitud, tiempo de examen, exposición a radiación y costo-efedividad.9
Se desconoce el número de hombres afedados de osteoporosis. Si se utiliza la aparición de fractura como punto final de valoración, se estima un índice de riesgo a lo largo de la vida del 13% al 25%.10
Este valor es inferior al de mujeres caucásicas (50%). No obstante, el diagnóstico de osteoporosis no depende del resultado final del desarrollo de la enfermedad. El advenimiento de nueva tecnología permitió descubrir la población de riesgo antes del desarrollo de una fractura. Tanto en hombres como en mujeres, el riesgo de esta eventualidad se relaciona de manera directa con la masa ósea. Según las recomendaciones de la Organización Mundial de la Salud, se presenta osteoporosis cuando la densidad mineral ósea (DMO) se ubica más de 2.5 desviaciones estándar (DE) por debajo del pico de masa ósea de referencia en mujeres jóvenes. Utilizando los mismos criterios de definición, 1 a 2 millones de varones tienen osteoporosis mientras que 8 a 13 millones presentan osteopenia, con una prevalencia ajustada a la edad del 6% al 47%. No está claro si es correcto aplicar los mismos parámetros debido a que los varones adquieren pico de masa ósea mayor que las mujeres y tienen huesos más grandes.6'9
Además de las consideraciones en relación con los criterios de definición, otro factor que contribuye con la incidencia más baja en varones es que la osteoporosis, en ellos, suele aparecer en forma tardía en la vida. Pero, por la misma razón, el impacto de la enfermedad es mucho mayor. Cuando un hombre desarrolla una fractura de cadera, la mortalidad asociada tiende a ser muy superior a la que se observa en mujeres.11
A. Edad: Es uno de los factores más determinantes. Luego de alcanzar el pico de Masa ósea, viene necesariamente una disminución de la masa ósea, más comúnmente mencionado como "descalcificación", proceso considerado como normal, y por lo tanto inevitable; sin embargo la velocidad a la cual se lleva a cabo este proceso, si es susceptible de modificación. En general podemos dedr que el riesgo de una fractura es el doble por cada 5 a 10 años de vida.
B. Estilo de Vida: Fadores que están bajo el control del padente, y que pueden acelerar la perdida de hueso: Una dieta defidente en caldo, y/o que contenga exceso de proteínas "perdedoras de caldo", Inadividad, Abuso de alcohol, Tabaquismo, Ingesta de cafeína.
C. Peso: A mayor peso, mayor la masa ósea. La explicación resulta de una mayor producción de estrógenos (estrona) en los adipositos a partir de los andrógenos adrenales. Pacini encontró en su estudio comparativo entre hombres con y sin osteoporosis que en los hombres osteoporoticos la media del peso corporal era de 65.8 +/-11.2 Kg., en los no osteoporoticos fue de 77.3 +/- 10.2, (p = 0.0013)
Kg-12
D. Uso de Corticoïdes: Los corticoides disminuyen la síntesis de colágeno Tipo I, inhiben la producción de Osteocladna por el Osteoblasto; disminuyen la absordón de calcio a nivel del tracto gastrointestinal como de los túbulos renales.
E. Uso de anticonvulsivantes.
F. Fractura Previa: El riesgo de una nueva fractura está aumentado entre 3 a 5 veces en parientes con fracturas de bajo impacto previas, aún luego de ajustar para la edad y la DMO.
G. Herencia: Pacientes sin ningún otro factor de riesgo, es más, con alto consumo de calcio, pueden tener Osteoporosis, si uno de sus progenitores también la ha tenido. Por esta condición un paciente sin fadores de riesgo no puede ser exento de una evaluación de su densidad mineral ósea. Cohén Solal ME encuentra en el grupo de pacientes con antecedentes familiares de fraduras por osteoporosis una prevalencia de masa ósea baja del 54% (definido como inferior a 1 desviadón estándar de los controles), mientras que en el grupo control, fue del 17%. Este resultado determina entonces tal como ocurre en mujeres, que la influencia familiar contribuye al desarrollo de osteoporosis en los varones de mediana edad.13
Sin embargo, las tres causas principales de este trastorno son el abuso de alcohol, el exceso de glu-cocorticoides y el hipogonadismo. Estos factores son responsables del 40% al 50% de los casos de osteoporosis en varones. Asimismo, se debe descartar hiperparatiroidismo primario, hiper-tiroidismo, mieloma múltiple, sin embargo, que la declinación de estrógenos puede ser un factor importante. Esta reducción parece relacionarse más con la pérdida de masa ósea que el descenso de andrógenos.13
A. Osteoporosis Primaría o Idíopátíca.
Pacientes con Osteoporosis, quienes no presentan una condición médica identificada, se dice que tienen una Osteoporosis primaria.
Clásicamente la Osteoporosis primaria se dividía en dos tipos:
Tipo I. Donde la perdida de hueso ocurre principalmente en el compartimiento trabecular, y se relaciona a la perdida de la función hormonal.
Tipo II. Que involucra principalmente al hueso cortical y que se relaciona con el proceso fisiológico del envejecimiento.
B. Osteoporosis Secundaria.
Cerca del 20% de las fracturas osteoporóticas de bajo impacto, pueden ser secundarias a:
1. Condiciones médicas como: Falla Renal crónica, Gastrectomía y bypas intestinal, Síndrome de mala absorción, Mieloma Múltiple, Cáncer metastádco a hueso.
2. Endocrínopatías: Hiperproladinemia, Hiper-paratiroidismo, Hipertiroidismo, Sobreactividad adrenocortical (Síndrome de Cushing), Diabetes, Hipogonadismo.
3. Desordenes del tejido conectivo: Osteogénesis imperfecta, Síndrome de Ehlers-Danlos, Homocistinuria, Artritis Reumatoidea.
4. Medicamentos: Agonistas GnRH, Antian-drógenos, Anticonvulsivantes, Antiáddos con aluminio, Terapia con Hormona Tiroidea, Heparina.
5. Deficiencias nutricionales: El alcoholismo es la causa más común de pérdida ósea en hombres jóvenes. El etanol disminuye la absordón intestinal de caldo.
6. Osteoporosis por inmovilidad: La masa ósea cambia en respuesta a esfuerzos mecánicos. Tras una inmovilización la densidad del hueso disminuye profunda y rápidamente, con una pérdida propordonal de matriz y mineral óseos. Tras 6 meses se reduce 30 a 40%.
7. Enfermedad Crónica: Casi todas las enfermedades crónicas pueden ocasionar osteopenia, siendo la malnutrición y la inmovi-lizadón los principales fadores. La osteopenia es también una complicación común de muchos tumores de la médula ósea (mieloma múltiple, leucemia, linfoma).
Hormonas sexuales y osteoporosis en hombres.
La deficienda de andrógenos parece tener un papel importante en muchos casos de osteoporosis en el hombre; el 20% de los pacientes que presentan fracturas vertebrales y más del 50% de los que sufren fractura de cadera tienen resultados bioquímicos de hipogonadismo. En los estudios con cultivos de células tipo osteoblásticas humanas, tanto de hombres como de mujeres, pueden identificarse receptores androgénicos específicos. En forma similar, los osteoblastos obtenidos de muestras frescas de hueso femoral también pueden metabolizar la androste-nodiona circulante y producir testosterona y 5(alfa) dihidrotestosterona (DHT) en ambos sexos, según la concentración de la primera. Las células de la línea osteoclástica también pueden presentar esas propiedades, aunque esta posibilidad no se ha determinado por completo. Los receptores de andrógenos aparecen también en los osteoblastos y osteodtos de las cercanías de la placa de crecimiento. Los andrógenos pueden favorecer la proliferadón y la diferenciadón de los osteoblastos, inhibir el reclutamiento de los osteodastos o afectar las señales entre ambos.15
Existen dudas sobre los resultados de los estudios con animales, ya que suelen realizarse en ratas macho orquiectomizadas, en las cuales el esqueleto sigue credendo durante toda su vida. El tratamiento de reemplazo con testosterona o DHT produce un aumento de la masa ósea, aunque ésta sigue siendo inferior a la de las ratas control. Por otra parte, en los hombres los andrógenos ejercen un efedo importante sobre el crecimiento del hueso y el pico de masa ósea a través del eje hormona de crecimiento/IGF-I, y la deficienda androgénica antes de la pubertad hace que la densidad mineral ósea sea inferior en el hueso cortical y el trabecular. La falta de andrógenos en etapas posteriores de la vida se acompaña de aumento de la resorción ósea y pérdida del hueso trabecular, aunque el cortical no se ve demasiado afectado.16
En un estudio de 12 hombres castrados se observó que aumentaba el remodelamiento óseo y disminuía de manera significativa la densidad mineral ósea, en forma acelerada, durante los 5 primeros años tras la castración.17 La pérdida ósea era del 7% anual, similar a la que aparece en las mujeres posmenopáusicas. Otros investigadores encontraron en hombres con hipogonadismo niveles bajos de 1,25-dihidroxivita-mina D y dificultades en la absorción de calcio. Estos hallazgos han llevado a creer que los andrógenos gonadales son las principales hormonas esteroideas con actividad sobre el hueso de los varones. Sin embargo, los últimos datos sugieren que también existe un efecto considerable de los estrógenos y los andrógenos adrenales.18
Kenny AM en la determinación de la densidad mineral ósea en los hombres mayores sanos con niveles de testosterona baja (< o = 4.44 nmol/1), concluyo que el Cincuenta y dos por ciento (52 %) de los hombres con niveles de testosterona bajo tenían niveles de DMO por debajo del rango del normal en comparación con el adulto joven y es un probable factor de riesgo aumentado de fractura.20 Por su parte, Scopacasa F, en su estudio sobre 37 varones sanos entre 60 y 70 años, determina que la densidad mineral ósea en varones, así como el estado metabólico óseo, se ve más relacionado en esta muestra con los niveles de andrógenos libres en sangre que con los de estrógenos.21
En una revisión de 40 artículos de la literatura, realizada por Vanderschueren D, Boonen S, Bouillon R. acerca del papel que juegan los andrógenos y los estrógenos sobre el dimorfismo sexual del tejido óseo, su maduración, y su mantenimiento a lo largo de la vida de los varones, con la finalidad de estudiar el efecto de los andrógenos frente al de los estrógenos en el metabolismo óseo de los varones. Dentro de los resultados de esta revisión se determina que existen receptores tanto para andrógenos como para estrógenos en el tejido óseo. Asimismo, también se han descrito dos enzimas, la aromatasa P450, que cataliza el paso de andrógenos a estrógenos; y la 5 alfa reductasa, responsable del paso de testosterona a dihidrotestosterona (no aromatizable). Los andró-genos tienen importancia en la aparición de las características propias del tejido óseo en varones, como puede ser un mayor crecimiento axial. Los estrógenos, por otro lado, tienen una importancia capital en la maduración del tejido óseo tanto de los varones como de las mujeres; produciendo su déficit,
o las mutaciones de su receptor, un retraso en el cierre de las fisis de crecimiento, y de la correcta mineralization de la matriz ósea. Estos efectos pueden paliarse administrando estrógenos, con normalización de dichos parámetros. En el tejido óseo adulto, los estrógenos también tienen un efecto directo en el mantenimiento de la masa ósea, mientras que los andrógenos pueden actuar sólo de forma indirecta, sirviendo como substrato para su aromatización en estrógenos. Existen múltiples estudios en varones castrados, ya sea quirúrgicamente o farmacológicamente, con la disminución subsiguiente de su masa ósea. Sin embargo, el uso concomitante de estrógenos, ya sea para el tratamiento de una neoplasia de próstata, como para adquirir caracteres sexuales femeninos (transexuales); impiden dicha pérdida ósea, y si ya ha aparecido, la disminuyen, incluso normalizando su densidad mineral. La acción de los estrógenos es muy importante tanto para la adecuada maduración como para el mantenimiento del tejido óseo en varones. Los andrógenos pueden jugar también un papel en el crecimiento axial del individuo, pero parecen tener mayor importancia como substrato para su conversión a estrógenos.22
Son pocos los estudios donde se ha utilizado la SHBG en pacientes osteoporoticos, dentro de los mas importantes se encuentra el realizado por Gillberg P, Johansson AG y Ljunghall S. donde estudiaron a hombres con osteoporosis primaria y se determino que el índice de masa corporal fue menor en el grupo de osteoporoticos, alcanzando significación estadística. Los niveles de estradiol, cociente estradiol/SHBG, cociente testosterona/SHBG, son menores en el grupo de osteoporosis frente al grupo control, alcanzando significación estadística. El nivel de SHBG fue mayor en el grupo de osteoporosis. Los marcadores bioquímicos de metabolismo óseo muestran un cociente calcio-creatinina en orina mayor en grupo de osteoporosis, alcanzando significación estadística. En cuanto al estudio con recta de regresión, se correlacionó de forma positiva la DMO en cuello femoral con el cociente estradiol/SHBG sólo en el grupo de pacientes, pero no en el de controles. No hubo relación lineal entre estradiol y los índices de composición corporal. Los niveles de SHBG se correlacionaron negativamente con el porcentaje de grasa corporal en el grupo control pero no en el de pacientes. Se realizó asimismo, un modelo de regresión múltiple, según el cual, el 64 % de la variación del cociente estradiol/SHBG se explicaba por la edad y el IMC de los osteoporóticos, no de los pacientes, pero no en los controles. La combinación del cociente estradiol /SHBG con la edad explican el 76% de la variación de DMO en cuello femoral en varones con osteoporosis, no así en el grupo control. Los niveles de estrógenos y andrógenos están relacionados con el nivel de densidad mineral ósea en los varones con osteoporosis idiopática. El cociente estradiol/SHBG, así como el índice Androgénico libre, están disminuidos en os varones con osteoporosis idiopática. El papel de los estrógenos en el tejido óseo masculino puede venir mediado por la aromatización de los andrógenos sistémicos. Sin embargo, el patrón histo-morfométrico de la osteoporosis hipogonadal, tanto en hombre como en mujer, es muy distinto que el que presenta el varón con osteoporosis idiopática masculina.23
Carlsen realizo su estudio en 63 hombres con osteoporosis y determino que los niveles de estrógenos en varones pueden ser más importantes que los niveles de andrógenos para explicar una baja masa ósea.24
En los hombres sanos puede detectarse niveles de estradiol plasmático similares a los de las mujeres posmenopáusicas, como resultado de la conversión periférica de testosterona mediante la enzima aro-matasa. Debido a que esos niveles son relativamente bajos, no se les dio importancia hasta que la investigación epidemiológica sobre el riesgo cardíaco sugirió que los estrógenos endógenos ejercían un papel protector en los hombres y que los niveles normales de estradiol son suficientes para alterar en forma favorable los lípidos. Los osteoblastos en cultivo tienen receptores estrogénicos y responden metabóli-camente a ellos, tanto in Vitro, como en muestras de biopsia fresca de hueso masculino. Los osteoblastos cultivados tienen la capacidad de convertir la testosterona en estradiol, y viceversa. En las ratas orquiec-tomizadas, el estradiol previene la pérdida ósea más eficazmente que la progesterona o la DHT, aunque la combinación de las tres resulta más eficaz que cualquier agente por separado.15'18
En un estudio transversal con 37 hombres ancianos sanos sin antecedentes de patología ósea, los autores encontraron que la densidad mineral ósea en la columna vertebral y la cadera se correlacionaban más con el estradiol sérico que con la testosterona. Por otra parte, en un estudio prospectivo de 93 hombres sanos mayores de 65 años, los niveles de estradiol en suero se asociaban de manera positiva, con los valores iniciales de la densidad mineral ósea de cualquier localización, mientras que los valores de testosterona no tenían valor pronóstico. Las concentraciones de testosterona y estradiol se relacionaban con las características diferenciadoras y complementarias de la histomorfometría del hueso, como el grosor trabecular y el número de trabéculas. Las gónadas, por supuesto, no son la única fuente de hormonas sexuales. En la actualidad se estudia con mucho interés el papel del andrógeno adrenal dehidroepiandrosterona (DHEA) y su sulfato (DHEAS) para prevenir las enfermedades por envejecimiento, como la osteoporosis.16
Los osteoblastos humanos convierten DHEA en estrona, precursor de la testosterona y el estradiol, y la DHEA actúa directamente sobre los receptores de los andrógenos en los osteoblastos para estimular la proliferación y la diferenciación. En dos estudios transversales se sugirió una correlación positiva de la DHEA y la DHEAS con la densidad mineral ósea en las mujeres posmenopáusicas, aunque un estudio prospectivo no corroboró esta relación. Es por ello que se necesita investigar más el papel de estas dos hormonas en el metabolismo óseo, particularmente en los hombres. En presencia de niveles bajos de cualquier clase de hormona sexual durante el crecimiento, se produce cierta insuficiencia en la maduración del esqueleto y un pico de masa ósea por debajo de lo normal, mientras que la escasa actividad de estas hormonas en etapas más tardías de la vida se asocia con una involución ósea rápida y fracturas osteoporóticas. Este concepto de una interdependencia entre los andrógenos y los estrógenos es una hipótesis generada, esencialmente, por los estudios transversales y los hallazgos clínicos; esta relación ayuda a explicar algunas características no del todo comprendidas de la acción de los andrógenos sobre el esqueleto masculino. Puede argumentarse, que la relación observada entre las hormonas sexuales y la osteoporosis en los hombres es trivial (ya que el hueso es un órgano blanco aceptado para esas hormonas), pero el punto importante es la interacción de ambas clases de hormonas sexuales con el hueso y entre sí. La actividad estrogénica en el hombre es incluso menos conocido, que la androgénica en las mujeres, y puede ser muy importante, desde el punto de vista clínico, estar alerta al papel de la aromatasa.15'16
Si se acepta la relación, se desprende que las determinaciones de estrógenos son una parte necesaria en el protocolo de cualquier estudio sobre la osteoporosis masculina, en el que los andrógenos se ven afectados por el tratamiento. La osteoporosis en los hombres, es una patología importante y poco conocida. Todos los tratamientos de la osteoporosis idiopática siguen siendo experimentales y, en vista de los efectos secundarios de los tratamientos hormonales, muchos médicos pueden preferir utilizar otros agentes como la calcitonina, los bisfosfonatos o el flúor.
Un largo período asintomático precede a la aparición de los síntomas clínicos ó a las complicaciones de la osteoporosis. Los recursos esqueléticos resultan depletados durante décadas. Aunque todo el esqueleto es susceptible, hay regiones de elevada remodeladón del hueso trabecular, tales como los cuerpos vertebrales, las costillas, el fémur y el húmero proximal y el radio distal.25
Pueden ocurrir fracturas vertebrales por compresión. El síntoma más precoz de osteoporosis es el dolor de espalda agudo asodado con fradura vertebral por compresión torádca o lumbar, por actividades cotidianas. El comienzo del dolor es súbito, el lugar es ubicado con precisión.25
El movimiento de la columna está limitado. El dolor se intensifica al sentarse o al ponerse de pie, por la tos, maniobras de valsalva. El reposo en decúbito supino, produce alivio. La pérdida de apetito, la distensión abdominal y el íleo secundario a una hemorragia retroperitoneal pueden acompañar a las fraduras vertebrales por compresión torádcas inferiores y/o lumbares superiores.6'25
Aunque son estables, las radiculopatías se asocian con la compresión de las fracturas torácicas o lumbares superiores y causan dolor unilateral o bilateral que se irradia anteriormente a lo largo del borde costal de la raíz nerviosa afectada.7'25
Durante los intervalos entre las fraduras de compresión, se es asintomático. Alrededor del 30% continúa afectado con dolor crónico, sordo, molesto, postural, en la región mediotorácica y lumbar superior que sólo se alivia por períodos frecuentes de reposo en cama. Cada episodio de colapso vertebral segmentario causa una cifosis progresiva y la estatura disminuye. También hay disminución de las cavidades torádca y abdominal.25
A veces el primer signo de la enfermedad es una fractura en el esqueleto apendicular. Las más frecuentes son las del fémur proximal (principalmente entre los 65 y 75 años) y del radio distal.6'25
La evaluadón para determinar si un paciente padece osteoporosis se puede realizar a través de diversos métodos, los cuales están clasificados en dos grupos prindpales: Clínicos y Paradínicos.
Los métodos clínicos: son los que permiten identificar síntomas de la enfermedad sin recurrir a exámenes de laboratorio.
Los métodos paradínicos: recurren a diversas formas de examen de laboratorio para identificar los síntomas de la enfermedad Evaluadón Clínica: Para realizar la evaluadón de un posible caso de osteoporosis otras causas de pérdida ósea sintomática deben exduirse. Por tanto, es esendal una historia completa para hacer el diagnóstico diferendal, esto debe induir:
• Historia de enfermedad aguda. Comienzo, duradón, localización, radiadón, reladón al movimiento, etc.
• Revisión de síntomas relacionados. Malestar, pérdida o gananda ponderal reciente; pérdida de estatura; alteración de la visión; púrpura o acné; hipertensión; bodo; cambios de voz; sensibilidad; palpitaciones; cambios en el hábito intestinal; nefrolitiasis; dolor o edema articular, etc.
• Historia médica anterior y personal. Operaciones; hospitalizadones; medicaciones; dieta; adividad; así como una evaluadón de todos los factores de riesgo.
• Historia familiar. Osteoporosis, enfermedades de los huesos o las articulaciones, trastornos del credmiento.
• Después de contemplar la historia, se lleva a cabo una exploración física completa la cual debe incluir medición de la talla del paciente y comparación con el promedio, así como la comparación de la talla con el pasar de los años, y pérdidas de 2,5 cms a 4 cms pueden ser normales, pero pérdidas mayores pueden representar fracturas por compresión de los cuerpos vertebrales, así mismo se deben evaluar factores de riesgo como pérdida de la visión, marcha y habilidad para la incorporación desde la posición sedente.
• Posterior a esto se deben realizar los exámenes necesarios para tener una medición de masa ósea y poder tener unos "test" de la densidad ósea.
Los métodos de evaluación paraclínicos se dividen en dos grupos principales según la técnica empleada: El primer grupo incluye los que emplean fuentes de radiación iónica para realizar el examen. En el segundo grupo se encuentran los exámenes que se realizan empleando fuentes acústicas.
Rayos X
• Absordometría dual de Rayos X
Densítometrías
• Absordometría de fotón único.
• Absordometría de fotón dual
• Tomografía computarizada cuantitativa
• Absordometría radiográfica
Ultrasonido
Interpretación de los resultados
La Organizadón Mundial de la Salud (OMS) ha definido una densidad ósea normal como un valor mayor a -1 desviadón estándar del valor medio de los adultos jóvenes (T score) de la misma raza y sexo.26
Normal: La medidón de la MO se encuentra mayor de -1 desviadones estándar. Un valor normal en un solo lugar no excluye la posibilidad de pérdida de la MO en otro lugar del esqueleto, el hueso trabecular tiene un mayor recambio y por lo tanto una mayor propensión a la desmineralizadón.
Si es una medidón periférica, se recomienda una medición central adicional (columna o cadera) en parientes con alto riesgo.
Osteopenia: La medición de la masa ósea se encuentra entre - 1 y - 2.5 desviaciones estándar. Representa una baja MO y se debe descartar condiciones que produzcan osteopenia
Osteoporosis: la medición de la masa ósea se encuentra por debajo de -2.5 desviaciones estándar.
Definitivamente es más fádl prevenirla que tratarla. Así expertos han propuesto que el objetivo principal del tratamiento de la osteoporosis es prevenir la primera fractura.
Para la osteoporosis primaria y la reladonada con la edad, el adecuado aporte de vitamina D y caldo, aunado al esfuerzo para la prevendón de caídas. Cualquier actividad que incremente la fuerza y la coordinación en los miembros inferiores resulta eficaz. Los hábitos que favorecen la pérdida de masa ósea (tabaquismo, inadividad, consumo abusivo de alcohol) deberían ser abolidos. Los agentes antirre-sortivos que pueden utilizarse incluyen la calcitoni-na, por vía nasal y en dosis de 200 Ul/día, y los bis-fosfonatos (10 mg/día ó 70 mg/semanal de alen-dronato), y se considera que pueden ser tan eficaces en el hombre como en la mujer. En casos de osteoporosis secundaria, la intervención más importante es la corrección de la causa que le dio origen.9'26
Además, la óptima provisión de vitamina D y calcio así como la práctica de ejerdcio físico resultan de utilidad. Así, la ingesta de caldo debe oscilar entre los 1.200 y 1.500 mg. por día y la de vitamina D entre 400 a 600 UI por día. Un grupo de pacientes puede beneficiarse con otras drogas. Es el caso de los individuos con hipogonadismo bien estableado en los cuales la terapia con testosterona incrementa la masa ósea y reduce el índice de remodelamiento. Como no se estableció ni la dosis ni el tiempo durante el cual debería ser empleada, se adopta el criterio del régimen comúnmente empleado para tratar el resto de los síntomas de hipogonadismo. También el alendronato parece ser un recurso útil en estos enfermos.26
El tratamiento de sujetos con osteoporosis cor-tisónica, además de las medidas específicas, incluye el uso de bisfosfonatos, sobre todo en los casos en los cuales se requieren altas dosis de glucocorticoides.26
Los enfermos deben ser evaluados con determinaciones seriadas de DMO y marcadores de recambio óseo. Es de esperar que estos parámetros tengan igual valor predictivo que en mujeres posmenopáusi-cas. No obstante, aún no hay estudios al respecto. Trabajos con risedronato en hombres tomando corti-coides, muestran una reducción en la perdida de masa ósea.28
En hombres con masa ósea baja, pero sin causa secundaria de osteoporosis, se demostró que el alendronato, tuvo un efecto de igual magnitud al observado en las mujeres. Aún mejor, alendronato tuvo una sustancial reducción en nuevas fracturas (riesgo relativo=0.1, CL 0.0-0.9).29 Gonnelli en su estudio de 3 años de tratamiento, el alendronato aumentó la DMO en la columna lumbar en 9,9% y en el cuello femoral en 4,0.30 Por su parte Orwoll E, encuentra una disminución en la incidencia de fracturas del 18.1% de los tratados con placebo y en el 3.1% de los que recibieron alendronato con un incremento de la DMO en el grupo del alendronato fueron de 7.1%, 2.5% y 2% en la columna, cadera y esqueleto total, respectivamente, todo esto con 2 años de tratamiento.31
OSTEOPOROSIS EN EL HOMBRE, EN LA POBLACIÓN VENEZOLANA. ESTUDIO DEL SERVICIO DE UROLOGÍA DEL HOSPITAL GENERAL DEL ESTE "DR. DOMINGO LUCIANI"
Entre enero de 2001 y mayo de 2002 se realizaron pruebas de densitometría ósea periférica de cubito y radio distal a un total de 1893 pacientes de 35 o más años. Los resultados determinaron una incidencia de osteoporosis de 16,3 %, encontrándose además que el
35.5 % presenta osteopenia, es decir que solo el 48,3 % de nuestros pacientes presentaba una masa ósea normal al momento del estudio, lo que nos indica una incidencia elevada de osteoporosis en el hombre. La osteoporosis secundaria se presento en el 47.2 % de los pacientes del estudio, siendo las causas mas frecuentes el hipogonadismo, el consumo de corti-costeroides y el alcoholismo crónico
Con respecto al grupo etareo la edad promedio de los pacientes normales fue de 56.57 años (DS: 9.721) con rangos entre 36 y 75 años. En el grupo de pacientes con osteopenia la edad promedio fue de 57.68 años (DS: 9.873), rangos entre 35 y 78. Con respecto al grupo de pacientes osteoporoticos la edad promedio fue 60.71 años (DS: 10.228) (rangos entre 35 y 82 años), siendo el grupo etareo mas frecuente el comprendido entre 60 y 69 años con 36.1 %.
Nuestros resultados reafirman las conclusiones de estudios previos debido a que el peso en los pacientes osteoporoticos fue menor. El peso promedio de los pacientes normales fue de 77.05 Kg (DS:
11.666) con rangos entre 57 y 103 Kg y en los pacientes osteoporoticos la edad promedio fue 71.16 Kg (DS: 13.131) rangos entre 42 y 124 Kg. De igual forma el índice de masa corporal también fue menor en los pacientes osteoporoticos, el IMC promedio de los pacientes normales fue de 27.205 Kg/cm2 (DS: 3.5552) con rangos entre 20 y 35.9 Kg/cm2. Y en los pacientes osteoporoticos el IMC promedio fue 25.239 Kg/cm2 (DS: 3.8146) rangos entre 17 y 36.1 Kg/cm2.
En lo referente a la talla de los diferentes grupos de pacientes, encontramos que la mayor cantidad de pacientes se encuentra entre 160 y 169 cm con un
46.5 % en hombres normales, 43.6 % en pacientes con osteopenia y 44.2 % de los hombres osteoporoticos. La talla promedio de los pacientes normales fue de 1.6791 cm (DS: 0.0723) con rangos entre 145 y 183 cm. En el grupo de pacientes con osteopenia la talla promedio fue de 1.6715 cm (DS: 0.0825), rangos entre 143 y 185. Y en el grupo de pacientes osteoporoticos la talla promedio fue 1.6715 cm (DS: 0.0830) rangos entre 145 y 185 cm.
Así como los resultados de estudios previos determinan que el habito tabaquico es un factor predisponente de osteoporosis en el hombre, en nuestros resultados este habito fue mas frecuente en los hombres osteoporoticos. El habito tabaquito se presento en el 41.8 % de los hombres con densitometría normal (23.7 % fumadores habituales y 14.5 exfumadores), mientras que en los parientes con osteopenia este habito se presento en el 47.4 % (28.6 de fumadores habituales y 18.8 % de exfumadores). En el grupo de hombres con osteoporosis este habito se presento en el 58.2 % (49.3 de fumadores habituales y 8.9 % de exfumadores).
El calcio sérico promedio para los pacientes con densidad mineral ósea normal fue de 9.0665 mg% (DS: 0.6139) con un rango de 7.90 -10.70 mg %; en los pacientes con osteopenia fue de 9.1631 mg % (DS:
0.5534) con rangos de 7.30 -11.00 mg %. Por su parte en los pacientes con osteoporosis el promedio fue de 9.2346 mg% (DS: 0.5121) con rangos de 7.30 - 10.40 mg %. Los resultados de calcio urinario en 24 horas determinan para los pacientes con densidad mineral ósea normal fue de 178.37 mg (DS: 133.44) con un rango de 100 - 486 mg; en los pacientes con osteopenia fue de 190.75 mg (DS: 169.34) con rangos de 88 -1560 mg. Por su parte en los pacientes con osteoporosis el promedio fue de 184.55 mg (DS: 142.80) con rangos de 150 -1210 mg. La hipercalciuria se presento en el 20.7 % de los hombres con osteoporosis, 24.5 de los hombres con osteopenia y el 30.6 % de los normales. El fósforo sérico resulto mayor en el grupo de hombres con osteoporosis (el promedio fue de 3.4411 (DS: 0.9017) con rangos de 2.00 - 10.20 mg %) que en los otros grupos (parra los pacientes con densidad mineral ósea normal de 3.0694 mg% (DS: 0.4762) con un rango de 2.10 - 4.70 mg % y en los pacientes con osteopenia fue de 3.3013 mg % (DS: 0.7004) con rangos de 1.60 - 6.50 mg %. Estos resultados entre los diferentes grupos con relación al calcio y fósforo sérico y calcio urinario no mostraron diferencias estadísticamente significativas.
Si fueron significativas las diferencias en el fósforo urinario de 24 horas entre los hombres osteo-poroticos (osteoporosis el promedio fue de 622.89 mg (DS: 350.92) con rangos de 10.40 -1490 mg.) y los controles (promedio de 532.41 mg (DS: 330.62) con un rango de 10.11 - 1900 mg).
En nuestro estudio no se lograron encontrar diferencias estadísticamente significativas entre los diversos grupos de pacientes con relación al valor de proteínas totales, albúmina, globulina, colesterol total, triglicéridos y creatinina.
Al evaluar los niveles hormonales encontramos que el valor de testosterona total promedio para los pacientes con densidad mineral ósea normal fue de 518.23 ng/ml (DS: 215.71); En los pacientes con osteopenia fue: 455.47 ng/ml (DS: 214.00) con rangos de 106 - 1670 ng/ml y en los hombres con osteoporosis el promedio fue de 460.50 ng/ml (DS: 217.69). El hipogonadismo bioquímico se presento en el 24,4 % de los hombres osteoporoticos. Los resultados de estradiol resultaron en diferencias muy marcadas entre los grupos siendo muy inferior en los hombres osteoporoticos. El valor de estradiol promedio para los pacientes con densidad mineral ósea normal fue de 43.784 pg/ml (DS: 26.077) con un rango de 9 -132 pg/ml; en los pacientes con osteopenia fue: 36.682 pg/ml (DS: 22.914) con rangos de 2 -121 pg/ml. Por su parte en los pacientes con osteoporosis el promedio fue de 32.26 pg/ml (DS: 22.591) con rangos de 0.89 -106 pg/ml. El hipoestrogenismo se presento en el 61.8 % (33 pacientes) de los hombres osteoporoticos contra 34.6 % de los hombres normales.
Los resultados de la globulina fijadora de hormona sexual de nuestro estudio determinan un valor de SHBG promedio para los pacientes con densidad mineral ósea normal de 95.331 nmol/L (DS: 44.179) con un rango de 14.1 - 252 nmol/L; en los pacientes con osteopenia fue: 92.261 nmol/L (DS: 48.216) con rangos de 21 - 209 nmol/L. Por su parte en los pacientes con osteoporosis el promedio fue de 101.31 nmol/L (DS: 43.030) con rangos de 14.1 - 252 nmol/L.
En virtud de estos resultados los autores proponemos una nueva escala de para valorar el riesgo de osteoporosis en el hombre:
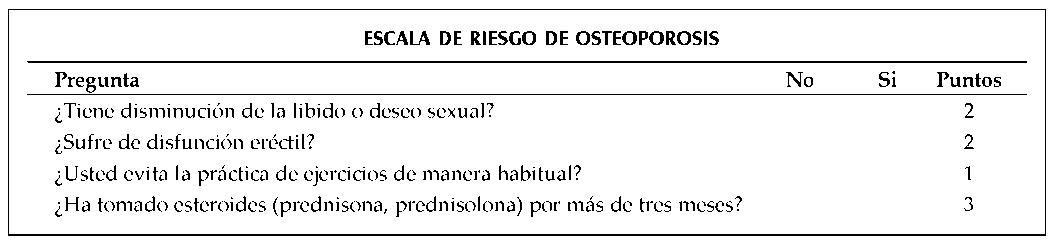

REFERENCIAS
1. MELTON LJ 3RD, ALOTHMAN KI, KHOSLA S, ACHENBACH SJ, OBERG AL, ZINCKE H. Fracture risk following bilateral orchiectomy. J Bone Miner Res 1998 Dec; 13(12): 1915-23.
2. PRESTON DM, TORRENS JI, HARDING P, HOWARD RS, DUNCAN WE, MCLEOD DG. Androgen deprivation in men with prostate cancer is associated with an increased rate of bone loss. The Journal Of Urology.
3. ROBERT W. ROSS; ERIC J. SMALL Osteoporosis in Men Treated With Androgen Deprivation Therapy for Prostate Cancer. The Journal Of Urology 2002; 167: 1952-1956.
4. HARRY W. DANIELL; STEPHEN R. DUNN; DAVID W. FERGUSON; GREGORY LOMAS; ZIAD NIAZI; P. TRYG STRATTE. Progressive osteoporosis during androgen deprivation therapy for prostate cancer. THE JOURNAL OF UROLOGY 2000; 163: 181.
5. BARRETT-CONNOR E The economic and human costs of osteoporotic fracture. Am J Med 1998(Suppl 2A): 3S-8S.
6. BONJOUR JP; BURCKHARDT P; DAMBACHER M; KRAENZLIN ME; WIMPFHEIMER C. Epidemiology of osteoporosis. Schweiz Med Wochenschr 1997 Apr 19; 127(16): 659-67.
7. MELTON 3RD LJ, EDDY DM, JONHSTON JR CC. Screening for osteoporosis. Ann Intern Med 1990; 112: 516 -28.
8. GLYNN NW; MEILAHN EN; CHARRON M; ANDERSON SJ; KULLER LH; CAULEY JA. Determinants of bone mineral density in older men. J Bone Miner Res 1995 Nov; 10(11): 1769-77
9. EBELING PR. Osteoporosis in men: new insights into aetiology, pathogenesis, prevention and management. Drugs and Aging 1998; 13: 421-434.
10. ORWOLL ES, BEVAN L, PHIPPS KR. Determinants of bone mineral density in older men. Osteoporos Int 2000; 11(10): 815-21.
11. NGUYEN TV, EISMAN JA, KELLY PJ, et al. Risk factors for osteoporotic fractures in elderly men. Am J Epidemiol. 1996; 144: 258-261.
12. PACINI S; ATERINI S; RUGGIERO M; GULISANO M. Bone mineral density and anthropometric measures in normal and osteoporotic men. Ital J Anat Embryol 1999 Oct-Dec; 104(4): 195-200.
13. COHEN-SOLAL ME; BAUDOIN C; OMOURI M; KUNTZ D; DE VERNEJOUL MC. Bone mass in middle-aged osteoporotic men and their relatives: familial effect. J Bone Miner Res 1998 Dec; 13(12): 1909-14.
14. HUUSKONEN J, VAISANEN SB, KROGER H, JURVELIN C, BOUCHARD C, ALHAVA E, RAURA-
MAA R. Determinants of bone mineral density in middle aged men: a population-based study Osteoporos Int 2000; 702-708.
15. MURPHY S, KHAW KT, CASSIDY A, COMPSTON JE. Sex hormones and bone mineral density in elderly men. Bone Miner 1993 Feb; 20(2): 133-40.
16. CENTER JR; NGUYEN TV; SAMBROOK PN; EISMAN JA. Hormonal and biochemical parameters in the determination of osteoporosis in elderly men. J Clin Endocrinol Metab 1999 Oct; 84(10): 3626-35.
17. STEPAN JJ, LACHMAN M, ZVERINA J, PACOVSKY V, BAYLINK D. Castrated men exhibit bone loss: effect of calcitonin treatment on biochemical indices of bone remodeling. J Clin Endocrinol Metab 1989; 69: 523-7.
18. KHAW S, KT, CASSIDY A, COMPSTON JE. Sex hormones and bone mineral density in elderly men. Bone Miner 1993 Feb; 20(2): 133-40.
19. LEGRAND E, HEDDE C, GALLOIS Y, DEGASNE I, BOUX DE CASSON F, MATHIEU E, BASLE M, CHAPPARD D, AUDRAN M. Osteoporosis in men: a potential role for the sex hormone binding globulin. Bone 2001 Jul; 29(1): 90-5.
20. KENNY AM; PRESTWOOD KM; MARCELLO KM; RAISZ LG Determinants of bone density in healthy older men with low testosterone levels J Gerontol A Biol Sci Med Sci 2000 Sep; 55(9): M492-7.
21. SCOPACASA F, HOROWITZ M, WISHART JM, MORRIS HA, CHATTERTON BE, NEED AG. The relation between bone density, free androgen index, and estradiol in men 60 to 70 years old. Bone 2000; 27: 145-149.
22. VANDERSCHUEREN D, BOONEN S, BOUILLON R. Acción de los andrógenos versus estrógenos en la homeostasis esquelética del varón. Bone 1998; 23: 391-394.
23. GILLBERG P, JOHANSSON AG, LJUNGHALL S. Decreased estradiol levels and free androgen index and elevated sex hormone-binding globulin levels in male idiopathic osteoporosis. Calcif Tissue Int 1999; 64: 209-213.
24. CARLSEN CG; SOERENSEN TH; ERIKSEN EF. Prevalence of low serum estradiol levels in male osteoporosis. Osteoporos Int 2000; 11(8): 697-701.
25. PERIS P, GUAÑABENS N, MONEGAL A, SURIS X, ÁLVAREZ L, MARTÍNEZ DE OSABA MJ et al. Aetiology and presenting symptoms in male osteoporosis. Br J Rheumatol 1995; 34: 936-41.
26. EASTELL R, BOYLE I, COMPSTON J, et al. Management of male osteoporosis: report fo the UK concensus group. Q J Med. 1998; 91: 71-92.
27. FAULKNER KG, ORWOLL E. Use of the WHO criterion in men: is -2.5 the right number?. J Bone Miner Res. 2000; 15(suppl 1): S144.
28. COHEN S, LEVY RM, KELLER M, BOLING E, EMKEY RD, GREENWALD M et al. Risedronate therapy prevents corticosteroid-induced bone loss. Arthritis Rheum 1999; 42: 2309-18.
29. RINGE J. D., H. FABER AND A. DORST. Alendronate Treatment of Established Primary Osteoporosis in Men: Results of a 2-Year Prospective Study. The Journal of Clinical Endocrinology & Metabolism 2001;Vol. 86, No. 11 5252-5255.
30. GONNELLI S, CEPOLLARO C, MONTAGNANI A, et al. Alendronate treatment in men with primary osteoporosis: a 3-year longitudinal study. J Bone Miner Res. 2000; 15(suppl 1): S228.
31. ORWOLL E, ETTINGER M, WEISS S, MILLER P, KENDLER D, GRAHAM J et al. Alendronate for the treatment of osteoporosis in men. N Engl J Med 2000; 343: 604-10.
Dr. Ricardo Szemat Nikolajenko
Urólogo Jefe y Director del Postgrado
Dr. Alejandro Egea
Urólogo residente Hospital General El Llanito "Dr. Domingo Luciani"
Dr. Ricardo Szemat Daher
Médico Interno
MEDICINA SEXUAL EN VENEZUELA
La Medicina sexual, es un concepto nuevo, donde se pretende agrupar en un solo nombre todo aquello que tenga una connotación en la esfera sexual y que asocie a mujeres y hombres. "Existen derechos fundamentales de los individuos incluyéndole derecho a la salud sexual y ala capacidad de disfrutar y controlar la conducta sexual y reproductiva de acuerdo con una ética personal y social" (OMS 1974). Los individuos con alteraciones de la función sexual tienen derecho a diagnóstico y a tratamientos médicos adecuados.
La medicina sexual puede ser dividida en: deseo, excitación, erección, eyaculadón y orgasmo, donde cada una puede sufrir distintas alteradones, las cuales se agrupan de la siguiente manera:
A) Alteraciones del deseo: hiperadividad, hipoac-tividad y aversión sexual.
B) Alteraciones de la erección: disfunción eréctil, erección prolongada (priapismo) y deformidad erédil.
C) Alteraciones en la eyaculadón: eyaculadón rápida, eyaculadón retrógrada, aneyaculación y eyaculadón retrasada.
D) Alteraciones del orgasmo: anorgasmia y orgasmo retrasado.
E) Alteraciones en la sensación: hiposensibilidad, hipersensibilidad y relaciones sexuales dolorosas.
EPIDEMIOLOGÍA
La Disfunción Eréctil (DE) es un problema muy común en la pradica médica que afeda espedal-mente en la edad adulta y que generalmente se asocia a otras patologías o estados co-mórbidos.1 Antiguamente, el término de "impotencia" se le atribuía a un hechizo o magia satánica2 y en la cultura europea una erección fuerte se le atribuía a un hombre fuerte;3 sin embargo, esto es un problema que ha ido aumentando en la pobladón masculina ya sea por el mayor interés que se le ha dado a este tema o porque mayor cantidad de hombres han consultado por esta causa, problema que afecta a millones de personas en todo el mundo y que resulta complicado estimar en forma segura la prevalenda de esta patología por la diversas clasificadones establecidas en la amplia literatura a nivel mundial.4
Se define DE como la falla persistente para desarrollar y mantener una erecdón lo suficientemente rígida para la penetración durante la reladón sexual.5 Sus causas son múltiples tales como psicológicas, neurológicas, endocrinológicas, vasculares, traumáticas e iatrogénicas, aunque está bien establecido que el 80-90 % de la etiología de la DE es orgánica;6 de igual manera se han descrito fadores de riesgo potenciales para la DE como hábitos tabáquicos, hipertensión arterial, hiperlipidemia y Diabetes Mellitus en presencia de enfermedad vascular,5 así como también la edad, depresión y el estilo de vida.7
La prevalencia de la DE en estudios de varias comunidades varía desde 7 hasta 52% la cual se incrementa con la edad;8 en México la prevalencia varía dependiendo del grupo etáreo, con 50% entre 40 y 50 años, 54% entre 51 y 60 años y 80% entre 61 y 70 años;36 en este país, Ugarte y Barroso, hallaron una tasa de DE igual a 55% en una muestra de 1200 hombres con el mismo rango de edad y de 9,7% entre 1800 hombres de 18 a 40 años. En la Argentina, una investigadón hecha de 2499 hombres de 40 75 años de edad durante una campaña de detecdón de Cáncer de Próstata en Buenos aires, revelo una prevalencia de DE igual a 41,7%. En Brasil un estudio realizado sobre DE en el año 2000 en una muestra de 1286 hombres de 40-70 años la prevalencia de DE fue de 48,8%. En Caracas- Venezuela, Szemat y Col, en 8 diferentes pesquisas de Cáncer de Próstata (1997-2003) realizadas en el Servicio de Urología, del Hospital Dr. Domingo Luciani , con más de 10.000 hombres pesquisados, encontraron un 55,25% de DE, en la pobladón entre 40 y 70años.73 en EUA la DE es tres (3) veces más probable entre los 50 y 59 años de
edad que entre los 18 y 29 años;37 en Europa igualmente se evidenda un aumento pronunciado de la DE relacionado con la edad de 2,3% a los 30 años a 53,4% a los 80 años38 y en América del Sur, la prevalencia de DE el riesgo de DE es 3 veces mayor entre los 60-69 años y 6 veces mayor riesgo en los pacientes mayores de 70 años;39 actualmente se cuenta con diversidad de cuestionarios para el estudio de la prevalencia de esta patología, de los cuales el más utilizado por su fádl entendimiento y gran predsión es el índice Internacional de Fundón Erédil-5 (IIFE-5). El estudio realizado en Massachussets sobre la inddencia de esta patología en hombres entre 40 a 69 años conduyó con 25,9 casos por 1000 hombres/año, con un incremento anual de 12,4 casos por 1000 hombres/año, 29,4 y 46,4 entre los grupos etáreos entre 40-
49, 50-59 y 60-69 años respedivamente. En este estudio igualmente se evidendó mayor riesgo para DE en hombres con bajo nivel de educadón, (la cual no está del todo clara su asociación con la DE, tomando en cuenta que este tipo de pacientes están reladonados con otros estados co-mórbidos tales como diabetes, hábitos tabáquicos acentuados e hipertensión arterial),20 diabetes mellitus, enfermedades cardíacas e hipertensión arterial.9
En Brasil, se realizó un estudio similar al anterior en el cual se estimó la inddencia de DE en hombres entre 40 y 69 años la cual fué de 65,6 casos por 1000 personas/año y se incrementa a 33,3, 53,7 y 189, 5 casos por 1000 personas/año para hombres con grupo etáreo entre 40-49 años, 50-59 y 60-69 años respedivamente; los pacientes con nivel de educación baja, con diabetes mellitus (DM), hipertensión arterial (HTA) e hiperplasia prostática benigna (HPB), presentaron mayor riesgo de desarrollar DE.10 Otros estudios de este país igualmente utilizan el IIFE-5 para la determinación de la prevalenda de la DE; el score variaba entre 1 y 25 puntos clasificando como severa de 1 a 7 puntos, moderada de 8 a 11, leve a moderada , 12 a
16, leve, 17 a 21 puntos y sin DE , 22 a 25 puntos. La edad promedio fué de 60,7 años con rangos entre 40 y 90 años. La prevalenda general de todos los grados de DE fue de 53,9%, la división por grados fue de 21,5% (leve), 14,1% (leve a moderada), moderada (6,3%) y severa (11,9%). La prevalencia por grupo etáreo fué 36,4% (entre 40-49 años), 42,5% (50-59), 58,1% (60-69), 79,4% (70-79) y mayor de 80 años 100% de DE, demostrando daramente en este trabajo la ele-vadón de la prevalencia en la DE a medida que aumenta la edad e insistiendo en el uso del IIFE-5 como método fádl de utilizar el cual evalúa las condiciones de la función erédil en un gran número de hombres.19
De igual manera, en Colombia, Ecuador y Venezuela se realizó un estudio de prevalencia de DE (DENSA), la cual fue registrada en 53,4 % combinando los grados de leve, moderada y severa, presentando las 2 últimas una prevalenda del 19,8%.11 La DE severa fue mayor en hombres por endma de los 79 años (31,9%), entre 70 y 79 años, la incidenda fue del 17,2% y entre 40 y 49 años, menos del 3%, con diversas condiciones médicas que aumenta el riesgo de DE como HTA, HPB, DM, así como diversos fármacos.
Estados Unidos también ha sido objeto de estudio por esta patología con una prevalencia del 39,4% dividido en "ocasional" (9,6%), "a veces" (8,9%) y DE completa en 18,6%. Estas cifras se incrementan con la edad, presentando DE en 2% de los hombres entre 40 y 49 años hasta 44,9% entre las edades de 70 y 79 años. Los estados co-mórbidos registrados fueron parecidos a los estudios descritos anteriormente tales como HTA, enfermedad cardiaca isquémica, enfermedad vascular periférica y DM. El 40% de los parientes con DM mayores de 60 años presentó DE completa.13
En estudios multinacionales de Brasil, Italia, Japón y Malasia la prevalencia para DE moderada o severa fue del 34% en Japón, 22% en Malasia, 17% en Italia y 15% en Brasil. La prevalencia por edades fué del 9% para hombres entre 40-44 años, del 12% entre 45-49 años, 18% entre 50-54 años, 29% entre 55-59 años, 38% entre 60-64 años y del 54% entre 65-70 años. Al igual que el resto de los estudios descritos, el riesgo de DE se vio incrementado por la presencia de DM, enfermedades del corazón, síntomas del trado urinario bajo, fumadores habituales y depresión, e inversamente asodado con el nivel de educación, el hábito tabáquico y la adividad física.19 Sin embargo la epidemiología de la DE en España no varía tanto en lo que a prevalenda se refiere, reportando valores del 18,9% en un estudio realizado en más de 2400 pacientes y determinados por el índice Internacional de Función Erédil y asodados con los factores de riesgo descritos para los trabajos ya descritos.20 La DE en Turquía reportó una prevalencia del 69,2% y clasificado en leve (33,2%), moderado (27,5%) y severa (8,5%) presentando asociación principalmente con la edad. Otras asociaciones no menos importantes
fueron con el bajo nivel de educación, desempleo, hipertensión arterial, diabetes, problemas de próstata o síntomas del tracto urinario bajo.34 En Bélgica, las cifras de prevalencia para la DE se dividieron igualmente como severa (10,1%), moderada (24,7%) y leve (26,6%) con 38,7% que no reportaron DE.35 En la Unidad de Medicina Sexual del Servicio de Urología del Hospital Domingo Luciani, para el año 1999 se entrevistaron 717 pacientes entre 40 y 70 años reportando las siguientes cifras por grupo etáreo (presentado en SLAIS, Río de Janeiro, Brazil):73
- < de 40 años: 52% de Eyaculadón prematura (EP) y 32% de DE.
- < de 50 años: 45% de parientes con EP y 44% de DE.
- > de 50 años: 15% con EP y 64% con DE.
Podemos ver con claridad como con la edad la De aumenta (32%-44%-64%) y la EP (52%-45%-15%) disminuye.
El tiempo en este trabajo para definir eyaculadón precoz, fue de 3 minutos posterior a la penetración. De estos 717 pacientes, 112 eran diabéticos (15,6%) de los cuales, el 74% que presentaban este trastorno, padecían de DE.
De igual manera, en esta misma unidad, para el año 2001, se entrevistaron 955 pacientes (Presentado en la ISSIR, Montreal ,2002)73 de los cuales, el 79,68% de los pacientes pertenecían a los grupos etéreos entre los 40 y 69 años, y clasificados con los siguientes porcentajes entre los grupos etéreos: el grupo etáreo entre 40 y 49 años, 24,58%; entre 50 y 59 años, 28,54% y entre 60 y 69 años, 26,56%.41
De estos pacientes, el 13,87% eran profesionales universitarios, el 15,27% se dedicaban a las ventas y el 16,07% a la industria del servicio. Dentro de la encuesta, fueron interrogados sobre sus hábitos, como la masturbación, evidenciándose que el 34,30% se masturbaba 1-2 veces por semana, el 7,40% interdiaria y el 3,20% 5 veces a la semana. El 45,10% negaba masturbarse y el 10,% no contestó a esta pregunta. La cantidad de parejas sexuales varió entre los encuestados; el 42,55% presentaron 7 ó más parejas en toda su vida, el 20,57% 4 a 6 parejas y el 25,01% 1 a 3 parejas. El 11,06% no respondieron a este item.41
Los motivos de consulta más comunes fueron:41
- Disfunción eréctil: 70,6%.
- Eyaculadón precoz: 11,8%.
- Disfunción Eréctil + Eyaculadón Precoz: 9,8%
- Otros: 7,8%
Los fadores de riesgo reportados con mayor fre-cuenda en esta unidad fueron:41
- Hipertensión arterial. 26.6%.
- Diabetes Mellitus:13,l%
- Enfermedad Coronaria: 4,4%
Dato curioso es el horario preferido por las personas encuestadas para la relación sexual, prefiriéndolo en la noche en el 38,90% y le es indiferente en el 25,45%. El 13,24% prefiere las mañanas y el 3,88% las tardes. De los pacientes encuestados, el 8,1% tuvieron reladones homosexuales.41
En el año 2002, se realiza nuevamente un estudio epidemiológico sobre los resultados de nuestra consulta de Medicina Sexual evidenciando que las patologías registradas se reportaron de la siguiente manera (Aceptado para su presentación en SLAIS, Cartagena, Colombia, Agosto 2003): Disfunción Erédil: 63,72%, Eyaculadón Prematura (EP) 29,41%, Disfunción Erédil + Eyaculadón Prematura 5,88% y otras causas 1,47%.
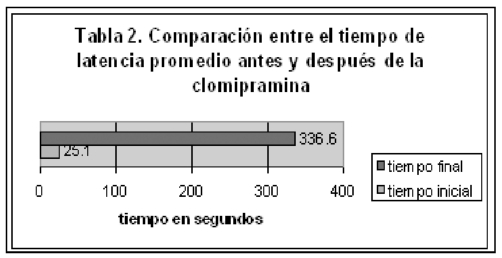
La disfundón sexual leve se evidenció en el 18,46%, leve a moderada en 43,07%, moderada 23,07% y severa en 15,38% de los pacientes. La asociación de la DE con estados co-mórbidos fué la siguiente: DE+ HTA: 22,30%, DE+ Diabetes Mellitus: 11,53% y DE+ DM+ HTA: 10,76%; el resto con DE sin estados co-mórbidos fué de 72 pacientes (55,41%) (Datos en vías de publicación).
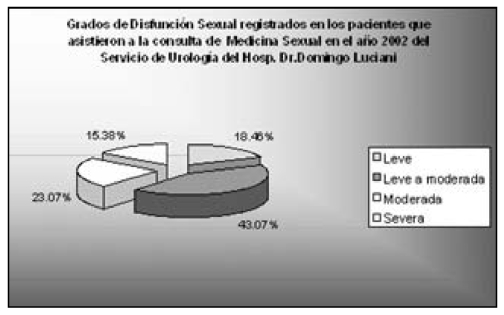
Las proyecciones en la incidencia ajustado para la edad de DE para el año 2025 se ubica entre 152 a 322 millones de pacientes, con un promedio de 170 millones de personas que podrían padecer de esta patología. Para Norteamérica se pronostica una incidencia de 21,1% para dicho año, para Centro & Sudamérica y el Caribe de 26,1%, Europa con 42,8%, Asia con 199,9%, Africa con 30,8% y Oceanía con 1,9%.40
Los determinantes o las causas de la DE se han modificado desde 1980 ya que anteriormente se le atribuía a las causas psicogénicas como los responsables del 90% de los pacientes con DE, concepto que ha cambiado en forma radical a favor de las causas orgánicas como determinantes para disfundón de la erección,12 con mayor predominio a las causas arteriales y todos los factores que puedan produdr riesgo cardiovascular tales como el hábito tabáquico, HTA, DM e hiperlipidemia.5
El hábito tabáquico ha demostrado tener aso-ciadón incierta con la DE cuando se comparan en fumadores con no fumadores; las afras reportadas indican una prevalencia de DE, 2,2% para los no fumadores y de 3,7% para los fumadores habituales.14 Estudios realizados en pacientes diabéticos fumadores reportan 30% de DE, 40% en los ex fumadores y 30% en los no fumadores;15 sin embargo el riesgo de fumar dgarrillos no está definido como causa direda de DE; según el estudio de Massachussets Male Aging Study (MMAS), el riego de padecer de DE aumenta en pacientes fumadores portadores de enfermedades cardiovasculares y bajo medicación para el corazón (del 14 al 41%), con anti-hipertensivos (del 7,5 al 21%) y con vasodilatadores (del 21 al 52%). Este estudio concluye la existenda de DE completa en el 11% de los fumadores y 9,3% de los no fumadores sin lograr determinar a ciencia cierta la relación direda del hábito tabáquico con la disfundón eréctil.16
Como dato adicional, en el Hospital Domingo Luciani, Caracas, Venezuela, en el servicio de Urología, se realizó un estudio sobre las dimensiones peneanas en la población venezolana, obteniendo que para el grupo en general, la longitud peneana promedio en fladdez fue de 9,5 cm, y del pene elon-gado fue de 12,7 cm. La circunferenda proximal promedio fue de 8,8 cm y la retroglanular fue de 8,2 cm; las mayores dimensiones fueron vistas en la raza negra, algo mayores que en la raza blanca y mestiza.58
DISFUNCIÓN ERÉCTIL Y HORMONAS
La asociadón de hormonas con DE también ha sido revisado en forma muy cuidadosa y detallada; en el estudio de MMAS se demostró que la testosterona tiene mayor importanda en la libido y la conduda sexual que en el proceso de la erecdón.16 En un estudio realizado en Inglaterra se examinó la asociadón entre la testosterona y la ausencia de erecciones concluyendo que esta hormona aumenta el interés sexual, aumenta la frecuencia de los actos sexuales y aumenta la frecuencia de las erecciones nocturnas, pero con poca influencia en las erecciones inducidas visualmente o por fantasías.17 Una disminución en la concentradón de testosterona circulante produce reducdón de la libido y potenda sexual, infertilidad, letargía, fatiga y disminudón en el volumen de la eyaculación.16 Sin embargo un estudio realizado en Lille, Franda, en el cual reportó los resultados de un despistaje endoaino en parientes con DE, en cada uno de los cuales se le determinaron valores de testosterona y a 451 pacientes se les determinó muestras para prolactina sérica solo en pacientes con bajo deseo sexual, ginecomastia o testosterona por debajo de 4 ng/cc. La prevalencia de niveles de testosterona por debajo de 4 ng/cc en pacientes con DE fue de 4% antes de los 50 años la cual se incrementa con la edad a 9% por encima de los 50 años;21 la prolactina se elevó en 5 pacientes con el descubrimiento de 1 proladinoma (estos resultados reportaron afras menores a los valores hallados hace 2 décadas donde la prolactina se elevaba por encima de 20 ng/cc en 1,86%). En base a estos resultados, este estudio concluye que debido a que la baja prevalencia de testosterona baja y de prolactina
elevada en parientes con DE, no se justifica su determinación de rutina, indicando que la determinación de testosterona en menores de 50 años debe ser realizada en casos de bajo deseo sexual y examen físico anormal, pero medida en todos los hombres mayores de 50 años con DE. Por el contrario, la prolactina debe ser medida solo en casos de bajo deseo sexual, ginecomastia y/o testosterona menor de 4 ng/cc,21 sin embargo, los resultados son divididos y a veces opuestos debido a que en un estudio realizado en Inglaterra, concluyen que la medición de testosterona sérica no contribuyen la evaluación de la potencia o de la libido y que los niveles séricos de testosterona no se relacionan con la edad, agregando que la corrección de los bajos niveles de la testosterona no mejoran el cuadro de DE o de la libido.22 En Brasil igualmente se han realizado estudios similares de pacientes con DE relacionados con la edad, así como con la prevalencia del grado de DE y la medición de los niveles de testosterona. La variación de los niveles de dicha hormona no fue estadísticamente significativo en cada grupo etáreo con DE, así como tampoco lo fue con los grados de DE y los niveles de testosterona total sérica; este estudio concluyó que existe una clara asociación de la DE con la edad pero no se evidenció una asociación consistente ni significativa entre DE y los niveles de testosterona total,23 resultados de características similares a otro estudio realizado en el mismo país en el cual la concentración sérica de la hormona fue similar en todos los grados de DE; no se evidenciaron diferencias de niveles de testosterona sérica en pacientes con y sin DE; solo un paciente presentó niveles subanormales de testosterona con DE; por lo tanto concluyen la falta de asociación entre niveles de testosterona total y DE.24
En un estudio presentado por Nickel y col, 1984, la incidencia global de endocrinopatia entre pacientes con DE fue de 17,5%. En series contemporáneas varia entre 1,7% y 35% (Johnson & Jarrow, 1992). Estas diferencias se deben a que las poblaciones vistas (Urólogos vs. Endocrinólogos) son diferentes. En una pesquisa de 330 hombres referidos a la practica Urológica se les realizó testosterona total(TT) y encontraron que 10 tenían una TT baja (240-950 pg/dl) , en estos pacientes se repitieron los estudios incluyendo TT, biodisponible, Testosterona Libre(TL), 9-30ng/dl, además de hormonas pituitarias; LH, FSH, Prolactina, esto los llevo a descubrir 7 pacientes con hipogonadismo verdadero, 2,1% ,se encontró una atrofia testicular en 5 de los 7 pacientes, 6 reportaron disminución de la libido, todos los pacientes tenían ó atrofia testicular ó disminución de la libido, en este sentido la pesquisa se hace costosa.
Algunos piensan que basta con una buena historia y un buen examen físico (disminución de la libido y/ó atrofia testicular estos pacientes necesitan ser evaluados. Govier en 1996, chequea de rutina los niveles hormonales, en hombres que consultan por disfundón sexual. Definen el hipogonadismo, con 2 exámenes de TT en niveles anormales y encontraron que de 268 hombres, 42 tenían un hipogonadismo, 15,6%. La disminución de la libido y la atrofia testicular, no predice el hipogonadismo en sus parientes. Sin embargo una pesquisa especifica, con una fracción libre de testosterona, normal (9-30 ng/dl) les ahorra a 50% de los pacientes una evaluación endocrinológica. El autor concluye que una pesquisa inicial usando la fracción libre de la testosterona, disminuye en un 50% una evaluación endocrina innecesaria. La prolactina se recomienda en pacientes con hipogonadismo documentado y/o si presenta historia de disminución de la libido.
Buvat en 1997, pesquiso 1022 hombres que consultaron por DE y concluyo que mas del 40% de los pacientes con hipogonadismo se hubiesen perdido si se les hubiera aplicado la metodología de Johnson & Jarrow (Libido baja y/o atrofia testicular). Buvat en 1997 aboga que la edad es un factor discriminatorio importante en una pesquisa costo-efectividad. Recomienda; que un paciente con menos de 50 años, se le debe hacer un perfil hormonal solo si reúne los criterios de Johnson & Jarrow (Atrofia testicular y/o disminución de la libido), y los pacientes con DE y con más de 50 años se le debe hacer test hormonales de rutina (TT y TL).E1 panel de expertos internacionales en la primera consulta de DE en París, 1999 recomendaban como test iniciales; Testosterona total, glucosa rápida ó hemoglobina glicosilada y lípidos.
Refiere el Dr. Broderick, que cuando el paciente llega a su consultorio ya tiene una TT (normal 300-1000 ng/dl), debido a que los resultados pueden ser confusos en el obeso y en el paciente más viejo (aumento de la SHBG) ,recomienda medir la testosterona libre (TL),ella estima mejor la función gonadal. Solo los hombres con un hipogonadismo primario documentado, van a recibir terapia de reemplazo, con testosterona. Si existe un hipogonadismo secundario es mejor consultar con el departamento de endocrinología para estudiar este paciente en profundidad.
En un numero pequeño de parientes, la DE es la manifestación inicial de una enfermedad seria como es un tumor proladino secretante. Una prolactina > de 22 ng/ml.
Puede bajar la secreción de testosterona a través de la inhibición de la LHRH por el hipotálamo y esto resulta en DE. A pesar que la incidencia de estos tumores es baja, más del 90% de los pacientes, tienen impotencia y una disminución del la libido como queja importante.
DIÁBETES MELLITUS Y DISFUNCIÓN ERÉCTIL
Con respecto a la Diabetes Mellitus, es, de todas las enfermedades crónicas, la que se asocia de un modo más constante y característico con la DE. En un estudio realizado en Arabia Saudita se evaluaron 562 hombres con DM no insulino dependiente, con una edad promedio de 53 años; de ellos, el 86,1% presentaron algún grado de DE reportado como leve en un 7,7%, moderado en un 29,4% y severa en 49,1%. La prevalencia de DE fue del 25% en pacientes menores de 50 años, incrementándose a 75% en mayores de 50 años. Los pacientes mal controlados desde el punto de vista metabólico presentaron 12 veces más riesgo de DE que los pacientes bien controlados.18 Desde Julio 1999 a Febrero de 2001, de 717 pacientes en nuestra consulta de Disfundón sexual masculina, 112 resultaron diabéticos (16,0%), con edades entre 30 y 78 años (promedio 56,0+10,5 años). De este grupo que acudieron, 7 parientes no se sabían diabéticos, de ellos 6 consultaron por DE. El motivo de consulta en 74% de los casos fue DE (50% de DE en el grupo de no diabéticos), 16% de eyaculación precoz + DE (12% en el no diabético), solo 4,5% acudió con EP sola (28,4% en el grupo no DM). Otros factores de riesgo para disfundón sexual masculina en este grupo: 8% de enfermedad coronaria (3,6% en el grupo no diabético), Hiperlipemia en 46% ( 31% en el grupo sin Diabetes), Hipertensión Arterial y tabaquismo fue similar en ambos grupos (30% vs27% y 21% vs. 24% respectivamente. 25% de los pacientes diabéticos, refirieron escasa cantidad de liquido seminal en su eyaculado (14% en el grupo sin diabetes). De 14 % de pacientes con Aneyaculadón, sin antecedentes de cirugía Prostática, 60% son Diabéticos. La DE puede ser la manera de presentadón clínica de la Diabetes. En el grupo controlado en el año 2001 en nuestra consulta especializada de Medicina Sexual, el grupo de Diabéticos con DE, que acudió a nuestra consulta fue de 13%.
En el grupo controlado en el año 2002, encontramos un 12% de paciente diabéticos que consultaron con DE y un 11% eran diabéticos y tenían asociada una Hipertensión arterial.
Hipertensión Arterial y DE
La prevalencia y la severidad de la hipertensión arterial (HTA) en pacientes con DE ha sido estudiada y evaluada por la relación existente entre ambas patologías; diversos estudios han demostrado mayor prevalencia de DE en pacientes con HTA que en el resto de la población.41'42 En un estudio realizado en Dinamarca, Jensen y col. estudiaron a 101 pacientes masculinos que sufrían de HTA y encontraron que el 27% de ellos presentaban DE, de los cuales, el 89% era causado por disfunción arterial o cambios vasculares arteriales, probablemente por ateroesclerosis.42 Es bien sabido que la HTA per se es causante de DE; sin embargo el tratamiento de la HTA también es afeda negativamente en la fundón sexual exacerbando la incidencia de DE.43 Entre las drogas anti-hipertensivas que influyen en la presencia de DE están:
Simpaticolíticos de acción central.
Beta-bloqueantes.
Bloqueantes de los canales de calcio.
Inhibidores de la enzima convertidota (datos
limitados).
Por lo tanto al momento de la indicación de una terapia de drogas antihipertensivas es importante evaluar los beneficios y riesgos de cada uno de ellos así como su riesgo potencial de producir DE.43
En un estudio realizado en Londres, Mikhailidis y col. la incidencia de DE en pacientes con HTA fue de 14,4% e igualmente confirman que la terapia anti-hipertensiva aumenta la incidencia de DE.44
Otras enfermedades y DE
Diversas enfermedades se han asociado a DE tales como el Síndrome de Parkinson, el cual se relaciona con DE en un 60%, la esclerosis múltiple en un 40 a 80%, la insuficiencia renal crónica en 40% ó más y niveles de colesterol total elevado aumentan el riesgo de DE en 1,32 veces más que el resto de la población normal.
De igual manera se ha visto reladón de DE con depresión así como el tratamiento de esta, con Sertralina (2,5% de DE) y Paroxetina (6,4% de DE).
Szemat y Col, en su estudio del año 1999-2001, encontraron un 34% de parientes que presentaban rasgos de estrés, ansiedad ó personalidad depresiva.
Diversas enfermedades se han asociado a DE tales como la enfermedad de Parkinson, el cual se relaciona con DE en un 60%.
Disfunción Sexual Masculina y Esclerosis Múltiple. Se realiza una revisión de Esclerosis múltiple (EM) y DE, nos dice que el 91% de los pacientes varones experimentó cambios en su vida sexual siendo los trastornos de la erección (62%) los más frecuentes. Vas.75 En otro estudio realizado de 217 pacientes el 75% de los varones se quejo de cierta DE.77 En un estudio reciente sobre 108 pacientes no seleccionados afectados de EM confirmada se encontró 73,1% de disfundón sexual.78 En el estudio de Minderhoud y colaboradores, el 71,4% de los varones presentaron algún problema sexual, contra 19,6% de los pacientes control. El estudio de Hennessey, el 82% de los varones reportaron deterioro de la actividad sexual luego del diagnostico.85 En el estudio realizado por los Dres. Dicapua -Szemat y Colaboradores, 2002, en el Servicio de Urología del Hospital Dr. Domingo Luciani,77 se revisaron 22 pacientes; 14 mujeres (63,6%) y 8 Hombres (36,4%) edades comprendidas entre 25 y 53 años (37,7-+ 9,4). En la esfera sexual de la mujer con EM, el 43% de las mujeres considero tener algún problema sexual, pero solo el 28,6% considero que su pareja no estaba satisfecha con su rendimiento sexual. El 35,7% respondió que su deseo sexual estaba disminuido contra un 50,0% que respondió que no había variado y un 42,9% que había disminuido. El 35.7% de las mujeres respondió no lograr un orgasmo y un 42,9% considero que se le había hecho más difícil llegar al orgasmo, con 35,7% de las mujeres que respondieron que no lograban llegar al orgasmo igual que antes. La debilidad o parálisis muscular junto con las contracturas, la fatiga y la disfundón vesical e intestinal fueron los aspectos mas frecuentes que entorpecían con la actividad sexual.
El 42,9% de las mujeres respondió tener disminución ó ausenda de la libido así como alteración de la sensibilidad genital. El 28,6% respondió tener falta relubricadón, el 28,6% respondió tener disminución de la frecuenda ó intensidad del orgasmo. Solo el 14,3% de las mujeres tuvieron dificultad para la exdtadón. Se evaluó el cuestionario de índice de Fundón Sexual Femenina (FSFI), que evalúa el deseo sexual, la exdtadón sexual, la lubricación, el orgasmo, la satisfacdón sexual personal, de pareja y el dolor. Según este cuestionario 21,4% no tenían disfunción sexual, 9 mujeres (64,3%) presentaban una disfundón sexual leve y 2 mujeres presentaron una disfundón sexual moderada, ninguna mujer presentó una disfundón sexual severa. El parámetro mas afedado fue el orgasmo, luego la satisfacdón sexual, luego el deseo y excitación sexual por igual, luego dolor y el menos afedado fue el de la lubricadón.
En los hombres el 87,5% mantenían relaciones sexuales y todos consideraron tener problemas sexuales con un promedio de evolución de 41.'+ 41 -s Meses2-120 La mitad de los parientes consideraron que su pareja no estaba satisfecha con su desempeño sexual. En el 87,5% de los pacientes la actividad sexual había disminuido y en la misma proporción la actividad coital había disminuido. El deseo sexual se encontraba normal ó bajo en el 62,5% de los pacientes. El 25% de los pacientes no lograban un orgasmo y al 87,5% de los pacientes se les había hecho difícil llegar al orgasmo. Ellos consideraron que la debilidad ó parálisis muscular, la fatiga y la disfundón vesical e intestinal entorpecían con la actividad sexual. Todos los parientes presentaron disminución de la erección y solo 25% presentaban erecciones rígidas. El 75% presentaban erecciones durante el sueño y todos presentaban erecciones en las mañanas al despertarse. La mitad presentaban erecciones con la masturbación y solo el 12,5% de los pacientes presentaban erecciones al ver películas eróticas. El 75% de los pacientes no tenían erecciones firmes desde el inicio del acto sexual por lo que no les permitía la penetración. Ningún paciente era capaz de mantener la erección rígida hasta terminar el ado sexual. Todos manifestaron necesitar mucha concentradón para poder alcanzar una erección suficientemente rígida y todos los pacientes coincidieron en que la rigidez de su erección no era la misma que antes de la enfermedad. Solo un 25% de los pacientes presentaban erecciones desde el inicio del ado sexual. 75% de los parientes reportaron tardar más para eyacular, el 75% consideraban tener sensación de deterioro genital. El promedio del ISSM de los pacientes fue de 13,75 +- 4,9 puntos (5-20).El parámetro más afedado fue la capacidad de mantener la erección luego de la penetración (pregunta 3) con un promedio de 2,25+-
0,89 puntos (1-3) seguida de la confianza de lograr y mantener una erección (pregunta 1) con un promedio de 2,5+- 0,93 puntos (1-3), pregunta 2 con promedio de 2,75+-1,58 puntos (1-5), pregunta 5 con promedio de 3+- 1,69 puntos (1-5), puntos y la pregunta 4 con promedio de 3,25+-1,39 (1-4). Conclusiones: la prevalencia de la disfunción sexual en la mujer se situó en 78,6%, valor muy alto si se compara con las cifras como el 43% en el Condado de Olmsted y algo más alto si lo comparamos con la revisión de Litwiller. En el caso del hombre todos sufrieron de disfunción eréctil y en el 75% el tiempo de eyaculadón fue más prolongado, por lo que la prevalencia de la disfunción sexual en el hombre con EM es del 100% en nuestra serie, valor comparable con el resto de los estudios. La insuficiencia renal crónica en 40% ó más y niveles de colesterol total elevado aumentan el riesgo de DE en 1,32 veces más que el resto de la población.
En la eyaculadón igualmente se han descrito diversos trastornos, los cuales pueden ser agrupados de la siguiente manera:
- Eyaculadón precoz.
- Eyaculadón retrógrada
- Aneyacul ación
I) La eyaculadón precoz: Algunos la definen con criterios cuantificable, pensando que existe un tiempo mínimo entre penetradón vaginal y la eyaculadón (2 minutos posterior a la penetración vaginal),45 sin embargo otros estudios lo definen como la aparición del orgasmo a los 3 minutos posterior a la penetración de la pareja.46 La incidencia de este problema en el hombre se reporta en un 35%.47 Se presenta después de una estimulación sexual mínima, antes, durante ó inmediatamente después de la penetración. Otros le dan valor a los movimientos luego de la penetradón (ir y venir) en número más o menos de 10. Los datos sobre la prevalenda son muy divergentes, porque los estudios pobladonales utilizan distintos diagnósticos y muestras, los índices varían entre 1% y 75%. La prevalencia de 29% es la más aceptada y se basa en un estudio reciente de prevalencia en EE.UU. En clínicas de atención primaria varia de 2% a 31%. En clínicas para tratamiento de trastornos de sexualidad, de 0% a 77%.En Latinoamérica se han reportado cifras en centros de atendón de problemas sexuales de 31% al 40%. Las consecuencias de este trastorno son el sufrimiento personal y/o las dificultades de relación interpersonal.
Eyaculadón prematura (EP), Criterios para definir el Tiempo al Orgasmo. Dicapua, Szemat y Col; presentaron, 56 parientes que consultaron por; 20 por DE, 28 por EP y 8 por DE + EP, se compararon los 36 pacientes con EP, contra los que no tenían EP. El average del tiempo hasta el orgasmo en los que tenían EP fue de
l,44minutos, contra 5,18 en el grupo sin EP, propusimos en esa oportunidad un punto de corte de 3 minutos, lo que nos daba 94% de sensibilidad y 47% de especificidad, lo que podría orientar a la población Venezolana y a los médicos, en un tiempo al Orgasmo, promedio, para nuestra población.76
Tiempo de Latencia a la Eyaculadón ( TLE) en una población masculina en Venezuela, Szemat y Col.
Se les paso cuestionario acerca de preguntas relacionadas con el aspedo sexual y el tiempo a la eyaculadón, clasificadas: previo a la penetración, menos de 2 minutos, entre 2 y 5 minutos, 6 a 10 minutos, más de 10 minutos, aneyaculadón y sin tener relaciones.
Respondieron los cuestionarios 935 pacientes. Edad promedio 54,8 -+ 9,1 (30-83 años).
No se les pregunto acerca de disfundón sexual. Todos los parientes eran heterosexuales y tenían ó tuvieron una pareja sexual estable.
11 Pacientes (1,1%) respondieron que tenían, TLE previa a la penetración. 269 pacientes (28,8%) respondieron que tenían TLE desde la penetración en menos de 2 minutos. 413 pacientes (44,2%) tenían TLE entre 2 y 5minutos luego de la penetración. 142 pacientes (15,2%) tenían TLE entre 6 y 10 minutos, 74 pacientes (7,9%) tenían un TLE de más de 10 minutos luego de la penetración y 26 pacientes respondieron que no tenían relaciones ó tenían aneyaculación.
Es necesario conocer el TLE de la población en general, para poder establecer el tiempo a la eyacu-lacion, cuando estamos tratando pacientes con EP, es para tener un parámetro objetivo, y comparar los resultados del tratamiento.77
LA CLOMIPRAMINA EN EL TRATAMIENTO DE LA EYACULACIÓN PREMATURA. EFICACIA Y EFECTOS SECUNDARIOS. Szemat y Col.
Se incluyeron a 28 parientes con edades de 46,5 ± 12,9 años (23-73 años). Veintitrés pacientes (82,1%) respondieron haber tenido mejoría con el tratamiento y 5 (17,9%) respondieron no haber tenido mejoría. El tiempo de latenda antes del tratamiento fue de 25.1 ± 35.9 segundos (1 a 180 segundos) y el tiempo de latencia después del tratamiento fue de 336.6 ± 219.4 segundos con un rango entre 3 segundos y la aneyaculadón lo que resultó ser estadísticamente significativo (p<0,01) (tablas 1 y 2). Dieciocho pacientes (64,3%) presentaron efectos secundarios menores que no hicieron descontinuar el tratamiento siendo los más comunes la cefalea en 6 pacientes, nauseas en 4, mareos en 3, somnolencia en 2, insomnio en 1, depresión en 1, disfunción eréctil en 1, hipertensión arterial en 1, diaforesis en 1 y otros efectos secundarios en 3 pacientes (Tabla3).
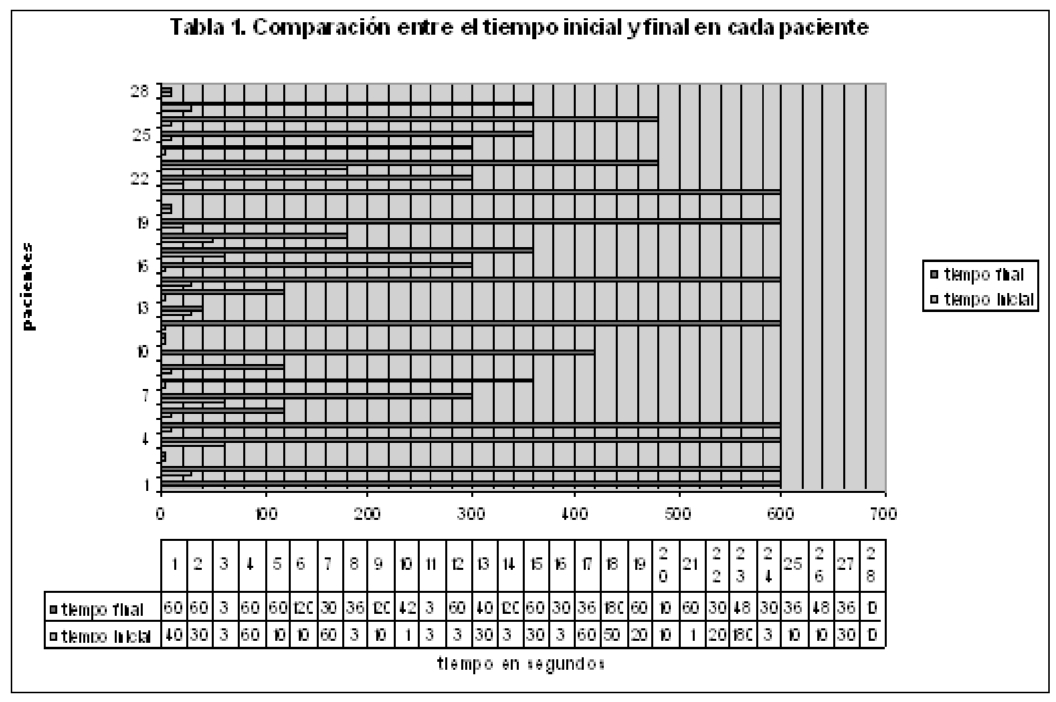
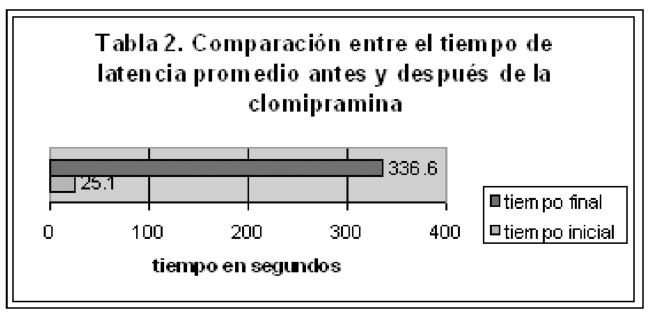
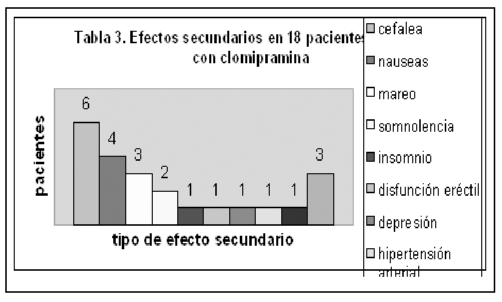
Conclusión: La administración de 25 mg de clomipramina entre 6 y 8 horas antes de la relación sexual resultó ser muy eficaz en el tratamiento de la EP. Durante la entrevista telefónica el 82,1% de nuestros pacientes respondió sentir mejoría con la utilización del tratamiento y aunque el alto porcentaje de efectos secundarios haría considerar la administración de otros tratamientos ninguno de nuestros pacientes suspendió el tratamiento debido a que los efectos fueron leves o moderados. Sin embargo el tratamiento debe individualizarse para determinar quien es el que más se pudiera beneficiar del mismo debido a sus efectos secundarios.
II) La eyaculadón retrógrada resulta más complicado de determinar su incidencia, sin embargo en estudios realizados sobre este tópico se ha determinado que el 14 a 18% de los pacientes con aspermia sufren de este proceso,48 aunque en 1400 parejas estériles estudiadas se demostró que el 0,7% de los varones tenían eyacu-lación retrógrada como causa de su esterilidad.49 Entre las causas de esta patología se encuentran: A) Diabetes Mellitus: observado en el 32% de pacientes diabéticos. B) Lesiones de la médula espinal: en caso de lesiones completas no se evidencia eyaculadón; cuando existe lesión en la inervación del cuello vesical, la eyaculadón suele producirse en forma retrógrada.50 C) Como complication de la cirugía: 1.- Resección transuretral de próstata: en este tipo de operaciones o de incisión de cuello vesical se ha demostrado que el 25% de los parientes presentan eyaculadón retrógrada y no debe confundirse con aneyaculadón que puede referir el paciente después de haber sido sometido a este tipo de procedimiento.51 2.- Cirugía a cielo abierto: incluye las cirugías abdominopelvianas, la resección colorrectal, lin-fadenedomía retroperitoneal en casos de cáncer testicular, entre otras, pueden lesionar los ganglios nerviosos simpáticas o fibras postganglionares que controlan la eyaculadón produdendo la eyaculadón retrógrada con una inddencia que oscila entre el 8 y 80% de los casos.52 D) De origen medicamentoso: paroxetina, sertralina, clomipramina, tiazidas, etc.
III) Aneyaculadón:
- De origen congénito: llamada también primaria o psicogénica, con una incidencia del 0,14% en la pobladón general y del 0,39% en los varones que consultan por esterilidad.53
- De origen farmacológico: corresponde a los mismos fármacos que producen la eyaculadón retrógrada.
- Diabetes: en casos de larga data, puede existir calcificaciones en los condudos deferentes o eyaculadores que les impidan contraerse para expulsar el semen.54
- Por lesiones de la médula espinal o condición post-quirúrgica: observado en lesiones nerviosas por debajo de D-10 o en padentes sometidos a cirugías retroperitoneal o pelviana por lesiones de los nervios que discurren en ese nivel.
DISFUNCIÓN SEXUAL FEMENINA
Dentro de la medicina sexual, un tema que no se puede dejar de lado corresponde a la disfunción sexual femenina (DSF), la cual presenta una alta prevalencia pero no está bien definida ni totalmente comprendida. La DSF es definida como la alteración en el proceso que caraderiza al dclo de respuesta sexual o como el dolor asociado a la relación sexual.29 En un trabajo de revisión se evidenciaron distintas definiciones y clasificaciones para la DSF; por tal motivo se organizó un consenso de 5 países (Sexual Function Health Council of the American Foundation for Urologic Disease), formado por un panel de 19 expertos en DSF, cada clasificación incluía causas psicogénicas y causas orgánicas como el deseo sexual, definido actualmente como:
I Trastornos del deseo sexual:
IA) Trastorno del deseo sexual hipoadivo
IB) Aversión sexual.
II Trastornos de la exdtadón y sensadón vaginal.
III Trastornos del orgasmo.
IV Dolor durante la reladón sexual: IVA: Dispareunia: se refiere al dolor presentado por la padente durante la reladón sexual. IVB: Vaginismo: se refiere al espasmo vaginal recurrente o persistente en forma involuntaria de la musculatura vaginal, el cual interfiere con la penetración.25'26'57
La DSF es un problema que afeda a un número considerable de mujeres en Estados Unidos y se relaciona con la edad; sin embargo, las investigadones epidemiológicas basadas en la comunidad sobre disfunción sexual femenina son limitadas. Datos redentes revelan que el 76% de las mujeres reportan algún grado de disfundón sexual;55'56 en un censo de la población femenina norteamericana, reporta datos de 10 millones de mujeres que presentan algún grado de disfundón sexual con edades comprendidas entre 50 y 74 años,55'56 además es un problema que es progresivo y de alta prevalencia.26 En un estudio realizado en la Universidad de Chicago, la Disfunción Sexual (DS) fue de mayor prevalenda en mujeres (43%) que en hombres (31%), la cual se asodaba con características demográficas que incluían la edad y el nivel de educación;32 sin embargo se ha descrito que la edad, al igual que en los hombres, juega un papel fundamental en la DS. Es por eso que la menopausia está descrita como factor de riesgo y que la prevalencia de la DS en este tipo de pacientes se aumenta. En un estudio realizado en la Universidad de Chile, se demostró que las mujeres entre 40 y 44 años, la prevalencia de DS fue del 22 % y aumentó hasta el 66% en mujeres entre 60 y 64 años.33
En la consulta de Mediana Sexual del Servicio de Urología del Hospital Domingo Ludani, Caracas, Venezuela, (Trabajo presentado en SLAIS, Argentina, 1999-2000) también las mujeres fueron objeto de estudio; el 85,6% pertenedan al grupo etáreo ubicado entre 40 y 69 años. El 43,2% eran de estado dvil casadas, el 20% solteras y el 19% divorciadas. El 51,2% tenían pareja fija para el momento de la entrevista. De las mujeres entrevistadas, el 19,2% se masturbaban y el 44% no lo hacían. Los tópicos estudiados fueron lubricación, dolor durante la relación sexual y el orgasmo. El 26,4% lograba una buena lubricadón contra un 28,8% que no la lograba; el dolor durante la reladón sexual fue observado en el 6,4% mientras que el 47,2% no experimentaba dolor. Con respecto al orgasmo, el 52% respondieron afirmativamente mientras que el 11,2% lo negaron.
En términos generales, la DS tiene una prevalencia alta, afectando a 43% en mujeres y 31% en hombres.27 El deseo sexual hipoactivo fue reportado en 30% de las mujeres y 15% en hombres. Los problemas del orgasmo son relativamente comunes en mujeres afedando a 10 a 15 % de las comunidades de mujeres estudiadas; sin embargo, en el hombre, la eyaculación prematura resultó ser el problema más común, con una tasa del 30% aproximadamente. Finalmente, el dolor durante el sexo se ubicó entre 10 y 15% para las mujeres y menos del 5% para los hombres.27 Para el Dr. Goldstein, de la Universidad de Boston, se estima que la DSF ocurre entre un 22 a 43%, presentando factores de riego asociado que induyen la edad, educadón, historia de abuso sexual o enfermedades de transmisión sexual.28
Otros estudios reportan cifras de DSF en 26,6% en los últimos 6 meses antes del estudio. La edad promedio de mujeres que presentaron algún tipo de disfundón sexual fué de 36,76% +/- 12,67 años; 29% no tenían educación, 78% no tenían adividad profesional y 58% estaban casadas.29 Los problemas mayormente registrados fueron la ansiedad y la inhibidón durante la actividad sexual (38,1%), pérdida del placer y de satisfacdón por el sexo (16,3%) y dificultad para alcanzar el orgasmo (15,4%). Otros problemas comunes son la falta de lubricación (13,6%) y el dolor durante la reladón sexual, el cual presentó mayor prevalencia en el grupo post-meno-páusico. La frecuenda de las reladones sexuales en las mujeres encuestadas corresponde a 48,5% semanal comparada a 28,4% que no presentaban relaciones sexuales al momento del estudio.30
Las afras reportadas por los ingleses indican cuales son los tipos de DS de la pobladón en general así como la prevalenda de cada uno de ellos. La edad promedio de la población estudiada era de 50 años, entre los cuales el 34% eran hombres y el 41% eran mujeres. En los hombres la DE fue el problema mas frecuente seguido por la eyaculadón prematura, la cual puede variar para algunos autores con una prevalencia que oscila entre un 30 al 40%.38 En las mujeres, la resequedad vaginal fue el problema que mas reportaron las parientes seguido por orgasmos infrecuentes.31
1. Int J Impot Res 2000 Feb; 12(1): 41-5.
2. Bancroft J. Human sexuality and its problems, 2nd edn. Edinburg: Churchill Livingstone, 1989.
3. Bancroft J. Impotence and perspective. Edinburg: Churchill Livingstone, 1993.
4. Bortolotti A, Parazzini F, Colli E, Landoni M. Int J Androl 1997 Dec; 20(6): 323-34.
5. Kirby R S . Impotence: diagnosis and management of male erectile dysfunction. Br Med J 1994; 308: 957-961.
6. Goldstein I, Rothstein L. The potent male: facts, fiction and future. Los Angeles: Body Press, 1990.
7. Nusbaum MR. Erectile dysfunction: prevalence, etiology and major risk factors. J Am Osteopath Assoc 2002 Dec; 102(12 suppl 4): Sl-6.
8. Lewis RW. Epidemiology of erectile dysfunction. Urol Clin North Am 2001 May; 28(2): 209-16, vii.
9. Johannes CB, Araujo AB, Feldman HA, Derby CA, Kleinman KP, McKinlay JB. Incidence of erectile dysfunction in men 40 to 69 years old: longitudinal results from the Massachusets male aging study. J Urol. 2000 Feb; 163(2): 471.
10. Moreira ED Jr, Lbo CF, Diament A, Nicolosi A, Glasser DB. Incidence of erectile dysfunction in men 40 to 69 years old: results from a population-based cohort study in Brazil. Urology 2003 Feb; 61(2): 431-6.
11. Morillo LE, Diaz J, Estevez E, Costa A, Mendez H, Davila H, Medero N, Rodriguez N, Chaves M, Vinueza R, Ortiz JA, Glasser DB. Prevalence of erectile dysfunction in Colombia, Ecuador, and Venezuela: a population-based study (DENSA). Int J Impot Res 2002 Aug; 14 Suppl 2: S10-8.
12. Kinsey AC, Pomeroy W B, Martin C E. Sexual behaviour in the human male. Philadelphia: Saunders, 1985.
13. Laumann EO, Paik A, Rosen RC. Sexual dysfunction in the United States: prevalence and predictors. JAMA. 1999 Oct 6; 282(13): 1229.
14. Mannino DM, Klevens RM, Flanders WD. Cigarette smoking: an independent risk factor for impotence? Am J Epidemiol 1994 Dec 1; 140(11): 1003-8.
15. Bortolotti A, Fedele D, Chatenoud L, Colli E, Coscelli
C, Landoni M, Lavezzari M, Santeusanio F, Parazzini
F. Cigarette smoking: a risk factor for erectile dysfunction in diabetics. Eur Urol 2001 Oct; 40(4): 392-6; discussion 397.
16. Feldman HA, Goldstein I, et al: Impotence and its medical psychosocial correlates: results of the Massachusetts male aging study. J Urol. 151: 54,1994.
17. Mulligan T, Schmitt B: Testosterone for erectile failure. J Intern Med 8: 517, 1993.
18. AHMED I. EL-SAKKA; KHALID A. TAYEB. Erectile Dysfunction Risk Factors in Noninsulin Dependent Diabetic Saudi Patients The Journal of Urology 2003; 169(3): 1043-1047.
19. Nicolosi A, Moreira ED Jr, Shir ai M, Bin Mohd Tambi MI, Glasser DB. Epidemiology of erectile dysfunction in tour countries: cross-national study of the prevalence and correlatos of erectile dysfunction. Urol 2003 Jan; 61(1): 201-6.
20. Antonio Martin Morales, José J Sanchez-Cruz et al. Prevalence and independent risk factors for erectile dysfunction in Spain: results of the epidemiology of the erectile dysfunction male study. The Journal of Urology 2001; 166: 569-575.
21. Buvat J, Lemaire A. Endocrine screening in 1.022 men with erectile dysfunction: clinical significance and cost-effective strategy. J Urol. 1997 Nov; 158(5): 1768-9.
22. Fahmy AK, Mitra S, Blacklock AR, Desai KM. Is the measurement of serum testosterone routinely indicated in men with erectile dysfunction. BJU Int. 2000 Sep; 86(4): 563.
23. Rhoden EL, Teloken C, Sogari PR, Souto CA. The relationship of serum testosterone to erectile function in normal aging men. J Urol 2002 Apr; 167(4): 1745-8.
24. Rhoden EL, Teloken C, Mafessoni R, Souto CA. Is there any relation between serum levels of total testosterone and the severity of erectile dysfunction. Int J Impot Res 2002 Jun; 14(3): 167-71.
25. Basson R, Berman J, Burnett A., et al. Report of the international consensus development conference on female sexual dysfunction: definitions and classifications. J Urol 2000 Mar; 163(3): 888-93.
26. Berman JR, Adhikari SP, Goldstein I. Anatomy and physiology of female sexual function and dysfunction: classification, evaluation and treatment options. Eur Urol 2000 Jul; 38(1): 20-9.
27. Rosen RC. Prevalence and risk factors of sexual dysfunction in men and women. Curr Psychiatry Rep 2000 Jun; 2(3): 189-95.
28. Goldstein I. Female sexual arousal disorder: new insigghts. Int J Impot Res 2000 Oct; 12 Suppl 4: S152-7.
29. Kadri N, McHichi Alami KH, McHakra Tahiri S. Sexual dysfunction in women: population based epidemiological. Arch Women Ment Health 2002 Oct; 5(2) 59-63.
30. Rosen RC, Taylor JF, Leiblum SR, Bachmann GA. Prevalence of sexual dysfunction in women: results of a survey study of 329 women in an outpatient gynecological clinic. J Sex Marital Ther 1993 Fall; 19(3): 171-88.
31. Dunn KM, Croft PR, Hackett GI. Sexual problems: a study of the prevalence and need for health care in the general population. Fam Pract 1998 Dec; 15(6): 519-24.
32. Laumann EO, Paik A, Rosen RC. Sexual dysfunction in the United States: prevalence and predictors. JAMA. 1999 Oct 6; 282(13): 1229.
33. Blumel JE, Araya H, Riquelme R, Castro G, Sanchez
F, Gramegna G. Prevalence of sexual dysfunction in climacteric women. Influence of menopause and hormone replace therapyl. Rev Med Chil 2002 Oct; 130(10): 1131-8.
34. Akkus E, Kadioglu A, Esen A, Doran S, Ergen A., et al. Prevalence and correlates of erectile dysfunction in TurKey: a population-based study. Eur Urol 2002 Mar; 4(3): 298-304.
35. Mak R, De Backer G, Komitzer M, De Meyer JM. Prevalence and correlates of erectile dysfunction in a population based study in Belgium. Eur Urol 2002 Feb; 41(2) 132-8.
36. Ugarle y Romano F. Reu Mex Urol 2001;61(2): 63-76.
37. Laumann EO, et al. J Am Med Assoc. 1999; 281:537-544.
38. Braun M, et al. J Impot Res. 2001; 12: 305-11.
39. Cifras presentadas en la reunión de la CAU, Septiembre 2000, Buenos Aires, Argentina.
40. Aytac IA, et al. BJU Int 1999; 84: 50-56.
41. Burchardt M, Baer L et al. Hypertension is associated with severe erectile dysfunction. J Urol 2000 Oct; 164(4): 1188-91.
42. Jensen J, Lendorf A, et al. The prevalence and etiology of impotence in 101 male hypertensive outpatients. Am J Hypertens 1999 Mar; 12(3): 271-5.
43. Fogari R, Zoppi A. Effects of antihypertensive therapy on sexual activity in hypertensive men. Curr Hypertens Rep 2002 Jun; 4(3): 202-10.
44. Mikhailidis DP, Khan MA et al. The treatment of hypertension in patients with erectile dysfunction. Curr Med Res Opin 2000; 16 Suppl 1: s31-6.
45. Clínicas de Urología de Norteamérica, Vol 2, 2001.
46. Eyaculadón prematura HDL.
47. Kennedy SH, Dickens SE et al. Sexual dysfuntion befóte antidepressant therapy in major depresión. J Urol 159: 425, 1998.
48. Sandler B. Idiopathic retrograde ejaculation. Fertil Steril 32: 474, 1979.
49. Van Der Linden PJQ. Retrograde ejaculation: succes-ful treatment with artificial insemination. Obstet Gynecol 79: 126, 1992.
50. Brackett NL. Semen retrieval by penile vibratory stimulation in men with spinal cord injury. Hum Reprod Update 5: 216, 1999.
51. Thorpe AC, Clearly R et al. Writen consent about sexual function in men undergoing transurethral prostatectomy. Br J Urol 74: 479, 1994.
52. Nesbakken A. Bladder and sexual dysfunction after mesorestal excision for rectal cancer.
53. Geboes K. Primary anejaculation: Diagnosis and therapy. Fertil Steril 26: 1018, 1975.
54. Sexton WJ, Jarow JP. Effect of diabetes mellitus upon male reproductive function. Urology 49: 508, 1997.
55. Spector I, Carey M. Incidence and prevalence of the sexual dysfunction: a critical review of the empirical literature. 19: 389-408, 1990.
56. Laumann EO, Paik A, Rosen RC. Sexual Dysfunction in the United States. Prevalence and Predictors. JAMA Feb 1999, Vol 281(6): 537-544.
57. Basson R, Berman J, Burnett A, Derogatis L, Ferguson D, Fourcroy J, Goldstein I, Graziottin A, Heiman J, Laan E, Leiblum S, Padma-Nathan H, Rosen R, Segraves K, Segraves RT, Shabsigh R, Sipski M, Wagner G, Whipple B. Report of the international consensus development conference on female sexual dysfunction: definitions and classifications. J Urol. 2000 Mar; 163(3): 888-93.
58. Szemat, Sucre y col. Dimensiones peneanas en la población venezolana. Revista venezolana de Urología. Enero-Junio 2001, vol 47 (1); 26-30.
59. Szemat R., Sucre T., Di Capua T, y col. Epidemiología de la disfunción sexual en Venezuela. Rev Ven Urol, Vol. 47, Ne 1: 26-30, Ene-Jul 2001.
60. Kim SC, Seo KK. Efficacy and safety of fluoxetine, sertraline and clomipramine in patients with premature ejaculation: a double-blind, placebo controlled study. J Urol 1998 Feb; 159(2): 425-7.
61. Abdel-Hamid IA, El Naggar EA, El Gilany AH. Assessment of as needed use of pharmacotherapy and the pause-squeeze technique in premature ejaculation. Int J Impot Res 2001 Feb; 13(1): 41-5.
62. Strassberg DS, de Gouveia Brazao CA, Rowland DL, Tan P, Slob AK. Clomipramine in the treatment of rapid (premature) ejaculation. J Sex Marital Ther 1999 Apr-Jun; 25(2): 89-101.
63. Haensel SM, Rowland DL, Kalian KT. Clomipramine and sexual function in men with premature ejaculation and controls. J Urol 1996 Oct; 156(4): 1310-5.
64. Rowland DL, De Gouveia Brazao CA, Koos Slob A. Effective daily treatment with clomipramine in men with premature ejaculation when 25 mg (as required) is ineffective. BJU Int 2001 Mar; 87(4): 357-60.
66. Seagraves RT, Saran A, Seagraves K, Maguire E. Clomipramine versus placebo in the treatment of premature ejaculation: a pilot study. J Sex Marital Therapy 1993 Fall; 19(3): 198-200.
67. Lee HS, Song DH, Kim CH, Choi HK. An open clinical trial of fluoxetine in the treatment of premature ejaculation. J Clin Psychopharmacol 1996 Oct; 16(5): 379-82.
68. McMahon CG. Treatment of premature ejaculation with sertraline hydrochloride: a single-blind placebo controlled crossover study. J Urol 1998 Jun; 159(6): 1935-8.
69.Waldinger MD, Hengeveld MW, Zwinderman AH. Ejaculation-retarding properties of paroxetine in patients with primary premature ejaculation: a dou-ble-blind, randomized, dose-response study. Br J Urol 1997 Apr; 79(4): 592-5.
70.Szemat R, Di Capua T, Sucre T y col. Disfunción Sexual Masculina y Diabetes Mellitus. Rev Ven Urol, Vol. 47, Ne 1: 31-33, Ene-Jul 2001.
71.Szemat R, Di Capua T, Sucre T y col. Dimensiones peneanas en la Población venezolana. Rev Ven Urol, Vol. 47, Ne 1: 37-40, Ene-Jul 2001.
72. Di Capua T, Szemat R, Sucre T y col. Eyaculadón Precoz: Utilidad del Tiempo-al-orgasmo como criterio diagnóstico. Rev Ven Urol, Vol. 48, Ne 1, Ene Jul 2002.
73. Szemat y col. Epidemiología de la DE en un programa de Despistaje de Cáncer de Próstata, datos en Historias del Servicio de Urología. En vías de Publicación.
74. Prevalencia disfunción sexual femenina. Fuente HCU de Caracas, El Nacional, 10 de Marzo de 2002.Vanessa Davies.
75. Contreras -Szemat y Col. Disfunción sexual femenina, en un Programa de atención y educación a la Comunidad con Incontinencia Urinaria Femenina. XXVCongreso de la Confederación Americana de Urología, vol. 65. n°3, pag. 131, 2000.presentación-
0.101
76. Dicapua-Szemat y Col, Premature eyaculation Possibility for a time-to orgasm reference criterion. Presentado Como póster en el 6th Latin American Congress on Sexual Impotence, Río de Janeiro,
Brazil. 13-16 June. 2001.1nterational Journal. Of Impotence Research, Vol 13, Supplement 2, June 2001.
77. Di Capua-Szemat y Col. Latency Time to Eyaculation(LTE)in a General Male Population in Venezuela.(CP3.10) S79. 10th World Congress of the Internacional Society for Sexual and Impotente Research.Montreal Canada.September 22-26, 2002.
78. Dicapua-Szemat y Col. Serie free Testosterone and total Testosterone related to low Libido in male patients with Sexual Dysfunction. Presentado en el 6th Latin American Congress on Sexual Impotence, and 6th Brazilian Congress on Sexual Impotence. 13-16 June 2001.Rio de Janeiro, Brazil. Publicado en el International Journal of Impotence Research. Vol 13, Supplement2, June 2001.
79. DiCapua-Szemat y Col. Effects of Clomipramine in treating Premature Eyaculation. Efficacy and side Effects. (CP3.09) S79. 10th World Congress of the Internacional Society for Sexual and Impotente Research.Montreal Canada.September 22-26, 2002.
80. Szemat y Col. Sexual Characteristics in Male Sexual Disfunction patients in Venezuela. (CPI.05) S50.10th World Congress of the Internacional Society for Sexual and Impotente Research.Montreal Canada. September 22-26, 2002.
81. Szemat y Col. Epidemiology of Male Sexual Disfunction In Venezuela.Results from 955 Patients. (CPI.21) S56. 10th World Congress of the Internacional Society for Sexual and Impotente Research. Montreal Canada.September 22-26, 2002.
82. Szemat y Col. Prevalence of erectile Disfunction in Prostate Cancer Screening Program in Venezuela. Patients. (CPI.42) S63. 10th World Congress of the Internacional Society for Sexual and Impotente Research.Montreal Canada.September 22-26, 2002.
83. Zorzon M, Zivadinov R, Bosco A, et al. Sexual dysfunction in multiple sclerosis: A case-control study.
1. Frequency and comparison of groups. Mult Scler 5: 418-27, 1999.
85. Chancellor MB, Rivas DA. American Urological Association symptom index for women with voiding symptoms: lack of index specificity for benign prostate hyperplasia. J Urol 1993 Nov;150 (5Pt
2):1706-8; discussion 1708-9.
86. Hulter BM, lundberg PO. Sexual function in women with advanced multiple sclerosis. J Neurol Neurosurg Psychiatry 1995 Jul; 59(1): 83-6.
87. Minderhoud JM, leemhuis JG, Kremer J, laban E, Smits PM. Sexual disturbances arising from multiple sclerosis. Acta Neurol Scand 1984 Oct; 70(4): 299-306.
88. Lilius HG, Valtonen EJ, Wikstrom J. Sexual problems in patients suffering from multiple sclerosis. Scand J Soc Med 1976; 4(1): 41-4.
89. Litwiller SE, Frohman EM, Zimmem PE. Multiple sclerosis and the urologist. J Urol 1999; 161: 743-57.
90. Hennessey A, Robertson NP, Swingler R. Compston DAS. Urinary, faecal and sexual dysfunction in patients with multiple sclerosis. J Neuroll999; 246: 1027-32.
REFERENCIAS BIBLIOGRÁFICAS: DISFUNCIÓN SEXUAL FEMENINA
I Consenso Latinoamericano de Disfunción Eréctil, Bahía, Brasil 28-31 agosto de 2002.
1. Berman JR, Adhikari SP, Goldstein 1. Anatomía y fisiología de la función sexual femenina y su disfunción. Eur Urol, 2001; 7(2): 225-34.
2. IslamA, Mitchel J, Rosen R et al. Topical alprostadil in
the treatment offemale sexual arousal disorder: a pilot study. J Sex Marital The_ 2001; 27: 531-40.
3. Goldstein, 1. Female sexual arousaldisorders: new insights.Int J ImpRes, 2000; 12 (Suppl. 4), S152-8157.
4. Bechara A, Becher E, Casabé A et al. Female sexual
prevalence in Argentina. Abstracts from New perspectives in the management offemale sexual dysfunction, Boston, 2000. Site; http://www.isswsh.o_.
5. Bechara A, Casabé A, Bertolino M et al. Disfunción
sexual femenina: prevalencia en la consulta ginecológica. Female sexual dysfunction: prevalence in the clinical practice gynecologist. CongresoA_ entino de Urología, XXX Congreso de la Confederación Argentina de Urología. BuenosAires. 2001, Abstract.
6. Lopes GP, Torres LO. Evaluation of sexual complaints among women in their forties and over in a sexology office. Acta Port Sexol, 1998; 42 (suppl. 2).
7. Rosen R, Brown C, Heiman 1, Leiblum S et al. The
female sexual function index (FSFI): a multidimensional self-report instrument for the assessment of female sexual function. J Sex MaritalThe_ 2000; 26: 191-200.
8. Becher E, Bechara A, Casabé A. Clitoral hemodyna
mic changes after topical application of alprostadil. J Sex MaritalThe_ 2001; 27: 405-10.
9. Bechara A, Bertolino M, Casabé A et al. Duplex doppler ultrasound assessment of clitoral hemodynamics after topical administration of alprostadil in women with arousal and orgasmic disorders. J Sex Marital The_ 2002. En prensa.
10. Yilmaz U, SoyluA, Ozcan C et al. Clitoral electromyography. J Urol, 2002; 167: 616-20.
11. BecharaA, Bertolino Mv, Casabé A et al. Assay on the efficacy and safety of sildenafil in female sexual dysfunction. ISSWSH Annual Meeting. Vancouver 2002. Site; http://www.isswsh.org.
12. Rosen RC et al. Oral phentolamine andfemale sexual arousal disorder: a pilot study. J Sex MaritalThe_ 1999; 25(2): 137-44.
13. Rubio E, Lopez M, Lipezker M et al. Alpha blockade and vaginal blood flow response in postmenopausal women withfemale sexual arousal disorda Abstracts New perspectives in the management offemale sexual dysfunction, Boston, 2000. site; http://www.isswsh.org.
14. Rubio E, Rampazzo C, Hurley H et al. Combination therapy for female arousal disorder: a clinical trial to evaluate the efficacy of a combination of phentolamine mesylate and apomorphine in the subjective response to video sexual stimulation. Abstracts from Female Sexual Function Forum. Boston, 2001. Site; http ://www.isswsh.org.
15. Tarcan T, Siroky M, Park K et al. Systemic administration of apomorphine improves the hemodynamic mechanism of clitoral and vaginal engorgement in the rabbit. Int J Imp Res, 2000; 12(4): 235.
16. Seagraves RT, Kavoussi R, Ascher JA et al. Bupropion sustained release_( SR) for the treatment of hypoactive sexual desire disorder (HSDD) in nondepressed women. J Sex Marital The_ 2001; 27: 303-16.
17. Modell JG, May RS, Katholi R. Effect of Burpopion-sf on orgasmic dysfuction in nondepressed subjects: a pilot study. J Sex Marital The_ 2000; 26: 231-40.
18. Gitlin M, Surir R, Altshuler LL et al. Bupropion-sus-tained release as a treatmentfor SSR1 induced sexual side effects. J Sex Marital The_ 2002; 28: 131-8.
19. Pauls R, Berman L, Berman J. A non-pharmacologi-cal method to enhance vaginal blood flow in patients with sexual arousal disorder. Female Sexual Function Forum, 2001. Site; http://www.isswsh.o_.
BIBLIOGRAFÍA TRASTORNOS DE LA EYACULACIÓN_
I Consenso Latinoamericano de Disfunción Eréctil, Bahía, Brasil 28-31 agosto de 2002.
1. Abdo CHN, Oliveira Jr. WN, Moreira ED, Fittipaldi
JAS. Perfil sexual da populaflio brasileira. Resultados do Estudo do Comportamento Sexual (ECOS) do brasileiro. RBM, 2002; 59(4): 250-7.
2. APA (American Psichiatric Association). Manual diagnóstico e estatístico de transtomosmentais (DSM N) 4" ed. Porto Alegre: Artes Médicas, 1995, p. 476-8.
3. Colpi GM, Fanciullacci F, Beretta G, Negri L, ZanollaA.
Evoked sacral potentials in subjects with true premature ejaculation. Andrologia, 1986; 18: 583-6.
4. Fanciullacci F, Colpi GM, Beretta G, ZanollaA. Cortical evoked potentials in subjects with true premature ejaculation. Andrologia, 1988; 20: 326-30.
5. Kaplan HS. The new sex therapy. New York: Brunner/Mazel, 1974.
6. Kockott G, FeilW, RevenstorfD, Aldenhoff J, Besinger U. Symptomatology and psychological aspects of male sexual inadequacy: results of an experimental study. Arch Sex Behav, 1980; 9: 457-75.
7. Laumann EO, Gagnon JH, Michael RT, Michaels S. The social organization of sexuality: sexual practices in the United States. Chicago: University of Chicago Press, 1994.
8. Masters WH, Johnson VE. Human sexual inadequacy. Boston: Little Brown, 1970.
9. Metz ME, Pryor JL, Nesvacil U, Faruk Abuzzahab SR, Koznar J. Premature ejaculation: a psychophysiolo-gical review. J Sex Mar Ther, 1997; 23(1): 3-23.
10. OmuAE, AI-BaderAA, Dashti H, Oriowo MA. Magnesium in human semen: possible role in premature ejaculation. Archives of Andrology, 2001; 46: 59-66.
11. Rubio E, Diaz J. Las disfunciones sexuales. In: Miguel Angel Porrua. Antropologia de la sexualidad humana. Tomo 11. México, 1994.
12. Segraves RT, SaranA, Segraves K, Maguire E. Clomipramine vs placebo in the treatment of prema-ture ejaculation. Manuscript present at the annual meeting of the International Academy of Sex Research. Prague, Czech Republic, 1992.
13. Segraves RT, SaranA, Segraves K, Maguire E. Clomipramine vs placebo in the treatment of premature ejaculation: a pilar study. J Sex Marit Ther, 1993; 19: 198-200.
14. Simons JS, Carey MP. Prevalence of sexual disfunctions: results from a decade of research. Arch Sex Behav, 2001; 30(2): 177-219.
15. Sociedade Brasileira de Urologia. 1 e II Consensos Brasileiros de Disfunflio Eretil. Slio Paulo: BG Cultural, 1998, 2002.
Dr. Femando ]. Bíanco Troconis * Urólogo
Hospital Memorial Sloan Kattering Cáncer Center (MSKCC) de Nueva York - USA
CARCINOMA INVASIVO DE VEJIGA: APROXIMACIÓN, PERSPECTIVAS Y TRATAMIENTOS
La historia natural del carcinoma de vejiga se presenta como un reto singular para el Urólogo. El dictamen clínico y la experiencia juegan un papel fundamental al manejar estos pacientes, ya que muchas veces la ventana de oportunidad para el tratamiento esta presente por pocas semanas, y decisiones delicadas enfrentan a la posible persistencia de esta enfermedad. Los tumores invasivos de vejiga se presentan comúnmente como lesiones locales, en donde la diseminación ha ocurrido pero no es clínicamente detectable al momento del "Tratamiento Definitivo". Si bien, en los Estados Unidos (USA), en los últimos 50 años hemos experimentado un aumento de la incidencia en un 50% las muertes por metástasis distantes han permanecido bastante constantes durante las ultimas tres décadas, debemos concluir que hemos avanzado poco, terapias emergentes o aproximaciones mas agresivas ante un enemigo letal, requieren de profunda reflexión.1'2 Este año (2003), la incidencia y prevalencia estimada de cáncer de vejiga en USA es de 57.000 y 600.000 respectivamente, y unos 12.500 pacientes sucumbirán ante esta letal.3 Es importante destacar que el carcinoma de células tran-sicionales (CaCTV) de vejiga es infrecuente en etapas tempranas de la vida, siendo diagnosticado después de la quinta década de la vida, tres veces mas común en hombres y casi nunca visto incidentalmente en estudios de autopsia, lo que sugiere que la persona que lo padece es tratada y curada o muere de esta enfermedad. El síntoma mas frecuente es la hema-turia microscópica (70%-90%), pero debemos tener presente que hasta un 30% de los pacientes padecen de síntomas irritativos al miccionar.1 CaCTV comprende un 90% de los tumores de vejiga, siendo puros una mitad, mientras la otra presenta variantes histológicas asociadas, algunas de las cuales (ej. diferenciación glandular o escamosa, presencia de variante micropapilar o sarcomatoide) compromete la sobrevida de estos pacientes.101 En general un 75% de las lesiones son superficiales, de los cuales entre un 15%-30% van a avanzar en estadio. En contraste, un 80% de los carcinomas invasivos al músculo son identificados en este estadio clínico en el momento del diagnostico. La naturaleza progresiva de estos tumores de alto grado esta sustentada en la presencia de síntomas meses antes de la presentación clínica, encontrándonos que un 50% de estos pacientes desarrollan metástasis durante los 24 meses posteriores al diagnostico. Los factores pronósticos de sobrevida y de control de cáncer son el grado de invasión y la diferenciación histológica. El grado no es relevante en la enfermedad invasiva ya que todos estos tumores son considerados de alto grado de malignidad. La discrepancia entre la estimación clínica y la realidad patológica ha sido foco de tremendo debate y controversia, debido primariamente a las implicaciones terapéuticas. Sin embargo, factores morfológicos como la arquitectura del tumor, el carácter del frente invasivo y la profundidad, se han relacionado con el incremento en la probabilidad de diseminación distante. El gran reto tanto para clínicos como investigadores es el de minimizar las dimensiones del cáncer y/o su tratamiento en la cantidad y calidad de vida de nuestros pacientes.
En este capítulo, examinaremos resultados recientes de las diferentes aproximaciones terapéuticas que comprenden cirugía radical y técnicas de preservación vesical, que incluyen la quimioterapia y la radioterapia para enfermedad invasiva. De vista al futuro, buscaremos maneras de incrementar el valor predictivo de nuestros juicios clínicos con la finalidad de mejorar el pronóstico de esta enfermedad. Reflexionaremos sobre la postura clínico-quirúrgica ante el tumor superficial de alto grado en la era de derivaciones ortotopicas y revisaremos el rol de marcadores moleculares en el manejo futuro de esta enfermedad cancerígena.
Unas cuantas décadas atrás, Jewett evaluó la sobrevida de aquellos pacientes a los que se les había removido la vejiga; el describió la profundidad de invasión al músculo como el factor mas determinante. Para 1944, Jewett y Strong habrían propuesto la primera clasificación formal para el estadio del cáncer de vejiga, dividiendo a los pacientes en tres grupos: A, B y C, que correspondía a invasión de la submucosa, músculo e infiltración perivesical, respectivamente.4 Dukes y Masina presentaron una clasificación similar en el Reino Unido en 1949.5 Así, para el final de los 1940s, estos reportes constituyeron la base de la clasificación TNM de los tumores de vejiga y desde entonces los tumores que penetran la muscular propia o mas allá son considerados invasivos.
La cistectomia radical es el tratamiento primario (de oro) para el carcinoma invasivo de vejiga (T2-4NxM0). La naturaleza amplia, en bloque de la cirugía, esta diseñada a prevenir márgenes positivos y así recurrencias locales. La técnica en si ha pasado la prueba del tiempo, suministrando porcentajes de sobrevida estables en el tiempo. Mejorías en el manejo anestésico, manejo intensivo, uso de antibióticos y la selección de pacientes, han reducido las complicaciones y la mortalidad de esta cirugía a un 15%-20% y 2%, respectivamente.610 Como lo demuestra la TABLA I, las series mas recientes reportan sobrevidas estimadas a 5 años para pacientes pT2 y pT3-pT4 con ganglios negativos de 67% a 84% y 32% a 58%, respectivamente. Aunque recientemente, Cheng et al. reporto una sobrevida especifica de cáncer a 10 años del 88% para aquellos pacientes con menos de 3 cm de penetración en la muscularis propia.11 Nuestra experiencia en la Universidad de Wayne State (Detroit, Michigan, USA) con 310 cystectomias realizadas en la década de los 90s, revelo sobrevidas especificas a 5 años de 87% en 45 pacientes con estadio patológico T2N0M0.12 Es de hacer notar, que no fueron encontradas diferencias significativas en sobrevida para aquellos pacientes con estadios pT3 o pT4.6'13 Para pacientes con metástasis en los ganglios linfáticos, observamos que menos del 25% viven 5 años después de la cirugía. Estos pacientes en la serie de la Universidad de Wayne State, presentaron una sobrevida media de 24 meses (rango 14 a 34 meses). Estudios por Herr et al., en el Hospital Memorial de Nueva York, subrayan la importancia en el numero de ganglios positivos mas que su pura presencia. En esas series la presencia de 3 o más ganglios positivos es lo que predice un desenlace fatal rápido. Adicionalmente 32% vs. 10% de aquellos con ganglios positivos y tumores primarios pT2 y pT3, respectivamente, vivieron 10 años después de sus cystectomias, señalando la importancia de la disección linfática.14
La idea de radioterapia sola o acompañada con resección transuretral agresiva con o sin quimioterapia se busca mantener la calidad de vida del paciente, al ser capaz de preservar su vejiga. El problema esencial radica en la eficacia de la radioterapia sola en esta enfermedad.15'16 El estudio sueco por Holmang et al., empleando dosis altas de radiación, reporto un 84% de carcinoma residual y/o recurrencia local. La sobrevida media para tumores T2/T3 fue de solo 16 meses y solo un 11% alcanzo sobrevida de largo plazo.17 Otros investigadores18'21 recientemente reportaron respuestas completas y sobrevidas a 5 años en pacientes T2-T4 de 44% a 57% y 20% a 26%, respectivamente. La selección del paciente es vital. La experiencia señala que tumores papilares, resección completa, ausencia de obstrucción ureteral, bajo grado histológico, ausencia de carcinoma in situ y tamaño menor a 5 cm son factores pronósticos buenos.18'22 Lo importante es que luego de radiación vesical, tanto urólogos como oncólogos, radiólogos deben de seguir a los pacientes de forma muy cercana. Si se presenta alguna evidencia de recurrencia local, cistectomia por salvación, si posible, debe de realizarse antes que tarde para poder percibir un beneficio en sobrevida.23
Para mejorar los resultados de radiación vesical, diversas técnicas como fraccionamiento acelerado, hiperfracdonamiento y quimio-radioterapia sensibilizada han sido utilizadas. Stuschke et al, analizo dos estudios randomizados en tumores T2 y T3 donde se comparo fraccionamiento convencional contra hyperfracdonamiento, este ultimo redujo significativamente las posibilidades de muerte.24 Horwich et al demostró respuestas completas en 81% de los 70 pacientes que fueron tratados con aceleraciones fraccionadas.25 Pero con esta técnica no hay estudios randomizados. Otros investigadores, han agregado un "sensibilizante" de radiación antes de la radiación externa para mejorar la sobrevida.26'28 Shipley, reporto un aumento de 10% a 20% en control del cáncer, después de agregar dsplatino a la radiación externa.
Ciertas revisiones cubren este tópico de forma extensa.8'29 31 El argumento para el uso de terapia sistémica en cáncer invasivo de vejiga se sustenta en el hecho que la mitad de los pacientes con estos tumores recurren con metástasis distantes después del control local-regional de la enfermedad. Aproximaciones creativas se han intentado, neoad-yuvante (antes de la cirugía), perioperativa (antes, durantes y después de la cirugía o radioterapia) y adyuvantes (después de la terapia local). Desde su introducción en 1985, MAVC (Metrotexate, Adriamydna, Vinblastina, Cisplatina) han sido las drogas de oro para esta enfermedad en estado distante. Pero, en una revisión de seis series y mas de 300 pacientes, los resultados de la quimioterapia como tratamiento único fueron muy pobres, tan solo un 27% de los parientes tuvieron respuestas completas.29 En conclusión, quimioterapia como modalidad única raramente es capaz de producir respuestas completas y no constituye una opción terapéutica definitiva para el cáncer invasivo de vejiga.
Sin embargo, la quimioterapia neoadjuvante se abre paso como posible estándar para pacientes con enfermedad local avanzada (T3 y T4NxM0). El estudio intercontinental, organizado por MRC/EORTC y reportado Hall et al.,32 en donde 976 pacientes (T2-4N0M0) fueron randomizados a recibir 3 ciclos de CMV vs. placebo, seguido por radioterapia o cirugía o ambos. Aunque, no se encontraron diferencias significativas en sobrevida especifica o total ajustada al uso de la quimioterapia, p=0.63 en la publicación inicial, análisis mas recientes de esta data y presentadas pero no publicados (todavía) en las conferencias de la
Asociación Americana de Urología (AUA), sugieren un beneficio hada el uso de quimioterapia antes de la cirugía. En este sentido la publicadón de la data ran-domizada del grupo SWAG/Intergroup en el NEJM ha intensificado el debate.33 Dicha discusión comenzó al presentarse esta data en el congreso de la sociedad dínica de oncología, El muestrario de este estudio (un tercio que el llevado a cabo por MRC) revelo una mejoría del 25% en mortalidad (diferencia de un solo lado) para aquellos pacientes expuestos a la quimioterapia neoadjuvante, el uso de la terapias neoadjuvantes, brindarían una sobrevida media de 76 meses comparados con 46 meses para aquellos no expuestos inidalmente.33 El problema radica en los análisis estadísticos, el tiempo que llevo a reclutar a estos parientes (11 años y el hecho de que 40% tuvieron estadio T2 y por ende buen pronostico.(34) Ahora, el ensayo clínico Nórdico I, demostró un beneficio en sobrevida del 15%, para pacientes T3-T4 a quienes recibieron la quimioterapia anticipada, p=0.003.35 Críticos a estos resultados, señalan que la cystectomia radical no se le practico a todos los pacientes y que el tamaño de la muestra fue insuficiente.
A nuestro parecer, resulta bien importante y mandatorio el análisis sobre todos estos estudios randomizados publicados en Lancet.36'37 Estudios randomizados anteriores alimentaron el debate ya que no han podido demostrar definitiva y consistentemente un beneficio en sobrevida para el brazo neoadjuvante.32'38-40 (Tabla I).
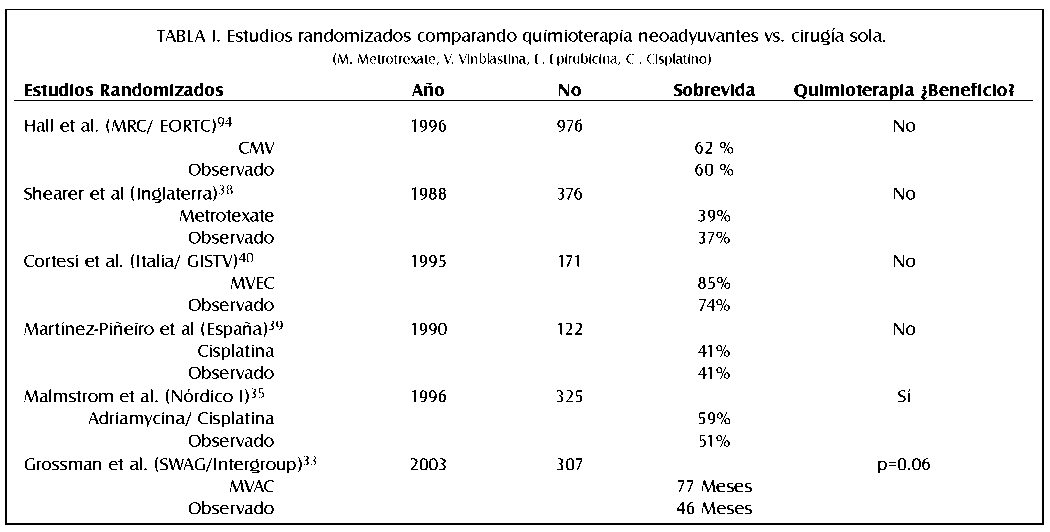
De forma similar, la data de los estudios randomizados analizando la eficacia de la quimioterapia adyuvante son insuficientes, TABLA II.41'45 Por ejemplo, el estudio iniciado en la universidad del sur de California, randomizó a 91 pacientes a recibir Ciclofosfamida, Adriamydna y Cisplatino (CISCA) vs. observación después de la cystedomia radical. Los riesgos de progresión de la enfermedad a 5 años demostraron un benefido a para el grupo tratado con quimioterapia ya que 49% de este grupo progreso vs. 66% de los observados. Sin embargo estos números no se transformaron en diferencias de sobrevida. La investigadón de Stockle et al. desde Alemania, busco respuesta a la misma pregunta comparando MVA(E)C vs. conduda expedante. Ellos encontraron luego de análisis multivariables que tanto la quimioterapia adyuvante (p=0.001) como el numero de nodos positivos tuvieron valor pronostico independiente. Diferendas significativas en el orden del 40% en estimaciones de sobrevida a 5 años fueron observadas para pacientes tratados con quimioterapia adyuvante Ahora, este benefido de sobrevida ha sido cuestionado ya que los parientes manejados de forma expedante nunca redbieron quimioterapia aun cuando la recurrencia del cáncer estaba establecida. Otros dos estudios randomizados han fallado en demostrar un beneficio de sobrevida para el brazo quimioterapeutico. Sin embargo, el uso hoy día de Gemdtabina y cisplatino, se considera menos mórbido y con efedividad similar respedo a tratamientos practicados en n los estudios randomizados.
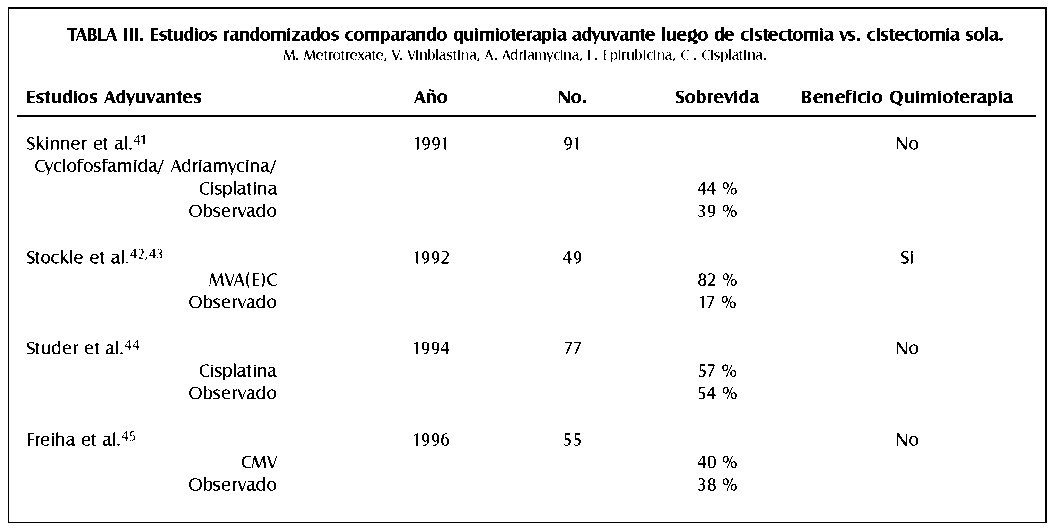
RESECCIÓN TRANSURETRAL (RTU) SOLA O EN COMBINACIÓN
Un grupo numeroso de reportes han demostrado que en casos altamente selectivos, las ratas de mortalidad asociadas a RTU como modalidad única, pueden ser aceptables.46-53 El grupo liderizado por Solsona en Valenda (España), reporto sobrevida a 5 años de 83% y recurrenda de 48%, donde un 20% fue más invasiva comparado al estadio previo. La serie de 217 padentes por Herr et al, encontró a 45 pacientes con histologías negativas en segunda RTU, de estos 65% (30 pacientes) manejados de forma conservadora estaban vivos 5 años después con sus vejigas naturales.46'50 Pero también se puede observar que solo un 17% fueron curados por la resección inicial. Así que, en general RTU como terapia única no es recomendada para el manejo del paciente con carcinoma invasivo de vejiga, solo debe ser empleada en aquellos con un gran riesgo quirúrgico o quienes son extremadamente responsables con su condición médica. Mas frecuentemente la RTU es precedida o seguida por otras formas de terapias. Hall y Roberts, reportaron sobrevidas a 3 años de 65% a 79% para pacientes tratados primariamente con RTU seguidos por quimioterapia sistémica.48 Uygur et al. válido estos resultados en 19 pacientes manejados con RTU mas 4 ciclos de MVEC.51 La experiencia del servicio
de Medicina Oncológica genitourinaria del Memorial con 31 pacientes T2-T4 luego de una segunda RTU después de quimioterapia MVAC observo sobrevida a 3 años fue del 86%, con 50% libres de ninguna recurrencia y 21 con vejigas intactas.52 Shipley et al. resumió elegantemente otras publicaciones, refiriéndose a cirugía conservadora (RTU), seguido por radio y quimioterapia. Si sumamos los pacientes de estos protocolos (N=350), la sobrevida encontrada en 5 años oscilo entre un 49% y un 52%. Un total de 40% de los pacientes inicialmente sometidos a estos protocolos conservadores de vejiga la conservaban 5 años mas tarde.29
CARCINOMA SUPERFICIAL DE ALTO RIESGO: ¿SUPERFICIAL?
La etiqueta de tumor superficial de alto riesgo es otorgada a pacientes con tumores con tumores múltiples, aquellos con grado histológico III (alto grado), presencia de carcinoma in situ (solos o asociados), tumores que penetran la lamina propia o la mucosa muscular o aquellos con pobre respuesta a la terapia intravesical. La particularidad insidiosa de la historia natural de los tumores superficiales de alto riesgo ha sido documentada plenamente por Herr et al., este grupo observo una tasa de muerte en 10 años del 20% en 86 pacientes con carcinoma transicional de alto riesgo. Cuando el seguimiento se extendió a 15 años esto tumores "superficiales" habían progresado en un 53%, con o sin tratamiento intravesical de BCG, recurrencia en uréteres o pelvis renal alcanzo un 21% y 34% habían muerto por cáncer de vejiga.53 De forma similar, Zhang et al., describió tasas de progresión y muerte de 35% y 22%, respectivamente luego de 4 años de seguimiento e independientemente de terapia local para tumores de alto grado y estadio TI, en línea con reportes previos.54'55
De esta forma, nos preocupa extremadamente el manejo de estos pacientes. Un análisis meticuloso es imperativo ante el paciente con tumores grado III (alto grado). Actualmente, la clasificación de 1997 por la comisión americana en conjunto con la Unión Internacional Contre le Cáncer (TNM) es empleada para el estadiaje de estos tumores.56 Como disertábamos anteriormente, esta clasificación es una mezcla nacida de la unión del sistema TNM y la clasificación original de Jewett-Marshall. Lo angustiante hoy día es que la diversidad de opciones terapéuticas quirúrgicas se basa en la estimación correcta de la enfermedad, la cual no es nada simple. Para entender estoe fenómeno debemos de reflexionar en el significativo desbalance entre los estadios clínicos y quirúrgicos (patológicos) el cual ha mantenido una prevalecía inaceptable y frustrante a través de los años. Este resultado de subestimación clínica es mucho mas acentuado en pacientes con enfermedad de alto riesgo.
Nuestra experiencia en la Universidad de Wayne State con 59 pacientes con carcinoma transicional de alto grado y estadios Ta/TIS/Tl, a quienes se les realizó cystectomia en lo 90s, confirmo un subestadiaje clínico en 32% de los casos, pero mas específicamente 52% (17/33) de aquellos con estadio clínico TI fueron subestadiados y 24% de ellos han perecido57 Kenny et al, reporto índices de subestadiaje del 33% (35/105), pero para pacientes con tumores Ta/Tl/TIS esta figura pervasiva se incremento a un 44%.58 Amling et al., encontró errores del estadiaje clínico en 56% de sus pacientes, estadiaje correcto y subestadiaje para aquellos con enfermedad Ta fueron de 35% (11/31) y 55% (17/31), respectivamente. Particularmente, en un 19% (32/166) de las vejigas provenientes de los pacientes con tumores TI no se encontró cáncer microscópico.59 En su trabajo, Freeman et al. destaco la naturaleza agresiva de los tumores subestadiados, de 62 pacientes encontrados, solo la mitad tuvo enfermedad confinada a la vejiga patológicamente.60 Wijkstrom et al. concluyo que mas de un 35% del subestadiaje se explicaba por la falta de músculo en el espécimen transuretral.61 El estudio de microscopía electrónica de Cheng et al., evaluó las discrepancias de estadiaje entre la resección transurethral y cystectomia radical en pacientes no expuestos a quimioterapia intravesical. Tasas impresionantes de subestadiaje (78%) en pacientes con tumores TI fueron encontradas, con un 40% presentando invasión a grasa intravesical o incorporando estructuras adyacentes.11 El particular peligro del carcinoma superficial de alto riesgo, consiste en su remoción incompleta aun cuando el urólogo endo-scopista esta convencido que una resección completa ha sido ejecutada. Esto nos lleva al punto sobre una segunda observación/resecdon
Investigadones por Klan et al., en 46 pacientes con tumores TI completamente resecados, demostraron una incidenda de tumores residuales de un 44% en el momento de la segunda resección 6 semanas mas tarde62 Mersdorf, valido estos resultados en 94 pacientes con enfermedad superficial, encontrando enfermedad residual e incrementando el estadiaje en 31% y 14% en tumores Ta, para aquellos con enfermedad TI, las tasas fueron 18% y 16%, respectivamente.63 Herr et al., ha estresado las dificultades encontradas al analizar la profundidad de la invasión de la pared vesical, demostrando que un 32% de pacientes con supuestos tumores <T1/TIS luego de terapia neoadjuvante, tendría enfermedad en la pared muscular o mas allá.64 Este mismo autor ha destacado la importancia suprema de tener músculo en el espécimen transuretral, al encontrar un 49% de invasión muscular en aquellos pacientes que no tenían músculo en la resección inicial. Se concluyo que una segunda RTU reduciría el volumen de tumor y detectaría invasión muscular silente.50 Además, la asociación de Carcinoma in situ y la respuesta inicial a la terapia intravesical aportan datos acerca del posible curso clínico de estos pacientes. El trabajo de Vicente et al., con tumores TI grado III, señalo que progresiones en 5 años de 64% vs. 10% para aquellos pacientes sin o con CIS asociado. Cementando así que biopsias randomizadas del urotelio vesical son particularmente importante en tumores de alto grado histológico.65 Otros investigadores han reconocido la naturaleza progresiva en paciente con tumores Ta/Tl pero de alto grado histológico (OMS, Grado III) que no responden o lo hacen pobremente a la terapia intravesical.66-69 En cohortes de pacientes con tumores superficiales de alto grado, Herr y Merz observaron progresión en 82% de los pacientes que no respondieron a los 3 y 9 meses, respectivamente.67'69 Recientemente, Solsona et al., enfatizo que la respuesta al tercer mes de terapia intravesical como el único factor independiente predicativo de invasividad en pacientes con tumores superficiales de alto riesgo.70
Los Urólogos en especial debemos de estar claros que en el ambiente quirúrgico, pocos procedimientos como la RTU o cistoscopia con biopsia randomizadas, pueden impactar la cantidad y calidad de vida en un individuo con presumible enfermedad superficial.
También en este grupo de pacientes debemos de tener presente la sobrevida que experimentan estos pacientes luego de cystectomia. La base de datos nacional en cáncer de vejiga de los Estados Unido de América, ha reportado sobrevida especifica a 5-años de un 80% para pacientes con tumores Tl/TIS después de cystectomia.71 Data que es consistente con otras series individuales.9'59'72 Esta mejoría en sobrevida que aporta la cirugía radical así como la disminución en el impacto de la calidad de vida que proporcionan la neovejigas, hace que esta salida terapéutica este ganando adeptos y proveyendo eficacia en control del cáncer y prolongación de vida para nuestros pacientes.
Los avances de las derivaciones continentes, orto-topicas en general y la mejoría en la calidad de vida comparado con pacientes con segmentos ileales, incita al urólogo hacia conductas mas agresivas que proporcionen mejores sobrevidas para nuestros pacientes. Sin embargo, no todos, son candidatos para estas derivaciones. En general, pacientes jóvenes, motivados, mentalmente competentes sin compromiso intestinal o renal son los buenos candidatos.44'73 El dilema ético es enfrentado aconsejando pacientes con pobre riesgo quirúrgico, aquellos con co-morbilidades significativas (ej. Insuficiencia cardiaca o pulmonar, hipertensión severa, diabetes pobremente controlada) las cuales se hacen mas prevalentes con el avance de la edad.
La muerte perioperatoria es cuatro veces mas probable en pacientes mayores con co-morbilidades que en individuos jóvenes.74 El reconocimiento del impacto de condiciones médicas asociadas ha llevado al desarrollo de sistemas de evaluación de riesgo quirúrgico que se deben incorporar en la evaluación inicial. Ejemplos claros incluyen: a) La clasificación del estatus físico por la Asociación Americana de Anestesiólogos, aquí los pacientes son categorizados en uno de 5 grupos con mortalidad operatoria directamente proporcional al grupo ASA; b) El índice de riesgo cardiaco (IRC), específicamente predice el riesgo de una complicación cardiovascular para un paciente sometido a una intervención no cardiaca; y c) El índice de co-morbilidad Charson's, que predice la probabilidad de mortalidad debido a la co-morbi-lidades durante el primer año postoperatorio.75 77 Un estudio reciente, comparando el sistema ASA con el IRC, demostró las ventajas de la clasificación ASA. Sin embargo, el uso combinado fue mas efectivo.78
Por el otro lado los algunos protocolos de preservación de vejiga, utilizando RTU, radio y quimioterapia han demostrado resultados promisorios.79 La observación de que algunos agentes dtotóxicos como el dsplatino y el 5-fluoradlo, fungen como radió sensibilizadores celulares y aumentando así la cantidad de células que perecen por dosis de radiadón, trabajando en forma sinergistica, presenta como una alternativa en aquellos parientes mayores con problemas formidables, que quieren preservar sus vejigas o que no estén interesados en terapias quirúrgicas. Así, el juicio clínico es fundamental e individual cuando analizamos a estos pacientes.
Mientras la ciencia se moviliza a nivel molecular para descifrar la patogénesis y la posible conducta de estas lesiones, podemos destacar trabajos significativos que han propuesto datos informativos relevantes en e intento de prever el curso clínico. Nuevas aproximaciones al nivel molecular y genético se convertirán en las herramientas para vencer esta enfermedad.
Marcadores Moleculares y Terapia Genética
La estricta necesidad de predecir que tumor superficial va a recurrir o más importante va a progresar, o cual eventualmente disparara metástasis y en que tiempos estos hecho pudieren ocurrir, ha llevado a una carrera por descubrir potenciales marcadores pronósticos que eventualmente se incorporasen a la clasificación patológica, como ocurre con los tumores testiculares. Así, el uso de marcadores moleculares pudieran guiar en la decisión medica y el tratamiento del carcinoma "superficial" e vejiga.80'81 La extensa revisión de la literatura por Stein et al. ilumina el gran trabajo que ha involucrado disciplinas como la biología molecular, inmunología y técnicas citogenéticas en cáncer de vejiga.6'7 Importante han sido los hallazgos en carcinoma invasivo del pro-oncogen c-erbB-2 (HER-2/neu), la activación de este gen, desencadena crecimiento celular a través de su producto proteico, una proteína de transmembrana similar al receptor del factor de crecimiento epidermoide. Algunos científicos reportan que la expresión del HER-2/neu en cáncer de vejiga esta asociada con progresión y metástasis.82-84 Sin embargo, Jiménez at el. examino 80 pacientes con tumores invasivo sometidos a cystectomia y que desarrollaron metástasis, este grupo concluyo que la sobre expresión de HER-2/neu en los primarios consistentemente predecía invasión regional o metástasis distantes. Pero, esta sobre expresión de HER-2/neu no se correlaciono con la sobrevida en estos pacientes con enfermedad invasiva.85 Otros autores han señalado la falta de valor adicional que sobre estadio patológico o grado histológico que proporciona la expresión del HER-2/neu.86'87
La terapia genética esta arribando de manera innovativa, que busca modificaciones directas a la expresión de diferentes genes para tratar ambas: células somáticas y enfermedades hereditarias de las células somáticas. En general, existen dos escuelas: immunomoduladon genética o terapia correctiva. La immunomoduladon, busca enriquecer la respuesta inmunológica al activar linfocitos T-dtotóxicos anti-tumoral, se logra por la estimulación que induce la interleukina-2 (IL-2) o por el factor granulocitico estimulador de macrófagos; el ejemplo clásico ha sido la terapia intravesical con BCG en el carcinoma superficial de vejiga. Larcan y colaboradores, valiéndose de una transfecdon genética liposomal a la cytokina (IL-2) o al HLA-B7 en ratones, demostró un incremento de sobrevida del 100%, en aquellos ratones que expresaban la IL-2 luego de habérsele implantado células cancerígenas transidonales. Pero lo mas interesante fue la duradón de la remisión en estos animales, 75% de los ratones transfedados con genes codificando para IL-2 y HLA-B7 tuvieron respuestas completas y perdurables.88 Mas recientemente, en un estudio fase I-II, regresiones parciales con toleranda adecuada fueron observadas en un 20% de los pacientes tratados con IL-2, de forma primaria por tumores transidonales dejados in-situ.89
La terapia correctiva, consiste en el reemplazo de un gene defeduoso que ha permitido el credmiento indolente y despiadado de un tumor por el gene original o salvaje, al lograrse esto la cadena apoptotica se restablece controlándose así la enfermedad; el ejemplo dásico consiste en la transferenda del p53 salvaje (original o fisiológico) hada células con mutaciones de este gene, que al corregirse inducen la apoptosis celular por su camino natural a través de la expresión del p21WAF-l.80'90 Cote et al., evaluó 88 parientes con carcinoma invasivo de la vejiga, reportando que el beneficio de la quimioterapia adyuvante era observado en aquellos pacientes con mutaciones y por ende con productos del p53 (proteínas) defectuosos.91 En los pacientes con expresión normal de p53, la sobrevida fue similar a los controles. Esta data se enfrenta en el cuadrilátero científico con la prevalerte creencia que tumores con mutaciones en el p53 son quimio-resistentes ya que son menos capaces de activar las cadenas moleculares apoptoti-cas.17'18'68'92'93 como fue demostrado por Sarkis entre otros, cuando pacientes con mutaciones del p53 tenían menores probabilidades de demostrar una respuesta patológica objetiva y sufrían de menor sobrevida específica luego de quimioterapia neoadjuvante comparados con aquellos que no presentaban esta mutación. Claramente, proyectos de investigación vastos, complejos y randomizados son requeridos para responder estas incertidumbres científicas y poder ofrecer mejores tratamientos a nuestros pacientes. El veredicto final esta allí, el la medicina molecular, la cual sigue enriqueciendo y retando las perspectivas y las fronteras del carcinoma invasivo de la vejiga y que no en un futuro distante, hará imperativo su incorporación al los sistemas de estadiaje y terapia.
Los riesgos implicados en el uso de terapias conservativas, el progreso capcioso de la enfermedad, el brutal y la pobre sobrevida en aquellos desafortunados pacientes victimas del subestadiaje, trae consigo un dilema para el urólogo oncólogo quien asume la responsabilidad y deber de entregarse a estos seres humanos, en busca de una mejor calidad de vida. No es una tarea fácil. En este sentido la relación medico paciente es vital, tanto clínico como espiritual. Las metas deben de estar muy claras y el paciente debe de participar de forma activa en la toma de decisiones para poder lograrlas. Los avances de la cirugía radical de vejiga, con menores índices de morbilidad, mortalidad y la creación de neovejigas ha cambiado el espectro y la calidad de vida de estos pacientes así como las combinaciones terapéuticas que buscan preservar los órganos lo mayor posible. Sin embargo, los riesgos de terapias conservativas deben de ser sopesados contra la letalidad de un cáncer rebelde o mal tratado. La era de la medicina molecular es inminente, nos captiva y nos lleva a buscar y entender casi de forma inquisitiva las minucendas microscópicas de una enfermedad compleja. La terapia genética y biotecnología se envisten como las nuevas armas. La renovadora farmacoterapia, será el instrumento que nos ayudara a progresar y ofrecer alegría frente a la desesperanza de los parientes. En el entretanto, nuestra compañía, sinceridad e incondicionalidad espiritual a través de nuestros ojos y lenguaje corporal deben nutrir y consolar el dolor de estas almas.
1. Messing EM. Urothelial Tumors of the Urinary Tract. In: Walsh et al., Campbell's Urology 2002; 8th: 2732-
84.
2. American Cancer Society. Annual Cancer Statistics Review. 1987.
3. Jemal A, Murray T, Samuels A, Ghafoor A, Ward E, Thun MJ. Cancer statistics, 2003. CA Cancer J Clin 2003; 53: 5-26.
4. Jewett HJ, Strong GH. Infiltrating carcinoma of the bladder: relation of depth of penetration of the bladder wall to incidence of local extension and metastasis. J. Urol 1944; 55: 366.
5. Dukes CE, Masina F. Classification of epithelial tumors of the bladder. Br. J. Urol. 1949; 21: 273-95.
6. Skinner DG, Stein JP, Lieskovsky G, Skinner EC, Boyd SD, Figueroa A, et al. 25-year experience in the management of invasive bladder cancer by radical cystectomy. Eur Urol 1998; 33: 25-6.
7. Stein JP, Grossfeld GD, Ginsberg DA, Esrig D, Freeman JA, Figueroa AJ, et al. Prognostic markers in bladder cancer: a contemporary review of the literature. J Urol 1998; 160: 645-59.
8. Braslis KG, Soloway MS. Management of ureteral and renal pelvic recurrence after cystectomy. Urol Clin North Am 1994; 21: 653-9.
9. Pagano F, Bassi P, Galetti TP, Meneghini A, Milani C, Artibani W, et al. Results of contemporary radical cystectomy for invasive bladder cancer: a clinico-pathological study with an emphasis on the inadequacy of the tumor, nodes and metastases classification. J Urol 1991; 145: 45-50.
10. Wishnow KI, Tenney DM. Will Rogers and the results of radical cystectomy for invasive bladder cancer. Urol Clin North Am 1991; 18: 529-37.
11. Cheng L, Weaver AL, Leibovich BC, Ramnani DM, Neumann RM, Scherer BG, et al. Predicting the survival of bladder carcinoma patients treated with radical cystectomy. Cancer 2000; 88: 2326-32.
12. Bianco FJ, Jr., Lin JC, Reddy AY, Grignon DJ, Pontes JE, Wood DP, Jr. 8-year disease-free survival of patients with transitional cell carcinoma of the bladder treated with radical cystectomy. J. Urol 2001; 165: 1245.
13. Dalbagni G, Genega E, Hashibe M, Zhang ZF, Russo P, Herr H, et al. Cystectomy for bladder cancer: a contemporary series. J Urol 2001; 165: 1111-6.
14. Herr HW, Donat SM. Outcome of patients with grossly node positive bladder cancer after pelvic lymph node dissection and radical cystectomy. J Urol 2001;165: 62-4; discussion 4.
15. Gospodarowicz MK, Warde PR. A critical review of the role of definitive radiation therapy in bladder cancer. Semin Urol 1993; 11: 214-26.
16. Wajsman Z. Is there a role for radiation therapy in the treatment of invasive bladder cancer? J Urol 1997; 157: 1647-8.
17. Holmang S, Hedelin H, Borghede G, Johansson SL. Long-term followup of a bladder carcinoma cohort: questionable value of radical radiotherapy. J Urol 1997; 157: 1642-6.
18) Pollack A, Zagars GK, Dinney CP, Swanson DA, von Eschenbach AC. Preoperative radiotherapy for mus-cle-invasive bladder carcinoma. Long term follow-up and prognostic factors for 338 patients. Cancer 1994; 74: 2819-27.
19. Mameghan H, Fisher R, Mameghan J, Brook S. Analysis of failure following definitive radiotherapy for invasive transitional cell carcinoma of the bladder. Int J Radiat Oncol Biol Phys 1995; 31: 247-54.
20. Fossa SD, Waehre H, Aass N, Jacobsen AB, Olsen DR, Ous S. Bladder cancer definitive radiation therapy of muscle-invasive bladder cancer. A retrospective analysis of 317 patients. Cancer 1993; 72: 3036-43.
21. Vale JA, A'Hem RP, Liu K, Hendry WF, Whitfield HN, Plowman PN, et al. Predicting the outcome of radical radiotherapy for invasive bladder cancer. Eur Urol 1993; 24: 48-51.
22. Colvett KT, Althausen AF, Bassil B, Heney NM, McGovern FV, Young HH, 2nd, et al. Opportunities with combined modality therapy for selective organ preservation in muscle-invasive bladder cancer. J Surg Oncol 1996; 63: 201-8.
23. Bochner BH, Figueroa AJ, Skinner EC, Lieskovsky G, Petrovich Z, Boyd SD, et al. Salvage radical cysto-prostatectomy and orthotopic urinary diversion following radiation failure. J Urol 1998; 160: 29-33.
24. Stuschke M, Thames HD. Hyperfractionated radiotherapy of human tumors: overview of the randomized clinical trials. Int J Radiat Oncol Biol Phys 1997; 37: 259-67.
25. Horwich A, Pendlebury S, Deamaley DP. Organ Conservation in Bladder Cancer. Eur J. Cancer 1995; 31: 208.
26. Shipley WU, Prout GR, Jr., Einstein AB, Coombs LJ, Wajsman Z, Soloway MS, et al. Treatment of invasive bladder cancer by cisplatin and radiation in patients unsuited for surgery. Jama 1987; 258: 931-5.
27. Kaufman DS, Shipley WU, Griffin PP, Heney NM, Althausen AF, Efird JT. Selective bladder preservation by combination treatment of invasive bladder cancer. N Engl J Med 1993; 329: 1377-82.
28. Chauvet B, Brewer Y, Felix-Faure C, Davin JL, Choquenet C, Reboul F. Concurrent cisplatin and radiotherapy for patients with muscle invasive bladder cancer who are not candidates for radical cystectomy. J Urol 1996; 156: 1258-62.
29. Shipley WU, Kaufman DS, Heney NM, Althausen
AF, Zietman AL. An update of combined modality therapy for patients with muscle invading bladder cancer using selective bladder preservation or cystectomy. J Urol 1999; 162: 445-50; discussion 50-1.
30. Herr HW, Bajorin DF, Scher HI. Neoadjuvant chemotherapy and bladder-sparing surgery for invasive bladder cancer: ten-year outcome. J Clin Oncol 1998; 16: 1298-301.
31. Angulo JC, Sanchez-Chapado M, Lopez JI, Flores N. Primary cisplatin, methotrexate and vinblastine aiming at bladder preservation in invasive bladder cancer: multivariate analysis on prognostic factors. J Urol 1996; 155: 1897-902.
32. Hall R. Neoadjuvant CMV chemotherapy and Cystectomy or Radiation in muscle-invasive cancer: first analysis of MRC/EORTC intercontinental trial. Proc Am Soc Clin Oncol 1996; 15: 612.
33. Grossman HB, Natale RB, Tangen CM, Speights VO, Vogelzang NJ, Trump DL, et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med 2003; 349: 859-66.
34. Sternberg CN, Parmar MK. Neoadjuvant chemotherapy is not (yet) standard treatment for muscle-inva-sive bladder cancer. J Clin Oncol 2001; 19: 21S-6S.
35. Malmstrom PU, Rintala E, Wahlqvist R, Hellstrom P, Hellsten S, Hannisdal E. Five-year followup of a prospective trial of radical cystectomy and neoadjuvant chemotherapy: Nordic Cystectomy Trial I. The Nordic Cooperative Bladder Cancer Study Group. J Urol 1996; 155: 1903-6.
36. Neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: a randomised controlled trial. International collaboration of trialists [see comments] [published erratum appears in Lancet 1999 Nov 6; 354 (9190): 1650], Lancet 1999; 354: 533-40.
37. Neoadjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis. Lancet 2003; 361: 1927-34.
38. Shearer RJ, Chilvers CF, Bloom HJ, Bliss JM, Horwich A, Babiker A. Adjuvant chemotherapy in T3 carcinoma of the bladder. A prospective trial: preliminary report. Br J Urol 1988; 62: 558-64.
39. Martinez-Pineiro JA, Gonzalez Martin M, Arocena F, Flores N, Roncero CR, Portillo JA, et al. Neoadjuvant cisplatin chemotherapy before radical cystectomy in invasive transitional cell carcinoma of the bladder: a prospective randomized phase III study. J Urol 1995; 153: 964-73.
40. Cortesi E. Neoadjuvant Therapy for locally advanced bladder cancer: a randomized prospective clinical trial. Proc Am Soc Clin Oncol 1995; 14: A623.
41. Skinner DG, Daniels JR, Russell CA, Lieskovsky G, Boyd SD, Nichols P, et al. The role of adjuvant chemotherapy following cystectomy for invasive bladder cancer: a prospective comparative trial. J Urol 1991; 145: 459-64; discussion 64-7.
42. Stöckle M, Meyenburg W, Wellek S, Voges G, Gertenbach U, Thuroff JW, et al. Advanced bladder cancer (stages pT3b, pT4a, pNl and pN2): improved survival after radical cystectomy and 3 adjuvant cycles of chemotherapy. Results of a controlled prospective study. J Urol 1992; 148: 302-6; discussion 6-7.
43. Stöckle M, Meyenburg W, Wellek S, Voges GE, Rossmann M, Gertenbach U, et al. Adjuvant polychemotherapy of nonorgan-confined bladder cancer after radical cystectomy revisited: long-term results of a controlled prospective study and further clinical experience. J Urol 1995; 153: 47-52.
44. Studer UE, Bacchi M, Biedermann C, Jaeger P, Kraft R, Mazzucchelli L, et al. Adjuvant cisplatin chemotherapy following cystectomy for bladder cancer: results of a prospective randomized trial. J Urol 1994; 152: 81-4.
45. Freiha F, Reese J, Torti FM. A randomized trial of radical cystectomy versus radical cystectomy plus cisplatin, vinblastine and methotrexate chemotherapy for muscle invasive bladder cancer. J Urol 1996; 155: 495-9; discussion 9-500.
46. Herr HW. Conservative management of muscle-infiltrating bladder cancer: prospective experience. J Urol 1987; 138: 1162-3.
47. Henry K, Miller J, Mori M, Loening S, Fallon B. Comparison of transurethral resection to radical therapies for stage B bladder tumors. J Urol 1988; 140: 964-7.
48. Hall RR, Roberts JT, Marsh MM. Radical TUR and chemotherapy aiming at bladder preservation. Prog Clin Biol Res 1990; 353: 163-8.
49. Solsona E, Iborra I, Ricos JV, Monros JL, Dumont R. Feasibility of transurethral resection for muscle-infiltrating carcinoma of the bladder: prospective study. J Urol 1992; 147: 1513-5.
50. Herr HW. The value of a second transurethral resection in evaluating patients with bladder tumors [see comments]. J Urol 1999; 162: 74-6.
51. Uygur MC, Yaman I, Altug U, Erol D. Conservative management of stage T2 or T3a bladder cancer with deep transurethral resection followed by four cycles of chemotherapy. Br J Urol 1996; 78:2 01-4.
52. Sternberg CN, Arena MG, Calabresi F, De Carli P, Platania A, Zeuli M, et al. Neoadjuvant M-VAC (methotrexate, vinblastine, doxorubicin, and cisplatin) for infiltrating transitional cell carcinoma of the bladder. Cancer 1993; 72: 1975-82.
53. Cookson MS, Herr HW, Zhang ZF, Soloway S, Sogani PC, Fair WR. The treated natural history of high risk superficial bladder cancer: 15-year outcome. J Urol 1997; 158: 62-7.
54. Jakse G, Loidl W, Seeber G, Hofstadter F. Stage Tl, grade 3 transitional cell carcinoma of the bladder: an unfavorable tumor? J Urol 1987; 137: 39-43.
55. Zhang GK, Uke ET, Sharer WC, Borkon WD, Bernstein SM. Reassessment of conservative management for stage T1N0M0 transitional cell carcinoma of the bladder [see comments]. J Urol 1996; 155: 1907-9.
56. UICC. International UnionAgainst Cancer. TNM Classification of malignant tumours. 5th ed. ed. New York: Wiley-Liss, Inc.; 1997.
57. Bianco FJ, Jr., Justa D, Grignon DJ, Sakr WA, Pontes JE, Wood DP, Jr. "Management of Clinical Tl Bladder Transitional Cell Carcinoma by Radical Cystectomy". Urology Oncology 2003: In-press.
58. Kenny GM, Hardner GJ, Murphy GP. Clinical staging of bladder tumors. J Urol 1970; 104: 720-3.
59. Amling CL, Thrasher JB, Frazier HA, Dodge RK, Robertson JE, Paulson DF. Radical cystectomy for stages Ta, Tis and Tl transitional cell carcinoma of the bladder. J Urol 1994; 151: 31-5; discussion 5-6.
60. Freeman JA, Esrig D, Stein JP, Simoneau AR, Skinner EC, Chen SC, et al. Radical cystectomy for high risk patients with superficial bladder cancer in the era of orthotopic urinary reconstruction. Cancer 1995; 76: 833-9.
61. Wijkstrom H, Norming U, Lagerkvist M, Nilsson B, Naslund I, Wiklund P. Evaluation of clinical staging before cystectomy in transitional cell bladder carcinoma: a long-term follow-up of 276 consecutive patients. Br J Urol 1998; 81: 686-91.
62. Klan R, Loy V, Huland H. Residual tumor discovered in routine second transurethral resection in patients with stage Tl transitional cell carcinoma of the bladder. J Urol 1991; 146: 316-8.
63. Mersdorf A, Brauers A, Wolff JM, Schneider V, Jaske
G. Second TUR for superficial bladder cancer: a must? J Urol 1998; 159 (Abst):542.
64. Herr HW. Uncertainty, stage and outcome of invasive bladder cancer [editorial]. J Urol 1994; 152: 401-2.
65. Vicente J, Laguna MP, Duarte D, Algaba F, Chechile
G. Carcinoma in situ as a prognostic factor for G3pTl bladder tumours. Br J Urol 1991; 68: 380-2.
66. Fitzpatrick JM, West AB, Butler MR, Lane V, O'Flynn JD. Superficial bladder tumors (stage pTa, grades 1 and 2): the importance of recurrence pattern following initial resection. J Urol 1986; 135: 920-2.
67. Herr HW, Wartinger DD, Fair WR, Oettgen HF. Bacillus Calmette-Guerin therapy for superficial bladder cancer: a 10-year followup. J Urol 1992; 147: 1020-3.
68. Bono AV, Benvenuti C, Damiano G, Lovisolo J. Results of transurethral resection and intravesical doxorubicin prophylaxis in patients with T1G3 bladder cancer. Urology 1994; 44: 329-34; discussion 34-5.
69. Merz VW, Marth D, Kraft R, Ackermann DK, Zingg EJ, Studer UE. Analysis of early failures after intravesical instillation therapy with bacille Calmette-Guerin for carcinoma in situ of the bladder. Br J Urol 1995; 75: 180-4.
70. Solsona E, Iborra I, Dumont R, Rubio-Briones J, Casanova J, Almenar S. The 3-month clinical response to intravesical therapy as a predictive factor for progression in patients with high risk superficial bladder cancer [see comments]. J Urol 2000; 164: 685-9.
71. Fleshner NE, Herr HW, Stewart AK, Murphy GP, Mettlin C, Menck H, R,. The National Natabase Report on Bladder Carcinoma. Cancer 1996 ;78: 1505-13.
72. Malkowicz SB, Nichols P, Lieskovsky G, Boyd SD, Huffman J, Skinner DG. The role of radical cystectomy in the management of high grade superficial bladder cancer (PA, PI, PIS and P2) [see comments]. J Urol 1990; 144: 641-5.
73. Studer UE, Burkhard F, Danuser HJ, Thalmann G. Keys to success in orthotopic bladder substitution. Can J Urol 1999; 6: 876-7.
74. Gibson JR, Jr., Mendenhall MK, Axel NJ. Geriatric anesthesia: minimizing the risk. Clin Geriatr Med 1985; 1: 313-21.
75. Goldman L, Caldera DL, Nussbaum SR, Southwick FS, Krogstad D, Murray B, et al. Multifactorial index of cardiac risk in noncardiac surgical procedures. N Engl J Med 1977; 297: 845-50.
76. Vaz FG, Seymour DG. A prospective study of elderly general surgical patients: I. Pre-operative medical problems. Age Ageing 1989; 18: 309-15.
77. Drips RD, Lamont A, Eckenhoff JE. The role of anesthesia in surgical mortality. JAMA 1961; 178: 261-6.
78. Koch MO, Smith JA, Jr. Influence of patient age and co-morbidity on outcome of a collaborative care pathway after radical prostatectomy and cysto-prostatectomy. J Urol 1996; 155: 1681-4.
79. McCaffrey JA, Bajorin DF, Scher HI, Bosl GJ. Combined-modality therapy for bladder cancer. Oncology (Huntingt) 1997; 11: 18-26.
80. Cordon-Cardo C, Sheinfeld J, Dalbagni G. Genetic studies and molecular markers of bladder cancer. Semin Surg Oncol 1997; 13: 319-27.
81. Malkowicz SB. Superficial bladder cancer: the role of molecular markers in the treatment of high-risk superficial disease. Semin Urol Oncol 1997; 15: 169-78.
82. Underwood M, Bartlett J, Reeves J, Gardiner DS, Scott R, Cooke T. C-erbB-2 gene amplification: a molecular marker in recurrent bladder tumors? Cancer Res 1995; 55: 2422-30.
83. Moriyama M, Akiyama T, Yamamoto T, Kawamoto T, Kato T, Sato K, et al. Expression of c-erbB-2 gene product in urinary bladder cancer. J Urol 1991; 145: 423-7.
84. Moch H, Sauter G, Moore D, Mihatsch MJ, Gudat F, Waldman F. p53 and erbB-2 protein overexpression are associated with early invasion and metastasis in bladder cancer. Virchows Arch A Pathol Anat Histopathol 1993; 423: 329-34.
85. Jimenez RE, Hussain M, Bianco FJ, Jr., Vaishampayan U, Tabazcka P, Sakr WA, et al. Her-2/neu overexpression in muscle-invasive urothelial carcinoma of the bladder: prognostic significance and comparative analysis in primary and metastatic tumors. Clin Cancer Res 2001; 7: 2440-7.
86. Lipponen P, Eskelinen M. Expression of epidermal growth factor receptor in bladder cancer as related to established prognostic factors, oncoprotein (c-erbB-2, p53) expression and long-term prognosis. Br J Cancer 1994; 69: 1120-5.
87. Mellon JK, Lunec J, Wright C, Horne CH, Kelly P, Neal DE. C-erbB-2 in bladder cancer: molecular biology, correlation with epidermal growth factor receptors and prognostic value. J Urol 1996; 155: 321-6.
88. Larchian WA, Horiguchi Y, Nair SK, Fair WR, Heston WD, Gilboa E. Effectiveness of combined interleukin 2 and B7.1 vaccination strategy is dependent on the sequence and order: a liposome-mediated gene therapy treatment for bladder cancer. Clin Cancer Res 2000; 6: 2913-20.
89. Tubaro A, Stoppacciaro A, Velotti F, Bossola PC, Cusumano G, Vicentini C, et al. Local immunotherapy of superficial bladder cancer by intravesical instillation of recombinant interleukin-2. Eur Urol 1995; 28: 297-303.
90. Waldman T, Lengauer C, Kinzler KW, Vogelstein B. Uncoupling of S phase and mitosis induced by anticancer agents in cells lacking p21. Nature 1996; 381: 713-6.
91. Cote RJ, Esrig D, Groshen S, Jones PA, Skinner DG. p53 and treatment of bladder cancer. Nature 1997; 385: 123-5.
92. Lowe SW, Bodis S, McClatchey A, Remington L, Ruley HE, Fisher DE, et al. p53 status and the efficacy of cancer therapy in vivo. Science 1994; 266: 807-10.
93. Soloway MS, Lopez AE, Patel J, Lu Y. Results of radical cystectomy for transitional cell carcinoma of the bladder and the effect of chemotherapy. Cancer 1994; 73: 1926-31.
94. Hall RR. Neoadjuvant treatment for invasive bladder cancer: is it worthwhile? Acta Urol Beta década de la vida, tres veces mas común en hombres y casi nunca visto incidentalmente en estudios de autopsia, lo que sugiere que la persona que lo padece es tratada y curada o muere de esta enfermedad. El síntoma mas frecuente es la hema-turia microscópica (70%-90%), pero debemos tener presente que hasta un 30% de los pacientes padecen de síntomas irritativos al miccionar.1 CaCTV comprende un 90% de los tumores de vejiga, siendo puros una mitad, mientras la otra presenta variantes histológicas asociadas, algunas de las cuales (ej. diferenciación glandular o escamosa, presencia de variante micropapilar o sarcomatoide) compromete la sobrevida de estos pacientes.101 En general un 75% de las lesiones son superficiales, de los cuales entre un 15%-30% van a avanzar en estadio. En contraste, un 80% de los carcinomas invasivos al músculo son identificados en este estadio clínico en el momento del diagnostico. La naturaleza progresiva de estos tumores de alto grado esta sustentada en la presencia de síntomas meses antes de la presentación clínica, encontrándonos que un 50% de estos pacientes desarrollan metástasis durante los 24 meses posteriores al diagnostico. Los factores pronósticos de sobrevida y de control de cáncer son el grado de invasión y la diferenciación histológica. El grado no es relevante en la enfermedad invasiva ya que todos estos tumores son considerados de alto grado de malignidad. La discrepancia entre la estimación clínica y la realidad patológica ha sido foco de tremendo debate y controversia, debido primariamente a las implicaciones terapéuticas. Sin embargo, factores morfológicos como la arquitectura del tumor, el carácter del frente invasivo y la profundidad, se han relacionado con el incremento en la probabilidad de diseminación distante. El gran reto tanto para clínicos como investigadores es el de minimizar las dimensiones del cáncer y/o su tratamiento en la cantidad y calidad de vida de nuestros pacientes.
En este capítulo, examinaremos resultados recientes de las diferentes aproximaciones terapéuticas que comprenden cirugía radical y técnicas de preservación vesical, que incluyen la quimioterapia y la radioterapia para enfermedad invasiva. De vista al futuro, buscaremos maneras de incrementar el valor predictivo de nuestros juicios clínicos con la finalidad de mejorar el pronóstico de esta enfermedad. Reflexionaremos sobre la postura clínico-quirúrgica ante el tumor superficial de alto grado en la era de derivaciones ortotopicas y revisaremos el rol de marcadores moleculares en el manejo futuro de esta enfermedad cancerígena.
Unas cuantas décadas atrás, Jewett evaluó la sobrevida de aquellos pacientes a los que se les había removido la vejiga; el describió la profundidad de invasión al músculo como el factor mas determinante. Para 1944, Jewett y Strong habrían propuesto la primera clasificación formal para el estadio del cáncer de vejiga, dividiendo a los pacientes en tres grupos: A, B y C, que correspondía a invasión de la submucosa, músculo e infiltración perivesical, respectivamente.4 Dukes y Masina presentaron una clasificación similar en el Reino Unido en 1949.5 Así, para el final de los 1940s, estos reportes constituyeron la base de la clasificación TNM de los tumores de vejiga y desde entonces los tumores que penetran la muscular propia o mas allá son considerados invasivos.
La cistectomia radical es el tratamiento primario (de oro) para el carcinoma invasivo de vejiga (T2-4NxM0). La naturaleza amplia, en bloque de la cirugía, esta diseñada a prevenir márgenes positivos y así recurrencias locales. La técnica en si ha pasado la prueba del tiempo, suministrando porcentajes de sobrevida estables en el tiempo. Mejorías en el manejo anestésico, manejo intensivo, uso de antibióticos y la selección de pacientes, han reducido las complicaciones y la mortalidad de esta cirugía a un 15%-20% y 2%, respectivamente.610 Como lo demuestra la TABLA I, las series mas recientes reportan sobrevidas estimadas a 5 años para pacientes pT2 y pT3-pT4 con ganglios negativos de 67% a 84% y 32% a 58%, respectivamente. Aunque recientemente, Cheng et al. reporto una sobrevida especifica de cáncer a 10 años del 88% para aquellos pacientes con menos de 3 cm de penetración en la muscularis propia.11 Nuestra experiencia en la Universidad de Wayne State (Detroit, Michigan, USA) con 310 cystectomias realizadas en la década de los 90s, revelo sobrevidas especificas a 5 años de 87% en 45 pacientes con estadio patológico T2N0M0.12 Es de hacer notar, que no fueron encontradas diferencias significativas en sobrevida para aquellos pacientes con estadios pT3 o pT4.6'13 Para pacientes con metástasis en los ganglios linfáticos, observamos que menos del 25% viven 5 años después de la cirugía. Estos pacientes en la serie de la Universidad de Wayne State, presentaron una sobrevida media de 24 meses (rango 14 a 34 meses). Estudios por Herr et al., en el Hospital Memorial de Nueva York, subrayan la importancia en el numero de ganglios positivos mas que su pura presencia. En esas series la presencia de 3 o más ganglios positivos es lo que predice un desenlace fatal rápido. Adicionalmente 32% vs. 10% de aquellos con ganglios positivos y tumores primarios pT2 y pT3, respectivamente, vivieron 10 años después de sus cystectomias, señalando la importancia de la disección linfática.14
La idea de radioterapia sola o acompañada con resección transuretral agresiva con o sin quimioterapia se busca mantener la calidad de vida del paciente, al ser capaz de preservar su vejiga. El problema esencial radica en la eficacia de la radioterapia sola en esta enfermedad.15'16 El estudio sueco por Holmang et al., empleando dosis altas de radiación, reporto un 84% de carcinoma residual y/o recurrencia local. La sobrevida media para tumores T2/T3 fue de solo 16 meses y solo un 11% alcanzo sobrevida de largo plazo.17 Otros investigadores18'21 recientemente reportaron respuestas completas y sobrevidas a 5 años en pacientes T2-T4 de 44% a 57% y 20% a 26%, respectivamente. La selección del paciente es vital. La experiencia señala que tumores papilares, resección completa, ausencia de obstrucción ureteral, bajo grado histológico, ausencia de carcinoma in situ y tamaño menor a 5 cm son factores pronósticos buenos.18'22 Lo importante es que luego de radiación vesical, tanto urólogos como oncólogos, radiólogos deben de seguir a los pacientes de forma muy cercana. Si se presenta alguna evidencia de recurrencia local, cistectomia por salvación, si posible, debe de realizarse antes que tarde para poder percibir un beneficio en sobrevida.23
Para mejorar los resultados de radiación vesical, diversas técnicas como fraccionamiento acelerado, hiperfracdonamiento y quimio-radioterapia sensibilizada han sido utilizadas. Stuschke et al, analizo dos estudios randomizados en tumores T2 y T3 donde se comparo fraccionamiento convencional contra hyperfracdonamiento, este ultimo redujo significativamente las posibilidades de muerte.24 Horwich et al demostró respuestas completas en 81% de los 70 pacientes que fueron tratados con aceleraciones fraccionadas.25 Pero con esta técnica no hay estudios randomizados. Otros investigadores, han agregado un "sensibilizante" de radiación antes de la radiación externa para mejorar la sobrevida.26'28 Shipley, reporto un aumento de 10% a 20% en control del cáncer, después de agregar dsplatino a la radiación externa.
Ciertas revisiones cubren este tópico de forma extensa.8'29 31 El argumento para el uso de terapia sistémica en cáncer invasivo de vejiga se sustenta en el hecho que la mitad de los pacientes con estos tumores recurren con metástasis distantes después del control local-regional de la enfermedad. Aproximaciones creativas se han intentado, neoad-yuvante (antes de la cirugía), perioperativa (antes, durantes y después de la cirugía o radioterapia) y adyuvantes (después de la terapia local). Desde su introducción en 1985, MAVC (Metrotexate, Adriamydna, Vinblastina, Cisplatina) han sido las drogas de oro para esta enfermedad en estado distante. Pero, en una revisión de seis series y mas de 300 pacientes, los resultados de la quimioterapia como tratamiento único fueron muy pobres, tan solo un 27% de los parientes tuvieron respuestas completas.29 En conclusión, quimioterapia como modalidad única raramente es capaz de producir respuestas completas y no constituye una opción terapéutica definitiva para el cáncer invasivo de vejiga.
Sin embargo, la quimioterapia neoadjuvante se abre paso como posible estándar para pacientes con enfermedad local avanzada (T3 y T4NxM0). El estudio intercontinental, organizado por MRC/EORTC y reportado Hall et al.,32 en donde 976 pacientes (T2-4N0M0) fueron randomizados a recibir 3 ciclos de CMV vs. placebo, seguido por radioterapia o cirugía o ambos. Aunque, no se encontraron diferencias significativas en sobrevida especifica o total ajustada al uso de la quimioterapia, p=0.63 en la publicación inicial, análisis mas recientes de esta data y presentadas pero no publicados (todavía) en las conferencias de la
Asociación Americana de Urología (AUA), sugieren un beneficio hada el uso de quimioterapia antes de la cirugía. En este sentido la publicadón de la data ran-domizada del grupo SWAG/Intergroup en el NEJM ha intensificado el debate.33 Dicha discusión comenzó al presentarse esta data en el congreso de la sociedad dínica de oncología, El muestrario de este estudio (un tercio que el llevado a cabo por MRC) revelo una mejoría del 25% en mortalidad (diferencia de un solo lado) para aquellos pacientes expuestos a la quimioterapia neoadjuvante, el uso de la terapias neoadjuvantes, brindarían una sobrevida media de 76 meses comparados con 46 meses para aquellos no expuestos inidalmente.33 El problema radica en los análisis estadísticos, el tiempo que llevo a reclutar a estos parientes (11 años y el hecho de que 40% tuvieron estadio T2 y por ende buen pronostico.(34) Ahora, el ensayo clínico Nórdico I, demostró un beneficio en sobrevida del 15%, para pacientes T3-T4 a quienes recibieron la quimioterapia anticipada, p=0.003.35 Críticos a estos resultados, señalan que la cystectomia radical no se le practico a todos los pacientes y que el tamaño de la muestra fue insuficiente.
A nuestro parecer, resulta bien importante y mandatorio el análisis sobre todos estos estudios randomizados publicados en Lancet.36'37 Estudios randomizados anteriores alimentaron el debate ya que no han podido demostrar definitiva y consistentemente un beneficio en sobrevida para el brazo neoadjuvante.32'38-40 (Tabla I).

De forma similar, la data de los estudios randomizados analizando la eficacia de la quimioterapia adyuvante son insuficientes, TABLA II.41'45 Por ejemplo, el estudio iniciado en la universidad del sur de California, randomizó a 91 pacientes a recibir Ciclofosfamida, Adriamydna y Cisplatino (CISCA) vs. observación después de la cystedomia radical. Los riesgos de progresión de la enfermedad a 5 años demostraron un benefido a para el grupo tratado con quimioterapia ya que 49% de este grupo progreso vs. 66% de los observados. Sin embargo estos números no se transformaron en diferencias de sobrevida. La investigadón de Stockle et al. desde Alemania, busco respuesta a la misma pregunta comparando MVA(E)C vs. conduda expedante. Ellos encontraron luego de análisis multivariables que tanto la quimioterapia adyuvante (p=0.001) como el numero de nodos positivos tuvieron valor pronostico independiente. Diferendas significativas en el orden del 40% en estimaciones de sobrevida a 5 años fueron observadas para pacientes tratados con quimioterapia adyuvante Ahora, este benefido de sobrevida ha sido cuestionado ya que los parientes manejados de forma expedante nunca redbieron quimioterapia aun cuando la recurrencia del cáncer estaba establecida. Otros dos estudios randomizados han fallado en demostrar un beneficio de sobrevida para el brazo quimioterapeutico. Sin embargo, el uso hoy día de Gemdtabina y cisplatino, se considera menos mórbido y con efedividad similar respedo a tratamientos practicados en n los estudios randomizados.

RESECCIÓN TRANSURETRAL (RTU) SOLA O EN COMBINACIÓN
Un grupo numeroso de reportes han demostrado que en casos altamente selectivos, las ratas de mortalidad asociadas a RTU como modalidad única, pueden ser aceptables.46-53 El grupo liderizado por Solsona en Valenda (España), reporto sobrevida a 5 años de 83% y recurrenda de 48%, donde un 20% fue más invasiva comparado al estadio previo. La serie de 217 padentes por Herr et al, encontró a 45 pacientes con histologías negativas en segunda RTU, de estos 65% (30 pacientes) manejados de forma conservadora estaban vivos 5 años después con sus vejigas naturales.46'50 Pero también se puede observar que solo un 17% fueron curados por la resección inicial. Así que, en general RTU como terapia única no es recomendada para el manejo del paciente con carcinoma invasivo de vejiga, solo debe ser empleada en aquellos con un gran riesgo quirúrgico o quienes son extremadamente responsables con su condición médica. Mas frecuentemente la RTU es precedida o seguida por otras formas de terapias. Hall y Roberts, reportaron sobrevidas a 3 años de 65% a 79% para pacientes tratados primariamente con RTU seguidos por quimioterapia sistémica.48 Uygur et al. válido estos resultados en 19 pacientes manejados con RTU mas 4 ciclos de MVEC.51 La experiencia del servicio
de Medicina Oncológica genitourinaria del Memorial con 31 pacientes T2-T4 luego de una segunda RTU después de quimioterapia MVAC observo sobrevida a 3 años fue del 86%, con 50% libres de ninguna recurrencia y 21 con vejigas intactas.52 Shipley et al. resumió elegantemente otras publicaciones, refiriéndose a cirugía conservadora (RTU), seguido por radio y quimioterapia. Si sumamos los pacientes de estos protocolos (N=350), la sobrevida encontrada en 5 años oscilo entre un 49% y un 52%. Un total de 40% de los pacientes inicialmente sometidos a estos protocolos conservadores de vejiga la conservaban 5 años mas tarde.29
CARCINOMA SUPERFICIAL DE ALTO RIESGO: ¿SUPERFICIAL?
La etiqueta de tumor superficial de alto riesgo es otorgada a pacientes con tumores con tumores múltiples, aquellos con grado histológico III (alto grado), presencia de carcinoma in situ (solos o asociados), tumores que penetran la lamina propia o la mucosa muscular o aquellos con pobre respuesta a la terapia intravesical. La particularidad insidiosa de la historia natural de los tumores superficiales de alto riesgo ha sido documentada plenamente por Herr et al., este grupo observo una tasa de muerte en 10 años del 20% en 86 pacientes con carcinoma transicional de alto riesgo. Cuando el seguimiento se extendió a 15 años esto tumores "superficiales" habían progresado en un 53%, con o sin tratamiento intravesical de BCG, recurrencia en uréteres o pelvis renal alcanzo un 21% y 34% habían muerto por cáncer de vejiga.53 De forma similar, Zhang et al., describió tasas de progresión y muerte de 35% y 22%, respectivamente luego de 4 años de seguimiento e independientemente de terapia local para tumores de alto grado y estadio TI, en línea con reportes previos.54'55
De esta forma, nos preocupa extremadamente el manejo de estos pacientes. Un análisis meticuloso es imperativo ante el paciente con tumores grado III (alto grado). Actualmente, la clasificación de 1997 por la comisión americana en conjunto con la Unión Internacional Contre le Cáncer (TNM) es empleada para el estadiaje de estos tumores.56 Como disertábamos anteriormente, esta clasificación es una mezcla nacida de la unión del sistema TNM y la clasificación original de Jewett-Marshall. Lo angustiante hoy día es que la diversidad de opciones terapéuticas quirúrgicas se basa en la estimación correcta de la enfermedad, la cual no es nada simple. Para entender estoe fenómeno debemos de reflexionar en el significativo desbalance entre los estadios clínicos y quirúrgicos (patológicos) el cual ha mantenido una prevalecía inaceptable y frustrante a través de los años. Este resultado de subestimación clínica es mucho mas acentuado en pacientes con enfermedad de alto riesgo.
Nuestra experiencia en la Universidad de Wayne State con 59 pacientes con carcinoma transicional de alto grado y estadios Ta/TIS/Tl, a quienes se les realizó cystectomia en lo 90s, confirmo un subestadiaje clínico en 32% de los casos, pero mas específicamente 52% (17/33) de aquellos con estadio clínico TI fueron subestadiados y 24% de ellos han perecido57 Kenny et al, reporto índices de subestadiaje del 33% (35/105), pero para pacientes con tumores Ta/Tl/TIS esta figura pervasiva se incremento a un 44%.58 Amling et al., encontró errores del estadiaje clínico en 56% de sus pacientes, estadiaje correcto y subestadiaje para aquellos con enfermedad Ta fueron de 35% (11/31) y 55% (17/31), respectivamente. Particularmente, en un 19% (32/166) de las vejigas provenientes de los pacientes con tumores TI no se encontró cáncer microscópico.59 En su trabajo, Freeman et al. destaco la naturaleza agresiva de los tumores subestadiados, de 62 pacientes encontrados, solo la mitad tuvo enfermedad confinada a la vejiga patológicamente.60 Wijkstrom et al. concluyo que mas de un 35% del subestadiaje se explicaba por la falta de músculo en el espécimen transuretral.61 El estudio de microscopía electrónica de Cheng et al., evaluó las discrepancias de estadiaje entre la resección transurethral y cystectomia radical en pacientes no expuestos a quimioterapia intravesical. Tasas impresionantes de subestadiaje (78%) en pacientes con tumores TI fueron encontradas, con un 40% presentando invasión a grasa intravesical o incorporando estructuras adyacentes.11 El particular peligro del carcinoma superficial de alto riesgo, consiste en su remoción incompleta aun cuando el urólogo endo-scopista esta convencido que una resección completa ha sido ejecutada. Esto nos lleva al punto sobre una segunda observación/resecdon
Investigadones por Klan et al., en 46 pacientes con tumores TI completamente resecados, demostraron una incidenda de tumores residuales de un 44% en el momento de la segunda resección 6 semanas mas tarde62 Mersdorf, valido estos resultados en 94 pacientes con enfermedad superficial, encontrando enfermedad residual e incrementando el estadiaje en 31% y 14% en tumores Ta, para aquellos con enfermedad TI, las tasas fueron 18% y 16%, respectivamente.63 Herr et al., ha estresado las dificultades encontradas al analizar la profundidad de la invasión de la pared vesical, demostrando que un 32% de pacientes con supuestos tumores <T1/TIS luego de terapia neoadjuvante, tendría enfermedad en la pared muscular o mas allá.64 Este mismo autor ha destacado la importancia suprema de tener músculo en el espécimen transuretral, al encontrar un 49% de invasión muscular en aquellos pacientes que no tenían músculo en la resección inicial. Se concluyo que una segunda RTU reduciría el volumen de tumor y detectaría invasión muscular silente.50 Además, la asociación de Carcinoma in situ y la respuesta inicial a la terapia intravesical aportan datos acerca del posible curso clínico de estos pacientes. El trabajo de Vicente et al., con tumores TI grado III, señalo que progresiones en 5 años de 64% vs. 10% para aquellos pacientes sin o con CIS asociado. Cementando así que biopsias randomizadas del urotelio vesical son particularmente importante en tumores de alto grado histológico.65 Otros investigadores han reconocido la naturaleza progresiva en paciente con tumores Ta/Tl pero de alto grado histológico (OMS, Grado III) que no responden o lo hacen pobremente a la terapia intravesical.66-69 En cohortes de pacientes con tumores superficiales de alto grado, Herr y Merz observaron progresión en 82% de los pacientes que no respondieron a los 3 y 9 meses, respectivamente.67'69 Recientemente, Solsona et al., enfatizo que la respuesta al tercer mes de terapia intravesical como el único factor independiente predicativo de invasividad en pacientes con tumores superficiales de alto riesgo.70
Los Urólogos en especial debemos de estar claros que en el ambiente quirúrgico, pocos procedimientos como la RTU o cistoscopia con biopsia randomizadas, pueden impactar la cantidad y calidad de vida en un individuo con presumible enfermedad superficial.
También en este grupo de pacientes debemos de tener presente la sobrevida que experimentan estos pacientes luego de cystectomia. La base de datos nacional en cáncer de vejiga de los Estados Unido de América, ha reportado sobrevida especifica a 5-años de un 80% para pacientes con tumores Tl/TIS después de cystectomia.71 Data que es consistente con otras series individuales.9'59'72 Esta mejoría en sobrevida que aporta la cirugía radical así como la disminución en el impacto de la calidad de vida que proporcionan la neovejigas, hace que esta salida terapéutica este ganando adeptos y proveyendo eficacia en control del cáncer y prolongación de vida para nuestros pacientes.
Los avances de las derivaciones continentes, orto-topicas en general y la mejoría en la calidad de vida comparado con pacientes con segmentos ileales, incita al urólogo hacia conductas mas agresivas que proporcionen mejores sobrevidas para nuestros pacientes. Sin embargo, no todos, son candidatos para estas derivaciones. En general, pacientes jóvenes, motivados, mentalmente competentes sin compromiso intestinal o renal son los buenos candidatos.44'73 El dilema ético es enfrentado aconsejando pacientes con pobre riesgo quirúrgico, aquellos con co-morbilidades significativas (ej. Insuficiencia cardiaca o pulmonar, hipertensión severa, diabetes pobremente controlada) las cuales se hacen mas prevalentes con el avance de la edad.
La muerte perioperatoria es cuatro veces mas probable en pacientes mayores con co-morbilidades que en individuos jóvenes.74 El reconocimiento del impacto de condiciones médicas asociadas ha llevado al desarrollo de sistemas de evaluación de riesgo quirúrgico que se deben incorporar en la evaluación inicial. Ejemplos claros incluyen: a) La clasificación del estatus físico por la Asociación Americana de Anestesiólogos, aquí los pacientes son categorizados en uno de 5 grupos con mortalidad operatoria directamente proporcional al grupo ASA; b) El índice de riesgo cardiaco (IRC), específicamente predice el riesgo de una complicación cardiovascular para un paciente sometido a una intervención no cardiaca; y c) El índice de co-morbilidad Charson's, que predice la probabilidad de mortalidad debido a la co-morbi-lidades durante el primer año postoperatorio.75 77 Un estudio reciente, comparando el sistema ASA con el IRC, demostró las ventajas de la clasificación ASA. Sin embargo, el uso combinado fue mas efectivo.78
Por el otro lado los algunos protocolos de preservación de vejiga, utilizando RTU, radio y quimioterapia han demostrado resultados promisorios.79 La observación de que algunos agentes dtotóxicos como el dsplatino y el 5-fluoradlo, fungen como radió sensibilizadores celulares y aumentando así la cantidad de células que perecen por dosis de radiadón, trabajando en forma sinergistica, presenta como una alternativa en aquellos parientes mayores con problemas formidables, que quieren preservar sus vejigas o que no estén interesados en terapias quirúrgicas. Así, el juicio clínico es fundamental e individual cuando analizamos a estos pacientes.
Mientras la ciencia se moviliza a nivel molecular para descifrar la patogénesis y la posible conducta de estas lesiones, podemos destacar trabajos significativos que han propuesto datos informativos relevantes en e intento de prever el curso clínico. Nuevas aproximaciones al nivel molecular y genético se convertirán en las herramientas para vencer esta enfermedad.
Marcadores Moleculares y Terapia Genética
La estricta necesidad de predecir que tumor superficial va a recurrir o más importante va a progresar, o cual eventualmente disparara metástasis y en que tiempos estos hecho pudieren ocurrir, ha llevado a una carrera por descubrir potenciales marcadores pronósticos que eventualmente se incorporasen a la clasificación patológica, como ocurre con los tumores testiculares. Así, el uso de marcadores moleculares pudieran guiar en la decisión medica y el tratamiento del carcinoma "superficial" e vejiga.80'81 La extensa revisión de la literatura por Stein et al. ilumina el gran trabajo que ha involucrado disciplinas como la biología molecular, inmunología y técnicas citogenéticas en cáncer de vejiga.6'7 Importante han sido los hallazgos en carcinoma invasivo del pro-oncogen c-erbB-2 (HER-2/neu), la activación de este gen, desencadena crecimiento celular a través de su producto proteico, una proteína de transmembrana similar al receptor del factor de crecimiento epidermoide. Algunos científicos reportan que la expresión del HER-2/neu en cáncer de vejiga esta asociada con progresión y metástasis.82-84 Sin embargo, Jiménez at el. examino 80 pacientes con tumores invasivo sometidos a cystectomia y que desarrollaron metástasis, este grupo concluyo que la sobre expresión de HER-2/neu en los primarios consistentemente predecía invasión regional o metástasis distantes. Pero, esta sobre expresión de HER-2/neu no se correlaciono con la sobrevida en estos pacientes con enfermedad invasiva.85 Otros autores han señalado la falta de valor adicional que sobre estadio patológico o grado histológico que proporciona la expresión del HER-2/neu.86'87
La terapia genética esta arribando de manera innovativa, que busca modificaciones directas a la expresión de diferentes genes para tratar ambas: células somáticas y enfermedades hereditarias de las células somáticas. En general, existen dos escuelas: immunomoduladon genética o terapia correctiva. La immunomoduladon, busca enriquecer la respuesta inmunológica al activar linfocitos T-dtotóxicos anti-tumoral, se logra por la estimulación que induce la interleukina-2 (IL-2) o por el factor granulocitico estimulador de macrófagos; el ejemplo clásico ha sido la terapia intravesical con BCG en el carcinoma superficial de vejiga. Larcan y colaboradores, valiéndose de una transfecdon genética liposomal a la cytokina (IL-2) o al HLA-B7 en ratones, demostró un incremento de sobrevida del 100%, en aquellos ratones que expresaban la IL-2 luego de habérsele implantado células cancerígenas transidonales. Pero lo mas interesante fue la duradón de la remisión en estos animales, 75% de los ratones transfedados con genes codificando para IL-2 y HLA-B7 tuvieron respuestas completas y perdurables.88 Mas recientemente, en un estudio fase I-II, regresiones parciales con toleranda adecuada fueron observadas en un 20% de los pacientes tratados con IL-2, de forma primaria por tumores transidonales dejados in-situ.89
La terapia correctiva, consiste en el reemplazo de un gene defeduoso que ha permitido el credmiento indolente y despiadado de un tumor por el gene original o salvaje, al lograrse esto la cadena apoptotica se restablece controlándose así la enfermedad; el ejemplo dásico consiste en la transferenda del p53 salvaje (original o fisiológico) hada células con mutaciones de este gene, que al corregirse inducen la apoptosis celular por su camino natural a través de la expresión del p21WAF-l.80'90 Cote et al., evaluó 88 parientes con carcinoma invasivo de la vejiga, reportando que el beneficio de la quimioterapia adyuvante era observado en aquellos pacientes con mutaciones y por ende con productos del p53 (proteínas) defectuosos.91 En los pacientes con expresión normal de p53, la sobrevida fue similar a los controles. Esta data se enfrenta en el cuadrilátero científico con la prevalerte creencia que tumores con mutaciones en el p53 son quimio-resistentes ya que son menos capaces de activar las cadenas moleculares apoptoti-cas.17'18'68'92'93 como fue demostrado por Sarkis entre otros, cuando pacientes con mutaciones del p53 tenían menores probabilidades de demostrar una respuesta patológica objetiva y sufrían de menor sobrevida específica luego de quimioterapia neoadjuvante comparados con aquellos que no presentaban esta mutación. Claramente, proyectos de investigación vastos, complejos y randomizados son requeridos para responder estas incertidumbres científicas y poder ofrecer mejores tratamientos a nuestros pacientes. El veredicto final esta allí, el la medicina molecular, la cual sigue enriqueciendo y retando las perspectivas y las fronteras del carcinoma invasivo de la vejiga y que no en un futuro distante, hará imperativo su incorporación al los sistemas de estadiaje y terapia.
Los riesgos implicados en el uso de terapias conservativas, el progreso capcioso de la enfermedad, el brutal y la pobre sobrevida en aquellos desafortunados pacientes victimas del subestadiaje, trae consigo un dilema para el urólogo oncólogo quien asume la responsabilidad y deber de entregarse a estos seres humanos, en busca de una mejor calidad de vida. No es una tarea fácil. En este sentido la relación medico paciente es vital, tanto clínico como espiritual. Las metas deben de estar muy claras y el paciente debe de participar de forma activa en la toma de decisiones para poder lograrlas. Los avances de la cirugía radical de vejiga, con menores índices de morbilidad, mortalidad y la creación de neovejigas ha cambiado el espectro y la calidad de vida de estos pacientes así como las combinaciones terapéuticas que buscan preservar los órganos lo mayor posible. Sin embargo, los riesgos de terapias conservativas deben de ser sopesados contra la letalidad de un cáncer rebelde o mal tratado. La era de la medicina molecular es inminente, nos captiva y nos lleva a buscar y entender casi de forma inquisitiva las minucendas microscópicas de una enfermedad compleja. La terapia genética y biotecnología se envisten como las nuevas armas. La renovadora farmacoterapia, será el instrumento que nos ayudara a progresar y ofrecer alegría frente a la desesperanza de los parientes. En el entretanto, nuestra compañía, sinceridad e incondicionalidad espiritual a través de nuestros ojos y lenguaje corporal deben nutrir y consolar el dolor de estas almas.
1. Messing EM. Urothelial Tumors of the Urinary Tract. In: Walsh et al., Campbell's Urology 2002; 8th: 2732-
84.
2. American Cancer Society. Annual Cancer Statistics Review. 1987.
3. Jemal A, Murray T, Samuels A, Ghafoor A, Ward E, Thun MJ. Cancer statistics, 2003. CA Cancer J Clin 2003; 53: 5-26.
4. Jewett HJ, Strong GH. Infiltrating carcinoma of the bladder: relation of depth of penetration of the bladder wall to incidence of local extension and metastasis. J. Urol 1944; 55: 366.
5. Dukes CE, Masina F. Classification of epithelial tumors of the bladder. Br. J. Urol. 1949; 21: 273-95.
6. Skinner DG, Stein JP, Lieskovsky G, Skinner EC, Boyd SD, Figueroa A, et al. 25-year experience in the management of invasive bladder cancer by radical cystectomy. Eur Urol 1998; 33: 25-6.
7. Stein JP, Grossfeld GD, Ginsberg DA, Esrig D, Freeman JA, Figueroa AJ, et al. Prognostic markers in bladder cancer: a contemporary review of the literature. J Urol 1998; 160: 645-59.
8. Braslis KG, Soloway MS. Management of ureteral and renal pelvic recurrence after cystectomy. Urol Clin North Am 1994; 21: 653-9.
9. Pagano F, Bassi P, Galetti TP, Meneghini A, Milani C, Artibani W, et al. Results of contemporary radical cystectomy for invasive bladder cancer: a clinico-pathological study with an emphasis on the inadequacy of the tumor, nodes and metastases classification. J Urol 1991; 145: 45-50.
10. Wishnow KI, Tenney DM. Will Rogers and the results of radical cystectomy for invasive bladder cancer. Urol Clin North Am 1991; 18: 529-37.
11. Cheng L, Weaver AL, Leibovich BC, Ramnani DM, Neumann RM, Scherer BG, et al. Predicting the survival of bladder carcinoma patients treated with radical cystectomy. Cancer 2000; 88: 2326-32.
12. Bianco FJ, Jr., Lin JC, Reddy AY, Grignon DJ, Pontes JE, Wood DP, Jr. 8-year disease-free survival of patients with transitional cell carcinoma of the bladder treated with radical cystectomy. J. Urol 2001; 165: 1245.
13. Dalbagni G, Genega E, Hashibe M, Zhang ZF, Russo P, Herr H, et al. Cystectomy for bladder cancer: a contemporary series. J Urol 2001; 165: 1111-6.
14. Herr HW, Donat SM. Outcome of patients with grossly node positive bladder cancer after pelvic lymph node dissection and radical cystectomy. J Urol 2001;165: 62-4; discussion 4.
15. Gospodarowicz MK, Warde PR. A critical review of the role of definitive radiation therapy in bladder cancer. Semin Urol 1993; 11: 214-26.
16. Wajsman Z. Is there a role for radiation therapy in the treatment of invasive bladder cancer? J Urol 1997; 157: 1647-8.
17. Holmang S, Hedelin H, Borghede G, Johansson SL. Long-term followup of a bladder carcinoma cohort: questionable value of radical radiotherapy. J Urol 1997; 157: 1642-6.
18) Pollack A, Zagars GK, Dinney CP, Swanson DA, von Eschenbach AC. Preoperative radiotherapy for mus-cle-invasive bladder carcinoma. Long term follow-up and prognostic factors for 338 patients. Cancer 1994; 74: 2819-27.
19. Mameghan H, Fisher R, Mameghan J, Brook S. Analysis of failure following definitive radiotherapy for invasive transitional cell carcinoma of the bladder. Int J Radiat Oncol Biol Phys 1995; 31: 247-54.
20. Fossa SD, Waehre H, Aass N, Jacobsen AB, Olsen DR, Ous S. Bladder cancer definitive radiation therapy of muscle-invasive bladder cancer. A retrospective analysis of 317 patients. Cancer 1993; 72: 3036-43.
21. Vale JA, A'Hem RP, Liu K, Hendry WF, Whitfield HN, Plowman PN, et al. Predicting the outcome of radical radiotherapy for invasive bladder cancer. Eur Urol 1993; 24: 48-51.
22. Colvett KT, Althausen AF, Bassil B, Heney NM, McGovern FV, Young HH, 2nd, et al. Opportunities with combined modality therapy for selective organ preservation in muscle-invasive bladder cancer. J Surg Oncol 1996; 63: 201-8.
23. Bochner BH, Figueroa AJ, Skinner EC, Lieskovsky G, Petrovich Z, Boyd SD, et al. Salvage radical cysto-prostatectomy and orthotopic urinary diversion following radiation failure. J Urol 1998; 160: 29-33.
24. Stuschke M, Thames HD. Hyperfractionated radiotherapy of human tumors: overview of the randomized clinical trials. Int J Radiat Oncol Biol Phys 1997; 37: 259-67.
25. Horwich A, Pendlebury S, Deamaley DP. Organ Conservation in Bladder Cancer. Eur J. Cancer 1995; 31: 208.
26. Shipley WU, Prout GR, Jr., Einstein AB, Coombs LJ, Wajsman Z, Soloway MS, et al. Treatment of invasive bladder cancer by cisplatin and radiation in patients unsuited for surgery. Jama 1987; 258: 931-5.
27. Kaufman DS, Shipley WU, Griffin PP, Heney NM, Althausen AF, Efird JT. Selective bladder preservation by combination treatment of invasive bladder cancer. N Engl J Med 1993; 329: 1377-82.
28. Chauvet B, Brewer Y, Felix-Faure C, Davin JL, Choquenet C, Reboul F. Concurrent cisplatin and radiotherapy for patients with muscle invasive bladder cancer who are not candidates for radical cystectomy. J Urol 1996; 156: 1258-62.
29. Shipley WU, Kaufman DS, Heney NM, Althausen
AF, Zietman AL. An update of combined modality therapy for patients with muscle invading bladder cancer using selective bladder preservation or cystectomy. J Urol 1999; 162: 445-50; discussion 50-1.
30. Herr HW, Bajorin DF, Scher HI. Neoadjuvant chemotherapy and bladder-sparing surgery for invasive bladder cancer: ten-year outcome. J Clin Oncol 1998; 16: 1298-301.
31. Angulo JC, Sanchez-Chapado M, Lopez JI, Flores N. Primary cisplatin, methotrexate and vinblastine aiming at bladder preservation in invasive bladder cancer: multivariate analysis on prognostic factors. J Urol 1996; 155: 1897-902.
32. Hall R. Neoadjuvant CMV chemotherapy and Cystectomy or Radiation in muscle-invasive cancer: first analysis of MRC/EORTC intercontinental trial. Proc Am Soc Clin Oncol 1996; 15: 612.
33. Grossman HB, Natale RB, Tangen CM, Speights VO, Vogelzang NJ, Trump DL, et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med 2003; 349: 859-66.
34. Sternberg CN, Parmar MK. Neoadjuvant chemotherapy is not (yet) standard treatment for muscle-inva-sive bladder cancer. J Clin Oncol 2001; 19: 21S-6S.
35. Malmstrom PU, Rintala E, Wahlqvist R, Hellstrom P, Hellsten S, Hannisdal E. Five-year followup of a prospective trial of radical cystectomy and neoadjuvant chemotherapy: Nordic Cystectomy Trial I. The Nordic Cooperative Bladder Cancer Study Group. J Urol 1996; 155: 1903-6.
36. Neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: a randomised controlled trial. International collaboration of trialists [see comments] [published erratum appears in Lancet 1999 Nov 6; 354 (9190): 1650], Lancet 1999; 354: 533-40.
37. Neoadjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis. Lancet 2003; 361: 1927-34.
38. Shearer RJ, Chilvers CF, Bloom HJ, Bliss JM, Horwich A, Babiker A. Adjuvant chemotherapy in T3 carcinoma of the bladder. A prospective trial: preliminary report. Br J Urol 1988; 62: 558-64.
39. Martinez-Pineiro JA, Gonzalez Martin M, Arocena F, Flores N, Roncero CR, Portillo JA, et al. Neoadjuvant cisplatin chemotherapy before radical cystectomy in invasive transitional cell carcinoma of the bladder: a prospective randomized phase III study. J Urol 1995; 153: 964-73.
40. Cortesi E. Neoadjuvant Therapy for locally advanced bladder cancer: a randomized prospective clinical trial. Proc Am Soc Clin Oncol 1995; 14: A623.
41. Skinner DG, Daniels JR, Russell CA, Lieskovsky G, Boyd SD, Nichols P, et al. The role of adjuvant chemotherapy following cystectomy for invasive bladder cancer: a prospective comparative trial. J Urol 1991; 145: 459-64; discussion 64-7.
42. Stöckle M, Meyenburg W, Wellek S, Voges G, Gertenbach U, Thuroff JW, et al. Advanced bladder cancer (stages pT3b, pT4a, pNl and pN2): improved survival after radical cystectomy and 3 adjuvant cycles of chemotherapy. Results of a controlled prospective study. J Urol 1992; 148: 302-6; discussion 6-7.
43. Stöckle M, Meyenburg W, Wellek S, Voges GE, Rossmann M, Gertenbach U, et al. Adjuvant polychemotherapy of nonorgan-confined bladder cancer after radical cystectomy revisited: long-term results of a controlled prospective study and further clinical experience. J Urol 1995; 153: 47-52.
44. Studer UE, Bacchi M, Biedermann C, Jaeger P, Kraft R, Mazzucchelli L, et al. Adjuvant cisplatin chemotherapy following cystectomy for bladder cancer: results of a prospective randomized trial. J Urol 1994; 152: 81-4.
45. Freiha F, Reese J, Torti FM. A randomized trial of radical cystectomy versus radical cystectomy plus cisplatin, vinblastine and methotrexate chemotherapy for muscle invasive bladder cancer. J Urol 1996; 155: 495-9; discussion 9-500.
46. Herr HW. Conservative management of muscle-infiltrating bladder cancer: prospective experience. J Urol 1987; 138: 1162-3.
47. Henry K, Miller J, Mori M, Loening S, Fallon B. Comparison of transurethral resection to radical therapies for stage B bladder tumors. J Urol 1988; 140: 964-7.
48. Hall RR, Roberts JT, Marsh MM. Radical TUR and chemotherapy aiming at bladder preservation. Prog Clin Biol Res 1990; 353: 163-8.
49. Solsona E, Iborra I, Ricos JV, Monros JL, Dumont R. Feasibility of transurethral resection for muscle-infiltrating carcinoma of the bladder: prospective study. J Urol 1992; 147: 1513-5.
50. Herr HW. The value of a second transurethral resection in evaluating patients with bladder tumors [see comments]. J Urol 1999; 162: 74-6.
51. Uygur MC, Yaman I, Altug U, Erol D. Conservative management of stage T2 or T3a bladder cancer with deep transurethral resection followed by four cycles of chemotherapy. Br J Urol 1996; 78:2 01-4.
52. Sternberg CN, Arena MG, Calabresi F, De Carli P, Platania A, Zeuli M, et al. Neoadjuvant M-VAC (methotrexate, vinblastine, doxorubicin, and cisplatin) for infiltrating transitional cell carcinoma of the bladder. Cancer 1993; 72: 1975-82.
53. Cookson MS, Herr HW, Zhang ZF, Soloway S, Sogani PC, Fair WR. The treated natural history of high risk superficial bladder cancer: 15-year outcome. J Urol 1997; 158: 62-7.
54. Jakse G, Loidl W, Seeber G, Hofstadter F. Stage Tl, grade 3 transitional cell carcinoma of the bladder: an unfavorable tumor? J Urol 1987; 137: 39-43.
55. Zhang GK, Uke ET, Sharer WC, Borkon WD, Bernstein SM. Reassessment of conservative management for stage T1N0M0 transitional cell carcinoma of the bladder [see comments]. J Urol 1996; 155: 1907-9.
56. UICC. International UnionAgainst Cancer. TNM Classification of malignant tumours. 5th ed. ed. New York: Wiley-Liss, Inc.; 1997.
57. Bianco FJ, Jr., Justa D, Grignon DJ, Sakr WA, Pontes JE, Wood DP, Jr. "Management of Clinical Tl Bladder Transitional Cell Carcinoma by Radical Cystectomy". Urology Oncology 2003: In-press.
58. Kenny GM, Hardner GJ, Murphy GP. Clinical staging of bladder tumors. J Urol 1970; 104: 720-3.
59. Amling CL, Thrasher JB, Frazier HA, Dodge RK, Robertson JE, Paulson DF. Radical cystectomy for stages Ta, Tis and Tl transitional cell carcinoma of the bladder. J Urol 1994; 151: 31-5; discussion 5-6.
60. Freeman JA, Esrig D, Stein JP, Simoneau AR, Skinner EC, Chen SC, et al. Radical cystectomy for high risk patients with superficial bladder cancer in the era of orthotopic urinary reconstruction. Cancer 1995; 76: 833-9.
61. Wijkstrom H, Norming U, Lagerkvist M, Nilsson B, Naslund I, Wiklund P. Evaluation of clinical staging before cystectomy in transitional cell bladder carcinoma: a long-term follow-up of 276 consecutive patients. Br J Urol 1998; 81: 686-91.
62. Klan R, Loy V, Huland H. Residual tumor discovered in routine second transurethral resection in patients with stage Tl transitional cell carcinoma of the bladder. J Urol 1991; 146: 316-8.
63. Mersdorf A, Brauers A, Wolff JM, Schneider V, Jaske
G. Second TUR for superficial bladder cancer: a must? J Urol 1998; 159 (Abst):542.
64. Herr HW. Uncertainty, stage and outcome of invasive bladder cancer [editorial]. J Urol 1994; 152: 401-2.
65. Vicente J, Laguna MP, Duarte D, Algaba F, Chechile
G. Carcinoma in situ as a prognostic factor for G3pTl bladder tumours. Br J Urol 1991; 68: 380-2.
66. Fitzpatrick JM, West AB, Butler MR, Lane V, O'Flynn JD. Superficial bladder tumors (stage pTa, grades 1 and 2): the importance of recurrence pattern following initial resection. J Urol 1986; 135: 920-2.
67. Herr HW, Wartinger DD, Fair WR, Oettgen HF. Bacillus Calmette-Guerin therapy for superficial bladder cancer: a 10-year followup. J Urol 1992; 147: 1020-3.
68. Bono AV, Benvenuti C, Damiano G, Lovisolo J. Results of transurethral resection and intravesical doxorubicin prophylaxis in patients with T1G3 bladder cancer. Urology 1994; 44: 329-34; discussion 34-5.
69. Merz VW, Marth D, Kraft R, Ackermann DK, Zingg EJ, Studer UE. Analysis of early failures after intravesical instillation therapy with bacille Calmette-Guerin for carcinoma in situ of the bladder. Br J Urol 1995; 75: 180-4.
70. Solsona E, Iborra I, Dumont R, Rubio-Briones J, Casanova J, Almenar S. The 3-month clinical response to intravesical therapy as a predictive factor for progression in patients with high risk superficial bladder cancer [see comments]. J Urol 2000; 164: 685-9.
71. Fleshner NE, Herr HW, Stewart AK, Murphy GP, Mettlin C, Menck H, R,. The National Natabase Report on Bladder Carcinoma. Cancer 1996 ;78: 1505-13.
72. Malkowicz SB, Nichols P, Lieskovsky G, Boyd SD, Huffman J, Skinner DG. The role of radical cystectomy in the management of high grade superficial bladder cancer (PA, PI, PIS and P2) [see comments]. J Urol 1990; 144: 641-5.
73. Studer UE, Burkhard F, Danuser HJ, Thalmann G. Keys to success in orthotopic bladder substitution. Can J Urol 1999; 6: 876-7.
74. Gibson JR, Jr., Mendenhall MK, Axel NJ. Geriatric anesthesia: minimizing the risk. Clin Geriatr Med 1985; 1: 313-21.
75. Goldman L, Caldera DL, Nussbaum SR, Southwick FS, Krogstad D, Murray B, et al. Multifactorial index of cardiac risk in noncardiac surgical procedures. N Engl J Med 1977; 297: 845-50.
76. Vaz FG, Seymour DG. A prospective study of elderly general surgical patients: I. Pre-operative medical problems. Age Ageing 1989; 18: 309-15.
77. Drips RD, Lamont A, Eckenhoff JE. The role of anesthesia in surgical mortality. JAMA 1961; 178: 261-6.
78. Koch MO, Smith JA, Jr. Influence of patient age and co-morbidity on outcome of a collaborative care pathway after radical prostatectomy and cysto-prostatectomy. J Urol 1996; 155: 1681-4.
79. McCaffrey JA, Bajorin DF, Scher HI, Bosl GJ. Combined-modality therapy for bladder cancer. Oncology (Huntingt) 1997; 11: 18-26.
80. Cordon-Cardo C, Sheinfeld J, Dalbagni G. Genetic studies and molecular markers of bladder cancer. Semin Surg Oncol 1997; 13: 319-27.
81. Malkowicz SB. Superficial bladder cancer: the role of molecular markers in the treatment of high-risk superficial disease. Semin Urol Oncol 1997; 15: 169-78.
82. Underwood M, Bartlett J, Reeves J, Gardiner DS, Scott R, Cooke T. C-erbB-2 gene amplification: a molecular marker in recurrent bladder tumors? Cancer Res 1995; 55: 2422-30.
83. Moriyama M, Akiyama T, Yamamoto T, Kawamoto T, Kato T, Sato K, et al. Expression of c-erbB-2 gene product in urinary bladder cancer. J Urol 1991; 145: 423-7.
84. Moch H, Sauter G, Moore D, Mihatsch MJ, Gudat F, Waldman F. p53 and erbB-2 protein overexpression are associated with early invasion and metastasis in bladder cancer. Virchows Arch A Pathol Anat Histopathol 1993; 423: 329-34.
85. Jimenez RE, Hussain M, Bianco FJ, Jr., Vaishampayan U, Tabazcka P, Sakr WA, et al. Her-2/neu overexpression in muscle-invasive urothelial carcinoma of the bladder: prognostic significance and comparative analysis in primary and metastatic tumors. Clin Cancer Res 2001; 7: 2440-7.
86. Lipponen P, Eskelinen M. Expression of epidermal growth factor receptor in bladder cancer as related to established prognostic factors, oncoprotein (c-erbB-2, p53) expression and long-term prognosis. Br J Cancer 1994; 69: 1120-5.
87. Mellon JK, Lunec J, Wright C, Horne CH, Kelly P, Neal DE. C-erbB-2 in bladder cancer: molecular biology, correlation with epidermal growth factor receptors and prognostic value. J Urol 1996; 155: 321-6.
88. Larchian WA, Horiguchi Y, Nair SK, Fair WR, Heston WD, Gilboa E. Effectiveness of combined interleukin 2 and B7.1 vaccination strategy is dependent on the sequence and order: a liposome-mediated gene therapy treatment for bladder cancer. Clin Cancer Res 2000; 6: 2913-20.
89. Tubaro A, Stoppacciaro A, Velotti F, Bossola PC, Cusumano G, Vicentini C, et al. Local immunotherapy of superficial bladder cancer by intravesical instillation of recombinant interleukin-2. Eur Urol 1995; 28: 297-303.
90. Waldman T, Lengauer C, Kinzler KW, Vogelstein B. Uncoupling of S phase and mitosis induced by anticancer agents in cells lacking p21. Nature 1996; 381: 713-6.
91. Cote RJ, Esrig D, Groshen S, Jones PA, Skinner DG. p53 and treatment of bladder cancer. Nature 1997; 385: 123-5.
92. Lowe SW, Bodis S, McClatchey A, Remington L, Ruley HE, Fisher DE, et al. p53 status and the efficacy of cancer therapy in vivo. Science 1994; 266: 807-10.
93. Soloway MS, Lopez AE, Patel J, Lu Y. Results of radical cystectomy for transitional cell carcinoma of the bladder and the effect of chemotherapy. Cancer 1994; 73: 1926-31.
94. Hall RR. Neoadjuvant treatment for invasive bladder cancer: is it worthwhile? Acta Urol Belg 1996; 64: 39-42.
Dr. Nelson A. Medero P.
Urólogo. Policlínica Metropolitana. Servicio Integral de Urología, Caracas - Venezuela
Dr. Nelson A. Medero Álvarez
Médico Cirujano. Hospital Ambulatorio Rural Dr. David Espinoza. Salamanca, Isla de Margarita, Estado Nueva Esparta - Venezuela
AVANCES EN EL TRATAMIENTO FARMACOLÓGICO ORAL DE LA DISFUNCIÓN ERÉCTIL
INTRODUCCIÓN
Es evidente que en los últimos años de esta década, producto de los avances en las ciencias básicas y su aplicación clínica, se han realizado múltiples investigaciones científicas lo cual ha permitido el desarrollo de nuevas modalidades terapéuticas médicas cuya selección se adapten a las necesidades y condiciones específicas de cada paciente y según los criterios médicos establecidos.
Tal como lo demuestran los estudios epidemiológicos y el diario acontecer en la consulta médica, los pacientes portadores de disfundón eréctil al solicitar información sobre las distintas alternativas terapéuticas disponibles para solución de su problema, muestran su marcada preferencia por el tratamiento de administración oral, basados en las expectativas y deseos tanto de el como su pareja, aplicadón fácil y sencilla, además de la eficada, tolerancia, seguridad y accesibilidad.
Ahora bien, si bien es cierto el advenimiento de nuevos medicamentos ha revolucionado y modificado la estrategia en el manejo de la disfunción erédil por el benefido de ser tratamientos eficaces en restaurar la respuesta fisiológica erédil; es importante de tener en cuenta lo impresdndible del abordaje holistico o visión integral de la salud sexual tanto del padente como de su pareja de forma tal que permita lograr experiendas sexuales satisfactorias y mejoría de la calidad de vida de las parejas tratadas.
El diseño y desarrollo de estas nuevas drogas representan un importante avance dentífico basado en principios de biología y farmacología molecular, las cuales tienen como mecanismo de acción el activar procesos fisiológicos enzimáticos a nivel periférico o central del organismo, que fadliten y restauren la respuesta eréctil lo cual permita en el hombre ser capaz de lograr y mantener una erección lo suficientemente rígida para un desempeño sexual satisfactorio y el disfrute de una sexualidad plena.
Estos fármacos tienen en común como requisito primordial para poder ser efedivos, la necesidad de existencia de estímulos sexuales adecuados proeréc-tiles o eredogénicos previos.
De la misma manera requieren de la persistencia en algún grado de la integridad neuro- vascular así como de reserva fundonal corporal erédil a nivel del pene.
El beneficio clínico de estos medicamentos evi-dendados objetivamente mediante el disfrute de su sexualidad, recuperación de autoestima, produdivi-dad, así como relaciones interpersonales y con la pareja, garantiza la adherenda terapéutica a corto, mediano y largo plazo de ser necesario.
El uso de estos medicamentos es sólo de utilidad terapéutica para los pacientes portadores de disfunción eréctil y no como afrodisíaco o recreativo. Su indicación debe ser realizada después de una adecuada evaluación médica, por lo que es imprescindible acudir oportunamente a este profesional el cual es el más idóneo, por estar en capacidad de diagnosticar o identificar certeramente la afección , al igual que otras enfermedades asodadas o contribuyentes.
Existen un gran número de fármacos de uso oral para tratar la disfundón erédil, sin embargo nos limitaremos a describir los de más redentes adquisidón por cuanto las evidendas dínicas en cuanto a su eficada y seguridad, los permiten señalar como los medicamentos de la nueva era que han revoludonado el abordaje terapéutico en el manejo de esta entidad.
Sus atributos permiten considerarlos como la terapia patrón de primera elecdón para la gran mayoría de los parientes que consultan por esta patología.
El porcentaje de abandono del tratamiento con el uso de estos fármacos es muy bajo, reportándose entre las causas primordialmente: Respuestas insuficientes, Efedos adversos, entre otros.
Por su significado en la práctica clínica se define como pacientes no respondedores a la terapia oral, aquellos que "ya intentó con el comprimido y no obtuvo resultado". Entre los factores que influyen además de los propios según las características farmacológicas de cada fármaco es importante resaltar la insuficiente educación del paciente y falla en el seguimiento médico.
En este mismo sentido y no menos importante se destacan el desconocimiento de los profesionales de la salud especialmente los no especialistas, de los tratamientos disponibles, los cuales sumados al escaso tiempo de la consulta médica habitual y el considerar mas importante el tratamiento de otras condiciones clínicas impiden la prescripción e indicaciones precisas para garantizar el efecto clínico deseado.
Ahora bien superado estos factores es de aceptar que el 35% de los pacientes no responden al uso de estos fármacos. Esto sugiere la necesidad de nuevas opciones de tratamiento para la disfundón eréctil. Entre estas nuevas direcciones se encuentran mejoría de las terapias disponibles como sería incrementar la selectividad farmacológica, o por otra parte el uso de combinaciones de los fármacos existentes.
Estos Fármacos lo podemos clasificar desde el punto de vista del mecanismo de acción de la siguiente forma:
A. Medicamentos de Acción Periférica:
Inhibidores de la Fosfodíesterasas tipo 5
Sildenafil.
Valdenafil.
Tadalafil.
B. Medicamentos de Acción Central:
Agonistas dopamínergícos
Apomorfina
Los Inhibidores de la Fosfodiesterasa tipo 5
Esta nueva generación de medicamentos se caracteriza por poseer un mecanismo de acción periférico o local a nivel del pene al condicionar fisiológicamente a las estructuras eréctiles de responder ante un estímulo sexual adecuado. El efecto farmacológico de restaurar la respuesta fisiológica eréctil se logra por ser potentes inhibidores selectivos y específicos de las fosfodiesterasa tipo 5, enzima rica en los cuerpos cavernosos cuya función es degradar el GMPc el cual es el responsable de la relajación del músculo liso y por ende producir erección.
Por lo tanto son medicamentos facilitadores locales de la erección, de forma tal que necesitan esté activado la vía oxido nítrico/GMPc producto del estímulo sexual, requisito primordial para ser efectivo.
Diferencias entre algunas de sus características tales como estructuras químicas y propiedades far-macodnéticas permiten variadones en lo referente a su posología y benefido dínico.
Desde el punto de vista terapéutico la Eficacia y Seguridad de todos estos fármacos ha sido evaluada y demostrada en múltiples estudios experimentales tanto en animales como ensayos dínicos en humanos fase 1/2/3 y 4, siendo estos últimos, en diseños de doble dego, controlados con placeblo, dosis fijas y flexibles, paralelos o cruzados y Abiertos a largo plazo. En pobladones no selecdonadas al igual que grupos espe-dales de parientes portadores de disfundón erédil independientemente de la edad, etiología y severidad.
La contraindicación absoluta del uso de estos fármacos es el uso concomitante con nitratos o donantes del oxido nítrico. De la misma manera en pacientes que esté contraindicado la actividad física así como en procesos cardiovasculares adivos.
Precauciones deben tenerse en pacientes que toman otros medicamentos que prolonguen la vida media de estos fármacos o presente condidones tales como: hipotensión y bajo gasto cardiaco, entre otros.
A continuación se describen los aspectos más resaltantes de los 3 tipos de fármacos existentes y pertenecientes a este grupo, los cuales se encuentran disponibles en la adualidad:


a. Sildenafil:
Pionero en su grupo al ser comercializada desde 1998. Se estima que cerca de 20 millones de hombres en más de 110 países han sido tratados y el promedio de venta en la actualidad es de 9 tabletas cada segundo.
Suele ser considerado el medicamento que revolucionó la estrategia de abordaje en el diagnóstico y terapéutica de la Disfunción sexual eréctil.
Su introducción estimuló la elaboración de nuevos estudios en este campo con el objeto de determinar la prevalencia, factores de riesgos asociados, influencia etno-cultural y socioeconómicas a nivel mundial, permitiendo disponer una base de datos comparativa con el objeto de motivar el conocer y desmitificar esta afección, así como promover mediante campañas educativas la prevención y tratamiento de las disfunciones sexuales en hombres y mujeres.
Los resultados de estudios preliminares y 5 años después del lanzamiento han reportado una alta eficacia tanto en pacientes no seleccionados como en subpoblaciones especiales (Depresión, Hipertensión Arterial, Diabetes, Postratectomizados, entre otros), muy especialmente a la dosis máxima de 100 mg obteniendo mejoría entre el 74% y el 86% en la calidad de las erecciones y éxito entre el 65% y el 75% en los intentos de realización del acto sexual.
En tal sentido se confirma que la eficacia guarda una estrecha relación directa dosis/respuesta y sugiere una relación inversa con la severidad del daño vascular.
En estudios recientes ha aparecido un índice comparable en grupos mas variados de pacientes con condiciones comórbidas tales como esclerosis múltiple, espina bifida, enfermedad renal terminal, trasplantados de riñón, y cardíacos.
Los estudios de seguimiento según el uso a largo plazo son relevantes en demostrar la ausencia de taquifilaxia atribuible en tratamientos crónicos.
El perfil de seguridad del sildenafil destacado en los estudios prerregistros, ha sido confirmado durante los últimos cuatro años de experiencia postregistro, especialmente la ausencia de asociación con incremento en la incidencia de eventos isquémicos cardiovasculares y mortalidad.
Los efectos adversos o colaterales mas frecuentes informados son cefalea (7 al 25%), rubor facial (7 al 37%), congestión nasal (4 al 19%), dispepsia (1 al 11%), alteraciones visuales (1 al 6%).
La suspensión del tratamiento debido a estos eventos fue del 2.5%, no habiendo diferencia significativa en relación al grupo placebo.
La seguridad cardiovascular ha sido confirmada en múltiples estudios. Su utilización en pacientes coronarios no provocó ni aumento de sobrecarga cardíaca ni alteraciones hemodinámicas. De igual forma no se observaron alteraciones hemodinámicas en individuos hipertensos o que padecen insufiencia cardíaca congestiva.
La contraindicación absoluta del uso del sildenafil se restringe a pacientes que utilizan drogas que liberan oxido nítrico (nitratos).
Se sugiere precaución de uso concomitante con bloqueadores alfaadrenérgico (Doxazosina). Se recomienda usar sildenafil en dosis mínima (25 mg/día) y no ingerir doxazosina en el período de 4 horas del efecto del sildenafil.
Más del 50% de los pacientes que experimentan fracaso del tratamiento pueden ser beneficiado mediante reeducación y administración adecuada del medicamento. Ellos pueden ser ayudados con una mayor instrucción o aumento de la dosis. Por lo tanto es necesario verificar que se haya cumplido con los siguientes requisitos:
a. Estímulo sexual adecuado.
b Uso de la dosis óptima hasta un máximo de 100 mg/día.
c. Haber sido medicado en al menos cuatro oportunidades sin resultados satisfactorios.
d. No comer dos horas antes de la administración de la droga y una hora después, en especial alimentos grasos.
e. Esperar al menos 60 minutos entre la toma de la droga y sus intentos de coito.
b. Tadalafil
Este fármaco de administración oral a demanda para el tratamiento de la disfunción eréctil, además de ser un potente e inhibidor altamente selectivo de la fosfodiesterasa tipo 5, se caracteriza por poseer propiedades farmacológicas que lo diferencia del resto de su grupo.
Su estructura química y propiedades farma-codnéticas únicas le garantiza un perfil farmacológico con múltiples ventajas en su posología.
El desarrollo y diseño de esta nueva molécula ofrece una acdón eréctogénica local terapéutica altamente eficaz en mejoría considerable de la función eréctil en un amplio espectro de pacientes con disfundón eréctil.
A su vez proporciona la posibilidad de inidar la actividad sexual durante un amplio período de tiempo de respuesta tras la toma y previo estímulo sexual, con rapidez en el inicio de la erección y efecto benéfico de hasta 36 horas, lo cual sumado a la carenda de restricciones en la ingesta de alimentos y simpliddad en la dosificación la hace mas adaptable a la vida cotidiana y esfera de la sexualidad al traducirse en menos planificación ó presión y por ende en mas espontaneidad al poder escoger el momento mas apropiado, intentos múltiples de coito, naturalidad de la experienda sexual y satisfacción de la pareja.
La dosis inidal recomendada es de 20 mg / día, siendo indispensable y necesario que exista estimulo sexual para ser eficaz
Ensayos clínicos han demostrado su eficacia consistente y estadísticamente significativa en parientes con distintos niveles de severidad y sin distingo en etiología de disfunción eréctil, donde el 81% comunicaron mejoría en sus erecciones y un 75% de los intentos de coitos fueron satisfactorios.
Los resultados de los estudios de tolerancia y seguridad primaria con Tadalafil realizados que han finalizado y que continúa en curso a nivel mundial, han demostrado un bajo índice de eventos adversos (1.7%), comparable al grupo placebo y no diferentes a los referidos por otros de inhibidores de la fosfodiesterasa tipo 5.
Posee la ventaja al ser menos seledivo para la fosfodiesterasa tipo 6 (localizada en la retina) que los estudios realizados no relatan alteradones visuales como consecuencia del uso de esta droga.
Las reacciones adversas que se notificaron con mayor frecuenda y asodadas al Tadalafil fueron cefalea (14%), dispepsia (12%), dolor lumbar (6.5%). Mialgia (5.7%), enrojedmiento (4.3%) y congestión nasal (4.1%).
Estas reacciones fueron leves, transitorias y disminuyeron con la dosificación continua en la mayor parte de los pacientes.
El Tadalafil potencia los efedos hipotensores de los nitratos y se cree que tal acdón es el resultado de los efedos combinados sobre la vía oxido nítrico /CMPC. Por tal motivo esta contraindicado su uso en parientes que tomen cualquier forma de nitratos orgánicos.
Por otra parte aquellos parientes medicados con bloqueadores alfa adrenérgicos tipo Doxazosina no se recomiendan el uso combinado con Tadalafil, por el riesgo de hipotensión. En tal sentido se sugiere de ser necesaria la combinación, el uso de Tadalafil con Tamsulosina.
c. Vardenafil.
El clorhidrato de Vardenafil es un nuevo inhibidor seledivo de la fosfodiesterasa tipo 5. Los estudios clínicos pre-registros multicéntricos internacionales muestran resultados preliminares muy promisorios.
Las caraderísticas farmacológicas del tipo farma-cocinéticas arrojan resultados muy parecidas a los obtenidos con el sildenafil, en lo referente al inido de acción y duración del efecto, interacción medicamentosa y con los alimentos.
Existen diferencias en cuanto a la potencia bioquímica y seledividad inhibitoria expresada a favor del Vardenafil, en comparación con las otras drogas de su clase, sin embargo es importante tener presente que la eficacia clínica, tolerancia y seguridad depende no solo de las propiedades farmacológicas sino de otras variables tales como absorción, distribución, biotransformación, excreción, dosis, variabilidad del efecto y margen de seguridad.
Estudios recientes con Vardenafil en dosis de 5,10 y 20 mg/día, a demanda y con estimulo sexual previo, según parámetros de eficacia validados internacionalmente en el tratamiento de paciente con disfunción eréctil muestran porcentaje de éxito del orden del 71% y 75%. Estos resultados son consistente en comparación con placebo en un amplio espectro de pacientes, incluyendo los diabéticos y prostatectomizados. La magnitud del efecto especialmente con dosis de 10 y 20 mg es clínicamente significativa e iguales a los otros fármacos de su clase.
Se recomienda 10 mg como dosis inicial ajustando según eficacia y tolerancia a dosis de 20 ó 5 mg. Por el contrario se propone como dosis inicial de 5 mg/día para personas de edad avanzada así como pacientes con compromiso leve renal, hepático y aquellos que toman concomitantemente medicamentos inhibidores del dtocromo CYP3A4.
Los eventos adversos reportados con mayor frecuencia son cefalea (7-15%), rubor facial (10-11%), congestión nasal (4-7%) y dispepsia (0.7-/%). En lo que respeda al porcentaje de abandono por efectos adversos no fue estadísticamente significativa, comparado con el grupo placebo.
La contraindicación absoluta es la misma para los inhibidores de la fosfodiesterasa tipo 5, es dedr pacientes que utilicen nitratos
En vista a su potencial efecto hipotensor se sugiere precaución con el uso concomitante
con bloqueadores alfa adrenérgico, así como con nifedipina.
En la adualidad cumple con los requisitos exigidos por los órganos reguladores nadonales de control de medicamentos para la aprobadón de su uso.
Aún cuando este fármaco se conoce hace más de un siglo, su uso en el tratamiento de la disfunción erédil fue concebido a partir de su nueva formulación., como el primer y único agente oral de acción central que adiva los mecanismos fisiológicos de la erecdón, siempre y cuando exista un estimulo sexual adecuado.
Administrado vía sublingual, adúa a nivel del sistema nervioso central activando los receptores de dopamina DI y D2 en el área del mesencéfalo y del hipotálamo particularmente en los núcleos paraven-triculares, logrando un efecto fadlitador e intensifi-cador de los estímulos eredogénicos como la imaginación, auditivos, táctiles, olfatorios y visuales permitiendo que el estimulo sea transmitido a los núcleos medulares a través de vías oxitodnérgicas, dopaminérgicas y del oxido nítrico desencadenando cambios hemodinámicos y biomoleculares en el pene que promueven la erecdón.
Su efedo benéfico terapéutico en la esfera sexual se logra a dosis sensiblemente menores a aquellas que puedan desencadenar efedos intolerables, como nauseas o movimientos indeseables dopaminode-pendiente
Los resultados dínicos publicados prerregistros no han sido reproducidos en la práctica diaria.
En la actualidad la dosis recomendada es de 3 mg, requiriendo en la mayoría de los casos dosis subsecuentes con el objeto de obtener o mejorar los índices de éxitos reportados de 40-50% de intentos de coitos comparados con 30% con el uso de placebo.
En tal sentido debido a su eficacia limitada su uti-lizadón ha quedado restringida en los parientes con disfundón erédil psicógena y orgánica leve Desde el punto de vista farmacológico su formuladón sublingual permite al ser absorbida rápidamente, obtener niveles plasmáticos a partir de los 10 minutos alcanzando concentraciones máximas en 40 a 60 minutos para luego una eliminación total a las 8 horas. Esto explica su rápido inicio de acción después de administrado y la posibilidad de repetir su uso cada 8 horas.
Al no ingerirse carece de metabolismo hepático de primer paso evitando interacción medicamentosa y con los alimentos.
No existe contraindicación en los pacientes que ingieren nitratos.
Los efectos colaterales más comunes reportados son nauseas (7%), cefalea (7%), mareos (4%). Menos del 0.2% sufrieron sincope, el cual generalmente es precedido por nauseas, vómitos, sudoradón y mareos.
En los parientes considerados no respondedores es recomendable verificar el cumplimiento de los siguientes requisitos:
a. Utilizar la dosis máxima recomendada.
b. Cumplir en al menos cuatro oportunidades sin resultados satisfactorios.
c. Espera al menos 20 minutos entre la toma de la droga y los intentos de coito.
d. No deglutir la tableta. (El uso ademado es colocar la tableta debajo de la lengua para permitir que se disuelva, lo cual ocurre antes de los 10 minutos).
e. Existencia de estímulo sexual adecuado.
1. Braun M et al. Epidemiology of erectile dysfunction: results of the Cologne Male Survey. Int J Imp Res, 2000; 12: 305-11.
2. Melis MR. Angiolar A, Gessa GL. Apomorphine-induced penile erection and yowneng: site of action in brain. B Res, 1987; 415: 98-104.
3. Data on file. TAP Pharmaceutical Products Inc., 1999.
4. Heaton JPW. Apomorphine: an update of clinical trials results. Int J Imp Res, 2000; 12(suppl. 4): S67-S73.
5. Heaton JPW. Characterising the benefit of apomorphine SL (Uprima TM ) as an optimized treatment for representative populations with erectile dysfunction. Int J Imp Res, 2000; 13(suppl. 3): S35-S39.
6. Heaton JPW et al. Sequential administration enhances the effect of apomorphine SL in men with erectile dysfunction. Int J Imp Res, 2002; 14: 61-4
7. Rajfer J et al. Nitric oxide as an a mediator of relaxation of the corpus cavernosum in response to non-adrenergic, noncholinergic, neurotransmissor. New Engl J Med, 1992; 326: 90-4.
8. Sadovsky R et al. Three-year update of sildenafil citrate (Viagra®) efficacy and safety. Int J Clin Pract, 2001; 55(2): 115-28.
9. Becher E et al. Sildenafil citrate (Viagra) in the treatment of men with erectile dysfunction in southern
Latin America: a double blind randomized placebo controlled parallel-group, multicenter, flexible-dose escalation study. Int J Impot Res, 2002; 14 (2): S33-S41.
10. Hatzichristou DG. Sildenafil citrate: lessons learned from 3 years of clinical experience. Int J of Imp Res, 2002; 14(suppl. 1): S43-S52.
11. Kloner RA. Cardiovascular risk and sildenafil. Am J Cardiol, 2000; 86 (suppl.): 57F-61F.
12. Arruda-Olson AM et al. Cardiovascular effects of sildenafil during exercise in men with known or probable coronary artery disease. JAMA, 2002; 287: 719-25.
13. Howard C et al. Hemodynamic effects of sildenafil in men with severe coronary artery disease. N Engl J Med, 2000; 342: 1622-6.
14. Zusman RM et al. Effect of sildenafil citrate on blood pressure and heart rate in men with erectile dysfunction taking concomitant anti hypertensive medication. J Hypertens, 2000; 118(12): 1865-9.
15. Porst H et al. The efficacy and tolerability of vardenafil, a new, oral, selective phosphodiesterase type 5 inhibitor, in patients with erectile dysfunction: the first at-home clinical trial. Int J Imp Res, 2001; 13: 192-9.
16. Pryor J. Vardenafil: update on clinical experience. Int J Imp Res, 2002; 14 (suppl. 1): S65-S69.
17. Porst H. IC351 (tadalafil, Cialis): update on clinical experience. Int J Impot Res, 2002; 14 (1): S57-S64.
18. Padma- Nathan H et al. On demand IC351 (Cialis) enhancesd erectile function in patients with erectile dysfunction. Int J Import Res, 2001; 13: 2-9.
19. Morillo LE, Diaz J, Estevez E, Acosta A, Mendez H, Davila H, Medero N, Rodriguez N, Chavez M, Vinizuela R, Ortiz JA, Glasser DB. Prevalence of erectile dysfunction in Colombia, Ecuador and Venezuela: a population- based study (DENSA). Int J Import Res, 2002; 14(Suppl. 2): S10-S18.
20. Word Health Organization. 2002 Aviable at: http://www.who.int/inf-is/en/factl38.html. Saenz de Tejada Md, et all. Diabetes Care, 25:2159- 2164, 2002.
21. Porst H, Rosen RC, Padma- Nathan H, et al tadalafil allows men with erectile dysfunction to have successful intercourse up 36 hours postdose. J Urol. 2002;167(4 suppl): 177, Abstract 709.